Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.32 no.1 Bogotá Jan./Mar. 2012
REVISIÓN DE TEMA
1Instituto de Investigaciones Inmunológicas, Universidad de Cartagena, Cartagena, Colombia
2Fundación para el Desarrollo de las Ciencias Médicas y Biológicas (Fundemeb), Cartagena, Colombia
Contribución de los autores:
Luis Caraballo aportó la idea central de la hipótesis.
Ambos autores participaron por igual en la redacción y producción del manuscrito.
Recibido: 05/08/11; aceptado:31/10/11
Hay diversos vínculos entre las parasitosis, especialmente las helmintiasis, y las enfermedades alérgicas, ambas condiciones de importancia epidemiológica en las regiones tropicales. Mientras que se ha especulado con frecuencia los efectos de las enfermedades parasitarias sobre la evolución del sistema inmunitario, no se conocen las fuerzas selectivas que han moldeado la respuesta alérgica y pensamos que incluyen mecanismos evolutivos distintos a los tradicionalmente divulgados.
Los helmintos, fuente infecciosa y antigénica inductora de una respuesta parecida a la alérgica, se establecieron como parásitos en huéspedes que ya tenían grupos celulares de inmunidad de tipo 2. Hoy sabemos que un componente esencial en la relación de parasitismo entre los helmintos y sus huéspedes es la inmunosupresión que los primeros inducen, al crear una especie de equilibrio que permite la supervivencia de ambos.
El desarrollo de este equilibrio debió incluir adaptaciones de ambos organismos y la supervivencia del parásito podría ser el resultado de la adquisición de mecanismos supresores de la respuesta defensiva, la selección de los huéspedes con menor intensidad de la respuesta de tipo 2, o ambas. Esto, a su vez, sugiere que aunque las infecciones helmínticas hayan influido en la conformación de la inmunidad de tipo 2, no han sido una fuerza selectiva importante en el caso particular de la respuesta alérgica que, a su vez, está más ligada a una exagerada respuesta Th2/IgE.
Palabras clave: inmunoglobulina E, helmintos, áscaris, alergia e inmunología, genética.
The evolution of the Th2 immune responses and its relationships with parasitic diseases and allergy
A variety of links occur between parasites, particularly helminths, and allergic diseases--both common conditions of epidemiological importance in tropical regions. Although speculations are often made about the effects of parasitic diseases on the evolution of the immune system, the selective forces that have shaped the allergic response are unknown and probably include evolutionary mechanisms different to those traditionally reported. Helminths, infectious and antigenic sources that induce allergic-like responses, established themselves as parasites in organisms that already had cell groups related to the type 2 immunity. An essential component in the relationship between helminths and their hosts is that the former induce immunosuppression, creating a kind of balance that allows the survival of both. The development of this equilibrium undoubtedly includes adaptations in both organisms, and the survival of the parasite is the result of (a) acquiring immune suppressor mechanisms and (b) finding hosts with lower intensity of the type 2 response. This in turn suggests that although helminth infections have influenced the formation of type 2 immunity, they have not been an important selective force in the particular case of allergic response. The latter is more related to an exaggerated Th2/IgE response.
Keywords: Immunoglobulin E, helminths, Ascaris, allergy and immunology, genetics.
La respuesta inmunitaria alérgica es una reacción de hipersensibilidad frente a elementos inocuos, caracterizada por la producción de inmunoglobulina E (IgE) específica y la consecuente activación de procesos inflamatorios en algunos individuos genéticamente vulnerables, aproximadamente, el 25 % de los humanos. La mayoría de sus procesos son comunes a mecanismos de defensa, principalmente, contra helmintos (1), aunque estos últimos generan procesos inmunomoduladores ausentes en la respuesta contra alérgenos. La respuesta alérgica (sensibilización alérgica o atopia), que hace parte de la respuesta inmunitaria de tipo 2 (2-5), es un componente de las enfermedades alérgicas, entre las que están la rinitis, el asma, el eccema atópico y otras reacciones mediadas por IgE y con sintomatología clínica diversa. Como se ve, esta respuesta no tiene ventaja fisiológica aparente, pues sus consecuencias adversas ni siquiera se derivan del rechazo a fuentes antigénicas virulentas, lo que hace más interesante la investigación sobre su historia evolutiva.
Se cree que el proceso que genera la respuesta alérgica comprende principalmente mecanismos celulares de la inmunidad adaptativa, pues el control de la transcripción de la producción de IgE depende de la secreción de citocinas Th2 (interleucinas 3, 4, 5, 9, 10 y 13) y de las señales de contacto derivadas de los linfocitos T. Se piensa, además, que es el resultado de una predisposición genética que condiciona a un grupo pequeño de todas las poblaciones humanas estudiadas hasta ahora, a reaccionar exageradamente con los mecanismos celulares y moleculares de la respuesta Th2 (hiper-Th2/IgE). También, se han descrito mecanismos de síntesis de IgE independientes del reconocimiento con el complejo mayor de histocompatibilidad (CMH) (6) y lesiones inflamatorias alérgicas inducidas por alérgenos sin la participación de IgE (7), lo que sustenta la posibilidad de que haya existido una respuesta de tipo 2 más primitiva, antes de la aparición de los vertebrados mandibulados, los únicos animales con la respuesta adaptativa dependiente de las recombinasas RAG. Por ejemplo, los invertebrados tienen células con capacidad de liberación de gránulos y de sustancias proinflamatorias, y en los teleósteos se han descrito genes de respuesta Th2 (citocinas, receptores de citocinas y factores de transcripción).
Según la información disponible, la inflamación alérgica mediada por IgE es exclusiva de los mamíferos (8-10); este anticuerpo es filogenética-mente cercano a la IgY, una inmunoglobulina detectada en reptiles y aves, que interviene en reacciones de tipo anafiláctico en respuesta a antígenos de origen protozoario (11).
No se conocen las fuerzas selectivas que han moldeado la respuesta alérgica y pensamos que incluyen mecanismos evolutivos distintos a los tradicionalmente divulgados. Los helmintos, fuente infecciosa y antigénica que induce una respuesta parecida a la alérgica, se establecieron como parásitos en huéspedes que ya tenían grupos celulares de inmunidad de tipo 2. Hoy sabemos que un componente esencial en la relación del parasitismo entre los helmintos y sus huéspedes, es la inmunosupresión que los primeros inducen, la cual crea una especie de equilibrio que permite la supervivencia de ambos. El desarrollo de este equilibrio debió incluir adaptaciones de ambos organismos y la supervivencia del parásito podría ser el resultado de la adquisición de mecanismos supresores de la respuesta defensiva, la selección de los huéspedes con menor intensidad de la respuesta de tipo 2, o ambas. A su vez, esto sugiere que, aunque las infecciones helmínticas hayan influido en la conformación de la inmunidad de tipo 2, no han sido una fuerza selectiva importante en el caso particular de la respuesta alérgica que, a su vez, está más ligada a una exagerada respuesta Th2/IgE.
Puede pensarse que los helmintos primitivos y de vida libre que encontraban huéspedes con una fuerte respuesta inmunitaria (que podría ser de tipo 1 o 2), no sobrevivían y lograban finalmente colonizar aquellos que tenían una respuesta defensiva menos intensa o aquellos vulnerables ante sus propiedades inmunosupresoras. En ese sentido, es posible que hayan sido mecanismos evolutivos adicionales, distintos a los generados por los helmintos, los responsables de seleccionar y mantener los genotipos que sustentan el fenotipo hiper-Th2/IgE.
En forma breve, nuestra opinión es que el reconocimiento de proteínas como alérgenos y la fuerte respuesta Th2/IgE que se observa asociada a las enfermedades alérgicas en los humanos, no parecen haber sido seleccionados por los helmintos, quienes para su supervivencia como parásitos han establecido su relación con huéspedes con un perfil inmunológico más "tolerante".
En esta revisión se discuten algunos aspectos sobre la filogenia de la respuesta alérgica y sus posibles relaciones evolutivas con la inmunidad contra helmintos.
Algunos aspectos de la filogenia de la respuesta Th2
En las aves se observan procesos parecidos a los de los mamíferos en la defensa contra protozoarios, posiblemente mediados por IgY (11). En los peces también se dan reacciones de hipersensibilidad inmediata, incluyendo eritema o choque (12). En la trucha, la liberación de histamina inducida por la exposición a la exotoxina bacteriana resulta en un comportamiento típico de choque, con desorientación, vasodilatación de órganos viscerales, vómito, defecación, hemorragias petequiales y palidez de las branquias (12). Según esto, hay mecanismos primitivos con efectos parecidos a la respuesta alérgica de los mamíferos.
La producción de IgE está bajo el control de la interleucina 4 (IL-4) y la IL-13 mediante varios factores de transcripción, como STAT-6 y GATA-3. Los linfocitos Th2, que probablemente son anteriores a la IgE (13-15), son la fuente más importante de estas citocinas. Aunque hay células de la inmunidad innata que producen IL-4 e IL-13, los linfocitos son necesarios para la producción de IgE, pues a través de señales por contacto intercelular (CD40/CD40L) inducen el cambio de isotipo en los linfocitos B hacia la cadena pesada épsilon (16). Los teleósteos, que datan de hace más de 300 millones de años, tienen varios genes que codifican para componentes de la respuesta Th2 (17), así como células efectoras (mastocitos, eosinófilos y basófilos) que se activan frente a ciertos estímulos antigénicos de una manera similar a como lo hacen las de los mamíferos (18), lo cual sugiere que desde la aparición de los peces se dio una respuesta inmunitaria parecida a la que conocemos ahora como alérgica.
A continuación se tratan algunos puntos sobre la filogenia de dicha respuesta.
Inmunoglobulina E
La IgE es la molécula que define la especificidad de la respuesta y tiene características estructurales que determinan las particularidades de la activación celular que desencadena (19). Su producción está fuertemente regulada y aun en individuos con niveles elevados, estos permanecen por varios órdenes (ng/ml) menores que otros anticuerpos, como la IgG (mg/ml). Los trastornos de esta proteína son más por aumento de la producción que por deficiencias (20-21). Aunque experimentalmente un animal en buenas condiciones higiénicas puede sobrevivir sin este anticuerpo (20), en los estudios epidemiológicos de ambientes con altos índices de infestación parasitaria, la IgE se asocia a resistencia a ciertos helmintos (22). También, participa en la respuesta inmunitaria contra tumores (23); hay evidencia de asociación inversa entre varios tipos de cáncer y atopia (24,25) y producción de IgE específica contra antígenos tumorales (26). Su impacto en este aspecto comienza a estudiarse con mayor profundidad y el papel en la evolución de la respuesta de tipo 2 no se ha analizado.
En la inmunidad Th2, la IgE es tal vez la de aparición más reciente en la escala evolutiva (figura 1); como se ha mencionado, se ha detectado sólo en los mamíferos (8-10). En los monotremas se confirmó la presencia del locus c épsilon, lo cual sugiere que la divergencia de la IgE de otro gen más primitivo sucedió antes de la división de los mamíferos en sus tres ramas evolutivas (27). El locus de las inmunoglobulinas del ornitorrinco (Ornithorhynchus anatinus) codifica, además de todas las del humano, la IgY, una inmunoglobulina de anfibios, reptiles y aves. Se estima que es la molécula evolutivamente más cercana al ancestro común de la IgE y la IgG (28). Al parecer, tras un evento de duplicación del gen ancestral de la cadena pesada ípsilon (u), se originó una copia que evolucionó hacia la IgE actual (29). La estructura de la IgY es similar a la de la IgE, con cuatro dominios constantes, a diferencia de la IgG que tiene tres. Sin embargo, funcionalmente la IgY e IgG son más parecidas.
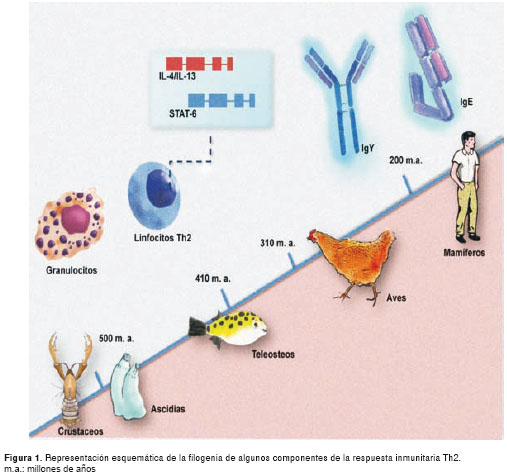
La cadena pesada ípsilon (u) de la IgY aviar contiene un dominio (cu2) conservado en la IgE de mamíferos, el cual está truncado en la IgG y es similar por su secuencia a la región bisagra de esta última. La IgY aviar activa los mastocitos en el pollo y participa en el desarrollo de reacciones anafilácticas en el intestino (11), importantes en la defensa contra infecciones por protozoarios, aunque no se sabe si la IgE actual emplea el mismo mecanismo molecular para desencadenar una reacción alérgica. Si bien en la IgE el dominio cε2 es responsable de la alta afinidad que tiene con su receptor FcεRI, no es así con el dominio homólogo en la IgY (cu2), pues su eliminación no altera la afinidad con el receptor Fc. Además, la afinidad de la IgY con su receptor está en el mismo orden que el de la IgG, 10 veces menor que el de la IgE (30).
Citocinas y receptores
Entre las citocinas del perfil Th2, IL-4, IL-5 e IL-13 inducen la mayoría de los procesos de la inflamación alérgica. Estas moléculas son estructuralmente distintas a otras citocinas y están codificadas por un grupo de genes en la región cromosómica 5q11.2 que parecen haberse originado en la duplicación de un ancestro común (31). Estos genes son más antiguos que los de la IgE, pues se han identificado ortólogos en especies más primitivas que los mamíferos. Aunque no tienen una alta conservación de secuencia, la sintenia se mantiene entre los genomas del ratón, el pollo y humano (32). La secuenciación del genoma del Tetraodon nigraviridis (pez globo) y el empleo de mejores herramientas de bioinformática, permitieron detectar ortólogos de estas citocinas, cuya existencia se había descartado inicialmente. El ortólogo IL-4/IL-13 de T. nigraviridis tiene, como en los mamíferos, una región promotora con un sitio predicho de unión al STAT-6, un factor de transcripción esencial en la respuesta Th2 (33). La predicción de la estructura de la proteína homologa a IL4/IL-13 indica que tiene un enlace disulfuro ausente en las de los mamíferos. En T. nigraviridis también se ha identificado el equivalente de la cadena α del receptor de la IL-4; la cadena g, común para los receptores de citocinas, fue clonada de la trucha (34). Recientemente, se identificaron dos clonas de ADNc que codifican para la cadena α de la IL-13 en T. nigraviridis y en el pez cebra (34).
El factor de transcripción STAT-6 es activado por la IL-4 y la IL-13, y participa en procesos intracelulares que permiten sus efectos sobre otras células, tales como el cambio de isotipo hacia IgE. La estructura del STAT-6 humano (HsSTAT6) tiene una organización de exones similar a la de su homólogo en T. nigraviridis (TnSTAT6), exceptuando la de su dominio de trans-activación C-terminal. Mediante análisis de cambio de movilidad electroforética (Electrophoretic Mobility Shift Assay, EMSA) se detectó que el TnSTAT6 tiene las mismas características de unión a ADN que el STAT6 de mamífero. La conservación de esta propiedad concuerda con la gran similitud de la secuencia de aminoácidos que existe entre las regiones de unión al ADN de estos genes. Aunque los aminoácidos del dominio SH2 que influyen en la unión del HsSTAT6 al receptor de la IL-4 se conservan en el TnSTAT6, no se pudo activar este factor de transcripción mediante estímulo con IL-4 de mamífero (17).
Estos hallazgos sugieren que en los teleósteos podría existir una vía de señalización IL-4/IL-13 análoga a la de los mamíferos. Sería importante confirmar, como se ha hecho con algunas citocinas Th1, el papel funcional de estos genes en la inmunidad del pez y su analogía con la inmunidad de tipo 2 del mamífero.
Células de la inmunidad innata
En la inmunidad de tipo 2 y la inflamación alérgica participan varias células efectoras, entre ellas eosinófilos, basófilos y mastocitos (células cebadas). En los mamíferos son diferenciables desde el punto de vista morfológico y funcional, aunque comparten ciertos mecanismos de activación y la capacidad de pérdida de gránulos frente a estímulos diversos, especialmente antigénicos. Su aparición evolutiva es anterior a la de los linfocitos, como lo demuestra el hallazgo de células parecidas en algunos invertebrados (35). Sus nombres provienen de la afinidad por ciertos colorantes de histoquímica, lo que depende del contenido de los gránulos. La búsqueda de células predecesoras de los granulocitos se hace más difícil a medida que aumenta la distancia filogenética. En ocasiones resulta difícil discernir entre la célula humana con la cual se presenta la homología, pues aunque se conserven mecanismos funcionales similares, la tinción con colorantes distingue varios tipos celulares.
Eosinófilos. Son leucocitos polimorfonucleares que actúan en la inmunidad contra parásitos y en algunas enfermedades, principalmente de tipo alérgico. Los de origen filogenético más ancestral y mejor caracterizados provienen del pez cebra, Danio rerio, especie que se ha convertido en un buen modelo general para estudiar la respuesta inmunológica de los vertebrados. Balla, et al., aislaron eosinófilos de este pez mediante GATA-2, un marcador celular descrito originalmente en los eosinófilos del ratón (18), y observaron que tenían similitud tanto morfológica como de expresión génica con los eosinófilos de mamíferos. Aunque se detectaron transcriptos de genes que se expresan en los gránulos (ARNasas, principalmente), no se hallaron homólogos de otras proteínas de importancia funcional como la proteína básica mayor y la peroxidasa de eosinófilos. Cuando las células se expusieron in vitro a un extracto del helminto Heligmosomoides polygyrus,se vio un aumento de la actividad peroxidasa y, por microscopía electrónica, cambios morfológicos indicativos de la pérdida de gránulos. La inmunización con papaína, un alérgeno que tiene actividad proteasa similar a otras de parásitos, indujo eosinofilia en el pez cebra. De igual manera, la exposición a Pseudocapillaria tormentosa, un nematodoque lo infecta de manera natural, provocó infiltración eosinofílica en la lámina propia del intestino (36).
La activación de eosinófilos por helmintos se observa desde los teleósteos hasta los mamíferos, pero aún se discute si los parásitos influyeron en la evolución del mecanismo de defensa. No está completamente establecida una correlación entre la actividad de los eosinófilos y su función parasiticida (37), ni tampoco una conservación filogenética de las proteínas relacionadas con la actividad citotóxica que contienen los gránulos, incluso entre especies primates cercanas (38). Algunos autores proponen que serían otras funciones de la pérdida de gránulos de los eosinófilos las que tendrían importancia evolutiva, tales como los procesos de depuración de proteínas y otras biomoléculas, las cuales aumentan principalmente en otras situaciones de daño tisular, adicionales a las causadas por infecciones helmínticas (39).
Mastocitos. Se originaron muy temprano en la filogenia de los vertebrados y participan en mecanismos de defensa contra una amplia variedad de patógenos, desde microorganismos extracelulares hasta helmintos. Se han conservado los mecanismos primitivos de activación propios de especies evolutivamente primitivas (receptores de tipo toll, del complemento, etc.) y se han integrado nuevas formas de activación, como la inducida por la IgE. En los artrópodos se encuentran hemocitos granulares que, ante la exposición a moléculas como lipolisacárido y beta-glucano, sufren pérdida de gránulos y liberan substancias proinflamatorias promotoras de la fagocitosis y la coagulación; además, tienen propiedades antifúngicas (35). Los ascidiáceos (urocordados) tienen estas células, con características parecidas a basófilos o mastocitos (40). A diferencia de los de otros invertebrados, sus gránulos contienen heparina e histamina y esta similitud con los mastocitos de los vertebrados sugiere que serían su ancestro filogenético.
Tanto en las lampreas como en los peces cartilagi-nosos se han detectado células con características microscópicas e histoquímicas similares a los mastocitos (41). En los peces se caracterizan por su heterogeneidad morfológica y el contenido de sus gránulos, que les confieren variaciones en la sensibilidad a colorantes; algunos son eosinófilicos (por esta propiedad algunos autores las denominan células granulares eosinófilicas) y otros basófilicos (42). Si bien se diferencian morfológicamente de las de origen mamífero, las células cebadas de los peces son funcionalmente similares, se localizan alrededor de los vasos sanguíneos asociados a los sitios de interacción con el ambiente exterior (piel e intestino, por ejemplo), tienen capacidad de liberación de gránulos y aumentan en número en las parasitosis. Matsuyama, et al., describieron que en los sitios de pérdida de gránulos de los mastocitos de peces aumenta la migración y acumulación de neutrófilos, lo cual demuestra la capacidad de liberar sustancias quimiotácticas, tal como sucede en los mamíferos (43). Los mastocitos de los peces contienen en sus gránulos componentes similares a los de los mamíferos (fosfatasas alcalinas, aminopeptidasas, péptidos antimicrobianos -piscidinas-). En cuanto a las aminas vasogénicas, la histamina sólo se ha detectado en ciertas especies de peces, a diferencia de la serotononina, cuya presencia es más común.
Basófilos. En los peces primitivos como Lampetra planeri y Petromyzon marinus, se describieron granulocitos basofílicos (44) pero no se caracte-rizaron bien con técnicas citoquímicas. En los teleósteos hay gran heterogeneidad en la abundancia y afinidad a las tinciones de los granulocitos. En el pez carpa, Cyprinus carpio, los basófilos junto con los granulocitos heterófilos constituyen el 1 % de los leucocitos totales, mientras que en los salmónidos, los basófilos son aún menos abundantes y en algunas especies están ausentes (45). Se desconoce si estas células son análogas a los basófilos de los mamíferos y el criterio morfológico no es suficiente para reconocer el tipo de granulocito; un claro ejemplo son los basófilos de origen de ratón. Anteriormente, se consideraba que los ratones carecían de ellos, pero después, con la ayuda de mejores técnicas de detección basadas en marcadores celulares, se encontró una población circulante de células análogas a los basófilos humanos, aunque su apariencia no es igual por su bajo contenido granular.
Los basófilos son células parecidas funcional y morfológicamente a los mastocitos y es probable que tengan un antecesor común. Las ascidias tienen células parecidas tanto a basófilos como a mastocitos. Los ratones tienen precursores comunes a estas dos poblaciones celulares (46). Sin embargo, en el humano, los basófilos tienen un origen diferente a los mastocitos y ontogénicamente son más cercanos a otros granulocitos. Todavía falta información relacionada con su caracterización en otras especies para llegar a conclusiones más precisas sobre su filogenia.
Otras células. Recientemente se han encontrado otros grupos celulares de interés, tanto inmuno-lógico como evolutivo, ya que representan linajes con funciones innatas en la inmunidad de tipo 2. Como ya se ha mencionado, se acepta que los parásitos intestinales se controlan con la inmunidad adaptativa dependiente de los linfocitos T, pero los hallazgos de una respuesta protectora asociada con el reclutamiento temprano de células hasta ahora desconocidas, sugieren la existencia de una respuesta de tipo 2 temprana independiente de linfocitos T (aunque ligada a ellos) e inducida por varias citocinas provenientes de células epiteliales y otras fuentes.
Por ejemplo, Moro, et al., descubrieron una población celular ("células ayudadoras naturales") en los ganglios linfáticos mesentéricos de ratones infectados con Nippostrongylus brasiliensis, las cuales, en respuesta a la IL-33, producen grandes cantidades de IL-13 y confieren protección contra ese nematodo (2). Por su parte, Neill, et al., describieron los "nuocitos" como un grupo de células que se expanden en los ganglios linfáticos del ratón bajo la influencia de la IL-25 y la IL-33. Estas células, consideradas como "nuevos leucocitos efectores innatos de tipo 2" son una fuente temprana importante de IL-13 durante la infección con el nematodo N. brasiliensis (3). Además, Sáenz, et al., identificaron las "células progenitoras totipotenciales de tipo 2" que también aumentan en número cuando se estimulan con IL-25 y son capaces de diferenciarse a células cebadas, basófilos y células presentadoras de antígenos si tienen suficiente IL-4, IL-5 e IL-13, y participan en mecanismos de resistencia a la infección por el nematodo Trichuris muris (4).
Dado que hacen parte de una reacción inmunitaria innata, rápida y temprana en la ontogenia de la defensa ante estímulos helmínticos y virales (47), estas células podrían ser filogenéticamente tanto o más primitivas que los mastocitos y los basófilos, actuando en circunstancias en las que la IgE no estaba presente. Sería importante dilucidar si ciertas condiciones u otros organismos son capaces de iniciar esta movilización celular.
Relación evolutiva entre la respuesta inmu-nitaria contra helmintos y la respuesta alérgica
La teoría de la evolución basada en la selección natural es un componente fundamental de la biología. Se contrasta con gran claridad en la respuesta inmunitaria por ser un mecanismo estrechamente relacionado con la supervivencia y condicionado por agentes externos fácilmente identificables, como los infecciosos. Sin embargo, en ocasiones se dan como un hecho los efectos de la selección natural o se invocan mecanismos muy generales para explicar aspectos particulares de la evolución, como es el caso de la respuesta alérgica, que para muchos es el resultado de una fuerte presión selectiva ejercida por los parásitos sobre sus huéspedes naturales.
El impacto que tiene un organismo en la evolución de su huésped depende de factores tales como la virulencia y el tiempo de aparición de la invasión (48). Es de esperarse que aquellos con tanta virulencia que causen mortalidad antes de la edad de reproducción, sean los de mayor capacidad de selección natural, pues ante una epidemia, la propagación de los alelos de los individuos resistentes prevalece en las siguientes generaciones. En estas circunstancias que, generalmente, tienen como actores los virus, bacterias u otros microorganismos patógenos, se detectan claramente las presiones selectivas, lo que hace pensar que han contribuido a modelar el sistema inmunológico.
Sin embargo, cuando la relación es de parasitismo, el análisis de sus efectos sobre la evolución del sistema inmunitario es diferente. En el caso particular de las helmintiasis hay, al menos, dos aspectos, uno teórico general y otro derivado de la investigación empírica de los últimos años, que merecen ser tenidos en cuenta. Como mencionamos anteriormente, una gran virulencia del parásito se opone a la relación de parasitismo, cuya existencia depende de la supervivencia del huésped (49). De esta manera, su evolución presupone distintas adaptaciones que la mantengan y es posible que el huésped ejerza mayores presiones selectivas sobre el parásito que viceversa, lo que es muy difícil de demostrar experimentalmente, pero podría ser el caso de los helmintos (50).
Por otro lado, en los últimos 15 años un gran número de investigaciones en inmunoparasitología han detectado el papel inmunomodulador, generalmente inmunosupresor, de varios helmintos como Ascaris lumbricoides y Schistosoma mansoni. Lo usual es que las infecciones por estas dos especies no afecten la reproducción pues, aunque, sin duda, perjudiciales para la salud, son enfermedades crónicas que permiten pasar a la edad de reproducción a una gran parte de los infectados, aun sin los tratamientos antiparasitarios modernos. De haber sucedido que en los huéspedes más primitivos se afectase sustancialmente la reproducción, el proceso no hubiera evolucionado hasta el parasitismo. Planteamos la hipótesis de que la relación de parasitismo que vemos hoy entre helmintos y humanos, se estableció porque los helmintos se adaptaron a convivir con aquellos huéspedes que fueran más vulnerables ante sus mecanismos inmunosupresores y, además, tuvieran una respuesta inmunitaria de tipo 2 lo suficientemente apropiada para no eliminarlos. Aquellos huéspedes con una fuerte respuesta de tipo 2 y poco vulnerables ante los efectos inmunosupresores, evolucionaron principalmente bajo fuerzas selectivas adicionales a los helmintos.
En ese sentido, es conveniente recordar que algunos componentes de la respuesta inmunitaria de tipo 2 precedieron al parasitismo como forma de vida de los helmintos (51). Los platelmintos colonizaron la vida marina alrededor del tiempo de aparición de los peces cartilaginosos. El encuentro con potenciales huéspedes que presentaban una maquinaria celular capaz de reconocerlos y desencadenar una inmunidad de tipo 2, pudo influir en la adaptación de especies de platelmintos a la vida parasitaria, seleccionándose positivamente aquellos resistentes a este tipo de respuesta, probablemente por su capacidad de inducir inmunosupresión.
Entonces, es necesario preguntarse qué otras fuerzas selectivas influyeron de manera decisiva en el mantenimiento del fenotipo hiper-T2: ¿otros agentes infecciosos?, ¿algunos tumores malignos?, ¿las moléculas que hoy consideramos alérgenos?, ¿ninguna fuerza importante y su conservación es el resultado de no tener implicaciones determinantes en el desarrollo de las especies contemporáneas?
Posibles ventajas evolutivas de la respuesta mediada por IgE
Es difícil establecer con certeza las causas de la aparición de nuevos genes y genotipos; pero, además, en el humano se desconocen todavía las bases genotípicas de la mayoría de los rasgos (52). En términos generales, aceptamos que las variaciones genéticas se dan por azar y como consecuencia de factores tanto del ambiente externo como del intracelular, pero las causas de fenómenos específicos, como la duplicación génica, generadora de diversidad y cada vez mejor explicada en términos operativos, continúan sin conocerse (53). En cuanto a la IgE, tampoco se conocen eventos selectivos importantes que expliquen su permanencia evolutiva. Sin embargo, un hecho trascendental es que su síntesis quedó bajo el control de la primitiva respuesta de tipo 2, rasgo que se ha mantenido hasta los mamíferos actuales, en los cuales las infecciones por helmintos, a pesar de la inmunosupresión que las acompaña, inducen una gran producción de IgE, la mayor parte inespecífica y sin relevancia aparente en el control de la infección.
Dado que entre los dos estímulos naturales más conocidos como inductores de producción de IgE específica (los otros son los alérgenos) están los antígenos derivados de helmintos, se ha especulado sobre su relación evolutiva con la conservación de este anticuerpo. Aunque en los vertebrados que no producen IgE los mecanismos inmunológicos que controlan la infestación helmíntica son eficientes (al menos, para evitar que alteren la supervivencia de la especie) y en algunos animales se ha observado que la IgE no determina la resistencia, los estudios en humanos y otras especies de mamíferos sugieren que esta inmunoglobulina participa en los mecanismos de protección (22,54-57). Sin embargo, es difícil precisar la magnitud en que la IgE habría mejorado la respuesta inmunitaria antihelmíntica, pues aun la inmunidad estéril (eliminación completa de los parásitos en un animal infectado) no es un fenómeno usual; además, no se ha descartado que en los estudios epidemiológicos mencionados, la IgE específica sea sólo una señal asociada a la activación de la inmunidad de tipo 2, la cual, con otros mecanismos efectores, se encargaría realmente de la defensa.
Lo anterior permite contemplar la posibilidad de que la evolución de la IgE haya sido influida por otros elementos como tumores malignos, agentes infecciosos como los virus o condiciones relacionadas con propiedades diferentes de su fisiología, como se ha discutido en el caso de los eosinófilos (39,58). Por otro lado, su evolución como proteína y como anticuerpo, no tiene necesariamente que ser producto de fuertes presiones de selección, además de los que confieren ventajas evolutivas, también se conservan rasgos que simplemente no son desventajosos para la supervivencia de la especie; éste es el caso de este anticuerpo, aunque participe en la inflamación alérgica.
La especiación de los helmintos guarda una estrecha relación con su huésped y las adaptaciones se dan en forma relativamente rápida (50,59). Es posible que la IgE tuviera algún impacto evolutivo sobre los helmintos, seleccionando aquellos que resistieran sus efectos. Pero, aunque sea un mecanismo de defensa útil contra los parásitos, no es indispensable para la supervivencia de los huéspedes. Como se mencionó, la inmunidad estéril, aun contando con todos los integrantes de la respuesta de tipo 2, es infrecuente y, al parecer, innecesaria, pues la mayoría de los integrantes de la especie puede vivir y reproducirse estando parasitada. El análisis de la relación huésped-parásito en comunidades humanas con alta exposición, indica que gran parte de los individuos conviven con el parásito pero con una carga parasitaria moderada y los más resistentes continúan hospedando parásitos, aunque en menor cantidad.
Aunque no sean absolutamente necesarias para su permanencia en la escala evolutiva, las ventajas de la respuesta inmunitaria mediada por IgE continúan sin conocerse, al igual que su posible papel fisiológico.
Respuesta TH2 ante moléculas inocuas como los alérgenos
Cerca de 30 % de los humanos normales tienen una respuesta Th2/IgE contra algún alérgeno y esto se detecta aislando clonas específicas de tipo Th2 y anticuerpos preferencialmente del isotipo IgE. Hasta ahora no hay motivos para concluir que esta hipersensibilidad se deba a diferencias en la exposición o a particularidades moleculares de los alérgenos, y todo parece indicar que la composición genética de los individuos es el factor decisivo. Otro aspecto interesante de la atopia es que inicialmente sus mecanismos se consideraban iguales a la inmunidad contra parásitos, pero la investigación clínica y experimental ha demostrado diferencias importantes, especialmente en cuanto al papel relativo de la IgE en ambos procesos, con un papel más evidente y relevante en la atopia y la inflamación alérgica. En este sentido, es importante considerar que cuando la IgE apareció en la historia evolutiva ya había transcurrido un gran período de interacciones entre huéspedes y helmintos (14).
Si bien se investiga con frecuencia sobre los aspectos evolutivos de la inmunidad de tipo 2 antiparasitaria, no es costumbre hacerlo respecto a los primeros organismos que reaccionaron a los alérgenos, que como los pólenes estaban presentes en la naturaleza mucho antes que los animales más primitivos. Hoy se da por sentado que estas reacciones son propias sólo de mamíferos porque tienen IgE, pero cada día hay más información que indica que ciertas moléculas ampliamente reconocidas como alérgenos activan vías de la respuesta inflamatoria T2 distintas a la producción de IgE específica (7). Parece, entonces, que esas substancias hayan estimulado el sistema inmunológico más temprano (en términos evolutivos) de lo que se cree, inclusive antes de que la IgE existiera. Actualmente, la definición de alérgenos tiene en cuenta sólo aquellas moléculas capaces de inducir una respuesta IgE, pero esto es simplemente una definición operativa y limitada a los mamíferos, sin pretensiones de abarcar lo que haya podido suceder evolutivamente.
Ante el conocido interrogante sobre por qué existe respuesta Th2/IgE contra alérgenos, la respuesta más aceptada es "porque es una consecuencia de las defensas contra los parásitos". En esta revisión hemos argumentado que este problema científico puede interpretarse y explicarse de otras maneras. Consideramos la posibilidad de que esta "hiperrespuesta" haya podido moldearse por ser protectora contra agentes infecciosos más virulentos que los parásitos, ya que estos últimos han empleado como huéspedes a la población con menor respuesta de tipo 2 y, además, vulnerable ante la inmunosupresión, la cual se ha demostrado estar dada por diversos mecanismos que incluyen células reguladoras y citocinas antiinflamatorias, tales como la IL-10 y el TGF-b (60).
La atopia es un rasgo genético modulado, por una parte, por alelos que determinan la especificidad de la respuesta inmunitaria y, además, por otros que, de manera más general, regulan la inmunidad de tipo 2. En muchos casos se asocia clínicamente con la enfermedad alérgica, fenotipo definido por componentes genéticos y ambientales adicionales. Sustentando la hipótesis de que la fijación de los alelos que condicionan una "hiperrespuesta" Th2/IgE sucedió por situaciones distintas a las helmintiasis, los resultados de estudios de epidemiología genética en diversas poblaciones, muestran numerosas asociaciones entre polimorfismos de genes del complejo mayor de histocompatibilidad y otros de respuesta inmunitaria e IgE específica contra alérgenos (61), una minoría de ellas con alelos que han sido asociados también con propensión a las infecciones parasitarias.
Sin embargo, hay datos que sugieren la existencia de alelos comunes a la respuesta alérgica mediada por IgE y la resistencia a helmintiasis, información que ha sido usada con frecuencia para sustentar la hipótesis de que fue la presión selectiva ejercida por los parásitos la generadora de la respuesta alérgica. Una característica de estos estudios es que los alelos de propensión a helmintiasis y de respuesta contra alérgenos se han investigado en poblaciones y ambientes diferentes, por lo que las conclusiones son indirectas en su mayoría (62-63), limitación que se extiende a otras investigaciones sobre el tema que emplean métodos de bioinformática (64). En cambio, en un estudio reciente se observó, en una misma población expuesta a alérgenos de ácaros y A. lumbricoides, asociaciones de algunos alelos con la respuesta IgE contra A. lumbricoides, pero no con la dirigida a los ácaros (65).
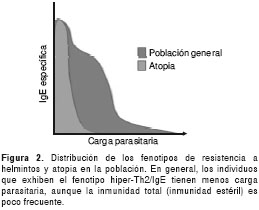
De acuerdo con nuestra línea de pensamiento, el hecho de que la atopia se observe más frecuentemente en la población que responde de manera más intensa a los parásitos (figura 2) no es prueba de un papel relevante de las infecciones parasitarias en el origen y evolución de la respuesta alérgica, especialmente la mediada por IgE. Por el contrario, apoya la idea de una evolución más independiente del fenotipo hiper-Th2/IgE respecto a las helmintiasis. El mismo fenómeno puede verse desde otro ángulo: en la población con una "hiperrespuesta" Th2/IgE, las infecciones por helmintos son menos frecuentes y más leves, posiblemente porque, además de su hiperreactividad inmunológica, carecen de los alelos expuestos a la inmunosupresión de los parásitos. Precisamente una alteración en las alergias es la disminución de los niveles de IL-10 y linfocitos T reguladores, a diferencia de la respuesta inmunitaria frente a helmintos, la cual, aunque esté polarizada hacia Th2, también incluye una producción elevada de IL-10 y la inducción de otros mecanismos inmunorreguladores. Queda así planteado que la naturaleza de las fuerzas selectivas que llevaron al fenotipo hiper-Th2/IgE es todavía un enigma sobre el cual merecen considerarse otras explicaciones distintas a las corrientemente aceptadas.
Situación actual
Nuestros argumentos no ponen en duda la gran trascendencia de las relaciones entre las helmintiasis y la respuesta Th2/IgE, la cual hemos analizado en otras oportunidades (66); más bien enfocan el tema hacia las interpretaciones de su impacto potencial en la evolución de la respuesta alérgica. La teoría de la selección natural nos da herramientas conceptuales esenciales para explicar la evolución de los organismos y sus caracteres, pero por sí misma no explica los mecanismos que intervienen en cada caso particular, para lo cual se requiere que logremos una coherencia teórica basada en los datos disponibles, desde los más primitivos hasta los contemporáneos; este ejercicio no se ha hecho con la suficiente rigurosidad en el tema específico de la respuesta alérgica. En ese sentido, esta revisión aspira a llamar la atención sobre esa necesidad, de gran importancia teórica y práctica.
Según los expertos, no es función de la teoría darwiniana predecir cómo será la evolución de los organismos en el futuro (67), pero es razonable contemplar sus consecuencias en el presente, con la precaución de que, en términos evolutivos, éste podría ser un momento fugaz. Por ejemplo, como consecuencia de la particular relación que se ha establecido entre helmintos y huéspedes después del largo proceso evolutivo, hoy es ampliamente aceptado que un factor influyente en el aumento actual de las enfermedades alérgicas es la ausencia de la inmunosupresión ejercida por los parásitos debido a la erradicación progresiva de las enfermedades parasitarias en muchos lugares del planeta. De ser verdadera esta hipótesis, tema que hemos analizado en otro lugar (68), sustentaría la idea de que los helmintos, en lugar de haber sido una fuerza selectiva importante en la generación de la respuesta atópica (hiper-Th2/IgE) de los humanos, se adaptaron a vivir de ellos mediante mecanismos inmunosupresores.
Sin embargo, dado que para presentarse clínicamente las enfermedades alérgicas requieren más alteraciones además de la atopia, la proporción en que se aumente su prevalencia como consecuencia de las medidas sanitarias se limitará a los grupos de población genéticamente predispuestos tanto a la atopia como a otras alteraciones que especifiquen el fenotipo. De hecho, en las sociedades donde se han erradicado las parasitosis desde hace muchos años, sólo una minoría de la población padece de enfermedades alérgicas. Esa minoría, que también existe en las poblaciones actualmente expuestas a grados diversos de helmintiasis, sin duda comparte con el resto de la población numerosos genes de resistencia a enfermedades, incluyendo las parasitarias, pero, a diferencia de los demás, se caracteriza por su tendencia a responder intensamente con IgE a una variedad de moléculas, desde las más conservadas filogenéticamente hasta los medicamentos más novedosos. Lo anterior puede plantearse de manera resumida así: la mayoría de los humanos reaccionan con una respuesta Th2/IgE contra los helmintos, pero un pequeño porcentaje de esa mayoría responde además a los alérgenos inocuos.
Pero aun exhibiendo esta "hiperrespuesta" inmu-nitaria, dicha población no es totalmente resistente a las helmintiasis; en consecuencia, creemos que sus integrantes se han mantenido por motivos distintos a que esa propiedad les confiera una ventaja evolutiva, respecto a la supervivencia a las helmintiasis, sobre el grueso de la población que tiene una respuesta Th2 promedio. Es más, este grupo tiene el riesgo potencial de dos condiciones adversas, a saber: a) los daños tisulares causados por el fuerte rechazo a la invasión por helmintos (69-70), y b) las enfermedades alérgicas. Ninguna de las dos situaciones confiere ventaja evolutiva, pero tampoco llegan a ser fuerzas selectivas porque no afectan de manera importante la reproducción de la población. Caracterizar fenotípica y genéticamente a esta subpoblación ayudaría mucho a reorientar las especulaciones sobre su origen evolutivo.
Los autores declaran que no tienen conflicto de interés.
Las investigaciones que sustentan la revisión fueron financiadas por Colciencias, contratos No. 680-2009 y No. 602-2009.
Correspondencia:
Luis Caraballo, Instituto de Investigaciones Inmunológicas, Universidad de Cartagena, Cartagena, Colombia Teléfono: (310) 352-7373; fax: (575) 669-8491 caraballo@fundemeb.org
Referencias
1. Allen JE, Maizels RM. Diversity and dialogue in immunity to helminths. Nat Rev Immunol. 2011;11:375-88. [ Links ]
2. Moro K, Yamada T, Tanabe M, Takeuchi T, Ikawa T, Kawamoto H, et al. Innate production of T(H)2 cytokines by adipose tissue-associated c-Kit(+)Sca-1(+) lymphoid cells. Nature. 2010;463:540-4. [ Links ]
3. Neill DR, Wong SH, Bellosi A, Flynn RJ, Daly M, Langford TK, et al. Nuocytes represent a new innate effector leukocyte that mediates type-2 immunity. Nature. 2010;464:1367-70. [ Links ]
4. Sáenz SA, Siracusa MC, Perrigoue JG, Spencer SP, Urban JF Jr, Tocker JE, et al. IL25 elicits a multipotent progenitor cell population that promotes T(H)2 cytokine responses. Nature. 2010;464:1362-6. [ Links ]
5. Jenkins SJ, Ruckerl D, Cook PC, Jones LH, Finkelman FD, van Rooijen N, et al. Local macrophage proliferation, rather than recruitment from the blood, is a signature of TH2 inflammation. Science. 2011;332:1284-8. [ Links ]
6. McCoy KD, Harris NL, Diener P, Hatak S, Odermatt B, Hangartner L, et al. Natural IgE production in the absence of MHC Class II cognate help. Immunity. 2006;24:329-39. [ Links ]
7. Mattes J, Collison A, Plank M, Phipps S, Foster PS. Antagonism of microRNA-126 suppresses the effector function of TH2 cells and the development of allergic airways disease. Proc Natl Acad Sci U S A. 2009;106:18704-9. [ Links ]
8. Mousavi M, Rabbani H, Hammarstrom L. Characterization of the bovine epsilon gene. Immunology. 1997;92:369-73. [ Links ]
9. Sakoyama Y, Hong KJ, Byun SM, Hisajima H, Ueda S, Yaoita Y, et al. Nucleotide sequences of immunoglobulin epsilon genes of chimpanzee and orangutan: DNA molecular clock and hominoid evolution. Proc Natl Acad Sci U S A. 1987 84:1080-4. [ Links ]
10. Vernersson M, Pejler G, Kristersson T, Alving K, Hellman L. Cloning, structural analysis, and expression of the pig IgE epsilon chain. Immunogenetics. 1997;46:461-8. [ Links ]
11. Faith RE, Clem LW. Passive cutaneous anaphylaxis in the chicken. Biological fractionation of the mediating antibody population. Immunology. 1973;25:151-64. [ Links ]
12. Jurd RD. Hypersensitivity in fishes: A review. J Fish Biol. 1987;31:1-7. [ Links ]
13. Miller NW. In vitro culture approaches for studying immune cell functions in ectothermic vertebrates. Dev Comp lmmunol. 1994;18(Suppl.1):S132. [ Links ]
14. Jackson JA, Friberg IM, Little S, Bradley JE. Review series on helminths, immune modulation and the hygiene hypothesis. Immunity against helminths and immunological phenomena in modern human populations: Coevolutionary legacies? Immunology. 2009;126:18-27. [ Links ]
15. Hu YL, Xiang LX, Shao JZ. Identification and characterization of a novel immunoglobulin Z isotype in zebrafish: Implications for a distinct B cell receptor in lower vertebrates. Mol Immunol. 2010;47:738-46. [ Links ]
16. Paul W. Fundamental Immunology. 6th edition. Philadelphia: Lippincott Williams and Wilkins; 2008. [ Links ]
17. Sung SC, Cheng CH, Chou CM, Chu CY, Chen GD, Hwang PP, et al. Expression and characterization of a constitutively active STAT6 from Tetraodon. Fish Shellfish Immunol. 2010;28:819-28. [ Links ]
18. Hirasawa R, Shimizu R, Takahashi S, Osawa M, Takayanagi S, Kato Y, et al. Essential and instructive roles of GATA factors in eosinophil development. J Exp Med. 2002;195:1379-86. [ Links ]
19. Gould HJ, Sutton BJ. IgE in allergy and asthma today. Nat Rev Immunol. 2008;8:205-17. [ Links ]
20. Oettgen HC, Martin TR, Wynshaw-Boris A, Deng C, Drazen JM, Leder P. Active anaphylaxis in IgE-deficient mice. Nature. 1994;370:367-70. [ Links ]
21. Altin J, Shen C, Liston A. Understanding the genetic regulation of IgE production. Blood Rev. 2010;24:163-9. [ Links ]
22. McSharry C, Xia Y, Holland CV, Kennedy MW. Natural immunity to Ascaris lumbricoides associated with immunoglobulin E antibody to ABA-1 allergen and inflammation indicators in children. Infect Immun. 1999;67:484-9. [ Links ]
23. Karagiannis SN, Wang Q, East N, Burke F, Riffard S, Bracher MG, et al. Activity of human monocytes in IgE antibody-dependent surveillance and killing of ovarian tumor cells. Eur J Immunol. 2003;33:1030-40. [ Links ]
24. Melbye M, Smedby KE, Lehtinen T, Rostgaard K, Glimelius B, Munksgaard L, et al. Atopy and risk of non-Hodgkin lymphoma. J Natl Cancer Inst. 2007;99:158-66. [ Links ]
25. Wiemels JL, Wiencke JK, Patoka J, Moghadassi M, Chew T, McMillan A, et al. Reduced immunoglobulin E and allergy among adults with glioma compared with controls. Cancer Res. 2004;64:8468-73. [ Links ]
26. Riemer AB, Untersmayr E, Knittelfelder R, Duschl A, Pehamberger H, Zielinski CC, et al. Active induction of tumor-specific IgE antibodies by oral mimotope vaccination. Cancer Res. 2007;67:3406-11. [ Links ]
27. Gambon-Deza F, Sánchez-Espinel C, Magadan-Mompo S. The immunoglobulin heavy chain locus in the platypus (Ornithorhynchus anatinus). Mol Immunol. 2009;46:2515-23. [ Links ]
28. Fellah JS, Kerfourn F, Wiles MV, Schwager J, Charlemagne J. Phylogeny of immunoglobulin heavy chain isotypes: Structure of the constant region of Ambystoma mexicanum upsilon chain deduced from cDNA sequence. Immunogenetics. 1993;38:311-7. [ Links ]
29. Mussmann R, Wilson M, Marcuz A, Courtet M, Du Pasquier L. Membrane exon sequences of the three Xenopus Ig classes explain the evolutionary origin of mammalian isotypes. Eur J Immunol. 1996;26:409-14. [ Links ]
30. Taylor AI, Gould HJ, Sutton BJ, Calvert RA. Avian IgY binds to a monocyte receptor with IgG-like kinetics despite an IgE-like structure. J Biol Chem. 2008;283:16384-90. [ Links ]
31. Huising MO, Kruiswijk CP, Flik G. Phylogeny and evolution of class-I helical cytokines. J Endocrinol. 2006;189:1-25. [ Links ]
32. Avery S, Rothwell L, Degen WD, Schijns VE, Young J, Kaufman J, et al. Characterization of the first nonmammalian T2 cytokine gene cluster: The cluster contains functional single-copy genes for IL-3, IL-4, IL-13, and GM-CSF, a gene for IL-5 that appears to be a pseudogene, and a gene encoding another cytokinelike transcript, KK34. J Interferon Cytokine Res. 2004;24:600-10. [ Links ]
33. Li JH, Shao JZ, Xiang LX, Wen Y. Cloning, characterization and expression analysis of pufferfish interleukin-4 cDNA: The first evidence of Th2-type cytokine in fish. Mol Immunol. 2007;44:2078-86. [ Links ]
34. Liongue C, Ward AC. Evolution of class I cytokine receptors. BMC Evol Biol. 2007;7:120. [ Links ]
35. Giulianini PG, Bierti M, Lorenzon S, Battistella S, Ferrero EA. Ultrastructural and functional characterization of circulating hemocytes from the freshwater crayfish Astacus leptodactylus: Cell types and their role after in vivo artificial non-self challenge. Micron. 2007;38:49-57. [ Links ]
36. Balla KM, Lugo-Villarino G, Spitsbergen JM, Stachura DL, Hu Y, Banuelos K, et al. Eosinophils in the zebrafish: Prospective isolation, characterization, and eosinophilia induction by helminth determinants. Blood. 2010;116:3944-54. [ Links ]
37. Klion AD, Nutman TB. The role of eosinophils in host defense against helminth parasites. J Allergy Clin Immunol. 2004;113:30-7. [ Links ]
38. Zhang J, Rosenberg HF, Nei M. Positive Darwinian selection after gene duplication in primate ribonuclease genes. Proc Natl Acad Sci USA. 1998;95:3708-13. [ Links ]
39. Lee JJ, Lee NA. Eosinophil degranulation: An evolutionary vestige or a universally destructive effector function? Clin Exp Allergy. 2005;35:986-94. [ Links ]
40. de Barros CM, Andrade LR, Allodi S, Viskov C, Mourier PA, Cavalcante MC, et al. The hemolymph of the ascidian Styela plicata (Chordata-Tunicata) contains heparin inside basophil-like cells and a unique sulfated galactoglucan in the plasma. J Biol Chem. 2007;282:1615-26. [ Links ]
41. Crivellato E, Ribatti D. The mast cell: An evolutionary perspective. Biol Rev Camb Philos Soc. 2010;85:347-60. [ Links ]
42. Reite OB, Evensen O. Inflammatory cells of teleostean fish: A review focusing on mast cells/eosinophilic granule cells and rodlet cells. Fish Shellfish Immunol. 2006;20:192-208. [ Links ]
43. Matsuyama T, Lida T. Degranulation of eosinophilic granular cells with possible involvement in neutrophil migration to site of inflammation in tilapia. Dev Comp Immunol. 1999;23:451-7. [ Links ]
44. Fey F. Vergleichende hamozytologie niederer Vertebraten. III. Granulozyten. Folia Haematol. 1966;86:1-20. [ Links ]
45. Rowley A, Hunt T, Page M. Fish. In: Rowley AF, Ratcliffe NA, editors. Vertebrate blood cells. Cambridge: Cambridge University Press; 1988. [ Links ]
46. Arinobu Y, Iwasaki H, Akashi K. Origin of basophils and mast cells. Allergol Int. 2009;58:21-8. [ Links ]
47. Chang YJ, Kim HY, Albacker LA, Baumgarth N, McKenzie AN, Smith DE, et al. Innate lymphoid cells mediate influenza-induced airway hyper-reactivity independently of adaptive immunity. Nat Immunol. 2011;12:631-8. [ Links ]
48. Schmid-Hempel P. Parasite immune evasion: A momentous molecular war. Trends Ecol Evol. 2008;23:318-26. [ Links ]
49. Anderson RM, May RM. Coevolution of hosts and parasites. Parasitology. 1982;85:411-26. [ Links ]
50. LoVerde PT, DeWald J, Minchella DJ, Bosshardt SC, Damian RT. Evidence for host-induced selection in Schistosoma mansoni. J Parasitol. 1985;71:297-301. [ Links ]
51. Littlewood DT, Curini-Galletti M, Herniou EA. The interrelationships of proseriata (Platyhelminthes: seriata) tested with molecules and morphology. Mol Phylogenet Evol. 2000;16:449-66. [ Links ]
52. Varki A, Altheide TK. Comparing the human and chimpanzee genomes: Searching for needles in a haystack. Genome Res. 2005;15:1746-58. [ Links ]
53. Caporale LH. Natural selection and the emergence of a mutation phenotype: An update of the evolutionary synthesis considering mechanisms that affect genome variation. Annu Rev Microbiol. 2003;57:467-85. [ Links ]
54. Bethony J, Loukas A, Smout M, Brooker S, Mendez S, Plieskatt J, et al. Antibodies against a secreted protein from hookworm larvae reduce the intensity of hookworm infection in humans and vaccinated laboratory animals. FASEB J. 2005;19:1743-5. [ Links ]
55. Turner JD, Faulkner H, Kamgno J, Kennedy MW, Behnke J, Boussinesq M, et al. Allergen-specific IgE and IgG4 are markers of resistance and susceptibility in a human intestinal nematode infection. Microbes Infect. 2005;7:990-6. [ Links ]
56. Dunne DW, Butterworth AE, Fulford AJ, Kariuki HC, Langley JG, Ouma JH, et al. Immunity after treatment of human schistosomiasis: Association between IgE antibodies to adult worm antigens and resistance to reinfection. Eur J Immunol. 1992;22:1483-94. [ Links ]
57. Pinot de Moira A, Fulford AJ, Kabatereine NB, Ouma JH, Booth M, Dunne DW. Analysis of complex patterns of human exposure and immunity to Schistosomiasis mansoni: The influence of age, sex, ethnicity and IgE. PLoS Negl Trop Dis. 2010;4:e820. [ Links ]
58. Lee JJ, Jacobsen EA, McGarry MP, Schleimer RP, Lee NA. Eosinophils in health and disease: The LIAR hypothesis. Clin Exp Allergy. 2010;40:563-75. [ Links ]
59. Maizels RM, Kurniawan-Atmadja A. Variation and polymorphism in helminth parasites. Parasitology. 2002;125(Suppl.):S25-37. [ Links ]
60. Dunne DW, Cooke A. A worm´s eye view of the immune system: Consequences for evolution of human autoimmune disease. Nat Rev Immunol. 2005;5:420-6. [ Links ]
61. Fernández-Caldas E, Puerta L, Caraballo L, Lockey RF. Mite allergens. Clin Allergy Immunol. 2008;21:161-82. [ Links ]
62. Grant AV, Araujo MI, Ponte EV, Oliveira RR, Cruz AA, Barnes KC, et al. Polymorphisms in IL10 are associated with total immunoglobulin E levels and Schistosoma mansoni infection intensity in a Brazilian population. Genes Immun. 2011;12:46-50. [ Links ]
63. Moller M, Gravenor MB, Roberts SE, Sun D, Gao P, Hopkin JM. Genetic haplotypes of Th-2 immune signalling link allergy to enhanced protection to parasitic worms. Hum Mol Genet. 2007;16:1828-36. [ Links ]
64. Fumagalli M, Pozzoli U, Cagliani R, Comi GP, Bresolin N, Clerici M, et al. The landscape of human genes involved in the immune response to parasitic worms. BMC Evol Biol. 2010;10:264. [ Links ]
65. Acevedo N, Mercado D, Vergara C, Sánchez J, Kennedy MW, Jiménez S, et al. Association between total immunoglobulin E and antibody responses to naturally acquired Ascaris lumbricoides infection and polymorphisms of immune system-related LIG4, TNFSF13B and IRS2 genes. Clin Exp Immunol. 2009;157:282-90. [ Links ]
66. Acevedo N, Caraballo L. IgE cross-reactivity between Ascaris lumbricoides and mite allergens: Possible influences on allergic sensitization and asthma. Parasite Immunol. 2011;33:309-21. [ Links ]
67. Coyne J. Why evolution is true. New York: Penguin Group; 2009. [ Links ]
68. Caraballo L, Acevedo N. New allergens of relevance in tropical regions: The impact of Ascaris lumbricoides infections. World Allergy Organization Journal. 2011;4:77-84. [ Links ]
69. Hoffmann KF, Cheever AW, Wynn TA. IL-10 and the dangers of immune polarization: excessive type 1 and type 2 cytokine responses induce distinct forms of lethal immunopathology in murine schistosomiasis. J Immunol. 2000;164:6406-16. [ Links ]
70. Pearce EJ, MacDonald AS. The immunobiology of schistosomiasis. Nat Rev Immunol. 2002;2:499-511. [ Links ]














