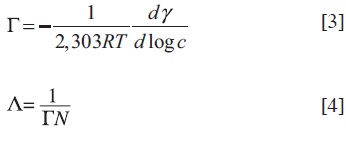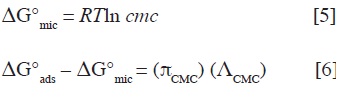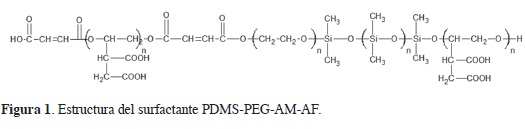Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.41 no.1 Bogotá Jan./Apr. 2012
PROPIEDADES INTERFACIALES DEL SURFACTANTE PDMS-PEG-ANHÍDRIDO MALÉICO-ÁCIDO FUMÁRICO (PDMS-PEG-AM-AF) EN SOLUCIÓN ACUOSA
INTERFACIAL PROPERTIES OF SURFACTANT PDMS-PEG-MALEIC ANHYDRIDE-FUMARIC ACID (PDMS-PEG-AM-AF) IN AQUEOUS SOLUTION
PROPRIEDADES INTERFACIAIS DO SURFACTANTE PDMS-PEG-ANIDRIDO MALEICO-ÁCIDO FUMÁRICO (PDMS-PEG-AM-AF) EM SOLUÇÂO AQUOSA
Johana Rodríguez-Ruiz1,2,3, Edgardo Meza-Fuentes4, Maria Cecília Azevedo Esperidião2
1 Grupo de Investigación en Procesos de la Industria Petroquímica. Sena - Centro para la Industria Petroquímica, Regional Bolívar, Cartagena, Colombia.
2 Laboratorio de Analise e Desenvolvimento de Polimeros, Universidade Federal da Bahia, Salvador, Brasil.
4 Grupo de Estudios en Materiales y Combustibles, Universidad de Cartagena, Cartagena, Colombia.
Recibido 27/12/11 – Aceptado: 23/04/12
RESUMEN
En este estudio se determinaron las propiedades interfaciales en solución acuosa del surfactante del tipo PDMS-éster que contiene polidimetilsiloxano (PDMS), polietilenglicol (PEG), anhídrido maléico y ácido fumárico. Para el estudio de las propiedades interfaciales se emplearon las técnicas tensiometría y espectroscopia en la región del UV-VIS. En solución acuosa este surfactante mostró un comportamiento complejo, que es dependiente de la concentración. En este surfactante se observó un cambio brusco en la curva de tensión superficial en función de la concentración, produciendo una reducción de la tensión superficial del agua hasta 48,9 mN/m en la CMC. La concentración del surfactante en la CMC fue de 1032 mg/L. La eficiencia del surfactante PDMS-éster se calculó como pC20 y se determinó como la concentración del surfactante necesaria para conseguir una disminución de la tensión superficial de 20 mN/m. El valor de C20 obtenido fue 213 mg/L (1,554x10-5 mol/L) (pC20=4,81). Esta concentración sirve como un indicador de la eficiencia de la adsorción del surfactante, ya que la reducción de la tensión superficial de la solución por el surfactante depende de la substitución de moléculas en la interface solución/vapor.
Palabras clave: silicona, surfactan-tes, propiedades interfaciales, concentración micelar crítica.
ABSTRACT
In this work the interfacial properties in aqueous solution of surfactant of si-licon PDMS-ester type containing PEG, anhydride maleic and fumaric acid had been determined. In order to study the interfacial properties tensiometry and spectroscopy UV-VIS techniques were used. The surfactant in aqueous solution showed a complex behavior and this is dependent on the concentration. This surfactant was showed an abrupt change in surface tension curve as a function of concentration, leading to reduced sur-face tension of water to 48.9 mN/m in the CMC. The concentration of surfac-tant in the CMC was 1032 mg/L. The effciency of the PDMS-ester surfactant was calculated as pC20 and determined as the concentration of surfactant re-quired to achieve a decrease in surface tension up 20mN/m. The value of C20 obtained was 213 mg/L (1.554 x10-5 mol/L) (pC20 = 4.81). This concentra-tion serves as an indicator of the eff-ciency of adsorption of the surfactant, since the reduction of surface tension of the surfactant solution depends on the substitution of molecules at the interfa-ce solution / vapor.
Key words: Silicon, surfactant, interfacial properties, Critical micellar concentration.
RESUMO
Neste trabalho foi feita a determinação das propriedades interfaciais do surfactante de silicone tipo PDMS-éster, con-tendo PEG, anidrido maleico e ácido fumárico. Para o estudo das propriedades interfaciais foram utilizadas as técnicas tensiometria e espectroscopia na região UV-VIS. Em solucao aquosa, este surfactante mostra um comportamento complexo e é dependente da concentracao; além disso, mostra urna mudança brusca na curva de tensão superficial em função da concentracao, produzindo urna reducao da tensão superficial da água até 48,9 (mN/m) na CMC. A concentracao do surfactante na CMC foi de 1032 mg/L. A eficiência do surfactante PDMS-éster foi calculada como pC20 determinada como a concentracao do surfactante necessá-ria para conseguir urna diminuicao da tensão superficial de 20mN/m. O valor de C20 obtido foi 213 mg/L (1,554x10"5 mol/L) (pC20=4,81). Esta concentracao serve como um indicador da eficiência da adsorcao do surfactante, já que a redução da tensão superficial da solução pelo surfactante depende da substituicao de moléculas na interface solucao/vapor.
Palavras-chave: Silicone, surfactan-tes, propriedades interfaciais, concentracao micelar crítica.
INTRODUCTION
Un surfactante adsorbe en la interface líquido-líquido como un flm interfacial orientado, lo que conduce a la disminución en la energía libre interfacial la cual permite una mayor área de contacto entre las fases. La formación de un flm molecular ordenado en las interfaces reduce la tensión interfacial y superficial, determinando así las propiedades únicas de los surfactantes. La clasificación química de los surfactantes se basa en la naturaleza del grupo hidrofílico presente en su estructura, clasifcándolos en cuatro grupos grandes: aniónicos, catiónicos, no iónicos y anfotéricos o zwitteriónicos (1).
Los surfactantes de silicona son regularmente oligómeros y polímeros derivados del poli-(dimetilsiloxano), en los que los grupos metilo (CH3) se substituyen parcialmente por grupos aniónicos. Estos surfactantes poseen una gran variedad de aplicaciones debido a propiedades como estabilidad térmica, baja tensión superf-cial, resistencia a rayos ultravioleta, versatilidad, bajo costo y ventajas tecnológicas.
Dependiendo de su estructura, los surfactantes de silicona pueden presentar actividad superficial no solamente en agua sino también en solventes orgánicos; además presentan una alta variedad de masas moleculares y estructuras (lineales, ramificadas, etc.). La gran variedad de rutas de síntesis conduce a la obtención de un alto número de productos con propiedades diferentes.
El grupo hidrofóbico poli-(dimetil-siloxano) (PDMS) funcionalizado con uno o más grupos polares puede producir materiales solubles en agua. Estos surfactantes son muy efectivos en las inter-faces líquido-aire (1), resultando un rápido proceso de mojado en superficies de baja energía, debido a que las cadenas de poli-(dimetilsiloxano) tienen grupos metilo cuya energía de cohesión es muy baja al compararse con los grupos metileno (2). La aplicación de los surfactantes de silicona se atribuye a su elevada actividad superficial, al bajo nivel de toxicidad y a que pueden utilizarse en emulsiones con una gran variedad de componentes lipofílicos.
Entre los surfactantes a base de PDMS se encuentran algunos en los que se han insertado grupos de poli-(óxido de etileno). Los poliésteres de PEG y PDMS presentan buena actividad superficial y solubilidad en agua; sin embargo, se hace necesario determinar la longitud ideal de la cadena PEG ya que el aumento de este parámetro puede disminuir la actividad superficial (3).
Propiedades interfaciales
Cuando están presentes en soluciones acuosas de bajas concentraciones, las moléculas de los surfactantes pueden localizarse en la superficie del agua formando el flm superficial, o en el interior de la solución de forma aislada o en pares. Cuando aumenta la concentración se forman las micelas que son agregados de monómeros que adoptan diferentes geometrías (4). Normalmente, el flm superficial formado es bien homogéneo y no admite más moléculas cuando la solución llega a una concentración específca llamada concentración micelar crítica (CMC). Cuando aumenta la concentración por encima de la CMC, la tensión superficial permanece constante ya que la fuerza de cohesión de las moléculas en la superficie se modifica poco (1).
En un ejemplo típico de variación de tensión superficial con la concentración, se pueden observar tres regiones distintas. En la primera región -a bajas concentraciones-, la tensión superficial prácticamente no se altera. Cuando ocurre la formación del flm superficial, la tensión disminuye acentuadamente hasta el punto donde se inicia la formación de micelas. Existe una tercera región donde la tensión superficial nuevamente permanece constante indicando que el máximo de absorción se alcanzó. La CMC se puede determinar a partir del segundo punto de infexión de la curva de la tensión superficial en función de la concentración del surfactante (5, 6). La CMC también puede calcularse a través de la medida de la variación de propiedades físicas como la conductancia eléctrica, presión osmótica, viscosidad, índice de refracción y por espectros de absorción en la región del U V, en función de la concentración del surfactante (7). En el caso de algunos surfactantes a base de silicona, debido a su carácter lipofílico, la CMC se ha determinado como la concentración en la que la tensión superficial se reduce al valor más bajo posible, y en este caso se denomina CMC relativa (5).
La determinación de la CMC por espectroscopia en la región del ultravioleta se realiza considerándose la concentración a partir de la cual la absorbancia en una longitud de onda predeterminada permanece constante (método del desvío de la absorbancia) o disminuye con el aumento de la concentración, indicando la formación de agregados (5, 8).
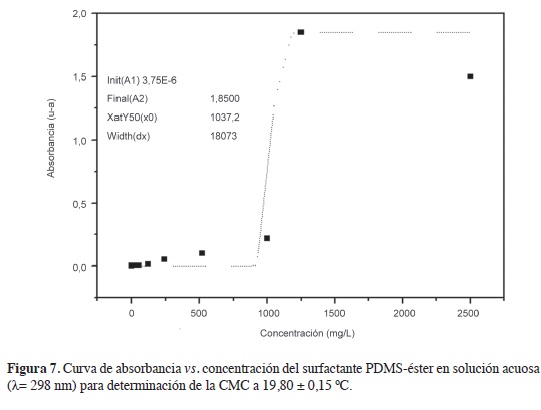
En otro método que usa la absorción en la región del ultravioleta la CMC se determina a partir de la curva de absorbancia en función de la concentración, ajustando los puntos a un modelo sig-moidal en el que el centro de la sigmoidea (x0) corresponde a la CMC (9, 10).
En concentraciones por debajo de la CMC, la tensión superficial varía li-nealmente con el aumento del logaritmo neperiano de la concentración, ya que en sistemas diluidos de surfactante la actividad puede sustituirse por la concentración sin pérdidas serias de exactitud, como indica la ecuación [1] (1).
La ecuación [1] es la isoterma de adsorción de Gibbs, en la que γ es la tensión superficial (dina/cm); Γ, la concentración máxima en la superficie; R, la constante universal de los gases; T, la temperatura absoluta, y c, la concentración en fracción másica.
La presión de la superficie en la CMC (πCMC) describe cuánto surfactante disminuye la tensión interfacial y se calcula por la ecuación [2], en la que γ0 es la tensión superficial del agua pura (1).
Los valores de Γ y del área mínima (Å2/molécula), ocupada por la molécula de surfactante en interface aire-líquido (A) pueden calcularse por las ecuaciones [3] y [4].
Donde N es el número de Avogadro y dγ/d(log c), la inclinación de la recta inmediatamente anterior a la CMC. La energía libre estándar de micelización ΔG°mic (ecuación [5]) y la energía libre estándar de adsorción ΔG°ads (ecuación [6]) pueden calcularse por la ecuación de Clausius-Clapeyron.
Cuando se discute el desempeño de un surfactante en la disminución de la tensión superficial de una solución es necesario considerar la concentración del surfactante requerida para producir una, dada la disminución de la tensión superficial (20 mN/m, valor estándar) y la reducción máxima en la tensión superficial que puede obtenerse, independientemente de la concentración del surfactante presente. Como la eficiencia de un surfactante es directamente relacionada a la termodinámica de la transferencia de cadena del surfactante al volumen de la interface, es de esperarse que modificaciones en la cadena puedan alterar esta característica. La efectividad de la adsorción puede determinarse con la CMC, y la cantidad máxima del surfactante adsorbida puede aproximarse a la concentración máxima en el volumen del surfactante libre, asumiendo que puede ignorarse la disminución mínima en la tensión superficial de algunos surfactantes encima de la CMC. En cuanto al efecto de la estructura molecular sobre la eficiencia de algunos surfactantes es primariamente termodinámica; la efectividad está más relacionada con el tamaño de las porciones hidrofílicas e hidrofóbicas de las moléculas adsorbidas. Considerando la adsorción de moléculas en una interface, el máximo número de moléculas que pueden acomodarse en un área determinada depende del área ocupada por cada molécula (1). En este estudio se sintetizó un surfactante del tipo PDMS-éster, y se midieron las propiedades interfaciales en solución acuosa de este material para comprobar su eficiencia en posibles usos.
METODOLOGÍA
La síntesis del surfactante PDMS-PEG-Anhídrido maléico-ácido fumárico (PDMS-PEG-AM-AF o PDMS-éster) se realizó utilizando la metodología de Liu et al. (3), que consta de cuatro etapas. Para la síntesis se usó polidimetilsiloxano comercial (masa molar media 3400 g/mol y viscosidad de 350 cps), ácido fumárico (99,9 %, marca Synth), polieti-lenglicol (masa molar media 3350 g/mol, Sigma-Aldrich), anhídrido maléico (99,0 %, marca Vetec), isopropilóxido de titanio (99,99 %, Sigma-Aldrich) y peróxido de benzoilo (75,0 %, Sigma-Aldrich) como catalizadores.
El surfactante obtenido se caracterizó a través de espectrometría en el infrarrojo con transformada de Fourier (FTIR), ter-mogravimetría (TGA y DSC) para medir las propiedades interfaciales en solución acuosa del surfactante; se utilizó tensio-metría y espectrometría en la región del ultravioleta (UV).
Para el análisis FTIR, muestras del surfactante se dispersaron en KBr en una relación 1:100 y se analizaron en el rango de número de onda de 4000 a 400 cm-1 con una resolución de 2cm-1 en un equipo Perkin Elmer, modelo Spectrum Bx.
Las transiciones térmicas y la estabilidad térmica del surfactante se estudiaron empleando las técnicas de calorimetría diferencial de barrido (DSC) y análisis termogravimétrico (TGA) utilizando un aparato TGA-50 Shimadzu, equipado con un módulo DSC. Para el análisis de TGA se usó una masa de 2,5 mg del surfactante, una celda de platino y una rampa de calentamiento de 10 °C/ min desde 25 hasta 400 °C en atmósfera de nitrógeno. Para el análisis de DSC se empleó una masa de aproximadamente 5 mg del surfactante y una celda de aluminio. Se sometió la muestra a una rampa de calentamiento de 10 °C/min desde 25 hasta 400 °C en atmósfera de nitrógeno.
Para la determinación de la CMC se usaron varios métodos; inicialmente se implementó el método de Wilhelmy en un tensiómetro y medidor de ángulo de contacto marca Dataphysics, modelo DCAT 21, con una resolución de ± 0,001 mN/m para medidas de tensión superf-cial de 1-1000 mN/m. Para este análisis se prepararon soluciones en el intervalo entre 1x10-4 y 1x105 mg/L usando un dosificador de líquidos -marca Metro-hm-, acoplado al equipo que realiza diluciones automáticas, y se midió la tensión superficial (γ) de cada solución a 19,80 ± 0,15 °C; esta temperatura en el equipo la miden dos termocuplas Pt 100 con una resolución de 0,01 K y controlada por un baño termostatizado externo -marca Lauda-.
En el método de Wilhelmy se mide la fuerza necesaria para quitar una placa de platino-iridio de la superficie del líquido.
Para la determinación de la CMC por espectroscopia en la región ultravioleta se usó un espectrómetro UV CARY 500 Versión 8.01. Durante este análisis se colectaron espectros en la región UV-VIS del surfactante en el intervalo de longitud de onda de 200-700 nm de 30 soluciones acuosas en intervalo entre 1x10 4 y 1x105 mg/L a una temperatura de 20 °C. La CMC se determinó a partir de la curva de absorbancia en función de la concentración en la longitud de onda de 298 nm, usando el método de ajuste de los puntos a un modelo sigmoidal. De acuerdo con la literatura, el centro de la sigmoidea (x0) corresponde a la CMC (9, 12).
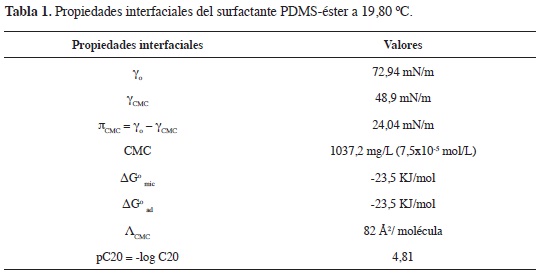
Las propiedades interfaciales del surfactante se calcularon a partir del gráfco de tensión superficial en función de la concentración. En este análisis se determinaron los valores de γo y γcmc (tensión superficial del agua y de la solución en la CMC), πCMC (la presión en la superficie en la CMC), ΔG°mic y ΔG°ad (energías libres de micelización y adsorción), ∧CMC (área mínima ocupada por la molécula) y el pC20 (el negativo del logaritmo de la concentración del surfactante [C20], necesaria para conseguir una disminución de la tensión superficial de 20mN/m).
RESULTADOS
Análisis FTIR
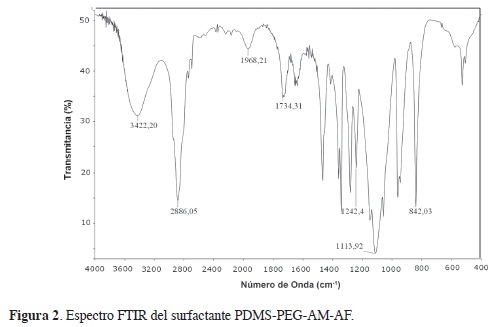
La Figura 1 ilustra la estructura sugerida para el surfactante con base en el espectro FTIR (Figura 2). El producto obtenido después de la síntesis fue un sólido de color amarillo.
En el espectro FTIR del PDMS-éster pueden verse las bandas de absorción a 3422 cm-1, correspondiente al estiramiento del grupo hidroxilo (O-H); una banda intensa con a 2886 cm-1, que se debe al estiramiento del grupo metileno (–CH2); una banda ancha de intensidad media en 1734 cm-1, originada por grupos carbonilo (C=O), presentes en grupos ácidos, superpuesta a la banda de deformación axial del carbonilo (C=O) del éster, que se confirma por la presencia de otra banda en 1242 cm-1, correspondiente a la banda de deformación axial del enlace C-O del éster (13, 14). En este compuesto también pueden observarse las bandas de absorción órgano-silicio, localizadas en 1113 y 842 cm-1, que se originan por los estiramientos Si-O-Si y CH3-Si-CH3, respectivamente. Estas bandas aparecen un poco desviadas al compararse con las bandas mostradas por el PDMS de la literatura (13, 14). El espectro del surfactante del PDMS-éster sintetizado coincide con el surfactante logrado por Liu et al. (3).
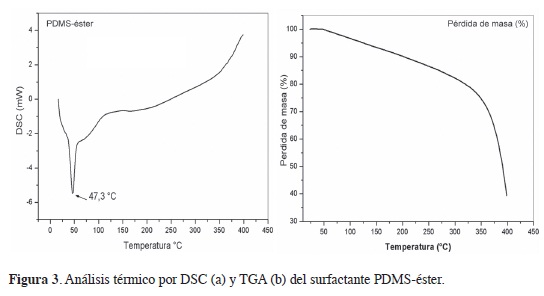
Análisis DsC y TgA
En la curva de DSC (Figura 3a) se observa un pico endotérmico con un máximo de 47,3 °C, correspondiente a la fusión del surfactante. En la curva de TGA (Figura 3b) se observa una pérdida del 20 % de la masa entre 80 y 300 °C, debido a la hidrólisis de algunos enlaces presentes en el surfactante y a la evaporación de agua residual. La degradación completa ocurre a partir de 350 °C.
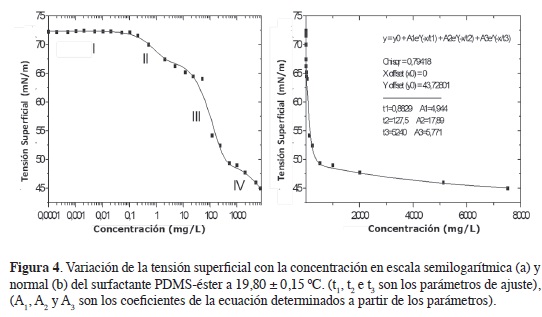
Determinación de la concentración micelar critica (CmC) y propiedades interfaciales
En la Figura 4 se muestra la tensión superficial de soluciones acuosas del surfactante en función de la concentración (Figura 4a, escala semilogarítmica; Figura 4b, escala normal). En la curva con datos en escala normal se observó que en la concentración más baja (1x10-4 mg/L) la tensión superficial generada por la presencia del surfactante es bastante próxima a la del agua pura -72,94 mN/m a 20 °C- (15, 16). A medida que la concentración del surfactante aumenta, se nota una acentuada disminución de la tensión superficial de las soluciones hasta que se llegó a un plateau. Los puntos de la curva se ajustaron a una ecuación de decaimiento exponencial con tres parámetros -t1, t2 y t3- (Figura 4b). Estos se determinaron empleando el software Origin, ajustándolos por simulación hasta obtener el mejor coeficiente de correlación.
A partir de las curvas, se observó que el modo de actuación del surfactante en la interface líquido-aire es complejo y que este depende de la concentración del surfactante. En bajas concentraciones, la tensión superficial disminuye con el aumento de la concentración más suavemente en la región II que en la región III. Esto puede atribuirse a la complejidad de su estructura química y a las interacciones entre los grupos hidrofílicos e hidro-fóbicos con el agua. Comportamientos complejos en surfactantes neutros se han observado previamente en la literatura (3, 8, 12).
La CMC se determina como la concentración en la transición de la región III para la I V, lo que da un intervalo aproximado entre 500 y 1000 mg/L. Para determinar el valor único se utilizó el método de ajuste sigmoidal de la curva de absorbancia en función de la concentración. En los estudios realizados por Liu et al., no se observó un cambio brusco en la infexión de la curva de tensión superficial vs. concentración, en este tipo de surfactantes; diferente a lo observado en surfactantes tradicionales, debido a la presencia de micelas mononucleares, no obstante, a que sus estudios se limitaron a intervalos de concentración, correspondientes a la regiones I y II, mientras que en nuestros experimentos el cambio brusco de la inclinación ocurrió en la región III.
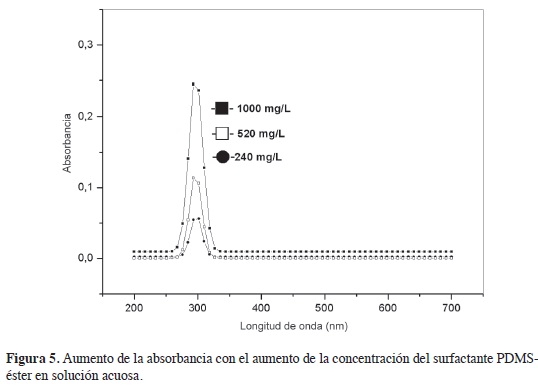
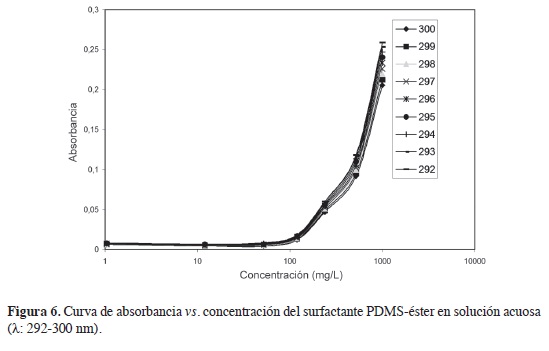
El espectro en la región del ultravioleta de las soluciones acuosas del surfactante PDMS-éster presentó máximos de absorción en aproximadamente 298 nm, como puede verse en las Figuras 5 y 6, por lo que la CMC se calculó para datos en la longitud de onda máxima γmax = 298< nm. En las longitudes de onda mencionados, la ley de Beer presenta coeficientes de correlación superiores a 0,990 en las concentraciones entre 120 e 1250 mg/l. En la Figura 7 se observa el ajuste de los datos al modelo sigmoidal para la determinación de la CMC. De acuerdo con la literatura, x es la concentración del surfactante; ai y af son las asíntotas inicial y fnal; x0, el centro de la sigmoidea que corresponde a la CMC (9, 12). La CMC calculada de esta forma tiene un valor de 1037,2 mg/L (0,104 %), valor un poco mayor al intervalo proporcionado por la curva de la tensión superficial en función de la concentración, pero próximo a la CMC del surfactante aniónico lauril sulfato de sodio (0,1 %-3,5 mM) a 25 °C, reportado por xu et ál., usando también el método de la placa de Wilhelmy (17).
Los valores calculados para las propiedades interfaciales del surfactante PDMS-PEG-AM-AF se resumen en la Tabla 1. Este surfactante tiene una tensión superficial en la CMC de 48,9 mN/m. El valor de dγ/d(logc) en el intervalo de concentración de la región III de la Figura 5 fue igual a -11,32 mN/m, usando R= 8,31x103 mN.m.K-1.mol-1 y T= 293,2 K.
El valor de ΛCMC, calculado a partir de la ecuación 4 del surfactante PDMS-éster, es de 82 Å2/molécula, valor que se encuentra en términos intermedios a los registrados en la literatura, los cuales oscilan entre 30 y 120 Å2/molécula (18-21).
La eficiencia del surfactante PDMS-éster se calculó a través del valor de pC20 (22). El negativo del logaritmo de C20 (concentración del surfactante necesaria para conseguir una disminución de la tensión superficial de 20mN/m). El valor de C20 obtenido fue 213 mg/L (1,554x10-5 mol/L) (pC20=4,81). Esta concentración sirve como indicador de la eficiencia de la adsorción del surfac-tante, ya que la reducción de la tensión superficial de la solución por el surfac-tante depende de la sustitución de moléculas en la interface solución/vapor. La eficiencia se atribuye predominantemente a los grupos hidrofóbicos del surfactante mientras que los grupos hidro-fílicos tienen la capacidad de solubilizar el surfactante en la solución.
La gran cantidad de grupos hidrofílicos en el surfactante PDMS-éster pueden ser los responsables, por su más alta eficiencia, cuando comparado con algunos surfactantes tradicionales como los ca-tiónicos entre 25 y 55 °C (pC20 entre 1,6 y 2,3) y los no iónicos a base de polisa-cáridos con enlaces del tipo éster -pC20 entre 1,2 y 3,9- (19).
La eficiencia del PDMS-éster es comparable a los de los surfactantes hetero-gemelos que contienen grupos terminales de ión amonio y carboxilatos -pC20 entre 4 y 7, a 25 °C- (23), a los surfac-tantes gemelos a base de polisacáridos con enlaces polipeptídicos (pC20 entre 5 y 8) y a los surfactantes anffílicos que contienen grupos NO y COOH -pC20 entre 4,9 y 6, a 25 °C- (24).
CONCLUSIONES
Los espectros FTIR del material sintetizado comprobaron la formación del surfactante del PDMS-éster, el cual originó bandas que coinciden con las reportadas por la literatura. En bajas concentraciones, la tensión superficial disminuye con el aumento de la concentración de una forma menos pronunciada que en las concentraciones mayores, lo que puede atribuirse a la complejidad de su estructura química y a las interacciones entre los grupos hidrofílicos e hidrofóbicos con el agua.
La eficiencia del surfactante PDMS-éster calculada a través del valor de pC20 (22) muestra que la gran cantidad de grupos hidrofílicos en el surfactante PDMS-éster pueden ser los responsables, por su mayor performance, cuando comparado con algunos surfactantes tradicionales como los catiónicos y los no iónicos a base de polisacáridos con enlaces del tipo éster.
AGRADECIMIENTOS
Johana I. Rodríguez R. agradece a CAPES y CNPq por la beca de estudios concedida.
REFERENCIAS BIBLIOGRÁFICAS
1. Myers, D. Surfactants science and technology. 2 ed. New York: John Wiley & Sons. 1999. [ Links ]
2. Shafrin, E.; Zisman, W. Constitutive relations in the wetting of low energy surfaces and the theory of the retraction method of preparing monolayers, J Phys Chem. 1960. 64: 519-524. [ Links ]
3. Liu, H.; Li-Huei, L.; Keng-Ming, C. Synthesis and surface activity of polyethylene glycol–maleic anhy-dride–polydimethylsiloxane poly-ester surfactants. Colloids Surf. A. 2003. 215: 213-219. [ Links ]
4. Myers, D. Surfaces, Interfaces and Colloids, Principies and Applications. 2a ed. New York: John Wiley & Sons. 1999. [ Links ]
5. Bacherizo, I.; Ruiz, M.A.; Holgado, J.A.; Cabrerizo, M.A.; Gallardo, V. Measurement of dynamic surface tensión to determine critical micellar concentration in lipophilic silicone surfactants. 11 Fármaco. 2000. 55: 583-589. [ Links ]
6. Behring, J.; Lucas, M.; Machado, C; Barcellos, I. Adaptacao no método do peso da gota para determinacao da tensão superficial: um método simplificado para a quantificacao da CMC de surfactantes no ensino da química. Quím Nova. 1002. 27: 492-495. [ Links ]
7. Schramm, L.; Marangoni, G. Surfactants: Fundamentáis and Applications in the Petroleum Industry Chapter 1. Surfactants and Their Solutions: Basic Principies. Ia ed. Cambridge University Press. 2000. [ Links ]
8. Moraes, S.L.; Oliveira M.O. Determinacao da concentracao micelar crítica de ácidos húmicos por medidas de condutividade e espectroscopia. Quím Nova. 2004. 27: 701-704. [ Links ]
9. Furton, K.; Norelus, A. Determimng the criticall micelle concentration of aqueous surfactant solutions. J chem edu. 1993. 70: 254-257. [ Links ]
10. Gargi, B.; Indranil, C; Satya, P Pyrene absorption can be a convenient method for probing critical micellar concentration (CMC) and indexing micellar polarity. J Colloid Interface Sci. 2006. 294: 248–254. [ Links ]
11. Rabockai, T. Físico-química de superfícies, Secretaria geral da organização dos estados americanos. Programa regional de desenvolvimento cientifco e tecnológico. Washington. 1979. [ Links ]
12. Basu Ray, G.; Chakraborty, I.; Moulik, S. Pyrene absorption can be a convenient method for probing critical micellar concentration (CMC) and indexing micellar polarity. J Colloid Interface Sci. 2006. 294: p.248–254. [ Links ]
13. Silverstein, R. M.; Webster, F. Spectrometric Identification of Organic Compounds. 7 ed. Wiley. 2005. [ Links ]
14. West Coast Analytical Service, Inc (WCAS). Espectro de FTIR de PDMS. Disponível em: <http:// www.wcaslab.com/tech/tech2.htm> [ Links ]
15. Gaonkar, A.; Neuman, R. The uncertainty in absolute values of surface tension of water. Colloids surfaces. 1987. 27: 1-14. [ Links ]
16. Kayser, W. Temperature dependence of the surface tension of water in contact with its saturated vapor. J Colloid Interface Sci. 1972. 56: 622-627. [ Links ]
17. Qingyi, x., Mitsutoshi, N.; Sosaku I.; Nobutaka N.; Poritosh R.; Hiroshi, O.; Takeo S. Effects of surfactant and electrolyte concentrations on bubble formation and Stabilization. J Colloid Interface Sci. 2009. 332: 208–214. [ Links ]
18. Ayça, E.; Yongsin, K.; Charles, M.K.; Richard, R.T. Adsorption properties of oligo(fuorooxetane)-b-poly(ethylene oxide)-b-oligo (fuorooxetane) tri-block copolymers at the air–water in-terface: Comparison of hydroxyl and acetate end groups. J Colloid Interfa-ce Sci. 2009. 336: 40-45. [ Links ]
19. Yoshimura, T.; Ishihara, K.; Esumi, K. Sugar-Based Gemini Surfactants with Peptide Bonds, Synthesis, Ad-sorption, Micellization, and Biode-gradability, Langmuir. 2005. 21: 10 409-10 415. [ Links ]
20. Castro, M.; Kovensky, J.; Fernández, A. New Family of Nonionic Gemi-ni Surfactants: Determination and Analysis of Interfacial Properties. Langmuir. 2002. 18: 2477-2482. [ Links ]
21. Abdel-Aziem, M.A.O.; Nagui, A.A.K. Surface and Thermodynamic Paameters of Some Cationic Surfac-tants. J Chem Eng Data. 1998. 43: 117-120. [ Links ]
22. Rosen, M.J. Surfactants and interfacial phenomena. 3 ed. New York Wiley-Interscience. 1975. [ Links ]
23. Yoshimura, T.; Nyuta, K.; Esumi, K. Zwitterionic Heterogemini Sur-factants Containing Ammonium and Carboxylate Head groups. 1. Adsorption and Micellization. Lang-muir. 2005. 21: 2682-2688. [ Links ]
24. Muller, P.; Akpo, C.C.; Stöckelhuber, K.W.; Weber, E. Novel amphi-philes with preorganized functionalities formation of Langmuir-flms and effciency in mineral fotation. Adv Colloid Interface Sci. 2005. 114-115: 291-302. [ Links ]




![EVALUATION OF THE CITOTOXICITY AND ANTIMICROBIAL ACTIVITY OF THE [Ag(phen)2]salH COMPOUND](/img/en/prev.gif)