Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.38 no.104 Medellín Jan./June 2016
https://doi.org/10.17533/udea.acbi.v38n104a07
ARTÍCULOS DE INVESTIGACIÓN
doi: 10.17533/udea.acbi.v38n104a07
Protección celular antioxidante y respuesta adaptativa inducida por estímulos oxidativos crónicos
Antioxidant cellular protection and adaptive response induced by chronic oxidative stimuli
Gloria A. Santa-González1,3; Mauricio Camargo1,2
1 Grupo Genética, Regeneración y Cáncer, SIU-UdeA, Lab. # 432. Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia.
2 Docente, Instituto de Biología, Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia. mauricio.camargo@udea.edu.co
Correo electrónico: 3. gloria.santa@udea.edu.co.
Recibido: marzo 2015; aceptado: noviembre 2015.
Resumen
La adaptación es un importante mecanismo por el cual las células y los organismos responden a retos ambientales y a cambiantes necesidades funcionales. Para lograrlo, las células integran cambios en el fenotipo, actividad metabólica, expresión génica y función celular, que deben coordinarse adecuadamente para mantener la viabilidad ante estímulos nocivos, como es el caso del reto ante un exceso de especies reactivas de oxígeno (ROS). En este estudio, se evaluó la hipótesis que pulsos crónicos y repetitivos con peróxido de hidrógeno (H2O2), pueden activar respuestas celulares que resultan en adaptación a estrés oxidativo. Para probar esto, se estableció un modelo in vitro, donde las células de origen mioblastoide C2C12, fueron expuestas a 5 mU/ml de la enzima glucosa oxidasa que durante breves pulsos de 1 hora/día genera una concentración constante de 50 μM de H2O2 en el medio. Este régimen de tratamiento se extendió durante 7 días, tras los cuales se evaluaron los efectos sobre la morfología y viabilidad celular, el contenido de ADN mitocondrial, la acumulación de ROS mitocondrial y la expresión de genes de defensa antioxidante. Los resultados obtenidos apoyan la idea de que los estímulos prolongados, repetitivos y a bajas concentraciones de ROS, pueden actuar como moléculas de señalización induciendo procesos celulares que convergen en la adaptación al estrés oxidativo crónico.
Palabras clave: adaptación, defensa antioxidante, estrés oxidativo crónico, homeostasis.
Abstract
Adaptation is an important mechanism in cells and organisms that allow them to respond to environmental challenges and changing functional demands. To accomplish these requirements, cells integrate modifications at different levels such as gene expression, metabolic activity, cellular functionality and phenotype. The orderly coordination of these changes is fundamental for cells to maintain viability despite a variety of harmful stimuli, such as the case of exceedingly concentrations of reactive oxygen species (ROS). In this study, we tested the hypothesis that chronic and repetitive stimuli with a mild concentration of hydrogen peroxide (H2O2) would activate cellular responses, resulting in adaptation. This was done confronting cell cultures to prolonged exposures of H2O2 obtained with glucose oxydase (GlucOx) added to the medium to generate a constant concentration of the oxidant (≈ 50 μM); this treatment protocol (1h/d) was extended during seven continuous consecutive days after which the following parameters were evaluated: cell morphology and viability, mitochondrial DNA content, mitochondrial ROS accumulation and antioxidant defense gene expression. These data further support the idea that exposure to continuous and low concentrations of ROS, could act as signaling molecules inducing cellular processes that converged toward adaptation to chronic oxidative stress.
Key words: adaptation, antioxidant defense, chronic oxidative stress, homeostasis.
INTRODUCCIÓN
Las especies reactivas de oxígeno (ROS) se producen continuamente como productos secundarios de ciertas vías metabólicas y por algunos sistemas específicos que están bajo fino control celular como procesos patológicos de inflamación (Mittal et al. 2014, Pluskota-Karwatka 2008) citoquinas, peroxisomas, xantina-oxidasa (XO), NADPH oxidasa (Holmstrom y Finkel 2014, Lemon et al. 2008) acetil-coA oxidasa y citocromos (D'Autréaux y Toledano 2007, Ji et al. 2004); y simultáneamente, las ROS son degradadas a través de varios mecanismos. Los procesos de generación y degradación de ROS generalmente se encuentran bajo un control celular riguroso manteniendo las concentraciones en bajo nivel (< 10-8 M) (Boveris y Cadenas 2000, Chance et al. 1979, Lushchak 2011).
La regulación de los procesos celulares de producción y degradación de ROS es crítica para la supervivencia, incluyendo sensores de especies reactivas, transducción de señales y modulación de la maquinaria de transcripción y traducción. Varias evidencias indican que las ROS son mensajeros importantes en vías de señalización que conducen a la adaptación celular (Powers et al. 2010) y desempeñan un papel importante en la homeostasis redox de diferentes procesos celulares como el crecimiento, la diferenciación, la proliferación y la apoptosis (Crawford y Davies 1994, Evans et al. 2003, Kefaloyianni et al. 2006, Marinho et al. 2014) Sin embargo, la exposición excesiva a ROS puede surgir como consecuencia de cambios en el ambiente celular, la exposición a medicamentos o compuestos oxidantes, o la insuficiencia en los sistemas de defensa antioxidante y conducir a un estado conocido como ''estrés oxidativo'', en el cual se produce daño a macromoléculas tales como ADN, ARN, proteínas y lípidos (Barzilai y Yamamoto 2004, Evans et al. 2003, Kumar et al. 2005).
Los sistemas de respuesta a estrés oxidativo se activan gradualmente y son dependientes del tipo celular, del carácter espacio-temporal del estímulo, y del tipo y concentración de ROS (Bar-Shai et al. 2008, Crawford y Davies 1994, Evans et al. 2003, Kefaloyianni et al. 2006, Lushchak 2011). Entre los principales mecanismos moleculares activados por las ROS están los de defensa antioxidante como las glutatión peroxidasas (GPx), las peroxirredoxinas (TPX), las superóxido dismutasas (SODs) y la catalasa (CAT); además, se encuentran las vías de señalización mediadas por Keap1/Nrf2 (Osburn y Kensler 2008) y las proteínas quinasas activadas por mitógenos (MAPKs); los reguladores transcripcionales NF-κB (factor nuclear κB) y activador transcripcional 1 (AP-1) (Hirota et al. 1997, Ji et al. 2007, Zhang 2004); y el factor redox Ref- 1 (Evans et al. 2000, Fritz et al. 2003). Estas vías operan en forma coordinada y son críticas para que las células de mamífero afronten al estrés oxidativo.
De otro lado, se sabe que los estímulos continuos a bajas concentraciones de ROS, pueden inducir de manera directa la activación/desactivación enzimática y cambios en los niveles de expresión génica (Gomez-Cabrera et al. 2008, Luna-López et al. 2013, Pickering et al. 2013, Radak et al. 2005, Wiese et al. 1995). Este fenómeno está relacionado con el concepto de hórmesis, caracterizado como una particular relación respuesta-a-dosis, la cual describe que un fenómeno biológico adverso puede llegar a ser benéfico cuando es aplicado en bajos niveles (Calabrese 2015, Yu 2004). En este contexto, los radicales libres de oxígeno pueden ser considerados como benéficos a bajas dosis (Calabrese y Baldwin 2003, Ji et al. 2006, Radak et al. 2008, 2005).
El objetivo de este estudio fue evaluar la capacidad de las células musculares para responder al estrés oxidativo inducido por la exposición crónica y repetitiva a bajas concentraciones de H2O2. Para ello, se estableció un modelo in vitro, donde las células de origen mioblastoide C2C12, fueron expuestas a 5 mU/ml de la enzima glucosa oxidasa (GlucOx) que durante breves pulsos de 1 hora/día genera una concentración de 50 μM de H2O2 en el medio; este régimen de tratamiento se extendió durante siete días, después de los cuales se caracterizó la adaptación celular.
Los resultados del presente trabajo, evidencian que estímulos crónicos repetitivos con H2O2 actúan como moléculas de señalización en células de mamífero, induciendo procesos celulares que incluyen: i) cambios morfológicos; ii) aumento del mtADN; y iii) modulación en los patrones de expresión génica. Esto resulta en un fenotipo de adaptación al estrés que hace a la célula significativamente más resistente a un eventual reto oxidativo mayor.
MATERIALES Y MÉTODOS
Cultivos celulares. Se empleó la línea celular de origen mioblastoide C2C12 (CRL-1772, ATCC), mantenida en medio DMEM suplementado con suero bovino fetal (SBF) al 5%, penicilina 100 μg/ml y estreptomicina 100 μg/ml, e incubadas a 37 ºC en atmósfera húmeda y CO2 al 5%.
Esquema de tratamientos. Para inducir la respuesta de adaptación, se realizaron tratamientos pro-oxidantes de manera intermitente y repetitiva; para ello, cada 24 h se adicionó glucosa oxidasa (GlucOx, G6641, Sigma) 5 mU/ ml para generar una concentración continua de 50 μM de H2O2 en el medio. Este régimen se mantuvo durante siete días como se ilustra en la figura 1.
Morfología celular. Después de los tratamientos, las células fueron sembradas en laminillas de vidrio estériles. Al día siguiente, fueron fijadas con paraformaldehído en buffer sucrosa (PFA-CBS) al 4% por 5 minutos, posteriormente, se lavaron tres veces con PBS y se montaron en portaobjetos con medio de montaje acuoso. Las células fueron observadas y fotografiadas con aumento de 128 X en estéreo microscopio Olympus SZX16.
Determinación de tamaño y granularidad medidos por citometría de flujo. Terminados los siete días de tratamiento pro-oxidante crónico, las células fueron fijadas con etanol frío al 70%, y posteriormente, incubadas con 100 μg/ml de RNasa (Sigma, R5000), marcadas con 100 μg/ml de yoduro de propidio (Sigma, P4170) y analizadas por citometría de flujo (Coulter Epics XL). Empleando los parámetros forward scatter (FSC) y side scatter (SSC) se determinó el tamaño y granularidad relativos de las células.
Determinación de viabilidad celular por citometría de flujo. Para determinar el efecto del tratamiento crónico con H2O2 sobre la viabilidad celular se empleó anexina V:PE Apoptosis Detection Kit I (559763, BD Pharmingen) siguiendo las indicaciones del fabricante. Brevemente, 1 x 106 células se resuspendieron en buffer de unión, y posteriormente, se adicionaron 5 μl de anexina V y 5 μl de 7-aminoactinomicina D (7-AAD). Tras incubación durante 30 minutos a temperatura ambiente, las células se analizaron por citometría de flujo (Coulter Epics XL).
Contenido de ADN mitocondrial. El ADN genómico se extrajo y cuantificó usando un procedimiento automatizado (QIAcube System); el contenido relativo de mtADN se evaluó por RT-PCR como se describe en Furda et al. (2012) y Rooney et al. (2015).
Detección de ROS mitocondrial. Para cuantificar las ROS mitocondriales se empleó el fluorocromo MitoSOXTM Red (M36008T, Life Technologies). Después del tratamiento, se tomaron ~ 5 x 105 células y se resuspendieron en PBS; luego se les adicionó MitoSOX a una concentración final de 3 μM por 30 min, seguido de 2 lavados con PBS para eliminar el exceso de fluorocromo. Finalmente, se realizaron lecturas en citómetro de flujo Coulter Epics XL.
Perfil de expresión génica. Para evaluar los efectos a nivel transcriptómico de la exposición a largo plazo a H2O2, se realizó un análisis de microarreglos basados en RT-PCR. Brevemente, se extrajo ARN total usando Qiagen RNeasy Mini kit (74104, QIAGEN), el cADN se sintetizó mediante transcripción reversa con 250 ng de ARN total y oligo-dTs con el RT2 first strand kit (330401, QIAGEN) siguiendo las instrucciones del fabricante. Se empleó el RT2 Profiler PCR Array Mouse Oxidative Stress and Antioxidant Defense (PAMM-065Z, QIAGEN) para evaluar 84 genes relacionados con defensa antioxidante, metabolismo de ROS y transporte de oxígeno. El microarreglo se procesó de acuerdo con las instrucciones del fabricante y se corrió en el termociclador BioRad C1000 con el sistema de detección CFX96. Los cambios relativos en la expresión génica se calcularon por el método ΔCt normalizado para los genes constitutivos incluidos en el microarreglo. Los datos se analizaron con el software SABiosciences PCR array data analysis.
Análisis estadístico. Todos los datos obtenidos representan los resultados de dos o tres experimentos independientes por grupo de tratamiento. Las pruebas t-Student y los análisis de varianza (ANOVA) se realizaron utilizando el software GraphPad Prism. Los valores p < 0,05 se consideraron como estadísticamente significativos. Las barras de error representan el error estándar de la media (SEM).
RESULTADOS
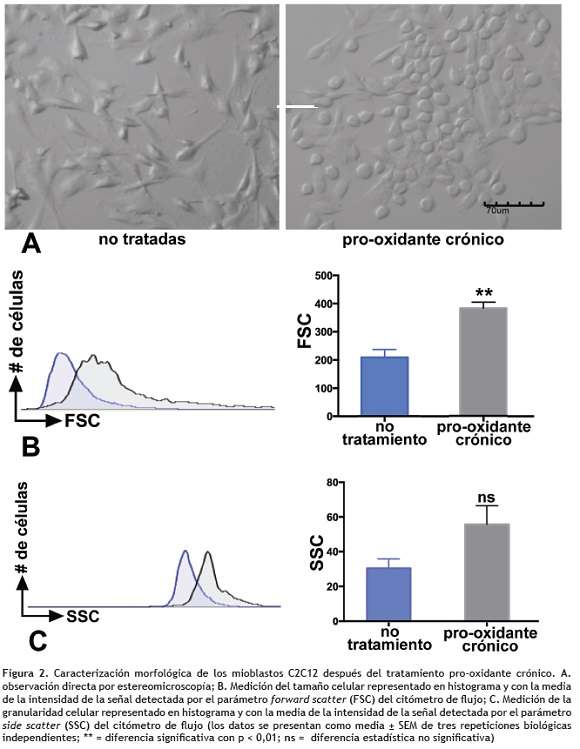
Tratamiento pro-oxidante crónico induce cambios en la morfología celular. La figura 2 muestra la morfología comparativa de las células control y las células expuestas a estímulos crónicos continuos con 50 μM de H2O2. En la figura 2A se muestra una fotografía representativa del análisis realizado por estereomicroscopía, donde se observa que los mioblastos no tratados están alargados, con forma fusiforme y ampliamente extendidos sobre la superficie de crecimiento; las células redondas y ligeramente adheridas al sustrato son mitóticas. La figura 2A también evidencia que después de la exposición crónica a H2O2 se observan varios cambios morfológicos: un importante porcentaje de la población celular tiene forma redondeada pero conserva la adherencia a la superficie de crecimiento, no se pierde el contacto entre las células y hay crecimiento en monocapa; aparentemente no hay lesiones en la membrana celular ni formación de vacuolas. Esto mismo pudo determinarse a través de análisis por citometría de flujo, donde se observa que el tamaño de las células con tratamiento oxidativo es significativamente mayor comparado con las células no tratadas (p = 0,009, figura 2B); adicionalmente, también hay una importante tendencia hacia el aumento de la complejidad celular en células con tratamiento pro-oxidante repetitivo (p = 0,0713, figura 2C).
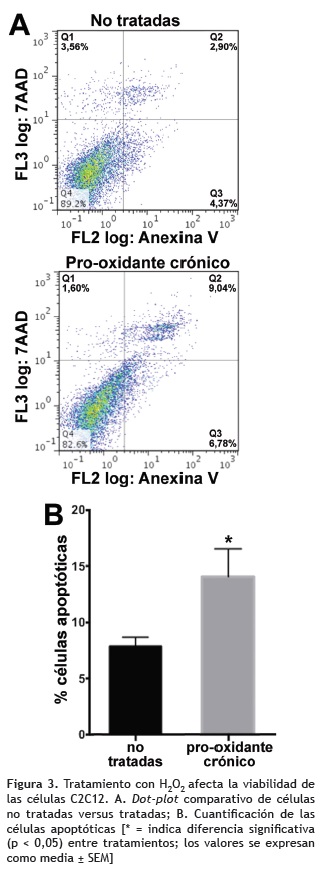
Estímulos continuos con H2O2 afectan la viabilidad celular. Para cuantificar la exposición de fosfatidilserina y el daño de la membrana citoplasmática como indicativo de apoptosis, las células se analizaron mediante el uso de anexina V y 7-AAD. La figura 3A muestra que el tratamiento crónico con 50 μM de H2O2 aumenta el porcentaje de células positivas para anexina V (Q2 y Q3), lo que podría representar un aumento de células apoptóticas respecto al control (p = 0,0103; figura 3B).
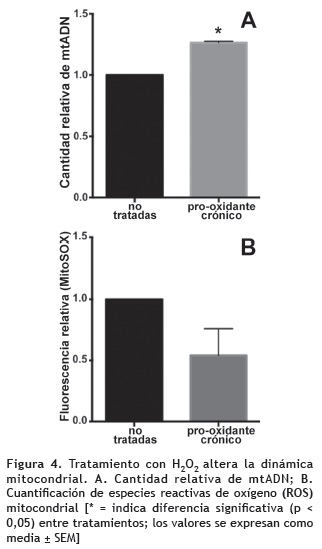
Aumento del contenido relativo de ADN mitocondrial y disminución de la acumulación de ROS mitocondrial después del estímulo pro-oxidante. La mitocondria es una de las organelas más sensibles a agentes oxidantes; por ello se evaluó si el tratamiento crónico podía alterar su capacidad de replicación del ADN y los sistemas de detoxificación de ROS. La figura 4 muestra que 50 μM de H2O2 durante siete días contribuye significativamente al aumento de copias de mtADN (p < 0,0001), mientras que la concentración de ROS se ve reducida respecto a las células no tratadas (p = 0,1704).
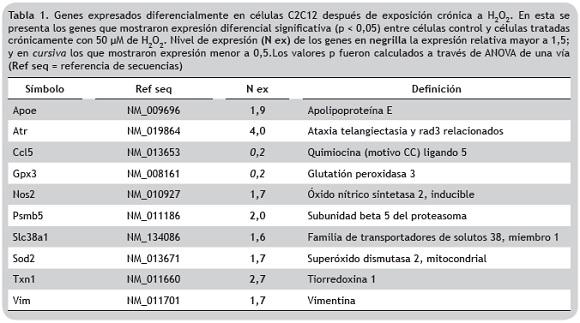
Expresión diferencial de genes asociados con la respuesta a estrés oxidativo. Para determinar si el tratamiento pro-oxidante empleado, induce cambios en el patrón de expresión de genes de respuesta a estrés, se evaluaron 84 genes antioxidantes y relacionados con el metabolismo y transporte del oxígeno, a través de microarreglos basados en RT-PCR. Se calcularon los valores Ct para todos los genes, y posteriormente, se determinó el nivel de expresión relativo al de las células no tratadas.
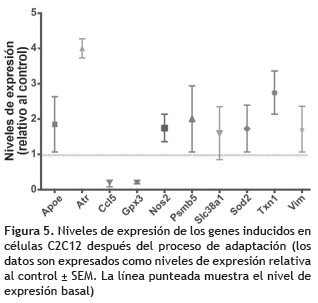
Los resultados obtenidos para RT2 Profiler PCR Array Mouse Oxidative Stress and Antioxidant Defense muestran que al final del protocolo de tratamiento pro-oxidante crónico hay expresión diferencial de diez genes; ocho fueron regulados positivamente (nivel de expresión > 1,5) y dos fueron regulados negativamente (nivel de expresión < 0,5) (figura 5, tabla 1).
DISCUSIÓN
Las adaptaciones celulares son respuestas funcionales y estructurales reversibles ante situaciones de estrés fisiológico y algunos estímulos patológicos. Estas respuestas, permiten alcanzar nuevos estados de equilibrio que permiten a las células sobrevivir y seguir funcionando (Kumar et al. 2005). Uno de los desafíos que afronta la célula constantemente es la acumulación de ROS como consecuencia de exposición a sustancias químicas, radiación, metabolismo y envejecimiento celular. De hecho, cuando aumenta la producción de ROS o los sistemas antioxidantes son ineficientes, se pueden inducir lesiones celulares relacionadas con múltiples procesos patológicos, incluidos el cáncer, el envejecimiento y algunos procesos degenerativos como el Alzheimer (Marteijn et al. 2014, Matsumura et al. 2015, Muñoz-Espín y Serrano 2014).
La célula solo puede disponer de un rango limitado de funciones y estructuras para hacer frente a una situación de estrés oxidativo; sin embargo, si el estímulo nocivo es crónico y repetitivo, la célula se puede adaptar a las necesidades fisiológicas para mantener el equilibrio redox (Kumar et al. 2005). Este estudio muestra evidencia sobre las exposiciones crónicas con bajas concentraciones de ROS que pueden inducir respuestas celulares, alterando la estructura celular y la expresión de genes nucleares específicos, para mantener la homeostasis y rescatar a las células del estrés.
Para establecer el modelo de adaptación a estrés oxidativo se emplearon las células C2C12, precursoras de fibras de miocardio, capaces de adaptarse a fuertes desequilibrios en el estado redox, y que representan un sistema experimental ideal para estudiar mecanismos activados durante la respuesta a estrés. Las células C2C12 poseen morfología mioblastoide característica de células musculares, crecimiento en monocapa (figura 2A) y tienen una duración de ciclo celular normal para células de mamífero; sin embargo, después del tratamiento crónico con H2O2, se evidencia un cambio en el tamaño, forma y granularidad de las células (figuras 2B y 2C). Uno de los mecanismos propuestos como reguladores en esta respuesta, involucra la estimulación de H2O2 a factores de crecimiento como VEGF y la subsecuente activación de las vías MAPK/ERK y PI3K que regulan la función y expresión de genes relacionados con el crecimiento y supervivencia celular (Cai 2005, Gough y Cotter 2011). Las observaciones de este estudio, muestran aumento en el tamaño celular, posiblemente relacionado con una hipertrofia compensatoria que se origina como mecanismo de respuesta inicial benéfica para minimizar el estrés, pero que al persistir en el tiempo puede desencadenar en muerte celular por apoptosis (Jain et al. 2015, Sabri et al. 2003).
Para determinar el efecto del estímulo oxidativo sobre la viabilidad, se empleó la doble marcación con anexina V y 7-AAD; la figura 3 muestra que con relación a las células control, el tratamiento pro-oxidante crónico indujo un aumento de la población positiva para anexina V (7,8 versus 14,08%, p = 0,0103). La muerte celular inducida por ROS se ha asociado principalmente a necrosis, pero se ha evidenciado que también pueden iniciar apoptosis a través de una compleja red de mecanismos que involucran daño mitocondrial, alteración en la homeostasis del calcio y daño en el ADN (Kupsco y Schlenk 2015). Aunque los datos obtenidos indican que la viabilidad de las células fue afectada durante el período de pre-condicionamiento, resultados recientes muestran que después de la exposición crónica a 50 μM de H2O2, el tratamiento agudo con 1 mM de H2O2 no causa efectos deletéreos como los inducidos en células sin adaptar, lo que implica que si las células no entran en apoptosis al final del proceso de precondicionamiento, adquieren ventajas para contrarrestar subsiguientes dosis agudas (Orozco et al. 2010).
Como las mitocondrias son un blanco importante de las ROS y su funcionamiento normal es crucial para el mantenimiento de la homeostasis celular, se investigó si durante el proceso de adaptación, estas organelas sufren algún tipo de alteración en relación a su proliferación y acumulación de ROS. La figura 4 muestra que el tratamiento crónico con bajas concentraciones de H2O2 induce un aumento en el número de copias del mtADN, lo cual se ha comunicado como un evento molecular temprano ligado al estrés oxidativo, y asociado a la proteína Parkin que interactúa con el mtADN y preserva la integridad del genoma en respuesta al aumento de los niveles de ROS; además, promueve la biogénesis mitocondrial a través de su asociación con el factor de transcripción mitocondrial A (TFAM) potenciando su actividad (Lee y Wei 2005, Palikaras y Tavernarakis 2014).
En un modelo de adaptación a estrés oxidativo, las células cambian su actividad metabólica y activan vías requeridas para combatir las ROS; por tanto, se espera que para lograr un nuevo estado de equilibrio se alteren los perfiles de expresión génica. Esta idea se evidenció con los resultados obtenidos en los microarreglos basados en RT-PCR, en los que se obtuvo cambio en el perfil de expresión de diez genes implicados en diferentes mecanismos celulares de respuesta a estrés oxidativo (tabla 1) y correlacionados con otros resultados obtenidos en este estudio. De un lado, se observó aumento en los niveles de expresión del gen Vim, que codifica para una proteína integrante de los filamentos intermedios, responsable del mantenimiento de la forma de la célula, la integridad del citoplasma y la estabilidad de las conexiones del citoesqueleto. Esta alteración en su perfil de expresión concuerda con las observaciones del cambio morfológico de las células después del tratamiento prooxidante crónico. Por otro lado, se observó aumento en la expresión del gen Sod2 que codifica para la manganeso superóxido dismutasa mitocondrial, una de las principales enzimas de defensa antioxidante de las células de mamífero, que cataliza la conversión del O2– mitocondrial a H2O2 para luego ser transformado en agua por la Gpx4 (Lee y Wei 2005). Los datos de RT-PCR obtenidos en este estudio también muestran incremento de 1,7 X en el nivel de expresión de Sod2, y aumento de 1,5 X para Gpx4; estos resultados se correlacionan con la disminución de las ROS mitocondriales reportadas en la figura 3B. Adicionalmente, el aumento en el nivel de expresión en Nos2 sugiere que la exposición crónica a H2O2 está relacionada con la sobrerregulación de la óxido nítrico sintetasa inducible (iNOS) y posiblemente a la subsecuente potenciación de la producción de óxido nítrico (NO), el cual ha sido registrado como un agente protector frente a la toxicidad del H2O2 (Phoa y Epe 2002, Wink et al. 1995).
Uno de los genes que mostró mayor aumento en los niveles de expresión fue Txn1. La tiorredoxina codificada por este gen, desempeña un papel crítico en la señalización redox. Su función principal es actuar como antioxidante, manteniendo el estado reducido de diversos factores de transcripción como NF-kB y NRF2, ambos involucrados en la modulación transcripcional de varios genes implicados en la detoxificación de ROS (Marinho et al. 2014). De está manera, la regulación positiva en la expresión de Txn1 en respuesta al tratamiento pro-oxidante crónico, indica que la proteína es un importante mediador en las cascadas de señalización redox que permiten la activación de los mecanismos celulares de adaptación a ROS.
Aunque las enzimas antioxidantes funcionan como scavengers de ROS, si la concentración intracelular de especies oxidantes es muy alta y se supera el balance redox, se pueden generar daños a los componentes celulares, incluyendo proteínas y el ADN. Cuando esto ocurre, se activan diferentes vías de rescate, una de ellas es el aumento de la actividad del proteosoma, encargado de remover de manera selectiva las proteínas oxidadas, evitando su agregación y reticulación, así como la toxicidad celular a la que darían lugar (Radak et al. 2002). En el análisis transcriptómico realizado después de la exposición crónica y repetitiva a H2O2 se vio aumento de dos veces en la expresión de Psmb5, el gen que codifica para la subunidad β5 del complejo proteosomal 20S; esto demuestra un potenciamiento de la actividad del proteosoma en la respuesta adaptativa a estrés oxidativo.
La lesiones oxidativas en el ADN son otra de las consecuencias del aumento en las ROS; la proteína ATR es una de las moléculas censoras que participa en el reconocimiento del daño y transmite la señal a moléculas efectoras que activan los puntos de control del ciclo celular y las vías de reparación del ADN; o en ciertos contextos, inducen muerte celular por apoptosis (Barzilai y Yamamoto 2004, Nam y Cortez 2011). Los resultados muestran que el tratamiento crónico con H2O2 induce aumento de cuatro veces en la expresión de Atr, lo que sugiere que esta proteína contribuye de manera significativa con la respuesta adaptativa funcional que protege a las células de muerte celular por daños oxidativos en el ADN. Asimismo, en el análisis se identificó la sobreexpresión de Apoe y Slc38a1 que han sido relacionados con el metabolismo energético y el mantenimiento del balance entre oxidantes y antioxidantes.
Finalmente, se encontraron genes con bajos niveles de expresión (< 0,5) como Ccl5 (Rantes) que codifica para una quimiocina importante en lesiones causados por isquemia-reperfusion y es secretada por varios tipos celulares, incluyendo células musculares. Un estudio reciente demostró que su inhibición con moléculas antagonistas, ejerce efectos cardioprotectores durante la reperfusión temprana a través de propiedades antiinflamatorias y antioxidantes (Braunersreuther et al. 2010). Aunque no hay evidencias experimentales sobre la regulación negativa de la expresión de este gen ante situaciones de estrés oxidativo, los hallazgos registrados en este estudio, podrían ser una evidencia importante sobre los mecanismos de adaptación en respuesta al estímulo crónico, como reguladores negativos de la transcripción de Ccl5, lo que representaría ventaja en la reducción de las lesiones provocadas por reperfusión; así que el papel fisiológico de Rantes en el proceso de adaptación, debe ser examinado en futuros estudios. El otro gen que mostró disminución en el nivel de expresión fue Gpx3, cuyo producto proteico es sintetizado principalmente en riñón y secretado en plasma para neutralizar el H2O2 (Burk at al. 2011, Takahashi y Cohen 1986). En este caso, la regulación negativa después del tratamiento pro-oxidativo posiblemente esté relacionada con su función sistémica in vivo, sobre la cual no es factible discutir ampliamente dado el modelo in vitro de cultivos celulares empleado en esta investigación.
En resumen, los datos obtenidos indican que la exposición crónica a H2O2 induce una respuesta altamente dinámica que permite alcanzar un estado de adaptación celular, que implica cambios morfológicos, funcionales y de expresión génica, y cuyo principal beneficio fisiológico sería proteger las células frente a una subsiguiente dosis aguda o letal de ROS.
AGRADECIMIENTOS
Este estudio fue financiado por la Estrategia para la Sostenibilidad 2013-2014, Universidad de Antioquia, y la Fundación para la Promoción de la Investigación y la Tecnología, Banco de la República. Los autores quieren agradecer al laboratorio de Joel Meyer de Duke University por el apoyo proporcionado en los experimentos de cuantificación de mtADN; al Grupo de Investigación e Innovación Biomédica del ITM y a Diego Fernando Uribe y Andrea Gómez por la asistencia técnica en RT-PCR; y a Melisa Hincapié y Antea Delgado por su colaboración con el montaje de muestras, toma de imágenes para la descripción de la morfología celular y los ensayos de viabilidad.
REFERENCIAS
Bar-Shai M, Carmeli E, Ljubuncic P, Reznick AZ. 2008. Exercise and immobilization in aging animals: the involvement of oxidative stress and NF-kappaB activation. Free Radical Biology and Medicine, 44: 202-214. [ Links ]
Barzilai A, Yamamoto KI. 2004. DNA damage responses to oxidative stress. DNA Repair, 3: 1109-1115. [ Links ]
Boveris A, Cadenas E. 2000. Mitochondrial production of hydrogen peroxide regulation by nitric oxide and the role of ubisemiquinone. International Union of Biochemistry and Molecular Biology Life, 50: 245-250. [ Links ]
Braunersreuther V, Pellieux C, Pelli G, Burger F, Steffens S, Montessuit C, Weber C, Proudfoot A, Mach F, Arnaud C. 2010. Chemokine CCL5/RANTES inhibition reduces myocardial reperfusion injury in atherosclerotic mice. Journal of Molecular and Cellular Cardiology, 48: 789-798. [ Links ]
Burk RF, Olson GE, Winfrey VP, Hill KE, Yin D. 2011. Glutathione peroxidase-3 produced by the kidney binds to a population of basement membranes in the gastrointestinal tract and in other tissues. American Journal of Physiology-Gastrointestinal and Liver Physiology, 301 (1): G32-38. [ Links ]
Cai H. 2005. Hydrogen peroxide regulation of endothelial function: Origins, mechanisms, and consequences. Cardiovascular Research, 68: 26-36. [ Links ]
Calabrese EJ. 2015. Hormesis: principles and applications. Homeopathy, 104: 69-82. [ Links ]
Calabre EJ, Baldwin LA. 2003. Hormesis: the dose-response revolution. Annual Review of Pharmacology and Toxicology, 43: 175-197. [ Links ]
Chance B, Sies H, Boveris A. 1979. Hydroperoxide metabolism in mammalian organs. Physiological Reviews, 59: 527-605. [ Links ]
Crawford DR, Davies KJ. 1994. Adaptive response and oxidative stress. Environmental Health Perspectives, 102 (Suppl 10): 25-28. [ Links ]
D'Autréaux B, Toledano MB. 2007. ROS as signalling molecules: mechanisms that generate specificity in ROS homeostasis. Nature Reviews Molecular Cell Biology, 8: 813-824. [ Links ]
Evans AR, Limp-Foster M, Kelley MR. 2000. Going APE over ref-1. Mutation Research, 461: 83-108. [ Links ]
Evans JL, Goldfine ID, Maddux BA, Grodsky GM. 2003. Are oxidative stress-activated signaling pathways mediators of insulin resistance and beta-cell dysfunction? Diabetes, 52: 1-8. [ Links ]
Fritz G, Grösch S, Tomicic M, Kaina B. 2003. APE/Ref-1 and the mammalian response to genotoxic stress. Toxicology, 193: 67-78. [ Links ]
Furda AM, Bess AS, Meyer JN, Van Houten B. 2012. DNA Repair Protocols. Methods in Molecular Biology, 920: 111-132. [ Links ]
Gomez-Cabrera MC, Domenech E, Viña J. 2008. Moderate exercise is an antioxidant: upregulation of antioxidant genes by training. Free Radical Biology and Medicine, 44: 126-131. [ Links ]
Gough DR, Cotter TG. 2011. Hydrogen peroxide: a Jekyll and Hyde signalling molecule. Cell Death and Disease, 2, e213. Doi: 10.1038/cddis.2011.96. [ Links ]
Hirota K, Matsui M, Iwata S, Nishiyama A, Mori K, Yodoi J. 1997. AP-1 transcriptional activity is regulated by a direct association between thioredoxin and Ref-1. Proceedings of the National Academy of Sciences of the United States of America, 94: 3633-3638. [ Links ]
Holmstrom KM, Finkel T. 2014. Cellular mechanisms and physiological consequences of redox-dependent signalling. Nature Reviews Molecular Cell Biology, 15: 411-421. [ Links ]
Jain A, Atale N, Kohli S, Bhattacharya S, Sharma M, Rani V. 2015. An assessment of norepinephrine mediated hypertrophy to apoptosis transition in cardiac cells: A signal for cell death. Chemico- Biological Interactions, 225: 54-62. [ Links ]
Ji LL, Gomez-Cabrera MC, Steinhafel N, Viña J. 2004. Acute exercise activates nuclear factor (NF)-kappaB signaling pathway in rat skeletal muscle. Journal of the Federation of American Societies for Experimental Biology, 18: 1499-1506. [ Links ]
Ji LL, Gomez-Cabrera MC, Viña J. 2006. Exercise and hormesis: activation of cellular antioxidant signaling pathway. Annals of the New York Academy of Sciences, 1067: 425-435. [ Links ]
Ji LL, Gomez-Cabrera MC, Viña J. 2007. Role of nuclear factor kappaB and mitogen-activated protein kinase signaling in exerciseinduced antioxidant enzyme adaptation. Applied Physiology, Nutrition, and Metabolism, 32: 930-935. [ Links ]
Kefaloyianni E, Gaitanaki C, Beis I. 2006. ERK1/2 and p38-MAPK signalling pathways, through MSK1, are involved in NF-kappaB transactivation during oxidative stress in skeletal myoblasts. Cellular Signalling, 18: 2238-2251. [ Links ]
Kumar V, Abbas AK, Fausto N, Aster JC. 2005. Respuestas celulares ante el estrés y las agresiones por tóxicos: adaptación, lesión y muerte. En: Mitchell RN, editor. Robbins y Cotran. Patología estructural y funcional. 7a. ed. España: Elsevier. p. 3-42. [ Links ]
Kupsco A, Schlenk D. 2015. Chapter One: Oxidative stress, unfolded protein response, and apoptosis in developmental toxicity. En: Jeon KW, editor. International review of cell and molecular biology. San Diego: Academic Press. p. 1-66. [ Links ]
Lee HC, Wei YH. 2005. Mitochondrial biogenesis and mitochondrial DNA maintenance of mammalian cells under oxidative stress. The International Journal of Biochemistry and Cell Biology, 37: 822-834. [ Links ]
Lemon JA, Rollo CD, Boreham DR. 2008. Elevated DNA damage in a mouse model of oxidative stress: impacts of ionizing radiation and a protective dietary supplement. Mutagenesis, 23: 473-482. [ Links ]
Luna-López A, González-Puertos VY, Romero-Ontiveros J, Ventura- Gallegos JL, Zentella A, Gomez-Quiroz LE, Königsberg M. 2013. A noncanonical NF-kB pathway through the p50 subunit regulates Bcl-2 overexpression during an oxidative-conditioning hormesis response. Free Radical Biology and Medicine, 63: 41-50. [ Links ]
Lushchak VI. 2011. Adaptive response to oxidative stress: Bacteria, fungi, plants and animals. Comparative biochemistry and physiology. Toxicology and Pharmacology: CBP, 153: 175-190. [ Links ]
Marinho HS, Real C, Cyrne L, Soares H, Antunes F. 2014. Hydrogen peroxide sensing, signaling and regulation of transcription factors. Redox Biology, 2: 535-562. [ Links ]
Marteijn JA, Lans H, Vermeulen W, Hoeijmakers JH. 2014. Understanding nucleotide excision repair and its roles in cancer and ageing. Nature Reviews Molecular Cell Biology, 15: 465-481. [ Links ]
Matsumura A, Emoto MC, Suzuki S, Iwahara N, Hisahara S, Kawamata J, Suzuki H, Yamauchi A, Sato-Akaba H, Fujii HG, Shimohama S. 2015. Evaluation of oxidative stress in the brain of a transgenic mouse model of Alzheimer's disease by in vivo electron paramagnetic resonance imaging. Free Radical Biology and Medicine, 85: 165-73. Doi: 10.1016/j.freeradbiomed.2015.04.013. [ Links ]
Mittal M, Siddiqui MR, Tran K, Reddy SP, Malik AB. 2014. Reactive oxygen species in inflammation and tissue injury. Antioxidants and Redox Signaling, 20: 1126-1167. [ Links ]
Muñoz-Espín D, Serrano M. 2014. Cellular senescence: from physiology to pathology. Nature Reviews Molecular Cell Biology, 15: 482-496. [ Links ]
Nam E, Cortez D. 2011. ATR signalling: more than meeting at the fork. Biochemical Journal, 436, 527-36. [ Links ]
Orozco E, Santa G, Camargo M. 2010. NAC and L-Carnitine antioxidant action in a chronic oxidative stress model in C2C12 myoblast cell line. Revista de la Asocación Colombiana de Ciencias Biologicas, 22: 31-54. [ Links ]
Osburn WO, Kensler TW. 2008. Nrf2 signaling: an adaptive response pathway for protection against environmental toxic insults. Mutation Research, 659: 31-39. [ Links ]
Palikaras K, Tavernarakis N. 2014. Mitochondrial homeostasis: The interplay between mitophagy and mitochondrial biogenesis. Experimental Gerontology, 56: 182-188. [ Links ]
Phoa N, Epe B. 2002. Influence of nitric oxide on the generation and repair of oxidative DNA damage in mammalian cells. Carcinogenesis, 23: 469-475. [ Links ]
Pickering AM, Vojtovich L, Tower J, Davies KJ. 2013. Oxidative stress adaptation with acute, chronic, and repeated stress. Free Radical Biology and Medicine, 55: 109-118. [ Links ]
Pluskota-Karwatka D. 2008. Modifications of nucleosides by endogenous mutagens-DNA adducts arising from cellular processes. Bioorganic Chemistry, 36: 198-213. [ Links ]
Powers SK, Duarte J, Kavazis AN, Talbert EE. 2010. Reactive oxygen species are signalling molecules for skeletal muscle adaptation. Experimental Physiology, 95: 1-9. [ Links ]
Radak Z, Naito H, Kaneko T, Tahara S, Nakamoto H, Takahashi R, Cardozo-Pelaez F, Goto S. 2002. Exercise training decreases DNA damage and increases DNA repair and resistance against oxidative stress of proteins in aged rat skeletal muscle. Pflügers Archiv European Journal of Physiology, 445, 273-278. [ Links ]
Radak Z, Chung HY, Goto S. 2005. Exercise and hormesis: oxidative stressrelated adaptation for successful aging. Biogerontology, 6: 71-75. [ Links ]
Radak Z, Chung HY, Goto S. 2008. Systemic adaptation to oxidative challenge induced by regular exercise. Free Radical Biology and Medicine, 44: 153-159. [ Links ]
Rooney JP, Ryde IT, Sanders LH, Howlett EH, Colton MD, Germ KE, Mayer GD, Greenamyre JT, Meyer JN. 2015. PCR based determination of mitochondrial DNA copy number in multiple species. Methods in Molecular Biology, 1241: 23-38. [ Links ]
Sabri A, Hughie HH, Lucchesi PA. 2003. Regulation of hypertrophic and apoptotic signaling pathways by reactive oxygen species in cardiac myocytes. Antioxidants and Redox Signaling, 5: 731-740. [ Links ]
Takahashi K, Cohen HJ. 1986. Selenium-dependent glutathione peroxidase protein and activity: Immunological investigations on cellular and plasma enzymes. Blood, 68: 640-645. [ Links ]
Wiese AG, Pacifici RE, Davies KJ. 1995. Transient adaptation of oxidative stress in mammalian cells. Archives of Biochemistry and Biophysics, 318: 231-240. [ Links ]
Wink DA, Cook JA, Pacelli R, Liebmann J, Mitchell JB, Murali C. 1995. Nitric oxide (NO) protects against cellular damage by reactive oxygen species. Toxicology Letters, 82/83: 221-226. [ Links ]
Yu BP. 2004. Hormesis and intervention of aging. Geriatrics and Gerontology International, 4: S81-S83. [ Links ]
Zhang Y. 2004. Reactive Oxygen Species (ROS), troublemakers between Nuclear Factor-B (NF- B) and c-Jun NH2-terminal Kinase (JNK). Cancer Research, 64: 1902-1905. [ Links ]