INTRODUCCIÓN
La enfermedad cardiovascular (ECV), y específicamente la cardiopatía coronaria, es la principal causa de muerte en el mundo de acuerdo con la Organización Mundial de la Salud (OMS), estas ocasionaron 17,5 millones de muertes en el 2012 1. El diagnóstico de diabetes mellitus (DM) se considera como uno de los principales factores de riesgo para el desarrollo de la cardiopatía isquémica 2, siendo la enfermedad coronaria de etiología aterosclerótica la principal causa de muerte en pacientes diabéticos 3. El tratamiento antiagregante plaquetario con ácido acetilsalicílico y clopidogrel es la terapia principal utilizada en pacientes con síndrome coronario agudo (SCA), con el objetivo de reducir eventos cardiovasculares adversos 4-6. Sin embargo, existen evidencias sobre el fracaso de esta terapia dual, explicada por el mayor riesgo de reincidencia en eventos cardiovasculares 7, con reportes de resistencia que van desde el 5 al 45 % en la población 4. Razón por la cual en el mundo, incluido Colombia, esta resistencia constituye un gran impacto en el estado de salud de los pacientes, ocasionando mayores complicaciones, un peor pronóstico y un aumento en el costo de la atención en salud 4. Un factor clínico común, que predispone a la resistencia a los antiagregantes plaquetarios y hace más precoz la cardiopatía coronaria, es la hiperglucemia. Esta propicia la activación de rutas bioquímicas que generan un ambiente proinflamatorio y procoagulante en el paciente, como la generación de especies reactivas de oxígeno, la activación de proteína cinasa C (PKC), formación de productos finales de glicación avanzada (PGA), la activación del factor nuclear κB, la vía del sorbitol y la vía de las hexosaminas 5,8. Esta revisión pretende hacer un compendio de la información encontrada en la literatura médica, con respecto a la relación existente entre la hiperglucemia y su efecto sobre el SCA, con el fin de poder establecer estrategias de promoción de la salud y prevención de la enfermedad.
METODOLOGÍA
Se realizó una revisión narrativa definiendo unos subtemas para el desarrollo del contenido. La búsqueda se hizo en PubMed con las palabras clave: hyperglycemia, acute coronary syndrome, platelet aggregation y diabetes mellitus. Se incluyeron los artículos que abordaran los temas propuestos, publicados tanto en inglés como en español y que estuvieran disponibles en texto completo. No se hizo restricción por año de publicación. Dado el tipo de revisión no se contabilizó la cantidad de artículos recuperados.
EPIDEMIOLOGÍA DE LA ENFERMEDAD CARDIOVASCULAR
Las enfermedades cardiovasculares hacen parte del grupo de enfermedades crónicas no trasmisibles, donde la más frecuente es la cardiopatía isquémica, la cual causa un número mayor de muertes que cualquier otro trastorno 1,9-10. Además, es una de las más importantes causas de incapacidad debido al fenómeno de envejecimiento poblacional con cambios en el estilo de vida, como la alimentación con alto contenido de grasas y carbohidratos, el aumento del estrés y la urbanización de las medianas y grandes ciudades 11. Todo lo anterior conlleva a un aumento del coste económico para el sistema de salud 12, haciendo que la enfermedad coronaria represente un importante problema de salud pública en el mundo 9. De acuerdo con la OMS, en el año 2012 se reportaron 17,5 millones de muertes por ECV 13, lo que representó el 31 % de las muertes registradas en el mundo. De estas, 7,4 millones se debieron a la cardiopatía coronaria, con un mayor número de casos en países de ingresos medios y bajos 1,14. En América la cardiopatía isquémica causó aproximadamente 82,9 muertes por cada 100.000 habitantes el año 2010, donde América Latina aportó 57,3 muertes por cada 100.000 habitantes 15. Para las diversas poblaciones en el ámbito mundial, los factores de riesgo convencionales para la ECV son el tabaquismo, el sedentarismo, la alimentación no saludable, el consumo excesivo de alcohol, la hipertensión arterial, hiperlipidemia, sobrepeso u obesidad, hiperglucemia y DM 9. La mayoría de estas comorbilidades conducen a un estado inflamatorio crónico que favorece el proceso aterotrombótico 10. También influyen factores ambientales, genéticos, epigenéticos y clínicos, que en últimas son los desencadenantes de la aparición, progresión y mal pronóstico de la enfermedad coronaria 1,16. La enfermedad coronaria se correlaciona con la presencia de alteraciones en el metabolismo de la glucosa, siendo la cardiopatía isquémica de etiología aterosclerótica la principal causa de muerte en pacientes diabéticos. La DM está presente en aproximadamente un tercio de los pacientes diagnosticados con SCA 3, y según la Federación Internacional de Diabetes, esta afecta actualmente a 425 millones de personas en el mundo y se estima que para el año 2045 serán aproximadamente 629 millones de personas 17.
DEFINICIÓN DEL SÍNDROME CORONARIO AGUDO
La cardiopatía isquémica se caracteriza por un suministro insuficiente de oxígeno y un desequilibrio entre el aporte y la demanda por parte de las arterias coronarias. La causa más común es la enfermedad ateroesclerótica 18, que dependiendo de la oclusión del flujo sanguíneo puede tener diferentes presentaciones clínicas, que van desde una angina estable a un SCA 19. Esta última presentación a su vez, se clasifica en angina inestable o infarto agudo de miocardio (IAM) con o sin elevación del segmento ST 9,18,20. Para definir un IAM se establecen criterios que incluyen la elevación en la sangre de biomarcadores cardiacos, acompañados de cambios electrocardiográficos y signos y síntomas característicos de isquemia miocárdica, como el dolor torácico 18,21. En el electrocardiograma se puede distinguir el IAM con y sin elevación del segmento ST. En el primero, se encuentra una oclusión completa de la arteria coronaria y requiere un tratamiento urgente enfocado en recuperar el flujo sanguíneo, con procedimientos farmacológicos y mecánicos invasivos. En el segundo caso, la arteria coronaria no está ocluida completamente, por lo cual el tratamiento se basa en antiagregantes plaquetarios y anticoagulantes 12,21.
LA HIPERGLUCEMIA Y SU RELACIÓN CON EL SÍNDROME CORONARIO AGUDO
La hiperglucemia aguda y crónica, con o sin previo diagnóstico de DM,se asocian al aumento del riesgo de eventos adversos, a una mayor estancia hospitalaria e incluso a una mayor probabilidad de muerte en los pacientes con SCA 22,23. Así la hiperglucemia predice un peor pronóstico y agrava la lesión miocárdica 24, lo que afecta la recuperación de los pacientes y genera complicaciones a mediano y largo plazo 25. Además, las concentraciones anormales de hemoglobina glicada (HbA1C) se asocian con un mayor riesgo de eventos cardiovasculares 26.
Se estima que dos de cada tres muertes en la población diabética es debida a ECV, de la cual aproximadamente un 40 % corresponde a la enfermedad coronaria isquémica, 15 % a cardiomiopatías, principalmente insuficiencia cardiaca y 10 % a isquemia cerebral. Este riesgo elevado de desarrollar ECV se debe principalmente a la disfunción endotelial generada dentro de las alteraciones metabólicas propias de la diabetes 27. Además, se ha estimado que por cada incremento en 1 % de la HbA1C se incrementa el riesgo cardiovascular entre un 11-16 %, y que a partir de una glucemia en ayunas de 105 mg/dl, por cada 18 mg/dl que esta aumente se eleva el riesgo de padecer ECV aproximadamente en un 12 % 27. Ha existido controversia acerca de si la prediabetes per se incrementa el riesgo cardiovascular en los que la padecen o si, por el contrario, este riesgo es potenciado por la coexistencia de la hipertensión arterial. En un estudio realizado por Li, et al., en donde se incluyeron 7.121 pacientes, se encontró que no existen diferencias estadísticamente significativas (p > 0,05) respecto al número de eventos y la gravedad de la enfermedad coronaria entre pacientes prediabéticos y normoglucémicos. Sin embargo, al evaluar y comparar la gravedad coronaria y el pronóstico clínico en los pacientes prediabéticos e hipertensos respecto a normoglucémicos y normotensos, se obtuvo una diferencia estadísticamente significativa 28. La hiperglucemia por estrés se define como la concentración plasmática de glucosa en ayunas mayor o igual a 126 mg/dL, o determinada en cualquier momento mayor o igual 140 mg/dL (200 mg/dL para otros autores) 29, que se encuentra en pacientes hospitalizados o críticamente enfermos, sin evidencia previa de diabetes 23,30. Esta condición se explica por el incremento de hormonas contrarreguladoras circulantes (cortisol, glucagón, hormona del crecimiento y catecolaminas) y de citoquinas proinflamatorias que interfieren con el metabolismo de los carbohidratos, lo que lleva a una excesiva producción hepática de glucosa y a una recaptación disminuida de ella en los tejidos periféricos. Por otro lado, situaciones como el uso de glucocorticoides, la sepsis, el trauma y los procesos inflamatorios en general, inhiben la secreción, liberación y acción de la insulina 22, aumentando las concentraciones plasmáticas de glucosa durante la estancia hospitalaria. En estos casos la determinación de hemoglobina glicada es clave para diferenciar pacientes con verdadera hiperglucemia por estrés, de aquellos diabéticos no diagnosticados 22. Las alteraciones del metabolismo de la glucosa son muy comunes en pacientes diagnosticados con SCA. En un estudio realizado en Bulgaria en el año 2011, se encontró que el 78 % de los pacientes con enfermedad arterial coronaria presentaban algún tipo de disglucemia 24. Adicionalmente, se ha reportado que los pacientes con SCA presentan hiperglucemia de estrés con una frecuencia entre el 25 y 50 % 31. Estudios epidemiológicos han hallado que el riesgo relativo de muerte intrahospitalaria en pacientes con SCA y DM o, hiperglucemia, fue 3,9 veces mayor que el de los normoglucémicos 25,32. El papel que desempeña la hiperglucemia en la aparición y progresión de las complicaciones en los pacientes coronarios es muy diverso, e incluye mecanismos moleculares, bioquímicos y celulares. Entre estos, se encuentra la formación y acción de los productos finales de glicación avanzada (PGA) sobre sus receptores, autooxidación de la glucosa, incremento de la vía del sorbitol, activación de la PKC, aumento del estrés oxidativo, activación del factor nuclear kB y la producción de isoprostanos, eventos que en conjunto llevan a la formación de un ambiente proinflamatorio, procoagulante y vasoconstrictivo, lo que favorece la aparición de las complicaciones del SCA 3,5,8,33. Estos efectos dependen no solo de la concentración de glucosa, sino del periodo de exposición a la hiperglucemia 3, permitiendo la activación de estas diferentes rutas bioquímicas que favorecen la progresión y evolución de la cardiopatía en el paciente (Figura 1). En el caso de la hiperglucemia aguda, sus efectos deletéreos están dados en su gran mayoría por la activación del sistema simpático y de las principales rutas metabólicas que llevan a estados proinflamatorios y procoagulantes; en la hiperglucemia crónica, además de lo anterior, se generan PGA con aumento de síntesis de tromboxano A2, lo que potencia, aún más, el estado procoagulante 34. A continuación, se describen los principales mecanismos activados en los estados de hiperglucemia y su relación con el SCA.
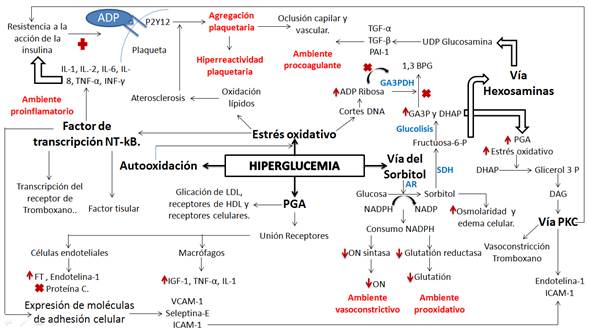
Figura 1 Principales mecanismos fisiopatológicos implicados en la generación del estado protrombótico, procoagulante, prooxidativo y proinflamatorio a partir de la hiperglucemia y su relación con el evento coronario Aumento:↑. Disminución:.Inhibición:×. Estimulación positiva:+. GA3P: Gliceraldehido 3 fosfato; DHAP: Dihidroxiacetona fosfato; GA3PDH: Gliceraldehido 3 fosfato deshidrogenasa; AR: Aldosa reductasa; SDH: Sorbitol deshidrogenasa; PGA: Productos de glicación avanzada; PKC: Proteína cinasa C; PAI-1: Inhibidor del activador tisular del plasminógeno; TNF-α: Factor de necrosis tumoral alfa; INF-γ: Interferon gamma; IGF: Factor de crecimiento insulínico; TGF: Factor de crecimiento transformante; ON: Óxido nítrico; DAG: Diacilglicerol; ICAM-1: Molécula de adhesión intercelular-1; VCAM-1: Molécula de citoadhesión vascular-1; 1.3 BPG: 1,3 Bifosfoglicerato; NADP: Nicotinamida adenina dinucleótido fosfato-forma oxidada; NADPH: Nicotinamida adenina dinucleótido fosfato-forma reducida; ADP: Adenosín difosfato. Fuente: elaboración Propia
Estrés Oxidativo
Las altas concentraciones de glucosa sanguínea favorecen la producción de radicales libres de oxígeno, principalmente radical superóxido (O2 - ) 35, los cuales se generan cuando el oxígeno se reduce de manera incompleta durante la fosforilación oxidativa a nivel mitocondrial 35,36, lo cual produce daño celular por estrés oxidativo debido a un desbalance entre radicales libres y los antioxidantes 37. Esta condición genera oxidación de compuestos celulares como proteínas y lípidos, lo que favorece aún más el proceso aterosclerótico. Además genera quiebres en el DNA incrementando la expresión de ADP ribosa que bloquea la enzima gliceraldehído 3 fosfato deshidrogenasa (GA3PDH) y aumenta el gliceraldehído 3 fosfato (GA3P) 35, y se activan así otras rutas bioquímicas como la vía del sorbitol, la de las hexosaminas y la PKC 35,37, que finalmente conducen al daño vascular.
La vía del sorbitol
Esta se activa cuando las concentraciones de glucosa aumenta en respuesta al bloqueo de la glucolisis por causa del estrés oxidativo, en consecuencia, la enzima aldosa reductasa (que presenta baja afinidad por la glucosa cuando sus concentraciones plasmáticas son normales) 37,38, cataliza la conversión de glucosa a sorbitol, con el consumo de una molécula de NADPH 35-38 que en condiciones normales es indispensable para la generación de antioxidantes como el glutatión y la producción de óxido nítrico 35. Por lo anterior, se establece un ambiente prooxidante y vasoconstrictor. El sorbitol es poco permeable a la membrana celular, lo que incrementa la osmolaridad y favorece el edema celular 35-38. La vía del sorbitol, además, genera fructosa 6 fosfato (F6P) que se acopla a la glucólisis, ocasionando una retroalimentación positiva al aumentar el GA3P, para comenzar nuevamente el ciclo y producir más estrés oxidativo y glicación de macromoléculas 35,38, todo lo anterior favorece la aparición de las complicaciones del SCA.
Vía de las hexosaminas y de la proteína cinasa C.
El incremento de la F6P activa una ruta metabólica poco usual, la vía de las hexosaminas, la cual da origen a UDP-glucosamina, molécula asociada con el aumento en la expresión de genes como los del factor de crecimiento transformante alfa (TGF-α), factor de crecimiento transformante β1 (TGF-β1) y del inhibidor del activador del plasminógeno PAI-1 38, lo que contribuye a generar oclusión capilar y vascular 35 en el paciente coronario. Al mismo tiempo que aumenta la concentración de GA3P, se incrementa la de dihidroxiacetona fosfato (DHAP) 38, que luego es reducida a glicerol 3 fosfato y, junto con la acetil coA, forman ácidos grasos. Esto propicia la formación del diacilglicerol (DAG) y activa la vía de la PKC. Esta enzima es un importante mensajero en la transducción de señales intracelulares, que terminan con la expresión de diversos genes 38 como la fibronectina, el colágeno tipo IV, el PAI-1 y el TGF β1 35,38-39. De modo adicional, la activación de la PKC reduce la síntesis de óxido nítrico y aumenta la de endotelina-1, potenciando el ambiente vasoconstrictor y trombótico 35.
Vía de los productos finales de glicación avanzada (PGA)
Dependiendo del estado hiperglucémico y de su cronicidad, se generan los PGA que se correlacionan con la memoria metabólica y con las alteraciones celulares 40. Los PGA se forman a partir de reacciones no enzimáticas entre el grupo amino libre de la lisina de una proteína y la glucosa 40,41. Esta glicación ocasiona modificaciones en las propiedades físico-químicas y biológicas de las proteínas, las cuales son reconocidas por receptores específicos en los macrófagos que inducen la producción de factor de crecimiento insulínico tipo 1(IGF-1), factor de necrosis tumoral alfa (TNF-α), interleuquina 1 (IL-1) y por células endoteliales que generan el factor tisular, endotelina-1 e inhiben la proteína C 41, lo que lleva a un estado procoagulante y proinflamatorio en el paciente con cardiopatía isquémica. La formación de los PGA también favorecen la aterosclerosis al glicar las lipoproteínas de baja densidad (LDL), haciéndolas más aterogénicas y fáciles de fagocitar por los macrófagos que están en el interior de la placa ateromatosa. Por otro lado, la glicación de las lipoproteínas de alta densidad (HDL) afecta su reconocimiento de parte del receptor, promoviendo la evolución de la placa 40.
Vía del factor de transcripción nuclear NF-Κb
Otro proceso activado por los niveles elevados de glucemia es la vía del factor de transcripción nuclear NF-κB. Este se encuentra localizado de forma inactiva en el citoplasma, unido a proteínas inhibidoras. Se activa tanto por procesos de fosforilación, mediante señales provenientes de citoquinas proinflamatorias como IL-1β y TNF-α, como por estrés oxidativo y aumento de calcio intracelular, entre otros 42-43. Estos estímulos permiten la liberación de la subunidad inhibitoria 42, posibilitando la translocación del NFκB al núcleo para promover la transcripción de genes como el del factor tisular, las moléculas de adhesión celular (molécula de citoadhesión vascular 1 (VCAM1), molécula de adhesión intercelular 1 (ICAM-1) y selectina-E), el gen del receptor del tromboxano y citoquinas proinflamatorias como IL-1; IL-2, IL-6, IL-8, TNF-α e INFγ 42,44-45. Lo expuesto anteriormente ilustra la manera cómo las diferentes rutas activadas por la hiperglucemia en el paciente con SCA favorecen las complicaciones, debido a que se establecen mecanismos inflamatorios y procoagulantes, que se asocian a una mayor estancia hospitalaria, reincidencia de eventos coronarios y un mayor riesgo de muerte 46.
TRATAMIENTO DEL SÍNDROME CORONARIO AGUDO
El tratamiento del SCA se fundamenta en reestablecer la circulación coronaria, ya sea por medios mecánicos (intervención coronaria percutánea (ICP), derivación coronaria) o farmacológicos (trombolisis), así como en impactar sobre las diversas vías fisiopatológicas implicadas en la génesis y progresión del SCA; la terapia dual antiagregante plaquetaria (ácido acetil salicílico sumado a un inhibidor del P2Y12, siendo el clopidogrel el más usado) es el pilar del tratamiento, tanto en la fase aguda como en la crónica 33,47-49.
HIPERGLUCEMIA Y RESISTENCIA A LA TERAPIA ANTIAGREGANTE PLAQUETARIA
La frecuencia de la resistencia a los antiagregantes plaquetarios en pacientes con SCA que han requerido ICP se encuentra entre el 5 y el 45 % para el ácido acetilsalicílico y entre el 4 y 30 % para el clopidogrel 4, en pacientes de diferentes poblaciones. Se presenta en ellos un mayor riesgo de recurrencia de eventos cardiovasculares como trombosis del stent, infarto o muerte súbita 50. La resistencia a los antiagregantes plaquetarios puede determinarse a nivel bioquímico a través de la prueba por transmisión de luz (ATL), o a nivel clínico cuando los pacientes presentan recurrencia de un evento coronario 48. Esta resistencia puede ser explicada por factores genéticos, epigenéticos y clínicos como la falta de adherencia al tratamiento, dosificación inapropiada, interacciones farmacológicas, comorbilidades asociadas 33, variantes en genes que codifican para las proteínas involucradas en la farmacocinética y farmacodinamia de los antiagregantes 48,51-57, entre otras. Aunque esta terapia farmacológica ha demostrado su efectividad en el mejoramiento clínico de pacientes con SCA sometidos a ICP, en los pacientes diabéticos tratados con estos agentes antiplaquetarios se ha evidenciado una mayor frecuencia de eventos isquémicos recurrentes en comparación con pacientes con SCA sin DM 5. Angiolillo, et al. (2005), analizaron los valores de agregación plaquetaria en 60 pacientes diabéticos versus 60 no diabéticos con SCA en terapia clopidogrel/ácido acetilsalicílico, evidenciaron un aumento significativo de la agregación plaquetaria comparado con los pacientes no diabéticos (p = 0,03), y en otro grupo, se observó un número mayor de no respondedores al clopidogrel en las 24 horas posteriores al inicio de la terapia en pacientes diabéticos (p < 0,04) 58. El método más usado por los laboratorios clínicos y de investigación para evaluar la inhibición de la agregación plaquetaria en respuesta a los antiagregantes, es la ATL; específicamente, para determinar la resistencia al clopidogrel y al ácido acetil salicílico se utilizan los agonistas adenosín difosfato (ADP) y ácido araquidónico (AA), respectivamente. Se considera un paciente resistente al ácido acetil silícico cuando se obtiene una agregación mayor o igual al 20 %, y para el clopidogrel con una agregación mayor o igual al 50 o 70 % 59-60. Es importante resaltar que, si bien la ATL es considerada actualmente el estándar de oro, este no es un método estandarizado, pues presenta reproducibilidad limitada y complejidad en la preparación de la muestra, no cuenta con intervalos de referencia establecidos, programas de control interno y externo de calidad, y tiene amplias fuentes de error en la fase preanalítica y analítica, entre otros 60.
Papel de la hiperglucemia en la resistencia a los antiagregantes plaquetarios
Otro mecanismo que potencia la resistencia a los antiagregantes plaquetarios es la hiperglucemia, y por ende, la diabetes mellitus 33. Las altas concentraciones de glucosa plasmática desencadenan rutas bioquímicas que disminuyen la efectividad de estos fármacos, como disfunción endotelial, anormalidades en la coagulación y fibrinólisis, generación de trombina y la hiperreactividad plaquetaria (una de las más importantes), conduciendo a un aumento del riesgo de aterotrombosis 61-64.
Hiperglucemia en la disfunción endotelial
La disfunción endotelial se define como la incapacidad del endotelio para mantener una homeostasis vascular 63, generada por un desequilibrio entre la biodisponibilidad de óxido nítrico debido al estrés oxidativo y el aumento de la vasoconstricción que es debido, principalmente, a la endotelina-1 que es generada a partir de la activación de la PKC 65 y por la unión de los PGA a los macrófagos. Ante la presencia de hiperglucemia, las células endoteliales aumentan la expresión de moléculas de adhesión vascular como ICAM-1 y VCAM-1, y la secreción de citoquinas proinflamatorias, moléculas quimioatrayentes y factores implicados en la trombosis, como PAI-1, tromboxano y factor tisular 63. La activación de la PKC en el endotelio vascular favorece la inflamación, angiogénesis, crecimiento celular y apoptosis, lo que conduce a la progresión de la lesión aterosclerótica y la disfunción endotelial, generando un ambiente protrombótico 65.
Hiperglucemia y su efecto en la terapia trombolítica
Dentro de las alteraciones relacionadas con la coagulación y la fibrinólisis en los pacientes hiperglucémicos, se encuentra un aumento del factor tisular debido a la presencia de procesos inflamatorios 65 y a la activación del factor de transcripción Nf-kB. Lo anterior favorece un aumento de la producción de trombina. Se generan además, otros fenómenos que evitan la degradación del coágulo (incremento en síntesis de fibrinógeno 63, una disminución en la biodisponibilidad del activador tisular del plasminógeno (t-PA) 63,65 y un aumento del inhibidor del activador tisular del plasminógeno). En un estudio realizado en el año 2005, Dunn, et al.,demostraron que a una mayor concentración de Hb1Ac son mayores los cambios estructurales en la conformación del coágulo, entre los que se observaron mayor densidad y menor porosidad. Se evidenció que la diabetes mellitus estaba involucrada tanto con el fracaso a la terapia antiagregante como a la terapia trombolítica en los pacientes con IAM 65.
Hiperglucemia e hiperreactividad plaquetaria
La hiperglucemia también favorece la hiperreactividad plaquetaria, puesto que altera la homeostasis del calcio por acción de las especies reactivas del oxígeno que estimulan la secreción de factores proagregantes 64-65. Adicionalmente, el estrés oxidativo generado por la hiperglucemia potencia la vía de señalización p38 MAPK, que activa la fosfolipasa citosólica A2 y permite la formación de ácido araquidónico y la biosíntesis de tromboxano A2 . Asimismo, la agregación inducida por el colágeno también es estimulada por la producción de especies reactivas de oxígeno 64. Por lo anterior, la hiperglucemia se puede considerar como un riesgo bioquímico al disminuir el efecto de los antiagregantes plaquetarios y promover la activación de las vías de señalización implicadas en empeorar el estado protrombótico del paciente con SCA. Es importante aclarar que no solo la hiperglucemia está involucrada en cada uno de estos mecanismos fisiopatológicos; también se ha demostrado que la hipercolesterolemia incrementa la actividad plaquetaria, incluso más que la hipertrigliceridemia, debido a que el LDL oxidado sirve como ligando para el CD34 al promover la activación plaquetaria, formación de micropartículas de factor tisular derivadas de monocitos y el aumento de la megacariopoyesis, entre otros mecanismos 66. Park, et al., encontraron que de un total de 1045 pacientes diabéticos medicados con ácido acetilsalicílico, 102 presentaron resistencia asociada a concentraciones de colesterol total (p = 0,013), LDL (p = 0,028) y colesterol no HDL (p = 0,008). En el análisis de regresión logística multivariado, solo el colesterol no HDL se asoció con la resistencia al medicamento en pacientes con DM y obesos 67. En otro estudio publicado por Grzegorz, et al., donde se incluyó a 52 pacientes con IAM con elevación del ST, se demostró que un nivel sérico más alto de lipoproteína A-I en fase aguda de IAM es un factor de riesgo independiente para la reactividad plaquetaria alta durante el tratamiento (p = 0,049); este hallazgo es novedoso y le atribuye una actividad distinta a la subfracción del HDL-C 68.
MANEJO DE LA HIPERGLUCEMIA CRÓNICA Y SU IMPACTO EN LA ENFERMEDAD CORONARIA
Se ha observado que el manejo intensivo del control glucémico reduce el riesgo de eventos microvasculares relacionados con la diabetes mellitus. En un estudio realizado por Holman, et al., se demostró que, además de reducir las complicaciones microvasculares, se lograba una reducción significativa del riesgo emergente de infarto de miocardio (p = 0,005) y muerte por cualquier causa (p = 0,002) 69. Se recomienda que en los pacientes diabéticos que cursen con un SCA el objetivo del tratamiento debe de contemplar también mantener una glucemia basal menor a 108 mg/dl y una hemoglobina glicada menor o igual a 6,5 %, además de una estrategia terapéutica multifactorial que incluya antihipertensivos, antiagregantes, hipolipemiantes y cambios en los estilos de vida 3. Es importante aclarar que no se ha demostrado el beneficio clínico con el tratamiento agresivo con insulina y existe controversia al respecto. Lo que sí se ha establecido de forma experimental es que la insulina reduce la inflamación, coagulación, mejora la función endotelial, la fibrinólisis y reduce la gravedad del infarto en el SCA 70.
CONCLUSIONES
Los pacientes con hiperglucemia presentan un mayor riesgo de desarrollar un evento coronario, así como de resistencia al tratamiento antiagregante plaquetario. Todo esto se hace evidente al entender la fisiopatología de las vías metabólicas implicadas en la hiperglucemia, las cuales terminan en dos vías comunes: estado proinflamatorio y procoagulante, lo que determina un mayor riesgo coronario y un peor pronóstico. Es fundamental el adecuado control glucémico para impactar en la morbimortalidad, tanto en la prevención primaria como secundaria.














