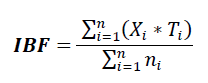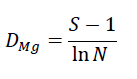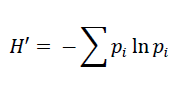INTRODUCCIÓN
En la actualidad, los ríos y arroyos, a nivel global, están siendo amenazados por contaminación antropogénica, recibiendo continuamente aguas residuales no tratadas y residuos sólidos domésticos e industriales, que causan deterioro en la calidad del agua (Dalu et al. 2017).
La preocupación por entender y proteger los ecosistemas fluviales ha generado el desarrollo de metodologías biológicas, para estimar la salubridad del agua. Entre los indicadores biológicos más utilizados para la evaluación de los ecosistemas fluviales y la calidad del agua, se destacan los macroinvertebrados bentónicos, por las ventajas que estos organismos presentan, como son: la presencia en casi todos los sistemas acuáticos, lo cual, facilita realizar estudios comparativos; la naturaleza sedentaria posibilita hacer análisis espaciales de los efectos de perturbaciones en el agua; la realización de muestreos y análisis con equipos simples de bajo costo y por la disponibilidad de métodos e índices, que se han venido validando en diferentes ríos del mundo (Rosenberg & Resh, 1993; Singh & Saxena, 2018). Además, los ciclos de vida de los macroinvertebrados bentónicos varían entre un mes y un año, dependiendo de la especie, lo que posibilita evidenciar alteraciones en el medio acuático, a corto y largo plazo (Tenjo & Cárdenas, 2015).
Los ensamblajes de macroinvertebrados de agua dulce han proporcionado información valiosa para desarrollar programas de evaluación de la calidad del agua por más de un siglo (Jackson & Füreder, 2006). Los índices de integridad biológica (IIB) convierten la información de varios atributos de los ensamblajes de fauna béntica en un solo valor y se han popularizado para evaluar y gestionar la condición del agua de los ríos (Rehn et al. 2007; Stoddard et al. 2008), de los lagos (Drake & Valley, 2005; Beck & Hatch, 2009), de los humedales (Lunde & Resh, 2012) y de los estuarios (Weisberg et al. 1997).
Según Armitage et al. (1983), las familias de macroinvertebrados intolerantes a la contaminación tienen puntajes altos, mientras que las familias tolerantes a la contaminación tienen puntajes bajos; por consiguiente, un valor alto en el promedio del puntaje por taxón (ASPT), caracteriza aguas de un río limpio, situado en tierras altas, con contenido relativamente grande de taxones, con puntuación alta. Los ríos en sitios de tierras bajas, generalmente, no soportan muchos taxones con alta puntuación y presentan valores más bajos de ASPT. De igual forma, Ríos et al. (2014) siguieron este concepto para la estimación del Andean Biotic Index y presentan valores de intolerancia a la contaminación para macroinvertebrados de los ríos andinos, situados por encima de 2.000m s.n.m; por el contrario, Hilsenhoff (1988) utiliza valores de tolerancia, que vienen a ser el inverso de los valores de intolerancia de Armitage et al. (1983) y de Ríos et al. (2014).
Entre las mediciones de calidad de agua, basadas en macroinvertebrados, tenemos los siguientes: índice Biótico de Familias (IBF), índice EPT (Ephemeroptera, Plecoptera y Trichoptera) Biological Monitoring Working Party (BMWP) y parámetros fisicoquímicos (Mandaville, 2002).
El Índice Biótico de Familias (IBF) fue perfeccionado por Hilsenhoff (1988), quien resumió las diferentes tolerancias de una comunidad de macroinvertebrados bentónicos en un único valor. Los valores de tolerancia los especificó para cada familia taxonómica por ponderación de la abundancia relativa respectiva. El IBF, se utiliza con frecuencia para analizar el agua en diferentes sectores de los ríos de alta montaña (Figueroa et al. 2003; Fierro et al. 2012; Cortes et al. 2013).
En Colombia, se han realizado varios estudios para adaptar el índice BMWP en la evaluación de la calidad de las aguas fluviales, mediante el uso de familias de macroinvertebrados bentónicos (Zamora, 2000; Zamora & Sarria 2001; Roldán-Pérez, 2003; Roldan-Pérez, 2016; Galeano et al. 2017); sin embargo, no se encontraron estudios relacionados con la aplicación de IBF para caracterizar la salubridad del agua. Según, Figueroa et al. (2003), el IBF es un buen indicador para estimar la calidad de los ríos de cuencas agrícolas y ganaderas. Asimismo, Figueroa et al. (2007) reportan que en la estimación del IBF se incorpora la razón entre la tolerancia y el total de familias encontradas en una muestra, lo cual, hace que el error de los muestreos cualitativos disminuya. Por esta razón, en la presente investigación, se utilizó el IBF, dado su carácter cuantitativo, la facilidad para calcularlo y porque el Río Teusacá atraviesa una zona de alta montaña de actividad ganadera e industrial.
El propósito de este trabajo fue analizar en dos sectores (alto y bajo) del cauce principal del río Teusacá y en dos temporadas seca y lluviosa, la calidad del agua, utilizando el Índice Biótico de Familias (IBF) y probar la correlación del IBF con las variables: COT, fosfatos, sulfatos, nitratos, nitritos, índice de Margalef e índice de Shannon-Wiener.
MATERIALES Y MÉTODOS
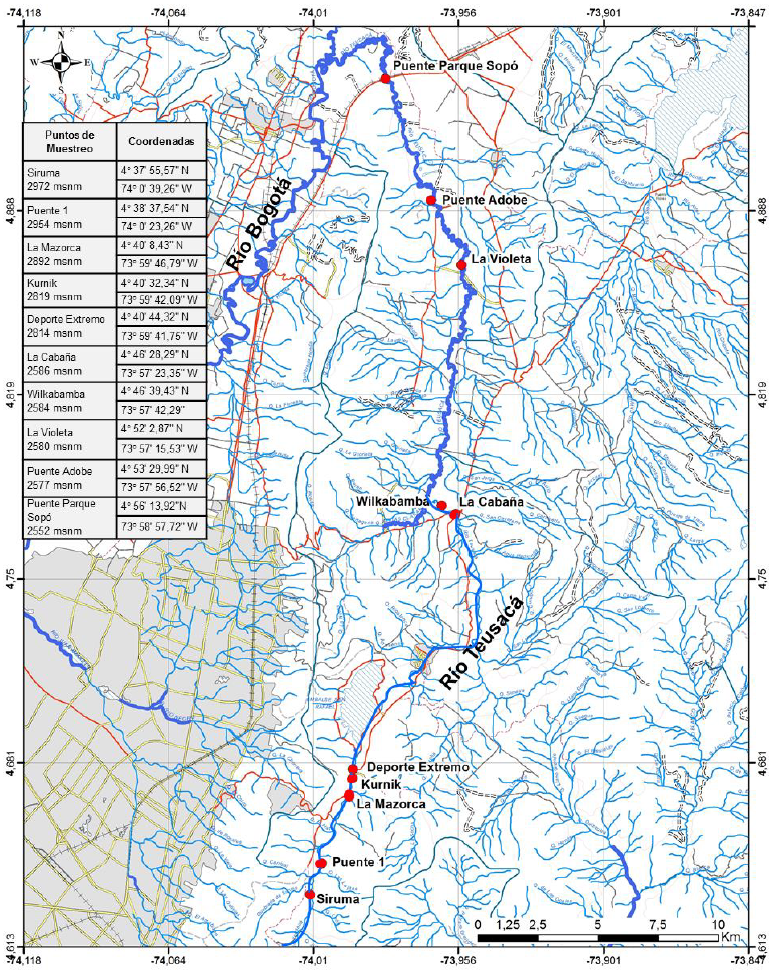
Lugar del estudio. El estudio, se realizó en la subcuenca del Río Teusacá, ubicada al oriente de Bogotá. El cauce principal del río mide, aproximadamente, 69km y atraviesa de sur a norte los municipios de La Calera y Sopó; además, hace parte de la cuenca del Río Bogotá. El sistema fluvial está sujeto a diferentes fuentes de contaminación, principalmente, vertimientos de aguas residuales domésticas e industriales y residuos de la actividad ganadera.
Recolección y análisis de muestras. Se eligieron dos sectores del río para hacer el análisis; uno, en la parte alta, entre 2.972 y 2.814m s.n.m., en donde se escogieron al azar cinco puntos de muestreo y, otro, en la parte baja, entre 2.586 y 2.552m s.n.m., en donde se escogieron al azar otros cinco puntos de muestreo. Se utilizó un GPS Garmin, para la georreferenciación de los sitios, en donde se tomó cada una de las muestras (Figura 1). El primer muestreo, se realizó al finalizar una temporada seca, los días 22 y 23 de octubre de 2016 y, el segundo, al terminar una temporada lluviosa, los días 29 y 30 de julio de 2017.
Se tomaron tres muestras de macroinvertebrados por cada sitio, utilizando una red Surber, con malla 500 micras y 0,09m2 de área de superficie de muestreo. Cada muestra, se colectó en un recipiente plástico (6cm x 4cm de diámetro) etiquetado y se fijó en alcohol etílico al 70%, para la posterior separación y determinación taxonómica, actividad realizada en el laboratorio de Ecología de la Universidad Santo Tomás. Para la determinación taxonómica de los macroinvertebrados, se utilizó un estereomicroscopio NexiusZoom y las claves taxonómicas de Oscoz et al. (2011), Prat et al. (2012) y Roldan-Pérez (2012).
En cada sitio, se tomó una muestra de agua de un litro en un envase plástico de la misma capacidad e, inmediatamente, se almacenaron en una bolsa plástica negra, para el transporte al laboratorio. El análisis químico de las muestras de agua fue realizado en el laboratorio Dr. Calderón, certificado por el IDEAM. El análisis de las muestras de agua fue realizado de la siguiente forma: para COT, con equipo TOC Hach; para fosfatos, con el método de ácido ascórbico; para sulfatos, con nefelometría y para nitratos y nitritos, con espectrofotometría.
Estimación del Índice Biótico de Familia. Los datos obtenidos de la determinación taxonómica de macroinvertebrados hasta familia y el número de individuos por familia, se agruparon y se asignó el puntaje de tolerancia, siguiendo la metodología sugerida por Carter et al. (2017). En la tabla 1, se presentan los valores de tolerancia para cada familia empleadas en la estimación del Índice Biótico de Familia (IBF), basada en los valores de intolerancia ABI, para los ríos alto andinos (Ríos et al. 2014). Los valores de tolerancia para cada familia varían entre 0 (taxón sensible) y 10 (taxón tolerante). Para el cálculo del IBF, se siguió el propuesto por Hilsenhoff (1988)), haciendo la sumatoria del producto del número de individuos encontrados por cada familia por el valor de tolerancia respectivo de esa familia, dividido entre el número total de individuos de la muestra. Se obtiene con la siguiente ecuación:
Donde, Xi es el número de individuos de cada familia; Ti es el valor de tolerancia de cada familia y ni es el número total de organismos.
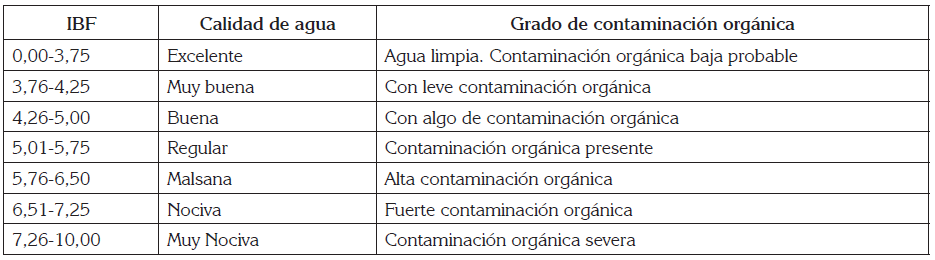
Los valores de IBF obtenidos en cada sitio fueron contrastados con los criterios de calidad de agua (Tabla 2), siguiendo el procedimiento de Hilsenhoff (1988).
Estimación de Índices de diversidad. El índice de Margalef relaciona el número de especies con el número total de individuos. Se estima con la siguiente ecuación:
Donde, S = número de especies y N = número total de individuos.
Un índice de biodiversidad de Margalef igual a cero (0) indica que en un área existe una sola especie, valores inferiores a 2,0 es indicativo de baja diversidad y valores por encima de 5,0 son indicativos de alta biodiversidad (Magurran, 2004).
El índice de Shannon-Wiener mide qué tan uniformes están representadas las especies en una muestra. La ecuación de cálculo es la siguiente:
Donde, pi = abundancia proporcional de la especie i, obtenida dividiendo el número de individuos de la especie i entre el número total de individuos de la muestra. Normalmente, los valores se encuentran entre 1,5 y 3,5; en raras ocasiones, se logra obtener un valor de 4,5. H’ = 0 cuando la muestra contiene solo una especie y será máximo cuando la comunidad tenga una distribución de abundancia equitativa H’=H’max (Magurran, 2004).
Tabla 1 Valores de Tolerancia ajustados para la aplicación del FBI (Hilsenhoff, 1988), con base en el Andean Biotic Index (Ríos et al. 2014).
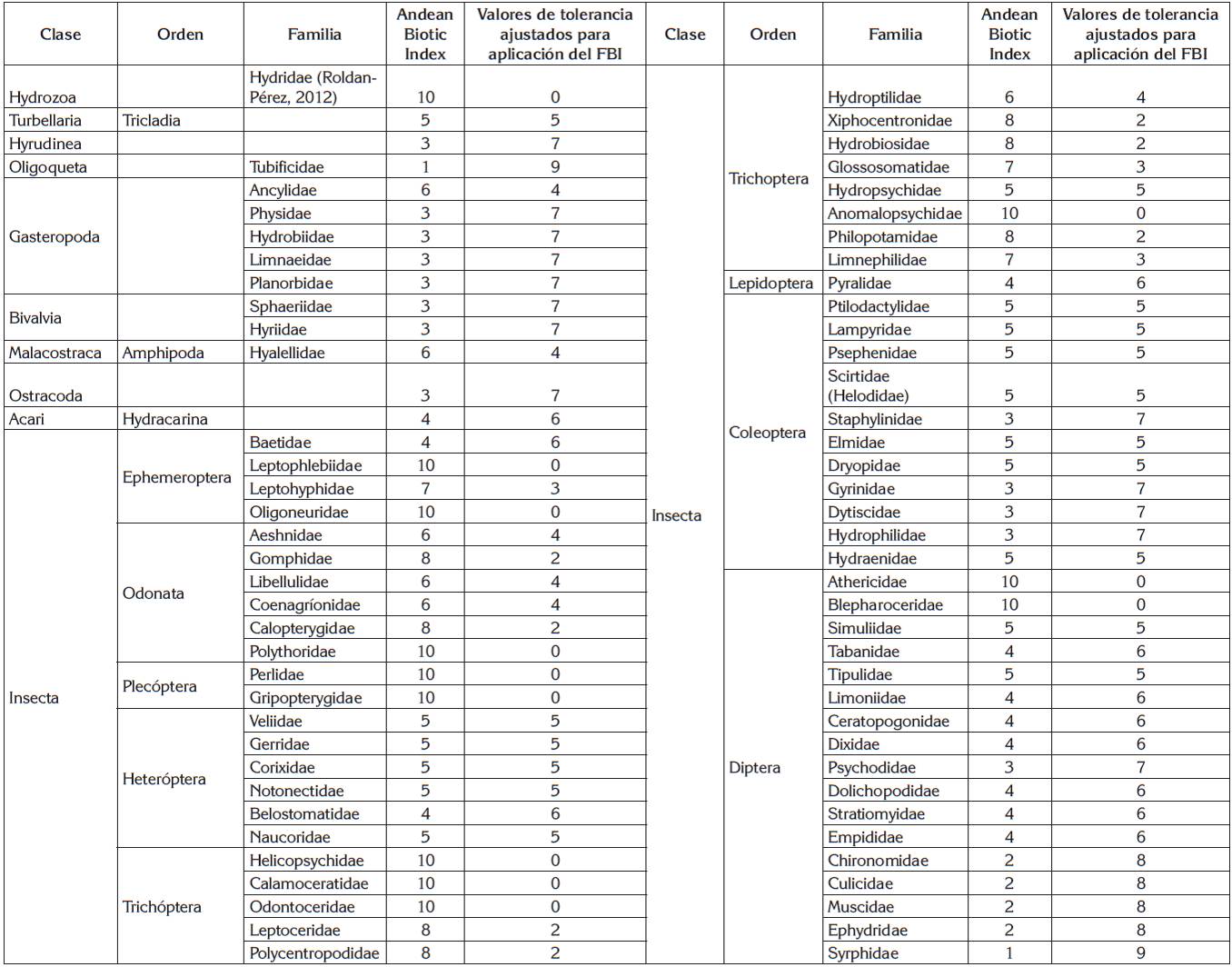
Tabla 2 Clasificación de calidad de agua basada en el Índice Biótico de Familia (IBF), según Hilsenhoff (1988).
El análisis estadístico, se ejecutó con el software R versión 3.5.1. Se realizó una prueba no paramétrica, para comparación de muestras independientes Kruskal-Wallis (con alfa=0,05), para probar diferencias significativas en los niveles promedios de las variables estudiadas con respecto a los dos sectores (alto y bajo) del río. Para probar diferencias significativas entre los niveles promedios de las variables con respecto a las temporadas seca y lluviosa, se realizó una prueba no paramétrica de comparación de medias para muestras pareadas Wilconxon (con alfa=0,05). Por último, para medir el grado de relación entre las variables, se utilizó el coeficiente de concordancia no paramétrico W de Kendall (con alfa=0,05), con el cual, se probó la correlación del IBF con las demás variables.
RESULTADOS Y DISCUSIÓN
El hábitat fluvial en donde se realizaron los primeros cinco muestreos, se caracteriza por ser inclinado, con fondo de rocas arenosas, con una diferencia en altitud de 158 metros, mientras que en donde se realizaron los últimos cinco muestreos, se caracteriza por ser ligeramente inclinado, con fondo arcilloso, con una diferencia de altitud de 34 metros.
En total, se registraron 35 taxones (Tabla 3), en su mayoría estadios inmaduros de la clase Insecta. Los órdenes con más familias fueron Diptera (28%), Coleoptera (17%) y Hemiptera (11%). En la parte alta (altitud 2.972 metros), se esperaba hallar, efemerópteros, plecópteros y trichópteros de baja tolerancia (Roldán-Pérez, 2003; Figueroa et al. 2003); sin embargo, se encontraron, en las dos temporadas, efemerópteros (Baetidae), con valor de tolerancia (T) de 6 y trichópteros Hydroptilidae, con T=4 y unos pocos individuos Philopotamidae, con T=2 (Tabla 4). El IBF detectó agua de buena calidad; sin embargo, el agua contenía fosfatos por encima del valor aceptado por los MPS-MAVDT (2007). La actividad antrópica en este punto es prácticamente residencial y ganadera.
Tabla 3 Macroinvertebrados y número de individuos encontrados en diez sitios de muestreo y en dos temporadas en el Río Teusacá.
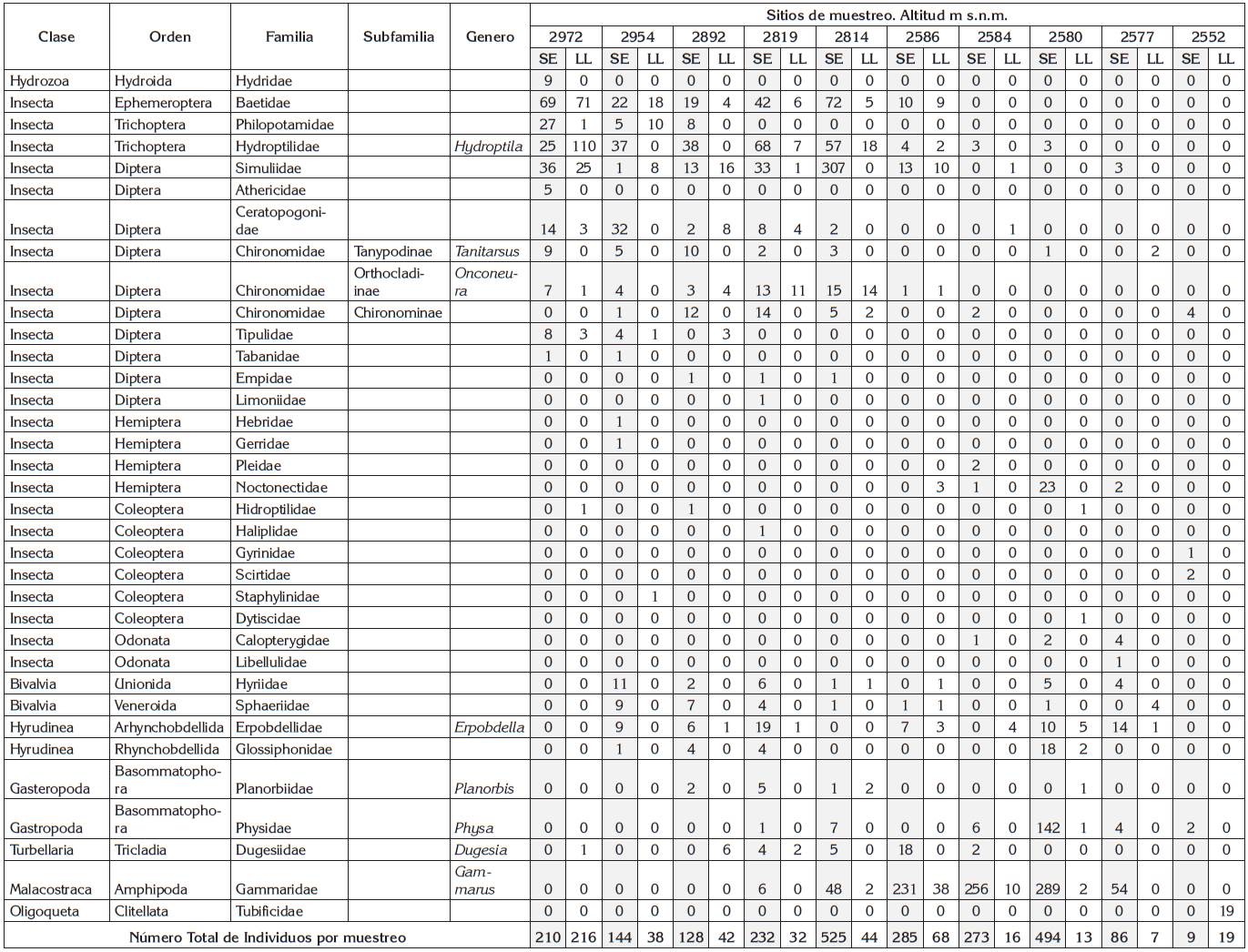
SE: Temporada seca, 22 y 23 de octubre de 2016. LL: Temporada lluviosa, 29 y 30 de julio de 2017.
En los puntos de muestro 4 al 5, en la parte alta del río, presentaron alta dominancia ephemeropteros (Baetidae, con T=6), trichopteros (Hydroptilidae, T=4) y dípteros (Simullidae, T=5; Ceratopogonidae, T=6 y Chironomidae, T=8). En estos puntos, el IBF detectó una calidad de agua regular, con contenidos crecientes de COT y fosfatos, aspectos que, posiblemente, son favorables para el crecimiento poblacional de estos insectos. La actividad antrópica en estos puntos, al igual que en el primer punto, es principalmente residencia y ganadera.
En la parte baja del río, entre los puntos de muestreo del 6 al 8, predominaron las sanguijuelas (Glossiphonidae, Erpobdellidae), los crustáceos anfípodos (Gammaridae) y gasterópodos; el IBF detectó agua malsana y nociva, con contenidos de COT mayores de 11,22mg/L y fosfatos por encima de 3,19mg/L, lo cual, demuestra el amplio rango de tolerancia, que presentan estas familias.
En los puntos de muestreo 9 y 10, se notó la presencia de unos pocos individuos de las familias: Notonectidae (Hemíptera), Gyrinidae, Scirtidae (Coleoptera), Physidae (Gastropoda) y Tubificidae (Haplotaxida), con agua nociva y muy nociva; estas familias presentan valores de tolerancia entre 9 y 10. La distribución de macroinvertebrados observada en este trabajo es consistente con lo reportado por Hilsenhoff (1988), Mandaville (2002), Roldán-Pérez, (2003) y Carter et al. (2017).
La tabla 4 presenta los contenidos de los contaminantes observados con los valores máximos aceptados para el consumo humano en Colombia, según la Resolución número 2115 de 2007 (MPS-MAVDT (2007), los valores del IBF, su relación con el grado de contaminación del agua e índices de diversidad de macroinvertebrados, en los dos sectores del río y en las dos temporadas.
Tabla 4 Sitios de muestreo, temporada, sustancias químicas, calidad del agua basada en el IBF y diversidad de macroinvertebrados, en el Río Teusacá.
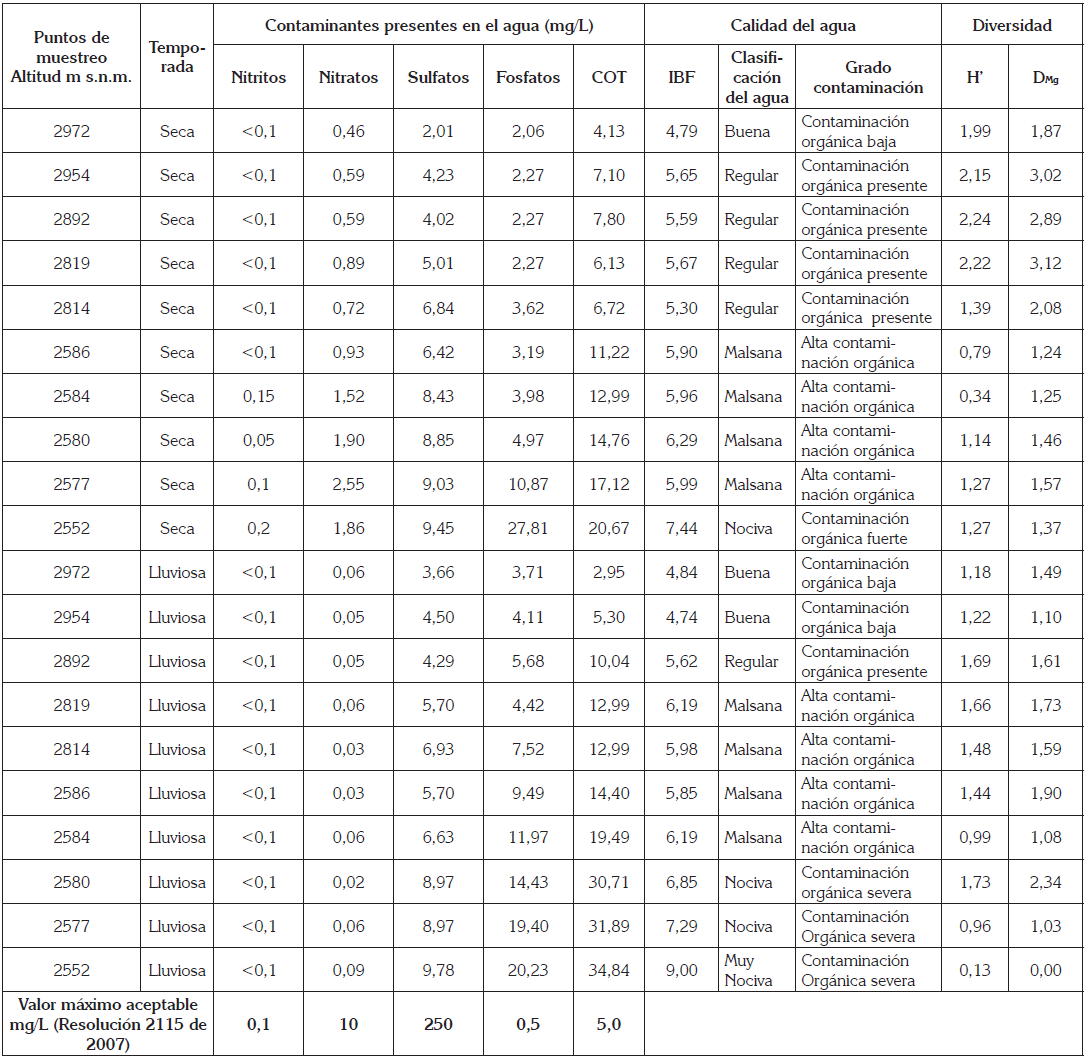
Comparando los promedios en los niveles de las variables (n=10, alfa=0,05) entre los dos sectores (alto y bajo) del río, al finalizar la temporada seca, se encontraron diferencias significativas entre las variables: COT (p=0,009), fosfatos (p=0,015), sulfatos (p=0,016), nitratos (p=0,009), IBF (p=0,009), DMg (p=0,009) y H’ (p=0,009). De igual forma, al finalizar la temporada lluviosa, se observaron diferencias significativas en las variables COT (p=0,0088), fosfatos (p=0,009), IBF (p=0,036 y sulfatos (p=0,035); sin embargo, no se evidenció diferencias significativas en los nitratos (p=0,83), en los dos sectores estudiados.
Al realizar la comparación del nivel del promedio de cada variable con respecto a las temporadas seca y lluviosa, se encontraron diferencias significativas en el contenido de COT (p=0,0097), de fosfatos (p=0,037) y de nitratos (p=0,006), mientras que el contenido de sulfatos (p=0,431), no tuvo diferencia significativa. En cuanto al IBF (p=0,10), DMg (p=0,10) y H’ (p=0,41), no hubo diferencias significativas en las dos temporadas.
Las concentraciones de COT en las dos temporadas, después de los 2.954m s.n.m. está por encima de los valores aceptados para consumo humano (MPS-MAVDT, 2007); la contaminación por COT en el sector alto del río, posiblemente, se da por descargas de aguas residuales domésticas y por la ganadería que, como lo reportan Figueroa et al. (2003) y Ordóñez Díaz et al. (2014), las actividades ganaderas, cerca de la rivera y las descargas directas al río de aguas residuales, incrementan la contaminación por COT. En el sector bajo del río existen urbanizaciones e industrias que, posiblemente, están causando el incremento de COT, por vertimientos al río.
En cuanto al contenido de fosfatos desde el primer sitio (2.972m s.n.m.), las concentraciones observadas están por encima de los valores aceptados (MPS-MAVDT, 2007); este aspecto, probablemente, se debe a vertimientos residenciales con residuos de detergentes, que contienen fosfatos, puesto que en la rivera de este sector del río existen varias residencias y descargas de residuos de fertilizantes, lo cual, es consistente con Figueroa et al. (2003), Bolaños-Alfaro et al. (2017) y Zhang et al. (2018), quienes afirman que la contaminación del agua con fosfatos, es consecuencia del uso indiscriminado de fertilizantes agrícolas, que contienen fosfatos solubles en agua.
Los sulfatos y los nitratos, aunque presentaron valores por debajo de los aceptados por MPS-MAVDT (2007), registraron diferencias significativas en los dos sectores alto y bajo del río en las dos temporadas, mientras que el contenido de nitritos en los dos sectores del río, en las dos temporadas, indicó variación muy leve, con valores por debajo de los aceptados (MPS-MAVDT, 2007).
En cuanto a la correlación del IBF (para n=10, alfa=0,05) con las demás variables, se encontró que, al finalizar la temporada seca, el IBF se correlacionó positivamente con las variables: COT, 77,8% (p=0,003); fosfatos, 73,6% (p=0,005); sulfatos, 77,8% (p=0,002) y nitratos, 76,4% (p=,003), mientras que no tuvo correlación con DMg (p=0,37) y H’ (p=0,17). Al finalizar la temporada lluviosa, el IBF tuvo correlación positiva con las variables: COT, 84,1% (p=0,001); fosfatos, 76,4% (p=0,003); sulfatos, 78,2% (p=0,003); sin embargo, no tuvo correlación con nitratos (p=0,45) ni con los índices de diversidad DMg (p=0,653) y H’ (p=0,53). La correlación alta del IBF con los contaminantes es acorde con lo observado por Figueroa et al. (2003).
En el presente estudio, no se observó correlación del IBF con los índices de diversidad de macroinvertebrados en las dos temporadas seca y lluviosa en los dos sectores del río; este resultado sugiere que la diversidad de macroinvertebrados bentónicos no tiene relación directa con la calidad del agua y que pocas especies, con baja tolerancia, pueden ser indicadores de buena condición del agua; por el contrario, alta diversidad con valores de tolerancia medios y altos pueden ser indicadores de aguas malsanas. Al respecto, Prat et al. (2009) reportan que la utilización de los índices de Margalef, Shannon-Wiener y Pielou está condicionada, porque consideran únicamente la riqueza y la abundancia y no se tienen en cuenta los niveles de tolerancia o sensibilidad a la contaminación; además, los índices de diversidad pueden dar valores muy variables y, por lo tanto, no ofrecen garantías como bioindicadores de calidad del agua; de otra parte, Zhang et al. (2018) manifiestan que la diversidad de macroinvertebrados muestra tendencia decreciente con el aumento de la contaminación y alteraciones del hábitat acuático, lo cual, no se observó en este trabajo.
La calidad del agua en el sector alto del río estuvo entre buena y regular, con valores de IBF, entre 4,79 y 5,62, en las dos temporadas, excepto en la temporada lluviosa, en los puntos de muestreo 4 y 5, en donde el valor de IBF indicó agua malsana, mientras que en el sector bajo del río, el valor del IBF estuvo entre 5,90 y 9,0, caracterizando aguas malsanas, nocivas y muy nocivas. Estos resultados son consistentes con Hilsenhoff (1988), Mandaville (2002), Figueroa et al. (2003) y Carter et al. (2017), quienes manifiestan que valores bajos de IBF en las partes altas de los ríos caracterizan aguas con bajo contenido de contaminantes, mientras que valores altos de IBF caracterizan aguas altamente contaminadas, en sitios con altitudes medias y bajas. Al respecto, se sugiere complementar la aplicación de IBF, con otras variables físico-químicas, para correlaciona el IBF frente a otros tipos de contaminantes en los ríos.