INTRODUÇÃO
A cajazeira (Spondia mombin L.) é uma planta de clima tropical, pertencente ao gênero Spondias e a família das Anacardiáceaes. No Brasil, está presente em todas as regiões, contudo, não há cultivos comerciais desta espécie (Araújo et al., 2014). Os frutos da cajazeira são muito consumidos, em virtude de serem ricos em compostos bioativos, com alto potencial antioxidante, agregando valor a esses frutos (Silva et al., 2012; Neves et al., 2015).
Na propagação desta espécie, comumente o método mais adotado é a estaquia, visto que proporciona plantas homogêneas e produção precoce invés da propagação via seminífera que ocasiona germinação desuniforme e produção demorada. Contudo, assim como as demais espécies do Spondias, algumas plantas apresentam dificuldade de enraizamento, sendo esse obstáculo ocasionado na maioria das vezes pelo balanço hormonal da planta matriz (Costa et al., 2015).
Para o enraizamento ocorrer, precisa-se de concentrações endógenas de auxina necessárias para estimular a formação de raízes (Meneguzzi et al., 2015). A auxina está entre os hormônios vegetais mais importantes para o enraizamento de estacas, sendo o ácido indolbutírico (AIB) o mais conhecido e um dos mais eficientes e usados na propagação via estaquia, uma vez que é foto estável e imune à ação biológica (Figueiredo et al., 2009; Alcantara et al., 2010).
Alguns trabalhos com o uso de ácido indolbutírico na propagação via estaquia em Spondias tem mostrado que as espécies desse gênero apresentam baixo enraizamento (Véras et al., 2017; Véras et al., 2018), a exemplo de Souza y Lima (2005), em cajazeira, utilizando ramos apicais para confecção das estacas e aplicação de concentrações de AIB, obtiveram 8,3 a 23,3% de estacas enraizadas. Paula et al. (2007) que observaram baixo percentual de enraizamento de estacas lenhosas e herbáceas de umbuzeiro e observaram percentual de 33,3% de estacas herbáceas enraizadas, com a aplicação da dose de 500 mg L-1 de AIB imersas por 10 min. Rios et al. (2012) em umbuzeiro com estacas de 20 cm de comprimento, tratadas com AIB (6000 mg L-1) verificaram baixo percentual de enraizamento (33,33%).
Além disso, um fator extremamente relevante para o enraizamento é a nutrição da planta matriz, uma vez que o estado nutricional da planta determina as respostas morfogenéticas como a formação de raízes adventícias, bem como, a modulação do comprimento e densidade das mesmas. Sendo assim, é essencial que a planta matriz esteja em balanço nutricional adequado (Cunha et al., 2009). Dentre os elementos minerais importantes para o enraizamento, o zinco é essencial, visto que participa da rota do triptofano, aminoácido precursor da auxina. Apesar disso há poucos estudos com o uso de zinco como cofator importante no enraizamento, podendo até mesmo substituir a utilização de auxinas sintéticas (Nicoloso et al., 1999).
Em virtude da carência de estudos relacionados à propagação da cajazeira, além do baixo percentual de enraizamento desta espécie o tratamento de planta matriz pode ser alternativa viável, para elevar o enraizamento. Neste sentido, o presente trabalho objetivou avaliar o efeito do tratamento da planta matriz com zinco sobre o enraizamento de estacas de cajazeira tratadas com ácido indolbutírico.
MATERIAL E MÉTODOS
O experimento foi conduzido no período de julho a novembro de 2016 no viveiro de Fruticultura, pertencente à Universidade Federal da Paraíba no município de Areia-PB, situada nas coordenadas geográficas 6°51'47" e 7°02'04" latitude Sul e longitude Oeste 35°34'13" e 35°48'28" do meridiano de Greenwich. Foram selecionados ramos lenhosos de plantas de cajazeira (Spondias mombin sp.), provenientes da estação experimental da Empresa Brasileira de Pesquisa Agropecuária (EMEPA), João Pessoa-PB. As plantas matrizes de cajazeira foram obtidas de enxertia, com idade de 10 a 20 anos.
No ensaio utilizou-se o delineamento inteiramente casualizado, com nove tratamentos, e níveis pré-determinados pela matriz "Composto Central de Box" referente as doses de zinco, combinadas com as doses de AIB, com quatro repetições, cada unidade experimental constituída por 12 estacas no total.
O tratamento com zinco foi formulado por meio do produto comercial (Maxizinco®, Agrichem), aplicado via pulverização nas plantas matrizes 7 d antes da retirada dos ramos. As doses de zinco correspondentes aos tratamentos (0; 5,8; 20; 34,2 e 40 mg L-1) foram diluídas conforme a indicação comercial do produto de 1.000 g L-1 de zinco, encontrando-se a partir da mesma a dose específica para cada tratamento. O zinco foi diluído dentro de um pulverizador costal e aplicado na copa das plantas de umbuzeiro com volume aproximado de 4 L.
Sete dias após a aplicação do zinco, foram coletados ramos de cajazeira com 3 a 4 mm de diâmetro e aproximadamente 30 cm de comprimento, sendo acondicionados em papel umedecido, colocados em sacos plásticos e transportados para o Viveiro de Fruticultura na Universidade Federal da Paraíba, município de Areia-PB, Brasil. Estes foram levados para a câmara de nebulização onde realizou-se o corte das estacas, sendo a parte superior cortada reta e a basal cortada em bisel, ficando com 20 cm de comprimento (Véras et al., 2017; Véras et al., 2018b).
A solução hidroalcoólica do AIB foi preparada pela pesagem de 872,35 mg L-1 de AIB e dissolvidos em 50 mL de álcool 96o, em um Becker. Após totalmente dissolvido, completou-se o volume para 1.000 mL, com água destilada, obtendo-se então a concentração de 872,35 mg L-1 de AIB; sendo repetido esse mesmo procedimento para as demais doses utilizadas (0, 872.35, 3.000, 5.127,65 e 6.000 mg L-1).
Após o término do preparo, as estacas foram agrupadas, por repetição e tiveram 1,0 cm da base colocada na solução hormonal por 5 s, conforme cada tratamento. Posteriormente, realizou-se o plantio em tubetes com diâmetro interno de 26 mm e diâmetro externo de 33 mm e volume de 55 cm3, preenchidos com substrato formado de areia e composto orgânico, na proporção 1:1 (v/v); sendo submetido a 50% de luz solar em estufa sob nebulização, com abertura de 10 s e intervalos de 15 min.
Aos 90 d após a instalação do experimento foram avaliados: o percentual estacas brotadas, o comprimento das brotações, o diâmetro das brotações, o percentual de estacas enraizadas, o percentual de estacas vivas com e sem calo, o percentual de estacas mortas, o número de raízes por estaca, o comprimento da raiz, a massa seca das raízes, folha e a massa seca total.
Os resultados foram submetidos à análise de variância pelo Teste F (P<0,05). Para as variáveis com efeito da interação significativa foram ajustadas a superfície de resposta, e caso contrário foi feito a análise de regressão polinomial. As análises foram realizadas com o software estatístico SAS (Cody, 2015).
RESULTADOS E DISCUSSÃO
Não houve efeito significativo para o percentual de estacas brotadas, número de brotações, comprimento e diâmetro de brotações, percentual de estacas enraizadas, de estacas vivas com e sem calo, estacas mortas, comprimento da raiz, número de raízes, massa seca da raiz, folha e total quando relacionada às concentrações de zinco, apresentando valores médios de 41,48%; 1,18; 3,32 cm; 2,17 mm; 25,92%; 9,7%; 9,7%; 22,22%; 3,39 cm; 1,58 raízes; 2,99 g; 4,8 g e 12 g, respectivamente (dados não apresentados).
O percentual de estacas brotadas (Fig. 1A) se ajustou a equação linear com tendência decrescente, apresentando redução com o aumento das concentrações de AIB, onde o máximo estimado (61%) foi observado sem aplicação de AIB (0 mg L-1), evidenciando que a formação de brotações é afetado negativamente pelo ácido indolbutirico, além disso, o excesso de formação de brotações pode ocasionar efeito negativo em virtude do desvio de reservas para o enraizamento (Véras et al., 2017; Véras et al., 2018).
Para efeito das concentrações de ácido indolbutírico, constatou-se que o número de brotações (Fig. 1B), comprimento (Fig. 1C) e diâmetro de brotações (Fig. 1D) mostraram tendência quadrática com as concentrações de AIB, observando-se incrementos de 30,76% (Fig. 1B), 43,06% (Fig. 1C) e 3,83% (Fig. 1D) quando as estacas foram tratadas com 6.000 mg L-1 de AIB em comparação com o tratamento controle, respectivamente.
Esses resultados foram superiores aos observados por Lima et al. (2002) que trabalhando com estaquia em umbucajazeira (Spondias sp.), obtiveram 30% de estacas brotadas. Os estudos com tratamento em plantas matrizes com zinco são muito incipientes, além disso, são muito escassas as informações sobre tratamentos da planta matriz com zinco em Spondias.
Corroborando com os observados por Tosta et al. (2012) em estacas de cajaraneira, onde constataram um aumento no número de brotações (2,9 brotações), à medida que se aumentou a concentração de AIB até 3.500 mg L-1, com decréscimo posterior.
Em relação ao comprimento de brotações (Fig. 1C), os resultados supracitados corroboram com os apresentados por Tosta et al. (2012) que constataram um aumento no comprimento das brotações de cajaraneira, à medida que se aumentou a concentração de AIB; no entanto obtiveram maior comprimento que o apresentado no presente ensaio, com valor máximo de 5,6 cm na concentração de 3.045 mg L-1 de AIB. Ao trabalharem com cajazeira, Gomes et al. (2005) constataram que o uso de AIB aumentou o comprimento das brotações das estacas.
Um dos aspectos negativos da formação de brotações é a redução que pode ocasionar no enraizamento, quando as reservas da estaca são utilizadas para esta finalidade, em detrimento do enraizamento. Porém, quando há tempo suficiente para que estas possam produzir auxinas e enviar para a base da estaca, num movimento basípeto, favorecem o enraizamento (Véras et al, 2017; Véras et al., 2018).
Observou-se que os percentuais de estacas vivas com calo (Fig. 1E) e estacas mortas (Fig. 1F) foram significativamente influenciados e, conforme as equações de regressão observa-se haver resposta quadrática, sendo estimados os percentuais máximos de estacas vivas com calo (37,5%) e estacas mortas (56,25%) nas estacas sem AIB (0 mg L-1), apresentando, a partir desta concentração tendência de decréscimo de 33,3% e 22,22% no percentual de estacas vivas com calo e estacas mortas, respectivamente, quando as estacas foram tratadas com maior a concentração de AIB (6.000 mg L-1) comparado com as estacas sob 0 mg L-1 de AIB.
Em amoreira preta, Yamamoto et al. (2013) não verificaram diferença significativa para o percentual de estacas enraizadas quando as estacas foram tratadas com AIB. Nacata et al. (2014), em estacas de caramboleira, constataram que a porcentagem enraizamento, de calejamento e de sobrevivência, apresentaram diferença significativa, na qual a concentração de 100 mg L-1 de AIB apresentou os melhores resultados para estas variáveis.
Sabião et al. (2011), em Passiflora nitida observaram que a porcentagem de sobrevivência de estacas não diferiram significativamente quando foi aplicado o AIB, contudo, a concentração máxima (5.000 mg L-1) apresentou valores superiores (87,69% de sobrevivência). Enquanto que para a porcentagem de enraizamento constataram que houve diferença significativa, obtendo 87,69% de enraizamento na concentração de 5.000 mg L-1.
Em outros trabalhos diversos autores também não obtiveram resultados significativos com a aplicação de AIB sobre a sobrevivência das estacas, em estacas de hibisco (Souza et al., 2015), umbuzeiro (Véras et al., 2018a; Véras et al., 2018b) e umbu cajazeira (Véras et al., 2018c). Gomes et al. (2005) também não constataram efeito significativo das doses de AIB no enraizamento de estacas de umbucajazeira.
O uso da estaquia depende da habilidade de formação de raízes de cada espécie e/ou cultivar, além disso, a qualidade do sistema radicular é um aspecto muito importante, uma vez que a baixa qualidade do sistema radicular desfavorecerá as mudas quando forem plantadas. Outrossim, a aplicação de auxina exógena como estratégia de favorecer o enraizamento também depende da espécie ou cultivar e da concentração de auxina existente no tecido. Sendo assim, a quantidade que deve ser utilizada varia conforme espécie, populações ou clones (Peña et al., 2012).
Um dos fatores que pode ter influenciado na não significância é o balanço hormonal endógeno, já que para ocorrer o enraizamento é preciso que haja equilíbrio nos teores endógenos de auxinas, giberelinas e citocininas, além disso, a concentração exógena dos reguladores vegetais é de extrema relevância, podendo favorecer ou não o enraizamento, o que pode não ter ocorrido no referido trabalho em virtude da temperatura, já que apresenta grande importância nas funções de regulação do metabolismo das plantas, afetando de forma positiva ou negativa o enraizamento (Cunha et al., 2009).
No presente experimento, devido da coleta das estacas ter sido feito no inverno, pode ter ocorrido dormência da planta, já que nesse período as plantas estão se preparando para entrar em dormência (Marangon et al., 2013). O enraizamento é influenciado pela duração 2 d, uma vez que dias curtos associados às baixas temperaturas afetam negativamente nos processos de translocação de compostos e fotossíntese em virtude da inibição do ingresso de fosfatos nos cloroplastos das árvores matrizes, consequentemente, prejudicando o processo de enraizamento do material coletado nessas estações (Lawson et al., 2012).
Semelhante ao observado para o percentual de estacas vivas com calo e estacas mortas, o comprimento da raiz também foi significativamente afetado pelo aumento das concentrações de AIB observando-se, a partir da equação de regressão (Fig. 1G) comportamento linear, sendo obtido o comprimento máximo (4,7 cm) nas estacas tratadas com a concentração máxima (6.000 mg L-1). Ao confrontar os dados obtidos nas estacas que foram tratadas com 6.000 mg L-1 em relação às que estavam sob 0 mg L-1 de AIB, constatase incremento de 54,46% no comprimento da raiz.
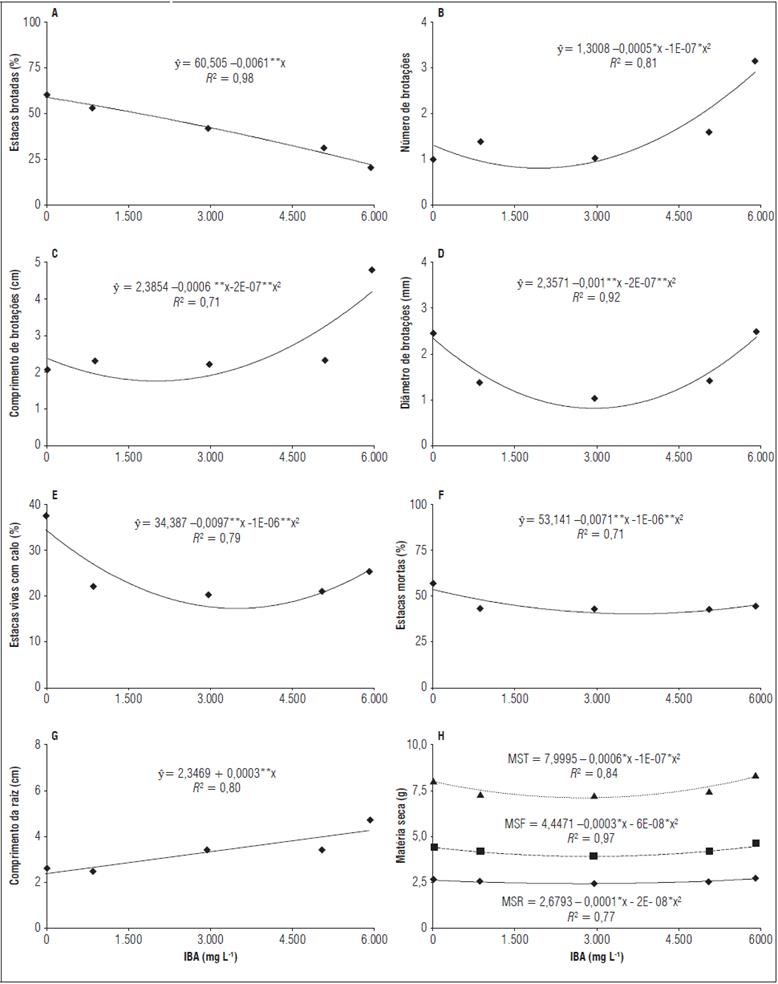
Figura 1 Percentual de estacas brotadas (A), número de brotações por estacas (B), comprimento de brotações (C), diâmetro de brotações (D), estacas mortas (E) e número de raízes por estaca (D) de umbu-cajazeira em função do tratamento com doses de AIB. Massa seca da raiz (MSR), folha (MSF) e total (MST). * significativa P<0,05; ** significativa P<0,01.
Estes valores são superiores aos observados por Rios et al. (2012), ao constatarem que o maior número de raiz foi de uma raiz por estaca de umbuzeiro, na concentração de 6000 mg L-1 de AIB. Os valores obtidos por Tosta et al. (2012) foram superiores aos encontrados neste trabalho ao verificarem máximo de 3,8 raízes por estaca de cajaraneira, na concentração máxima de 8545 mg L-1 de AIB.
Yamamoto et al. (2013) também não verificaram diferença significativa para o comprimento e numero de raízes por estaca quando as estacas de amoreira preta Xavante foram tratadas com AIB. Nacata et al. (2014), observaram em estacas de caramboleira, que a concentração de 5.000 mg L-1 influenciou positivamente o comprimento da raiz, enquanto que para o número de raízes a concentração de 100 mg L-1 apresentou os melhores resultados. Sabião et al. (2011), em Passiflora nitida observaram que o comprimento e o numero de raízes diferiram significativamente com o aumento das concentrações de AIB, obtendo os melhores resultados na concentração de 5.000 mg L-1, com os valores de 24,14 e 3,70, respectivamente.
Um dos parâmetros mais importantes para a qualidade das mudas é o comprimento das raízes e o número de raízes por estaca, uma vez que após a retirada das mudas da câmara de nebulização intermitente e levadas a campo um bom sistema radicular garante a sobrevivência das mesmas (Feldberg et al., 2010). Sendo assim, o uso de AIB é de extrema relevância, pois possibilita a rizogênese bem como induz a formação de um sistema radicular de qualidade, contudo, sua atuação varia conforme a espécie e a cultivar, podendo ainda estimular ou não o enraizamento, em virtude das concentrações endógenas de promotores (auxinas) e inibidores de enraizamento (Chagas et al., 2008; Bastos et al., 2009; Oliveira et al., 2010).
Os valores observados são superiores aos obtidos por Tosta et al. (2012) ao verificarem que o comprimento da raiz das estacas de cajaraneira aumentou até 1.295,2 mg L-1 de AIB, sendo observado valor de 5,0 cm, contudo, doses superiores promoveram decréscimo para esta variável.
Para o fator concentrações de AIB, o modelo de regressão no qual os dados obtiveram o melhor ajuste em termos de massa seca da raiz, folha e total foi o quadrático (Fig. 1H) constatando-se, na equação de regressão que o incremento nas concentrações de AIB proporcionaram um aumento na produção de massa seca, obtendo na concentração máxima (6.000 mg L-1) os valores máximos em massa seca da raiz (2,78 g), folha (4,54 g) e total (8,39 g).
Yamamoto et al. (2013) também não verificaram diferença significativa para o massa seca da raiz de estacas de amoreira preta Xavante foram tratadas com AIB. Para melhor desenvolvimento das mudas em campo, a maior massa de raízes influencia diretamente o desenvolvimento da muda, em virtude da maior capacidade de absorção de água e nutrientes (Santoro et al., 2010).















