Introducción
Las actividades antropogénicas como la sobreexplotación del hábitat, deforestación, contaminación e introducción de especies exóticas, entre otras, son las principales fuerzas que conducen los cambios en la diversidad y composición de las comunidades alrededor del mundo, y causan transformaciones de la vegetación natural en plantaciones forestales (Spooner 2005; Coates et al. 2006; Roe et al. 2006).
Los insectos son muy vulnerables a la fragmentación y pérdida de hábitat, por lo que cambios en su composición o abundancia pueden afectar el funcionamiento normal de los ecosistemas (Didham 1997). La pérdida de hábitat tiene fuertes efectos sobre la biodiversidad y se le considera el factor más importante para la extinción de poblaciones y especies (Fahrig 2003). Los efectos negativos de la pérdida de hábitat no sólo se refieren a mediciones directas de biodiversidad, tales como: la riqueza de especies (Steffan-Dewenter et al. 2002; Steffan-Dewenter 2003), abundancia y distribución de poblaciones (Best et al. 2001) y la diversidad genética (Gibbs 2001; Keller et al. 2005), sino también a patrones o procesos ecológicos que dependen de la biodiversidad.
Las notofagáceas (Nothofagaceae) corresponden a un elemento clave en la fitogeografía del hemisferio sur, particularmente en formaciones boscosas del extremo austral de Sudamérica. En Chile ocupan cerca de 7,4 millones de ha (CONAF et al. 1999). El paisaje dominante en la costa de la Región del Maule (34º41’S y 36º33’S) es una matriz extensa de plantaciones de monocultivo de pino insigne (P. radiata), con fragmentos de vegetación nativa principalmente de bosques primarios de coihue (Nothofagus dombeyi (Mirb.) Oerst) y secundarios de hualo (Nothofagus glauca (Phil.) Krasser) en las quebradas (Estades y Temple 1999). Esta última es una de las especies del género más septentrional de Chile. Se distribuye desde la Provincia de Melipilla (33º56’S) (Región Metropolitana) hasta la Provincia de Ñuble (36º17’S) (Región del BioBío) por la Cordillera de la Costa en forma discontinua y desde la Provincia de Curicó (35º01’S) (Región del Maule) hasta la Provincia de Ñuble (36º32’S) (Región del BioBío) por la Cordillera de los Andes donde es más continua (Hechenleitner et al. 2005). Nothofagus glauca es un elemento endémico del centro sur de Chile e históricamente ha sido afectado por diversos procesos antrópicos que han mermado su población, siendo la fragmentación una amenaza substancial (Bustamante-Sánchez et al. 2004; Echeverría et al. 2006). Cerca del 76 % de su área ha sido reemplazada por P. radiata (Echeverría et al. 2006). Además, forma parte de uno de los “hot-spot” para la conservación de la biodiversidad (Myers et al. 2000) y su estado de conservación es vulnerable (Barstow et al. 2017).
Pinus radiata fue introducido en Chile al término del siglo 19 con fines ornamentales y se comenzó a plantar productivamente en la década del 60, convirtiéndose en la conífera exótica más importante del país que, en la actualidad, cubre casi 1,3 millones de ha (INFOR 2020). Constituye un problema interesante a abordar debido al rol que juega en el mantenimiento de la diversidad biológica (Grez et al. 2003).
Se ha estudiado la entomofauna asociada al bosque maulino, calificándola de diversa y con un grado de endemismo alto y, en el último tiempo, se han detectado especies ya descritas, pero no registradas para el área (Huerta Fuentes et al. 2011; Ramírez Aliaga et al. 2017). Cabe resaltar que se han documentado daños severos (sobre el 50 %) en las semillas de hualo por el microlepidóptero Perzelia sp. (J. F. G. Clarke, 1978) (Lepidoptera: Oecophoridae) (Burgos et al. 2008; Huerta Fuentes et al. 2011) que amenazan la estabilidad de esta especie arbórea. A pesar de la gran extensión de las plantaciones de P. radiata en Chile, el estudio del impacto de la forestación sobre la comunidad de entomofauna nativa se ha documentado escasamente (Grez et al. 2003; Briones y Jerez 2007; Benítez et al. 2008; Simonetti et al. 2012).
En estudios chilenos se ha contrastado la diversidad entre el bosque nativo y plantaciones exóticas, indicando que la densidad, riqueza y diversidad específica de coleópteros epigeos han sido menores en los bosques de pino (Sáiz y Salazar 1981). En el mismo sentido, se han obtenido abundancias y riquezas superiores de coleópteros epigeos en parches de bosque nativo de latifoliadas respecto de la matriz circundante de plantaciones de P. radiata, y se ha concluído que las plantaciones de pino no afectan significativamente a los coleópteros epigeos, probablemente, por la presencia de un abundante sotobosque nativo (Grez et al. 2003), En Argentina, respecto del mismo gremio, las riquezas y abundancias más elevadas se detectaron en las formaciones nativas de notofagáceas (Paritsis y Aizen 2008). Sin embargo, se encontró que la abundancia y riqueza de especies de coleópteros asociados a las heces fue mayor en la matriz de pino que en los fragmentos de bosque nativo (Bustamante-Sánchez et al. 2004). Por otro lado, en Irlanda no se encontraron diferencias en la riqueza de carábidos recolectados con trampas de caída tanto en monocultivo de Picea abies (L) H. Karst, y en mezcla con Quercus suber Linnaeus y con Pinus sylvestris Linnaeus (Oxbrough et al. 2012). Por otra parte, las plantaciones jóvenes tienen un efecto mínimo en la diversidad de especies epigeas de escarabajos y hormigas, pero en la medida que crecen los árboles hay un cambio en la abundancia relativa (Sackmann et al. 2008; Roberge y Stenbacka 2014). Las investigaciones sobre la diversidad de coleópteros epigeos en formaciones nativas de latifoliadas y en plantaciones de coníferas han tenido resultados variables. En este contexto el objetivo de este estudio fue evaluar la diversidad estacional de ensambles de coleópteros epigeos en función de su composición, abundancia y riqueza en tres hábitats: bosques de N. glauca, plantaciones de P. radiata y formaciones mixtas (N. glauca - P. radiata), en una zona costera de Chile central.
Materiales y métodos
Área de estudio
El presente estudio se realizó en el Centro Experimental Dr. Justo Pastor León, Predio Pantanillos (35º26’S 72º17’O) de la Facultad de Ciencias Forestales y de la Conservación de la Naturaleza de la Universidad de Chile, Constitución, Región del Maule, Chile central (Fig. 1). El área de estudio se encuentra inserta en la región del bosque caducifolio mediterráneo costero (Luebert y Pliscoff 2018). La temperatura promedio mínima es 5,9 °C (julio) y la máxima 22,7 °C (enero) con lluvias concentradas en invierno (media anual de 881 mm) (Santibáñez y Uribe 1993).
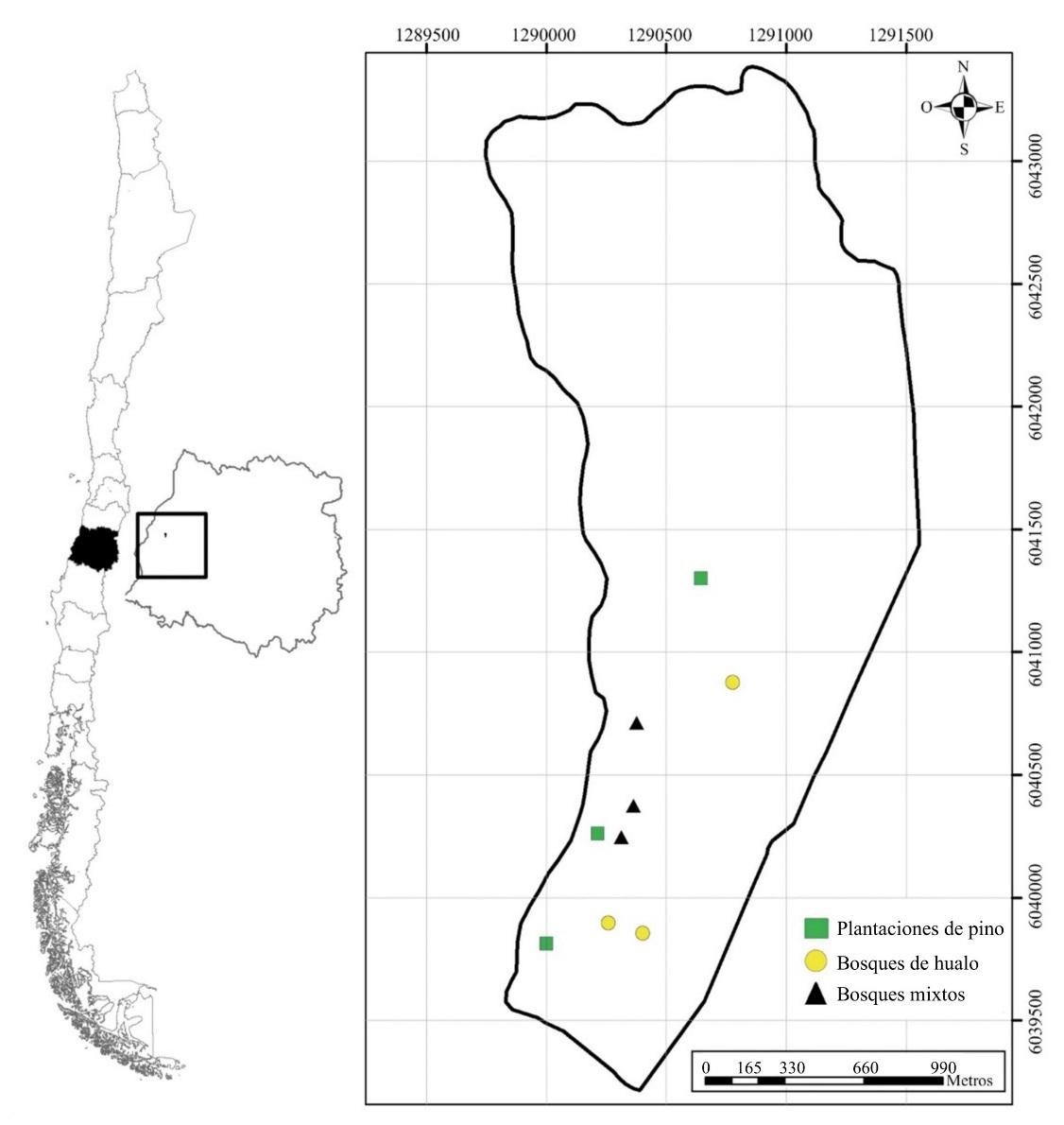
Figura 1 Ubicación geográfica de la zona de estudio, Centro Experimental Dr. Justo Pastor León, Predio Pantanillos, Constitución, Región del Maule, Chile.
Estas son las características de los tres hábitats estudiados (Fig. 2), obtenidas mediante observación visual, y representados por tres rodales de cada tipo de vegetación: 1) Bosques de N. glauca, ubicados principalmente en quebradas con pendiente promedio de 20 %, dosel y sotobosque relativamente poco denso (cobertura de 70 %), acompañado por especies como: Azara integrifolia Ruiz et Pav., Escallonia pulverulenta (Ruiz et Pav.) Pers., Gaultheria insana (Molina) D. J. Middleton, Laurelia sempervirens (Ruiz et Pav.), Luma apiculata (DC.) Burret, Lithraea caustica (Molina) Hook et. Arn., Persea lingue Nees y Ugni molinae Turczaninow; 2) Plantaciones de P. radiata adultas, con dosel denso (cobertura de 90 %; altura promedio de 25 m), topografía de lomaje suave (5-8 %) con sotobosque muy denso (95 %), compuesto principalmente por U. molinae y algunos ejemplares de Lapageria rosea Ruiz et Pav., y 3) Formaciones mixtas de individuos adultos de N. glauca con P. radiata, en sectores de media a alta ladera, con altura media de los árboles de 18-20 m, siendo los ejemplares de P. radiata los de alturas mayores, con cobertura arbórea de cerca de 70 %. Las principales especies que conformaron el sotobosque (70 % de cobertura) fueron: E. pulverulenta, L. caustica, Rosa moschata Herrm y U. molinae, entre otras.
Diseño experimental y muestreo
Se usó un diseño experimental bifactorial (3 x 2), siendo el primer factor el hábitat y el segundo la estación del año (primavera y verano), con tres repeticiones cada uno. Se establecieron 18transectos lineales al azar (de 100 m cada uno), con los tres hábitats y en dos estaciones, separados entre sí por al menos 150 m. En cada transecto se distribuyeron 10 trampas de caída o intercepción cada 10 m (180 trampas en total) (Grez et al. 2003; Fierro Tapia et al. 2011). Las trampas consistieron en contenedores plásticos con capacidad de 1 L, depositando en su interior una mezcla de etanol de 96º al 75 % (250 mL) para la preservación de los especímenes y agua con detergente al 5 % (500 mL) para la reducción de la tensión superficial. Sobre la boca del contenedor se dispuso un techo anclado al suelo para reducir la evaporación y se dejó un espacio entre ambos, para permitir el ingreso de insectos a las trampas. Éstas se retiraron a los 15 días de la instalación, similar a lo realizado por Siewers et al. (2014). La determinación de los insectos capturados se hizo mediante comparación con material de referencia conservado en el Instituto de Entomología de la Universidad Metropolitana de Ciencias de la Educación (IEUMCE) (Santiago, Chile) y el Museo de Entomología Forestal del Departamento de Silvicultura y Conservación de la Naturaleza de la Universidad de Chile (Santiago, Chile), lugar donde fueron depositados los especímenes; y a través de claves de reconocimiento (Roig-Juñent 1994; Jameson y Smith 2002; Paulsen 2005).
Análisis de los datos
El radio de acción por trampa de intercepción se consideró de 5 m (Péfaur y Pérez 1995), lo que se tradujo a una superficie equivalente a 0,079 hapara cada una de ellas. El número total de individuos se estimó para cada especie de coleóptero epigeo por hábitat y estación del año. También se estimó la abundancia (Nº promedio de individuos) y la riqueza (Nº promedio de especies) por hábitat y estación. Los índices de Shannon-Wiener (H’), equidad de Pielou (J’) (Magurran 2004) y Chao 2 y Jacknife 1 (Moreno 2001) se determinaron también por hábitat y estación, mediante el programa PAST (Hammer et al. 2001). Las medias de la abundancia, la riqueza, de los índices de diversidad se compararon entre los distintos hábitats, mediante la prueba no paramétrica de Kruskal-Wallis y la prueba de Dunn, y entre estaciones para cada hábitat con la prueba de Mann-Whitney, mediante el programa InfoStat (2008). Se construyeron curvas de rarefacción para estimar la riqueza esperada, con el programa EstimateS 9 (Colwell et al. 2012).
Resultados y discusión
En las trampas de intercepción instaladas se detectaron en total 19 especies nativas de coleópteros epigeos pertenecientes a 11 familias. La mayoría ha sido citada en reportes de prospecciones hechas en la zona central de Chile, ya sea usando trampas de caída o en recolectas directas del suelo o bajo troncos, en ambientes silvestres (en su mayoría) o intervenidos. Los grupos más abundantes y constantes, informados por la literatura, coinciden con los encontrados en el presente estudio, destacando las familias Carabidae, Hybosoridae, Lucanidae, Staphylinidae y Tenebrionidae. Los carábidos y estafilínidos detectados son reconocidos depredadores de estados inmaduros de Diptera, Lepidoptera y Coleoptera en el suelo (Tabla 1).Entre los estafilínidos (grupo más abundante y segundo más constante) capturados, destaca Loncovilius discoideus Fairmaire y Germain, 1862, coprófago depredador, la especie más abundante en este estudio, recolectada en ambas épocas (primavera y verano) y en los tres hábitats, aunque su presencia decreció notablemente en verano (cuando solo se encontró en N. glauca), coincidiendo con lo reportado por Bustamante-Sánchez et al. (2004). Otra especie de estafilínido recolectada, con este mismo método, pertenece al género Aleochara, con 15 especies en Chile (Zaviezo et al. 2004; Solervicens 2014). En el presente estudio Aleochara sp. fue la quinta especie más abundante (Tabla 1).
Tabla 1. Número total de individuos por especie, abundancia, riqueza e índices de Shannon-Wiener (H`), Pielou (J´), Chao 2 y Jacknife 1 de coleópteros epigeos por hábitat y estación del año en Constitución, Región del Maule, Chile.
| Familia / Especie | Primavera | Verano | ||||||
|---|---|---|---|---|---|---|---|---|
| Pino | Hualo | Mixto | Pino | Hualo | Mixto | |||
| Carabidae | ||||||||
| Callidula nigrofasciata (Solier, 1849) | 4 | 0 | 0 | 0 | 0 | 0 | ||
| Ceroglossus chilensis Eschcholtz, 1829 | 1 | 1 | 2 | 0 | 0 | 0 | ||
| Cnemalobus sp. | 0 | 2 | 20 | 0 | 3 | 12 | ||
| Cyanotarsus andinus Germain, 1855 | 102 | 0 | 0 | 55 | 0 | 0 | ||
| Cerambycidae | ||||||||
| Acanthinodera cummingi (Hope, 1833) | 0 | 1 | 0 | 0 | 0 | 0 | ||
| Chrysomelidae | ||||||||
| sp.1 | 0 | 0 | 1 | 0 | 0 | 0 | ||
| Curculionidae | ||||||||
| Rhyephenes maillei (Gay & Solier, 1839) | 0 | 0 | 0 | 2 | 0 | 0 | ||
| Elateridae | ||||||||
| Dilobitarsus cruxi Philippi, 1860 | 0 | 0 | 1 | 0 | 0 | 0 | ||
| Hybosoridae | ||||||||
| Germarostes (Germarostes) posticus (Germain, 1843) | 0 | 45 | 0 | 0 | 0 | 0 | ||
| Lucanidae | ||||||||
| Pycnosiphorus sp. | 2 | 3 | 0 | 0 | 0 | 0 | ||
| Sclerotomus (Chileistomus) cuculatus (Blanchard, 1842) | 0 | 0 | 0 | 0 | 0 | 3 | ||
| Scarabaeidae | ||||||||
| Brachysternus viridis Germain, 1905 | 0 | 1 | 0 | 0 | 0 | 0 | ||
| Staphylinidae | ||||||||
| Aleochara sp. | 6 | 0 | 24 | 0 | 0 | 5 | ||
| Loncovilius discoideus Fairmaire & Germain, 1862 | 253 | 35 | 44 | 0 | 9 | 0 | ||
| Tenebrionidae | ||||||||
| Gyrasida tomasiVidal y Flores, 2007 | 0 | 1 | 0 | 0 | 0 | 0 | ||
| Heliofugus (Heliofugus) impressus punctatus Solier, 1851 | 0 | 0 | 0 | 0 | 0 | 2 | ||
| Nycterinus (Nycterinus) substriatus Solier, 1848 | 1 | 1 | 1 | 4 | 0 | 0 | ||
| Nycterinus sp. | 1 | 1 | 1 | 0 | 0 | 0 | ||
| Trogidae | ||||||||
| Polynoncus bullatus (Curtis, 1844) | 0 | 0 | 0 | 3 | 0 | 0 | ||
| Nº promedio de individuos/transecto | 122 ± 1Ca | 16 ± 0Aa | 30 ± 0Ba | 22 ± 0Cb | 9 ± 0Ba | 4 ± 0Aa | ||
| Nº promedio de especies/transecto | 4 ± 1Aa | 5 ± 1Aa | 5 ± 0Aa | 4 ± 0Ba | 4 ± 0Ba | 2 ± 0Aa | ||
| Índice Shannon-Wiener (H`) | 1,0 ± 0Aa | 1,1 ± 0Aa | 1,7 ± 0Ba | 0,8 ± 0Ab | 1,8 ± 0Bb | 0,8 ± 0Ab | ||
| Índice Pielou (J´) | 0,5 ± 0Aa | 0,5 ± 0Aa | 0,8 ± 0Ba | 0,4 ± 0Ab | 0,9 ± 0Bb | 0,8 ± 0Ba | ||
| Chao 2 | 12,0 | 34,5 | 8,0 | 4,0 | 4,5 | 2,5 | ||
| Jacknife 1 | 11,6 | 16,3 | 14,4 | 4,0 | 4,9 | 2,9 | ||
Letras mayúsculas y minúsculas distintas indican diferencias significativas entre los hábitats en cada estación (Prueba Dunn) y entre estaciones para cada hábitat (Prueba Mann-Whitney), respectivamente.
Respecto de Carabidae (segunda familia más abundante, pero la primera en constancia), Cyanotarsus andinus Germain, 1855, fue la principal especie recolectada en esta familia y la segunda más abundante respecto del total, frecuentemente asociada al bosque esclerófilo. En el presente estudio sólo se detectó en las plantaciones de pino, similar a lo reportado por Grez et al. (2003). Esta especie se considera un taxón endémico, propio del bosque esclerófilo de la Cordillera de la Costa de la zona central de Chile (Roig-Juñent y Flores 2001).
Un representante del género Cnemalobus, con 18 especies en Chile, fue la segunda especie más abundante de carábidos (cuarta respecto del total, aunque ausente en pino). Este género es también principalmente endémico de Chile y la mayoría de las especies se encuentran en la Región del Maule (Solervicens 2014). A diferencia de las otras especies abundantes, la de Cnemalobus encontrada en nuestro estudio muestra un patrón inverso, pues no se detectó en las plantaciones de pino, donde había mayor cobertura vegetal. Sin embargo, existe escasa información sobre los hábitos, dieta, macro-micro hábitat o requerimientos ambientales de especies del género Cnemalobus como para explicar esta respuesta. Roig-Juñent (2002) señala que las especies cordilleranas y de bosques en Argentina, están asociadas a zonas con pastizales, con baja cobertura vegetal y relativamente alta humedad ambiental. Otras se encuentran en bosque esclerófilo e higrófilo (Cid-Arcos y Campodonico 2019). En Chile, de las 18 especies descritas, al menos cuatro se localizan en la Región del Maule (Roig-Juñent 1994), pero no hay antecedentes sobres sus hábitos específicos, salvo su condición depredadora. Roig-Juñent et al. (2007) señalan que algunas especies podrían, dentro de una misma localidad, tener hábitats específicos. Las especies de Cnemalobus son reportadas como particularmente susceptibles a la destrucción del hábitat natural (Jerez et al. 2015). Por tanto, aspectos como la ausencia de presas específicas, condiciones ambientales adversas (alta humedad, baja luminosidad, etc.), tipo de suelo (particularmente influido por la presencia de acículas de pino), entre otras, podrían explicar su ausencia en el caso de las plantaciones de pino. Por otro lado, Ceroglossus chilensis Eschcholtz, 1829, se ha reportado habitualmente en estos ambientes, aunque muy dependiente de la presencia de sotobosque nativo (Cerda et al. 2015) y Callidula nigrofasciata (Solier, 1849), se ha observado principalmente en muestreos desde el follaje, si bien también ha sido recolectada relativamente abundante, con trampas de caída (Solervicens 2014) (Tabla 1).
Germarostes (Germarostes) posticus (Germar, 1843) (Hybosoridae, tercera familia más abundante) fue también la tercera especie más frecuente encontrada en el estudio, aunque sólo se halló en N. glauca en primavera. Esta especie es la única del género representada en Chile, tiene amplia distribución (desde Coquimbo a Valdivia), y ha sido dominante en recolectas de la zona, aún en condiciones adversas (ausencia de vegetación, zonas ventosas), principalmente en primavera, tal como ocurrió en nuestro estudio. Los adultos y larvas viven bajo troncos y heces de vacunos (Alfaro et al. 2014), también coincidente con la presencia de éstas últimas observadas en el bosque de N. glauca, lo que no se detectó en los otros hábitats (Tabla 1).
Tenebrionidae, la cuarta familia más abundante y la segunda más constante en el estudio junto a Staphylinidae, no se encontró en N. glauca en verano. En general, el grupo se caracteriza por su condición fitófaga (las larvas de Nycterinus consumen raíces), pero algunas son saproxílicas (e.g. Heliofugus) (Vidal y Guerrero 2007). La especie más abundante (sexta respecto del total) fue Nycterinus (Nycterinus) substriatus Solier, 1848, que se presenta hasta la región central de la Cordillera de la Costa y ha sido frecuentemente recolectada en trampas de caída debido a su hábito caminador (Vidal y Guerrero 2007; Solervicens 2014) (Tabla 1).
La quinta familia que tuvo abundancias relativas altas fue Lucanidae (i.e., Pycnosiphorus), aunque sólo se encontró en primavera en plantaciones de pino y bosques de N. glauca. Representantes del género han sido recolectados con trampas de caída en estudios similares (Sackmann 2006). En Chile, el género está compuesto por 6 taxones (incluyendo sub-especies), se observan habitualmente caminando sobre el suelo, en particular en la noche, y con frecuencia se alimentan de madera semi-descompuesta (Paulsen 2010) (Tabla 1).
En primavera las abundancias fueron significativamente superiores (H = 7,2; P = 0,0036) en las plantaciones de pino (73 %), seguido de las formaciones mixtas y los bosques de N. glauca, mientras que en verano se redujeron significativamente en los tres hábitats respecto a la estación anterior, siendo también significativamente superior (62 %) (H = 7,2; P = 0,0036) en las plantaciones de pino, seguido de los bosques de N. glauca y, finalmente, en las formaciones mixtas. Al analizar entre estaciones por hábitat se detectaron sólo diferencias significativas en las plantaciones de pino (U = 117; P = 0,0031) (Tabla 1).
La riqueza relativa en primavera no tuvo diferencias significativas (H = 1,67; P > 0,4857) en los tres hábitats; en tanto que en verano las plantaciones de pino y los bosques de N. glauca fueron similares y significativamente superiores (H = 5,6; P = 0,036) a las formaciones mixtas. Al comparar entre estaciones, éstas fueron significativas superiores sólo en los bosques mixtos (U = 121; P < 0,0009) en primavera (Tabla 1).
En primavera los índices de diversidad (H’) en los bosques mixtos fueron significativamente superiores con respecto de las plantaciones de pino y los bosques de N. glauca, siendo también los que tuvieron la mayor parte de especies con abundancia similar, corroborado con una equidad de J’ = 0,8. En verano los H’ más bajos se presentaron en las plantaciones de pino y en los bosques mixtos, lo que significa que la mayoría de los individuos pertenecieron a una misma o pocas especies, en tanto que los bosques de N. glauca tuvieron los mayores H’, junto con el J’ más elevado, por lo que prácticamente todas las especies fueron igualmente abundantes (Tabla 1).
La riqueza esperada de coleópteros epigeos en primavera (Fig. 3A ) sólo se alcanzó en las plantaciones de pino, donde tendieron a estabilizarse en comparación con los bosques de hualo y formaciones mixtas. En verano (Fig. 3B ), se distingue que todos los tipos de vegetación alcanzaron rápidamente el máximo de especies posibles de captura. A su vez, se observa que el número de individuos fue mayor en las plantaciones de pino en comparación con los bosques de hualo y mixtos. Por otra parte, el número de especies esperadas fue el mismo en las plantaciones de pino y en los bosques de hualo; sin embargo, en las plantaciones de pino el número máximo esperado de especies se obtuvo con una cantidad superior de individuos. Al comparar ambas temporadas se observa que en primavera el número de especies esperadas fue mayor que en verano al igual que el número de individuos acumulados, lo que sugiere una riqueza y abundancia mayores. Asimismo, los índices de Chao 2 y Jacknife de primer orden (Tabla 1) están en concordancia con las curvas de rarefacción lo que demuestra que, en esta temporada, aún faltan especies e individuos por capturar. Por lo anterior, se recomienda aumentar la intensidad de muestreo en primavera, especialmente en las formaciones nativas, lo que implicaría una mayor riqueza y abundancia para dichas formaciones por sobre las plantaciones de pino. A su vez, cabe indicar que al analizar las curvas de rarefacción en verano el esfuerzo de muestreo fue el adecuado.
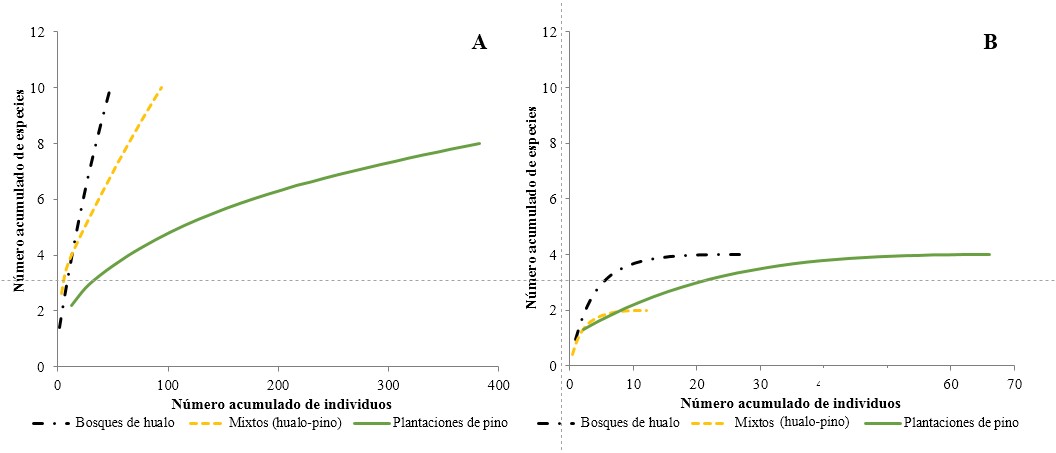
Figura 3 Curvas de rarefacción de la riqueza esperada de coleópteros epigeos para los distintos hábitats. A. Primavera. B. Verano.
La discrepancia en las diferencias en la abundancia de coleópteros epigeos con la bibliografía citada quizás se deba a que como lo señalan los autores no es dependiente de la composición de especies per sé, sino que está beneficiada más bien por el incremento de la complejidad estructural de la formación reflejada en la mayor cobertura arbórea y del sotobosque.
Las abundancias mayores en las plantaciones de pino se deben al predominio de L. discoideus y C. andinus, especies nativas (Grez et al. 2003) que presentan preferencia por este tipo de vegetación (Solervicens 2014), esto es ratificado por los índices H’ y J’. Lo anterior sugiere que puede existir una mayor disponibilidad de recursos en las plantaciones de pino o una preferencia por ellas, lo que implicaría mejores condiciones para el establecimiento de estas especies en particular. La presencia y distribución de carábidos a través de un hábitat está determinada por la humedad, acidez, profundidad del suelo, abundancias de presas, competidores y depredadores (Fierro Tapia et al. 2011), que también podrían estar explicando estas diferencias.
El comportamiento de la entomofauna asociada a las plantaciones de P. radiata, por lo general, se relaciona con las comunidades de artrópodos presentes en los remanentes vegetacionales nativos circundantes (Sáiz y Salazar 1981). Es importante destacar que en el actual estudio las plantaciones de pino presentaron una mayor cobertura del sotobosque, así como una notable acumulación de acículas en contraste con los bosques de N. glauca, donde hubo acumulación de hojarasca, pero en menor medida. En este sentido, es posible que en las plantaciones de pino estas condiciones de primavera sean un factor determinante para la mayor abundancia de L. discoideus y C. andinus. En plantaciones de pino insigne, con distintas coberturas de sotobosque, ubicadas sobre remanentes del bosque Maulino, Ceroglossus chilensis mostró una preferencia por rodales con un sotobosque más desarrollado (Cerda et al. 2015). Esto concuerda con los resultados actuales, debido a que también se presentó una mayor abundancia de C. chilensis en los bosques mixtos en primavera y en términos generales la abundancia de los coleópteros epigeos fue significativamente superior en las plantaciones de pino tanto en primavera como en verano, coincidiendo con una mayor cobertura del sotobosque.
Por otra parte, en un estudio en la misma localidad del presente trabajo, en tratamientos de manejo de residuos de post-cosecha de P. radiata rodeado de fragmentos de bosques de N. glauca, se obtuvieron abundancias y riquezas de coleópteros epigeos superiores tanto en primavera como en verano cuando se dejaban los residuos en los sitios en vez de su quema o remoción, actuando como refugio o reservorios de diversidad (Ramírez Aliaga et al. 2017) com aporte de heterogeneidad estructural (Demarais et al. 2017). Por lo que se puede deducir que ambos factores contribuyen a incrementar la diversidad de la fauna epigea.
Por último, el conocimiento de la entomofauna asociada a estos ecosistemas resulta relevante, especialmente cuando los bosques de N. glauca muestreados representan la distribución más septentrional y se consideran ecosistemas particulares y únicos, los que a su vez han disminuido su superficie producto de la tala indiscriminada y del reemplazo por especies exóticas (Litton y Santelices 1996). Los resultados permiten inferir que se requieren más estudios enfocados a los distintos ensambles como los señalados por Paritsis y Aizen (2008) y Bustamante et al. (2006) que incluyan variables microclimáticas y de la estructura del hábitat. Nuestros resultados también apoyan la teoría que los procesos de producción forestal deberían considerar fragmentos de preservación de biodiversidad (Fischer y Lindemayer 2002; Tscharntke et al. 2002) de esta formación nativa, así como la conservación o fomento de la cobertura del sotobosque (Cerda et al. 2015) que, a su vez, pueden influir en la persistencia de interacciones entre especies (Poch y Simonetti 2013). Esto puede ser parte de las estrategias a seguir para mantener la biodiversidad, en particular en la región de estudio, que presenta un grado de endemismo elevado (Simonetti et al. 2012) y contribuir a la conservación y uso racional de los recursos.
Conclusiones
Tanto la abundancia como la riqueza estacional de coleópteros epigeos fueron distintas en los hábitats estudiados, siendo superior la abundancia en las plantaciones de pino insigne tanto en primavera como en verano, favoreciendo su conservación, al actuar como reservorios de biodiversidad, posiblemente por la mayor cobertura arbórea y de sotobosque, en este hábitat particular. Los bosques de N. glauca muestran una situación especial y requieren investigación mayor sobre el conocimiento de la diversidad de la entomofauna asociada por su condición de ecosistemas únicos y distribución septentrional.
















