Introducción
La enfermedad de Parkinson (EP) es un trastorno neurodegenerativo caracterizado clínicamente por la aparición de bradicinesia (síntoma principal), acompañado de temblor de reposo o rigidez, además de otras características clínicas. Se caracteriza fisio-patológicamente principalmente por la progresiva pérdida de neuronas dopaminérgicas de la pars compacta, que forma parte de la sustancia negra y sus circuitos 1-2.
A nivel mundial, la carga de discapacidad y mortalidad por EP ha aumentado rápidamente, superando otros trastornos neurológicos. Así, durante los últimos 25 años, la prevalencia de la EP se ha duplicado. En el año 2019, se estimó que la EP causó 5,8 millones de años de vida ajustados por discapacidad, aumentando un 81 % desde el año 2000, y provocó 329 000 muertes, representando un incremento del 100 % 3. Se espera que para el año 2040, alrededor de 17 millones de personas padezcan esta enfermedad, convirtiéndola en la de más rápido crecimiento entre todos los trastornos neurológicos 1,4.
El tratamiento actual es principalmente sintomático e incluye terapia física, del lenguaje, cognitiva, múltiples fármacos, así como terapias avanzadas como las infusiones subcutáneas de apomorfina y levodopa, y duodenal de levodopa, además de opciones quirúrgicas como la estimulación cerebral profunda (ECP) y ablativas como la lesión por ultrasonido. Aunque la levodopa, introducida en los años 70, ofreció excelentes resultados, con el tiempo se han desarrollado complicaciones motoras y no motoras relacionadas con la propia enfermedad y el uso de esta medicación 2,5.
La ECP es un procedimiento quirúrgico utilizado para tratar síntomas neurológicos incapacitantes, como los síntomas motores debilitantes, el temblor, la rigidez y la bradicinesia, y de marcha, como los relacionados a los estados off. Este procedimiento también se usa para tratar otras patologías, como otros temblores no parkinsonianos, distonía, epilepsia focal (epilepsia que se origina en solo una parte del cerebro), dolor neuropático refractario y trastornos del comportamiento, entre otros 6.
La ECP se realiza implantando un dispositivo quirúrgicamente que, mediante un generador de pulso implantable (GPI) o un neuroestimulador alimentado por batería, envía impulsos eléctricos a áreas específicas del cerebro que controlan el movimiento, ayudando a inhibir las señales nerviosas anormales que causan los síntomas 7.
La ECP es actualmente el tratamiento quirúrgico de elección en pacientes con EP avanzada adecuadamente seleccionados. Las indicaciones para considerar la ECP incluyen: pacientes con EP idiopática de al menos cinco años de evolución, menores de 75 años, que presentan complicaciones motoras incapacitantes (como disquinesias o fluctuaciones), que no se controlan con medicamentos y que aún responden a la levodopa, sin persistencia de síntomas axiales en el estado on. También se considera en pacientes con temblor severo e incapacitante que no mejora con el tratamiento farmacológico 8-11; sin embargo, existen contraindicaciones importantes para la ECP, como sospecha de parkinsonismo atípico, falta de respuesta a la levodopa, demencia, psicosis asociada a la EP, enfermedades sistémicas graves que contraindiquen el procedimiento o afecten la expectativa de vida, y predominio de síntomas axiales que no responden al tratamiento, entre otras. Además, algunas condiciones como la depresión mayor no tratada, expectativas exageradas del paciente o la familia sobre los resultados de la cirugía, y la dificultad para seguir al paciente a largo plazo, son consideradas contraindicaciones relativas que deben ser evaluadas y tratadas antes de considerar la ECP 8-11.
Inicialmente, los dispositivos de ECP solo estaban disponibles en versiones no recargables, con una duración limitada de tres a cinco años, y la introducción de versiones recargables en 2008 ha permitido extender la vida útil de la batería y reducir las cirugías de reemplazo, aunque requiere de recargas frecuentes 12-13. Algunos estudios muestran que los dispositivos recargables son bien aceptados y pueden ser una opción rentable, aunque las preferencias de los pacientes y los factores que influyen en la elección del dispositivo requieren más investigación 14,15.
El objetivo principal de este artículo es revisar la evidencia sobre el tiempo de duración de los generadores de pulso implantable con batería recargable (GPI-r) y no recargable (GPI-nr) en pacientes tratados con ECP. Los objetivos secundarios incluyen describir la evidencia del impacto de estos dispositivos en la calidad de vida, los eventos adversos y los costos asociados.
Materiales y métodos
Se realizó una revisión sistemática rápida (RSR) de acuerdo con las directrices de la guía de métodos de revisión rápida, desarrollada por el Grupo Cochrane 16.
Estrategia de búsqueda
Se condujo una búsqueda el 13 de noviembre de 2023 en PubMed. Los términos de búsqueda y los operadores booleanos usados fueron: "Deep brain stimulation" OR "DBS" AND "Primary cell battery" OR "Rechargeable battery" AND "Parkinson disease", presentes en el título o el resumen del artículo. La sintaxis de búsqueda utilizada se puede encontrar en la tabla 1.
Tabla 1 Estrategia y resultados de búsqueda de estudios
| Tipo de búsqueda | Electrónica |
|---|---|
| Base de datos | PubMed |
| Fecha de búsqueda | 13/11/2023 |
| Rango de fecha de búsqueda | Sin restricción |
| Restricciones de lenguaje | Sin restricción |
| Estrategia de búsqueda | ((((Deep brain stimulation) OR (DBS device)) AND (Primary cell battery)) OR (Rechargeable battery)) AND (parkinson disease) |
| Referencias identificadas: revisiones sistemáticas de la literatura | 0 |
| Referencias identificadas: estudios clínicos aleatorizados y no aleatorizados | 0 |
| Referencias identificadas: estudios observacionales | 18 |
Fuente: elaboración propia.
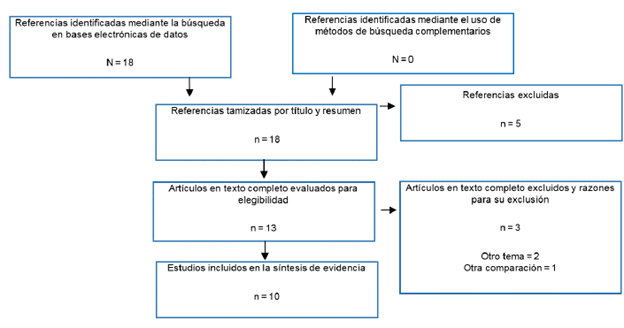
Posteriormente, se utilizó la aplicación web Rayyan® para organizar la lista de referencias y obtener los documentos completos para su revisión. El número de referencias identificadas en la búsqueda de literatura se resume mediante el diagrama de flujo Prisma (figura 1).
Criterios de inclusión y exclusión
Inclusión:
Población, intervención, comparación y desenlaces según la pregunta PICO (población, intervención, comparación y outcome o resultados) (tabla 2).
Tipos de estudios: revisiones sistemáticas de la literatura (RSL), ensayos clínicos aleatorizados (ECA) y no aleatorizados, y estudios observacionales.
Idioma: sin restricción.
Tiempo: sin restricción
Formato de publicación: reportes completos.
Estado de publicación: estudios publicados en revistas indexadas.
Reporte de resultados: estudios que informaran los desenlaces de interés y que fuesen atribuibles a la comparación de interés.
Tamizaje, selección de estudios y extracción de información
El total de referencias identificadas en la búsqueda fue tamizado por un revisor del equipo investigador, examinando los títulos y resúmenes frente a los criterios de elegibilidad predefinidos. A partir del grupo de referencias preseleccionados, se realizó la selección de estudios, para esto un revisor verificó que cada estudio cumpliera con los criterios de elegibilidad mediante la lectura de cada publicación en texto completo. Este proceso también fue validado por un revisor independiente. Para extraer la información, se utilizó una herramienta estándar en Excel y la estructura se basó en recopilar información sobre las características básicas de cada estudio, como participantes, intervención, comparadores y resultados. La extracción de datos se realizó por un revisor y, posteriormente, fue revisada por los investigadores involucrados.
Tabla 2 Pregunta de investigación según la estructura PICO
| Población | Personas con enfermedad de Parkinson |
|---|---|
| Intervención | Generador de pulso implantable con batería recargable |
| Comparador(es) | Generador de pulso implantable con batería no recargable (vida fija) |
| Desenlaces |
Tiempo de duración del dispositivo/tiempo hasta la sustitución (vida útil) Calidad de vida Satisfacción Eventos adversos Costos |
Fuente: elaboración propia.
Evaluación de la calidad
La evaluación de riesgo de sesgos se realizó mediante la herramienta de la lista de verificación de evaluación crítica del Joanna Briggs Institute (JBI) 16 para estudios de cohortes y transversales analíticos. Estas evaluaciones de riesgo de sesgos fueron realizadas por un revisor (tabla 3).
Resultados
Se muestran los resultados de búsqueda, la tamización y la selección de la evidencia para esta revisión rápida en el diagrama de flujo Prisma (figura 1). A través de la búsqueda en la base de datos de Pubmed, no se detectaron RSL, ECA y tampoco ensayos clínicos no aleatorizados, pero sí se detectaron 18 registros de estudios observacionales. Posterior a la tamización por título y resumen, 13 estudios fueron revisados en texto completo, de los cuales 10 fueron incluidos para esta síntesis de evidencia.
De los 10 estudios incluidos en el análisis, 9 presentaron un diseño de cohorte 14,17-24 y 1 fue de corte transversal 13. En cuanto a la población estudiada, solo 2 de estos estudios incluyeron exclusivamente a pacientes con EP, mientras que los 8 restantes abarcaron una variedad de trastornos neurológicos y del movimiento, siendo la EP el diagnóstico más representado. En total, los estudios incluyeron a 980 participantes, de los cuales el 71,9 %(705 pacientes) tenía diagnóstico de EP, el 14,5 % (142 pacientes) padecía distonía, el 10 % (98 pacientes) temblor esencial y el 3,6 % (35 pacientes) otros trastornos (tabla 4). Además, del total de participantes, el 60,1 % recibió un GPI-r (n = 593) y el 39,5 % un GPI-nr (n = 387); de estos últimos, 333 participantes posteriormente cambiaron a un dispositivo con batería recargable.
Tabla 3 Lista de verificación de evaluación crítica de JBI para estudios de cohortes y transversales analíticos
| Autor/año | ¿Los dos grupos eran similares y recluta-ron de la misma población? | ¿Se midió la exposición de manera similar para asignar a las personas a los grupos expuestos y no expuestos? | ¿Se midió la exposición de forma válida y fiable? | ¿Estaban los grupos/ participantes libres del resultado al comienzo del estudio o en el momento de la exposición? | ¿Se identificaron factores de confusión? | ¿Se establecieron estrategias para tratar los factores de confusión? | ¿Se midieron los desenlaces de forma válida y fiable? | ¿Se utilizó un análisis estadístico adecuado? | ¿Se informó el tiempo de seguimiento y fue suficiente para que ocurrieran los desenlaces? | ¿Se completó el seguimiento y, de no ser así, se describieron y exploraron las razones de la pérdida durante el seguimiento? | ¿Se utilizaron estrategias para abordar el seguimiento incompleto? | Sí/Total |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Cohortes | ||||||||||||
| Qiu et al., 2021 17 | S | S | S | S | PC | N | PC | PC | S | N | N | 5/11 |
| Furlanetti et al., 2020 18 | PC | S | S | S | S | N | PC | N | S | PC | N | 5/11 |
| Mitchell et al., 2019 19 | PC | N | S | PC | S | S | PC | PC | N | PC | N | 3/11 |
| Jakobs et al., 2018 20 | N | S | S | S | N | N | PC | PC | S | PC | N | 3/11 |
| Jakobs et al., 2019 21 | PC | N | S | PC | PC | S | PC | PC | S | PC | N | 3/11 |
| Hitti et al., 2018 22 | PC | S | S | PC | N | N | PC | PC | S | PC | N | 3/11 |
| Jia et al., 2016 23 | PC | S | S | PC | N | N | PC | PC | S | N | N | 3/11 |
| Rizzi et al., 2015 14 | N | S | S | PC | N | N | PC | PC | S | N | N | 3/11 |
| Timmermann et al., 2013 24 | N | S | S | PC | S | PC | PC | PC | S | N | N | 4/11 |
| Autor/año | ¿Se definieron claramente los criterios de inclusión en la muestra? | ¿Se describieron en detalle los sujetos de estudio y el entorno? | ¿Se midió la exposición de forma válida y fiable? | ¿Se utilizaron criterios objetivos y estándar para medir la condición? | ¿Se identificaron factores de confusión? | ¿Se establecieron estrategias para tratar los factores de confusión? | ¿Se midieron los resultados de forma válida y fiable? | ¿Se utilizó un análisis estadístico adecuado? | Si/Total | |||
| Corte transversal-analíticos | ||||||||||||
| Khaleeq et al., 2019 13 | S | S | S | PC | N | N | PC | PC | NA | NA | NA | 3/8 |
Nota: S: sí; N: no; PC: poco claro; NA: no aplica.
Fuente: elaboración propia.
En relación con la satisfacción del paciente, el 60 % de los estudios evaluaron este aspecto mediante cuestionarios aplicados en distintos intervalos y tras la implantación del dispositivo, utilizando una escala de Likert de 5 puntos para medir comodidad, facilidad de uso y posibles molestias térmicas durante la recarga, o mediante entrevistas en visitas de seguimiento para profundizar en la experiencia del paciente con el dispositivo en su vida cotidiana. Aquellos que recibieron un GPI-r desde el inicio del tratamiento con ECP o como reemplazo posterior a un GPI-nr, reportaron una satisfacción alta 17,19-22; sin embargo, solo dos estudios incluyeron pacientes específicamente con EP 17,23 y uno de ellos sí informó sobre la satisfacción del paciente. Este último estudio no encontró diferencias significativas en la satisfacción entre los pacientes que recibieron GPI-r y GPI-nr desde el inicio del tratamiento con ECP (88 % vs. 85,7 %, P >0,05) 17. Ocho estudios 13,14,18-22,24, además de pacientes con EP, incluyeron participantes con otros diagnósticos neurológicos y del movimiento. De estos, solo uno informó sobre la satisfacción en el subgrupo de pacientes con EP tratados con GPI-r (89,6 puntos en una escala de 0 a 100) 24 (tabla 4).
Tabla 4 Característica de los participantes y desenlaces evaluados de los estudios incluidos
| Autor, año | País | Indicación para ECP | Cohortes | Número de pacientes | Duración del seguimiento en meses (mediana/ media; rango inter- cuartílico) | Edad (años) (media/ mediana, DE) | n (%) masculino | Origen del fabricante del sistema ECP | Tasa de respuesta | Satisfacción general | Desenlaces principales Tiempo de duración del GPI sustitución, en años (vida útil) | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Qiu X, 2021 17 | China | EP | GPI-r | 192 (87 %) | 18 (de 8 a 36) | 62,5 ± 9,8 | 114 (59 %) | Internacional (Medtronic) = 142***. doméstico (PINS o SceneRay)= 78*** | 28,6 % (220/768) | 169 (88,0 %) ** | NR | |||
| GPI-nr | 28 (13 %) | 64,4 ± 10,0 | 21 (75 %) | 24 (85,7 %) | ||||||||||
| Furlanetti et al., 2020 18 | Reino Unido | EP (76,9 %, 20/26), Tremor esencial (11,5 %, 3/26) y distonía (11,5 %, 3/26) GPI-r | 11 | (42,3 %) | 18 (de 9 a 29) | 67,7 ± 7,3 | 84,6 % (22/26) | NR | 86,6 % (26/30 ) | NA | NR | |||
| GPI-nr | 15 (57,7 %) | |||||||||||||
| Mitchell et al., 2019 19 | Estados Unidos | EP (n = 30), distonía (n = 25), temblor esencial (n = 3) y síndrome de Tourette (n = 1) | GPI-r | 11 (18,6 %) | 6 | 59,5 | 54,2 % (32/59) | Activa RC (Medtronic, Minneapolis, Estados Unidos) = 59 | 49,6 % (59/119) | 91,7 puntos | NR | |||
| GPI-nr inicial (con cambio posterior a GPI-r) | 48(81.4%) | |||||||||||||
| Jakobset al., 2019 21 | Alemania | EP = 121 (62,1 %); temblor = 34 (17,4 %; distonía = 40 (20,5 %) | GPI-r | 139 (71.3%) | 40,3 (de 4 a 109 ) | 61,3 ± 12,3 | 65,1 % (127/ 195) | Modelo GPI-r Medtronic Activa RC 103 (52,8 %) Abbot Brio 45 (23,1 %) y Boston Scientific Vercise RC 47 (24,1 %) | 66,1 % (195/201) | 93,8 % (183/195) | NR | |||
| GPI-nr inicial (con cambio posterior a GPI-r) | 56 (28,7 %) | |||||||||||||
| Hitti et al., 2018 22 | EEUU | EP = 144 (70 %), temblor esencial = 41 (20 %), distonía 13 (6 %), depresión 5 (2 %), temblor de esclerosis múltiple 2 (1 %), epilepsia 1 (0,5 %) | GPI-r | 123 (60 %) | 27,6 | 61 ± 13 | 67 % (139/ 206) | Medtronic Activa RC 206 (100 %) | 50,5 % (102/202) | 87,3 % (89/102) | 2,6 ± 0,1 | |||
| GPI-nr inicial (con cambio posterior a GPI-r) | 83 (40 %) | |||||||||||||
| Khaleeq et al., 2019 13 | Reino Unido | EP = 22, temblor esencial = 5, distonía = 3 | GPI-r | 19 (63 %) | NA | 65 | 76,6 % (23/30) | Medtronic Activa a la mayoría de los pacientes | 100 % (30/30) | NR | NR | Preocupación por el tamaño de la batería en el total de pacientes | La mayoría de los pacientes manifestaron no tener preocupación por el tamaño de la batería | |
| GPI-nr | 11 (37 %) | |||||||||||||
| Preocupación por nueva cirugía para remplazo de batería | Números iguales (sexo, edad, enfermedad) de pacientes estaban preocupados por la necesidad de someterse a una cirugía para reemplazar la batería. Entre los que eligieron GPI-r, el 52,6 % (10/19), lo hicieron para evitar una nueva cirugía. | |||||||||||||
| Preocupación por la recarga de la batería | Menos de la mitad del total de pacientes estaban preocupados por la necesidad de recargar la batería. Entre los que eligieron GPI-nr, el 100 % (11/11) lo hicieron debido a que la batería de duración fija sería menos laboriosa y ofrecía un mejor estilo de vida, seguida por del 81 % (9/11) de la preocupación por olvidar para recargar el dispositivo. | |||||||||||||
| Jakobset al., 2018 20 | Alemania | EP = 21, temblor esencial = 8, distonía = 2 | GPI-r | 31 (100 %) | 21,2 | 63,3 | 61,3 % (19/31) | Abbott Brio GPI-r | 89 % (31/35) | 97 % (30/31) | NR | NR | NR | NR |
| Jia et al., 2016 23 | China | EP = 53 | GPI-r | 53 (100 %) | 12 | 57,6 ± 7,3 | NR | G102R, PINS Medical | NR | NR | NR | NR | Preocupación por la seguridad de la recarga de la batería | 52,8 % (28/53) |
| Rizzi et al., 2015 14 | Italia | Distónicos con 21 años o menores = 11 | GPI-nr inicial (con cambio posteriores a GPI-r) | 11 (100 %) | 7,6 ± 3,9 (de 2 a 14) en años | 13,5 ± 3,9 (de 8 a 21), al momento de la implantación | NR | 3,2 ± 1,1 (de 2 a 5) | ||||||
| Distónicos mayores de 21 años = 35 | 35 (100 %) | 7,5 ± 2,3 (de 3 a 12) en años | 41,2 ± 12,2 (de 24 a 77), al momento de la implantación | NR | NR | NR | NR | 3,9 ± 2,3 (de 1 a 12) | NR | NR | NR | |||
| EP = 66 | 66 (100 %) | 8,5 ± 2,7 (de 1 a 15) en años | 58,4 ± 8,1 (de 37 a 81) al momento de la implantación | NR | 5,1 ± 1,8 (de 2 a 11) | |||||||||
| Otros = 27 | 27 (100 %) | 7,6 ± 2,9 (de 1 a 12) en años | 42,7 ± 10,1 (de 20 a 64) al momento de la implantación | NR | 4,7 ± 3,1 (de 1 a 12) | |||||||||
| Todos = 139 | 139 (100 %) | 7,9 ± 2,7 (1 a 15) en años | 49,7 ± 16,6 (de 8 a 81) al momento de la implantación | 63,3 % (88/139) | 4,5 ± 2,3 (de 1 a 12) | |||||||||
| Timmermann et al., 2013 24 | Alemania, Italia, Noruega, España y Suiza | EP = 8, temblor esencial = 2, distonía = 10, trastorno obsesivo compulsivo = 1 | GPI-r | 14 (66,7 %) | 3 | Entre 12 y 69 años | NR | Medtronic Activa RC | 60 % (21/35) | 83,3 puntos | NR | NR | Satisfacción de los pacientes con GPI-r desde el inicio | 86,5 puntos |
| GPI-nr inicial (con cambio posterior a GPI-r) | 7 (33,3 %) | Satisfacción de los pacientes con GPI-r como remplazo de un GPI-nr | 75,0 puntos | |||||||||||
| Satisfacción general con el GPI-r en pacientes con EP | 89,6 puntos | |||||||||||||
Nota: ** valor exacto de la prueba de Fisher = 0,76, p >0,05; *** valor exacto de la prueba de Fisher = 0,72, p >0,05; NR: no reportado; NA: no aplica; ECP: estimulación cerebral profunda; GPI: generador de pulso implantable.
Fuente: elaboración propia.
En cuanto a las preocupaciones de los pacientes sobre características específicas de los tipos de baterías (GPI-r y GPI-nr), se encontraron diferencias en relación con el tamaño. En el estudio de Furlanetti et al. (2020) 18, se observó un aumento significativo en la preocupación por el tamaño entre los pacientes que eligieron GPI-nr (antes de la cirugía: 6,7 % y después de la cirugía: 60 %, p = 0,008). En contraste, la mayoría de los participantes en el estudio de Khaleeq et al. (2019) 13 no expresaron preocupación por el tamaño al elegir entre GPI-r y GPI-nr. En relación con la preocupación por la recarga de la batería, el estudio de Furlanetti et al. (2020) 18 informó que esta preocupación se mantuvo constante antes y después de la cirugía en el 9,7 % de los pacientes que optaron por GPI-r. Por otro lado, en el estudio de Khaleeq et al. (2019) 13, se encontró que el 100 % de los pacientes que eligieron GPI-nr lo hicieron porque consideraron que una batería de duración fija/no recargable sería menos laboriosa y ofrecería un mejor estilo de vida, seguido por el 81 % de los pacientes que expresaron preocupación por olvidar la recarga de la batería (tabla 4).
El tiempo de duración y sustitución del GPI fue reportado en un estudio que evaluó pacientes con EP, y se encontró que el tiempo promedio para la sustitución de un dispositivo GPI-nr por uno GPI-r fue de 5,1 años, con una desviación estándar (DE) de ± 1,8 años y un rango de 2 a 11 años 14. En otro estudio realizado por Hitti et al. en 2018 22, se informó que los participantes que tenían sistemas de ECP previos a la implantación de GPI-r tenían una duración promedio de 6,1 ± 0,4 años, antes de requerir la implantación de un nuevo GPI. Durante este tiempo, hubo un promedio de 2,7, DE ± 0,2 reemplazos de GPI, con una vida útil promedio del GPI de 2,6, DE ± 0,1 años (tabla 4).
La información disponible sobre la seguridad y tolerabilidad de los GPI-nr en comparación con los GPI-r es limitada, ya que los estudios informaron los eventos adversos de manera global, dificultando su comparación. En pacientes con EP que usan un GPI-r, se han reportado casos de conexión incorrecta del cable de extensión al dispositivo y dehiscencia de la herida, con o sin infección, afectando aproximadamente al 3,7 % de los pacientes 14. En todos los participantes, sin diferenciar el tipo de diagnóstico (EP, temblor esencial, distonía u otros) y utilizando un GPI-r o habiendo cambiado de un GPI-nr a un GPI-r, se reportaron eventos adversos a recargas fallidas (promedio del 8,0 %) 17,21, interrupciones de la terapia debido al olvido de la recarga (entre el 3,6 % y el 19 %) 17,21, infecciones (entre el 2,5 % y el 14,7 %) 21-22, problemas relacionados con el hardware (entre el 13,0 % y el 35,6 %) 19-20, así como hematomas y fallos del dispositivo (alrededor del 20,5 %) 22 (tabla 5).
En lo relacionado a los costos, según Hitti et al. (2018) 22, se encontró que la implantación de GPI-r en lugar de uno GPI-nr resultó en un ahorro de 60,900 USD durante un periodo de nueve años. Después de ajustar este ahorro por inflación y convertirlo a pesos colombianos, se estimó que el ahorro neto sería de aproximadamente 327 178 380.92 COP. Por otro lado, Rizzi et al. (2015) 14 encontraron un ahorro de 234 194 EUR durante un periodo de seguimiento de 7,9 años, al optar por un GPI-r en lugar de un GPI-nr. Después de ajustar este ahorro por inflación y convertirlo a pesos colombianos, se estimó que el ahorro neto sería de alrededor de 1 480 465 909.71 COP durante el mismo periodo (tabla 6).
Tabla 5 Desenlaces de seguridad según estudios
| Autor, año | País | Cohortes | Número de pacientes | Eventos de seguridad | ||
|---|---|---|---|---|---|---|
| Eventos adversos | Confianza en la seguridad/facilidad en el uso | |||||
| Manejo del dispositivo | Recarga del dispositivo | |||||
| Qiu X, 2021 17 | China | GPI-r | 192 (87 %) | Recarga fallida = 8 % (17/220) Interrupción de la terapia por olvido de la recarga = 19 % (42/220) | 178/192 (92,7 %) NR | 79/192 (41 %) NR |
| GPI-nr | 28 (13 %) | |||||
| Furlanetti et al., 2020 18 | Reino Unido | GPI-r | 11 (42,3 %) | NR | NR | NR |
| GPI-nr | 15 (57,7 %) | |||||
| Mitchell et al., 2019 19 | Estados Unidos | GPI-r | 11(18.6%) | Relacionados con el hardware = 35,6 °/o (21/59) | NR | NR |
| GPI-nr inicial (con cambio posterior a GPI-r) | 48 (81,4 %) | |||||
| Jakobs et al., 2019 21 | Alemania | GPI-r | 139 (71,3 %) | Recarga fallida = 8,7 % (17/195) Interrupción de la terapia por recarga fallida = 3,6 % (7/195), infección = 2,5 % y revisión quirúrgica = 4,1 % | 93,8 % (183/195) | 93,8 % (183/195) |
| GPI-nr inicial (con cambio posterior a GPI-r) | 56 (28,7 %) | |||||
| Hitti et al., 2018 22 | Estados Unidos | GPI-r | 123 (60 %) | Infección = 14,7 % (15/102), hematomas y fallas del dispositivo = 20,5 % (21/102) | 93,3 % (95/102) | NR |
| GPI-nr inicial (con cambio posterior a GPI-r) | 83 (40 %) | |||||
| Khaleeq et al., 2019 13 | Reino Unido | GPI-r | 19 (63 %) | NR | NR | NR |
| GPI-nr | 11 (37 %) | |||||
| Jakobs et al., 2018 20 | Alemania | GPI-r | 31 (100 %) | Relacionados con el hardware = 13 % (4/31) | NR | NR |
| Rizzi et al., 2015 14 | Italia | GPI-nr inicial (con cambio posterior a GPI-r) | 139 (100 %) | Conexión errónea del cable de extensión al GPI-r y dehiscencia de la herida con o sin infección demostrada = 6,4 % (9/139). Este evento ocurrió en el 3,7 % de los pacientes con EP. | NR | NR |
| Jia et al., 2016 23 | China | GPI-r | 53 (100 %) | NR | NR | NR |
| Timmermann et al., 2013 24 | Alemania, Italia, Noruega, Españay Suiza | GPI-r GPI-nr inicial (con cambio posterior a GPI-r) | 14 (66,7 %) 7 (33,3 %) | NR | NR | NR |
Fuente: elaboración propia.
Evaluación de la calidad de los estudios
Los estudios incluidos en esta revisión presentaron una calidad baja, con un porcentaje de cumplimiento en la lista de verificación de evaluación crítica de JBI 25, entre el 27 % y el 45 % (tabla 3). La baja calidad está relacionada, principalmente, con sesgos en la selección de los pacientes, dado que fue difícil de determinar si eran poblaciones homogéneas entre los grupos de comparación en cuanto a sus características sociodemográficas, comorbilidades asociadas y los factores pronósticos. Por otro lado, los factores de confusión no fueron analizados y ajustados adecuadamente. En cuanto a la evaluación de los desenlaces relacionados a satisfacción, se hicieron a través de cuestionarios construidos por cada grupo de investigación, enfoque que puede conllevar a un posible sesgo en la elección del contenido y la redacción de las preguntas. Las tasas de respuesta fueron entre el 28,6 % y el 100 %. Adicionalmente, los estudios con baja tasa de respuesta carecían de análisis de los factores que provocaron la deserción de los participantes (tabla 3).
Tabla 6 Cálculos de ahorro neto a partir de los datos de los estudios de costos, considerando inflación y tasa de cambio
| Hitti et al. (2018) (22) | Rizzi et al. (2015) 14 |
|---|---|
| Paso 1: calcular el ahorro original en dólares estadounidenses (USD): | Paso 1: calcular el ahorro original en euros (EUR): |
| El ahorro original es de 234 194 EUR. | |
| El ahorro original es de 60 900 USD (9 años). | Paso 2: convertir el ahorro original en euros a dólares estadounidenses (USD): |
| Paso 2: ajustar el ahorro original por inflación: tasa de inflación anual: 6,22 % (0,0622) | Se utiliza la tasa de cambio proporcionada: 1,09 USD / 1 EUR. |
| Periodo: 2018-2023 (5 años) | Ahorro original en USD = 234,194 EUR x 1,09 USD / 1 EUR |
| Nuevo valor en USD = 60,900 USD x (1 + 0,0622)A5 | Ahorro original en USD = 255 314,46 USD |
| Nuevo valor en USD = 83 581,36 USD | Paso 3: Ajustar el ahorro original por inflación: |
| Paso 3: convertir el nuevo valor en USD a pesos colombianos (COP), utilizando la tasa de cambio actual, la cual es de 1 USD a 3917 COP. | Tasa de inflación anual: 6,22 % (0,0622) |
| Nuevo valor en COP = 83 581,36 USD x 3917 COP / 1 USD | Periodo: 2015-2023 (8 años) |
| Nuevo valor en COP = 327 178 380,92 COP | Nuevo valor en USD = 255 314,46 USD x (1 + 0,0622)A8 |
| Por lo tanto, el ahorro neto después de 9 años, considerando la inflación y la tasa de cambio actual, sería aproximadamente de 327 178 380,92 COP. | Nuevo valor en USD = 377 991,83 USD |
|
Paso 4: convertir el nuevo valor en USD a pesos colombianos (COP), utilizando la tasa de cambio actual, la cual es de 1 USD a 3917 COP. Nuevo valor en COP = 377 991,83 USD x 3917 COP / 1 USD Nuevo valor en COP = 1 480 465 909,71 COP Por lo tanto, el ahorro neto después de 7,9 años, considerando la inflación y la tasa de cambio actual, sería aproximadamente de 1 480 465 909,71 COP. |
Nota: en este ejercicio de cálculos, los cuales son aproximados y dependen de las tasas de cambio y la inflación promedio anual.
El método utilizado para calcular el ahorro neto considerando la inflación y la conversión a pesos colombianos se dividió en tres pasos: en primer lugar, se determinó el monto del ahorro original en dólares estadounidenses para el periodo especificado. Luego, se ajustó este valor por la tasa de inflación anual durante un periodo determinado, utilizando la fórmula del interés compuesto y, por último, se convirtió el nuevo valor ajustado en dólares estadounidenses a pesos colombianos, multiplicándolo por la tasa de cambio actual. Este método permite calcular el ahorro neto en términos de la moneda local, teniendo en cuenta la influencia de la inflación y las fluctuaciones cambiarias.
Fuente: elaboración propia.
Discusión
Los estudios analizados revelaron que el 60 % evaluaron la satisfacción del paciente en relación con dispositivos GPI-r y GPI-nr en la ECP. Se observó que los pacientes que recibieron GPI-r desde el inicio del tratamiento o como reemplazo de un GPI-nr, reportaron una alta satisfacción sin diferencias estadísticamente significativas entre ambos tipos de dispositivos, sin embargo, la evidencia específica en pacientes exclusivamente con EP fue limitada. Las preocupaciones y preferencias de los pacientes variaron según el tipo de dispositivo y los pacientes con GPI-nr expresaron una mayor preocupación por el tamaño del dispositivo, mientras que aquellos usaban GPI-r señalaron la necesidad de recargar la batería como una consideración importante.
En relación con la duración de los dispositivos, se informó que el tiempo de sustitución del GPI en pacientes con EP que cambiaron de GPI-nr a GPI-r fue de aproximadamente 5,1 años 14, sin embargo, la vida útil de los dispositivos GPI-r no fue reportada en los estudios analizados, posiblemente debido a su menor frecuencia de reemplazo y con una vida útil informada de ≥10 años 6,13.
En términos de seguridad, los dispositivos GPI-r presentaron eventos adversos específicos, como fallas de recarga e interrupciones terapéuticas debido al olvido de recargar, además de complicaciones adicionales en ciertos pacientes, sin embargo, en los dispositivos GPI-nr, aunque se eliminó el riesgo asociado a la recarga, el riesgo de infección y otras complicaciones podría ser mayor debido a las reintervenciones quirúrgicas para el reemplazo de batería 22.
Además de evaluar los aspectos clínicos, es esencial considerar el impacto económico a largo plazo para el paciente y el sistema de salud al elegir entre GPI-r y GPI-nr. Los estudios indican que la implantación de dispositivos recargables puede resultar en ahorros significativos en costos directos e indirectos en comparación con los dispositivos de duración fija 14,22 y, aunque los dispositivos recargables pueden tener un costo inicial más alto, los ahorros a largo plazo debido a una menor necesidad de reemplazo y menores complicaciones pueden justificar esta inversión inicial.
Es fundamental destacar la equivalencia en la capacidad de programación y entrega de energía al cerebro entre los dispositivos GPI-nr y GPI-r, lo que no difiere en su efecto terapéutico para el control de síntomas. Es esencial que los profesionales de la salud informen a los pacientes sobre todas las opciones disponibles, incluyendo dispositivos recargables y de duración fija, para facilitar una toma de decisiones informada y compartida entre el médico, el paciente y la familia.
Antes de seleccionar un tipo de dispositivo GPI, es crucial considerar las preferencias y preocupaciones individuales del paciente. Algunos pacientes pueden preferir la conveniencia de un dispositivo recargable, mientras que otros pueden sentirse más seguros con una batería de duración fija. Esta personalización en la elección del dispositivo puede contribuir significativamente a la satisfacción del paciente y la adherencia al tratamiento.
Es importante evaluar los riesgos y beneficios de cada tipo de dispositivo en el contexto de cada paciente y aunque los dispositivos recargables pueden ofrecer ventajas en términos de duración y posiblemente menos riesgo de infección, también es esencial considerar las complicaciones o dificultades potenciales asociadas con la recarga y el mantenimiento a largo plazo.
Independientemente del tipo de dispositivo seleccionado, se requiere de un seguimiento cuidadoso del paciente para monitorear cualquier complicación o preocupación relacionada con el dispositivo. Este enfoque garantiza una atención continua y de alta calidad para los pacientes que se someten a terapia con ECP, permitiendo ajustes o intervenciones oportunas según sea necesario.
Por último, es importante tener en cuenta las limitaciones metodológicas presentes en esta revisión rápida de la literatura. Aunque se llevó a cabo una búsqueda sistemática, que puede ser reproducible, esta se restringió a una sola base de datos. Además, los procesos de tamización, selección y extracción de datos no se realizaron de manera pareada, no obstante, estas adaptaciones metodológicas son consistentes con las limitaciones de tiempo y recursos que a menudo se enfrentan al realizar revisiones sistemáticas completas. Por tanto, se han adoptado y adaptado metodologías pragmáticas que no comprometen la calidad y que permiten tomar decisiones rápidas basadas en la evidencia 26-27.