INTRODUCCIÓN
El género Atelopus (Duméril y Bibron, 1841), es un grupo de ranas que incluye un total de 96 especies descritas formalmente, que se distribuyen en distintos ecosistemas de la región Neotropical 1. De acuerdo con la Unión Internacional para la Conservación de la Naturaleza-UICN 2, en Ecuador el género está representado por 25 especies, de las cuales 18 especies (72%) son consideradas endémicas. La situación actual de conservación y el grado de amenazas son preocupantes, ya que el 84% de los Atelopus ecuatorianos se incluyen en alguna categoría de amenaza, causadas principalmente por la reducción de su hábitat, el cambio climático y enfermedades 2,3.
Las disminuciones poblacionales que se ha producido en muchas especies de anfibios durante las últimas décadas, y en especial sobre este género de ranas, es un fenómeno global reportado desde finales de la década de 1980 hasta la actualidad 3,4; y dada su relevancia e impacto, se ha propiciado varias investigaciones e iniciativas de conservación enfocadas en conocer las causas de esta problemática y responder a las amenazas 5.
Según la UICN 2, Atelopus balios es considerada como una especie en Peligro Crítico (CR) bajo los criterios B1ab (i, iii), ya que su área de distribución se restringe a 55 km2, y es conocida únicamente en cuatro localidades en los bosques húmedos tropicales occidentales en las provincias de Azuay, Cañar y Guayas en Ecuador, con distribución desde 100 a 900 metros de altitud. La mayor amenaza en la actualidad es la agricultura, ganadería, minería y la polución ambiental. Los estudios sobre la biología y conservación de la especie presentan importantes vacíos de información como: 1) existencia de otras poblaciones; 2) efectos de los factores de presión antrópica sobre las poblaciones; 3) presencia de quitridiomicosis y otros patógenos; 4) falta de un conocimiento más preciso de las interrelaciones con el ambiente que ocupa la especie. Con estos antecedentes, resulta imprescindible implementar acciones urgentes destinadas a conservar las poblaciones conocidas en el área de distribución de la especie.
En este contexto, el monitoreo biológico se presenta como una herramienta de suma importancia para los estudios de ecología, conservación y manejo de vida silvestre, ya que, determinar posibles cambios temporales-espaciales ocurridos en la dinámica de las poblaciones, puede resultar clave para la comprensión del efecto de sus posibles causas naturales o de origen antrópico sobre las especies 6,7. De este modo, el proyecto "Conservación de Anfibios y Uso Sostenible de Recursos Genéticos (PARG)", reconoce a Atelopus balios como una de las especies objetivo de conservación in situ y ex situ en Ecuador.
En este estudio se presenta información de línea base fundamentada en dos muestreos de captura-recaptura, cuyo objetivo es sumar información valiosa sobre el tamaño de la población de A. balios, su tamaño corporal, estructura de la población, el uso de sustrato, su actividad, y su distribución vertical y horizontal en el área protegida Cerro "Las Hayas" y zona adyacente, considerada una localidad clave para la conservación de la especie.
MATERIALES Y MÉTODOS
Área de estudio. El estudio se llevó a cabo en la comunidad 23 de noviembre que se ubica en la provincia del Guayas, Cantón Naranjal, Parroquia Naranjal (02°43' S; 79°38' W), comprende una extensión de aproximadamente 650 ha. Dentro de la comunidad se encuentra el Área Provincial Natural de Recreación (APNR) Cerro Las Hayas con una superficie de 397.16 ha 8, localizada en el piedemonte de la cordillera entre los 60 y 640 msnm (Figura 1). En dirección NO-SE transcurren dos ríos principales casi paralelos y distanciados por 1.2 km entre sí, con anchos entre 6 y 10 m. Ambos ríos sustentan a la comunidad 23 de noviembre, y posteriormente desembocan en el Océano Pacífico, poseen remanentes de bosque rodeado de áreas de cultivos como plátano, cacao, y pastizales.
El río Mina presenta topografía de colinas con pendientes entre 5° a >50° en algunos tramos, y se ubica en el ecosistema de bosque siempreverde estacional pie montano de la Cordillera Occidental de los Andes 9. Las laderas escarpadas presentan vegetación secundaria y arbustiva, con árboles entre 20 y 25 m de alto. Las orillas poseen sustrato de fondo pedregoso y grandes piedras, no se observa acumulación de material vegetal en descomposición.
El río Ochoa presenta topografía con pendiente <10°. Se ubica en el ecosistema de Bosque semideciduo de tierras bajas del Jama Zapotillo 9, desde 60 hasta 300 msnm. Presenta vegetación secundaria circundante y sotobosque en gradiente de moderado a abierto, con árboles entre 20 y 25 m de alto. Las orillas del río presentan sustrato de fondo pedregoso y grandes piedras, y poca materia orgánica.
Método. Durante octubre y noviembre de 2017, siguiendo el cauce en dos ríos de la localidad, se estableció en cada uno un transecto lineal de 1000 m de distancia y ancho variado entre 5-10 m, donde se realizaron relevamientos visuales para obtener datos de abundancia sobre la especie 7,10. Así: transecto río Mina (T1) dentro del APNR Cerro Las Hayas, y transecto río Ochoa (T2) aledaño al centro de la comunidad (Figura 1). En cada transecto se emplearon tres días seguidos de muestreo efectivo que fue realizado por dos personas (técnico y guía de la comunidad) con un esfuerzo de muestreo diario de 6 horas/persona, acumulando así un total de 36 horas de muestreo para cada transecto. Para evitar el conteo repetido del mismo individuo se utilizó la técnica de fotoidentificación, fotografiando el dorso de cada individuo capturado y asignándole un código único 10,11. Se registró, además, el sexo (definido por diferencias de tamaño corporal o evidencias de la presencia de ovocitos en la cavidad corporal), actividad al momento de captura (desplazándose, perchando), sustrato (hoja, rama, roca), la Longitud Rostro Cloaca (LRC), posición vertical en relación al suelo (altura en cm desde el suelo), posición horizontal (distancia de ubicación hacia el borde del río en cm) 7,10,11.
Para estimar el tamaño de la población se utilizó el estimador de Bailey incluyendo el error estándar (EE) para dos muestras de captura y recaptura 12. La estructura poblacional de machos y hembras, la LRC, el uso de sustrato y su distribución vertical y horizontal fueron analizadas mediante estadística descriptiva con el programa estadístico BioEstat 5.0 13.
RESULTADOS
Se obtuvo un total de 32 registros (tres en T1 río Mina y 29 en T2 río Ochoa) (Tabla 1). En T1 río Mina no se pudo aplicar el estimador de población por tener muy pocos datos. En T2 río Ochoa se estimó 52.25±EE18.64 individuos. Se obtuvo el registro de 29 individuos únicos (tres en T1 y 26 en T2) (Figura 2). En ambos transectos se registró 26 machos y tres hembras, para una proporción de sexo de 8.6:1. En T1 únicamente se registraron machos; mientras que en T2 se registraron 23 machos y 3 hembras, para una proporción de sexo de 7.6:1. El sustrato más frecuentado de A. balios fue hoja con el 59.4%. La actividad frecuente al momento de la captura fue desplazándose con el 75% (Tabla 1).
Tabla 1 Estructura poblacional, tipo de sustrato y actividad ocurridos en T1= Río Mina y T2= Río Ochoa.
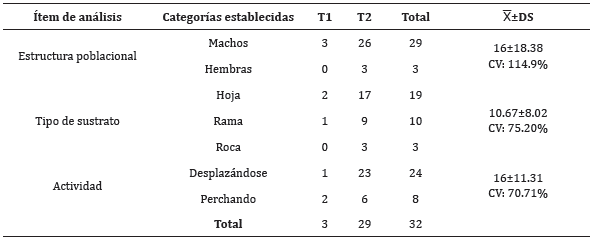

Figura 2 Láminas que muestran los dorsos de 29 individuos de A balios con su código de registro en el área de estudio.
La LRC varío entre 20.1 y 35.4 mm (X=24.66±3.55 mm), entre 20.1 y 27.96 mm para machos y entre 30.1 y 35.4 mm para hembras. La distribución vertical fue entre 20 y 250 cm de altura (X=127.96±64.6 cm). En T1 fue entre 30 y 120 cm (
DISCUSIÓN
En la población estudiada de Atelopus balios la proporción de machos/hembras fue de 8.6:1. Siendo similar a lo reportado en Atelopus varius, donde se registró una proporción de 8.08:1 14. Pero difieren de lo registrado en Atelopus spumarius donde fue de 4.1:1 15, en Atelopuszeteki que fue de 2.24:1 14, en Atelopus cruciger que fue de 2:1 16, y en contraste para Atelopus laetissimus que fue de 24.5:1 17.
Mediante dos muestreos de captura-recaptura, los individuos registrados mediante fotoidentificación mostraron patrones de manchas únicos (Figura 2), señalando así la importancia de este uso de métodos no invasivos de marcaje para especies amenazadas 10,11. El tamaño poblacional estimado en T2, podría sugerir que la población es estable dentro de un área que no se encuentra protegida, y que podría ser anexada a la APNR debido a que su población es más abundante que en T1.
Granda-Rodríguez et al 17, encuentra en Atelopus laetissimus que durante el día prefieren el sustrato de rocas y hojarasca, mientras que su distribución vertical es entre 40 y 120 cm, y la horizontal es a menos de 5 m. El uso de sustrato en A. balios tuvo mayor frecuencia en hoja, luego en rama y en menor proporción en roca (Tabla 1), pero no fue registrado en hojarasca, su distribución vertical tuvo un promedio de 128 cm de altura, lo cual estaría acorde a la preferencia de sustrato, tan solo el 22% fue registrado a menos de 50 cm y coincide con el uso de sustrato en roca. Su distribución horizontal tuvo un promedio de 275 cm del borde del río, y se encontró que el 78% (incluido las tres hembras registradas) fue registrado a distancias de más de un metro, lo cual puede cambiar dependiendo de su época reproductiva al igual que en otros Atelopus17. Esto coincide con el bajo registro de hembras, señalando así que en estos meses de muestreo no es su época reproductiva, y estarían descartados para futuros muestreos donde se busquen hembras para programas de conservación in situ o ex situ. Del mismo en su actividad no se registraron amplexus, lo cual confirmaría este hecho.
Hasta febrero de 2018, se desconoce sobre la presencia de quitridiomicosis, sin embargo, los individuos registrados no presentaban decaimiento y se veían sanos. No obstante, sería importante diagnosticar la presencia y prevalencia de enfermedades.
En cuanto a la diferente abundancia de individuos entre T1 y T2, se desconoce su razón. Se habría esperado que existan más individuos en T1 ya que está dentro de un área protegida, sin embargo, ocurrió lo contrario. Dados estos resultados de escasa abundancia en T1, no se pueden sugerir claras diferencias, sin embargo, se espera que las poblaciones de A. balios permanezcan estables y que esta diferencia entre ambos sitios de muestreo sea debida a una fluctuación normal dentro de la población. Por lo cual es importante su monitoreo. Gómez-Hoyos et al. 18, recomienda dos muestreos anuales durante tres años para detectar cambios poblacionales. Es importante señalar que, aunque el presente estudio tiene poca representatividad de muestreo, aporta con información primordial para futuros estudios y programas de conservación.