INTRODUCCIÓN
La enfermedad por coronavirus 2019 (COVID-19), causada por la infección del coronavirus 2 del syndrome respiratorio agudo severo (SARS CoV-2), ha sido declarada pandemia por la Organización Mundial de la Salud (OMS) y representa un grave problema de salud pública en el mundo 1. Para el 12 de enero del 2021 se han registrado 91.298.760 casos, de los cuales 1.954.383 han fallecido 2.
El espectro del COVID-19 es amplio, pudiéndose presenter infección asintomática o leve en el 80 % de los casos 3,4, el 15 % progresa a enfermedad moderada con síntomas como fiebre, tos, fatiga, mialgia y disnea, entre otros; el 5 % de los casos avanza a formas graves que pueden llevar incluso a la muerte 4. Los casos de COVID-19 graves se acompañan de una reacción inmune excesiva, caracterizada por hiperinflamación debida al síndrome de liberación de citoquinas proinflamatorias (CRS, cytokine release syndrome) con niveles plasmáticos aumentados de interleuquinas (IL) IL-1β, IL-2, IL-6, IL-7, factor de necrosis tumoral alfa (TNF-α), insuficiencia pulmonar, endotelitis, coagulación intravascular diseminada y, eventualmente, falla multiorgánica 5,6. Se ha propuesto que, además de las citoquinas proinflamatorias mencionadas, en el COVID-19 las respuestas de tipo IL-17/Th17 también participan en la desregulación inflamatoria con una polarización aberrante de la IL-17 que conllevaría al incremento en la severidad de la enfermedad 7-14. Una de las estrategias terapéuticas para el manejo de los estados avanzados del COVID-19 es la inmunomodulación negativa de citoquinas proinflamatorias 4 y, en este sentido, el bloqueo de IL-17/Th17 podría ser importante para disminuir la inflamación sistémica 7-12,14.
Descripción general de la respuesta IL-17/Th17
Las células T helper-17 (Th17) y la IL-17 desempeñan un papel central en la defensa contra las infecciones causadas por bacterias extracelulares y hongos 15. Sin embargo, en enfermedades inflamatorias y autoinmunes como la psoriasis, la artritis reumatoide, la esclerosis múltiple y las enfermedades inflamatorias del intestino, entre otras, hay secreción aumentada y persistente 16.
Las células Th17 son un subgrupo de linfocitos T CD4+, su diferenciación en humanos es inducida por un entorno inflamatorio de IL-6, IL-1β, IL-21 e IL-23 17,18, mientras que el factor de crecimiento transformante beta (TGF-β) parece tener un papel dual entre las células Th17 y las T reguladoras (Tregs) 18. El linaje Th17 está regulado por factores de transcripción específicos como RORγt y STAT3, que dirigen la transcripción de genes que codifican la producción de citoquinas de una familia de seis miembros (IL-17A a IL-17F), entre las cuales IL-17A (IL-17) es la más representative 18-20. En determinadas circunstancias, la IL-17 también puede ser producida por otras células como los neutrófilos, linfocitos T citotóxicos (Tc17) linfocitos T γδ, las células T natural killer (NKT) y las linfoides innatas del grupo 3 (ILC3) 21,22. El receptor de las IL-17A e IL-17F está formado por las subunidades IL-17RA e IL-17RC y se expresa en una variedad de células como fibroblastos, células endoteliales, células epiteliales, tejidos hematopoyéticos y células del músculo liso de las vías respiratorias 19,23. La union de IL-17 a su receptor induce la producción de citoquinas y mediadores proinflamatorios como IL-1β, IL-6, IL-8, IL-22, IL-23, TNF-α, factor estimulante de colonias de granulocitos-macrófagos (GM-SF), factor estimulante de granulocitos (G-CSF), prostaglandina E2 (PGE2), metaloproteinasas de matriz extracelular, óxido nítrico y quimioquinas (CXCL1, CXCL2, CXCL10, CCL2, CCL7 y CCL20) que median procesos claves como la activación, el reclutamiento de neutrófilos y células Th17 a los sitios de inflamación promoviendo el daño tisular 19,24,25 (Figura 1).
Posibles mecanismos de IL-17/Th17 en el SDRA
El potente papel inflamatorio de la IL-17 está sinérgicamente relacionado con la acción de otras citoquinas inflamatorias y la capacidad de reclutar células inmunes 26. La expression ubicua de su receptor (IL-17RA) posibilita que un gran número de células puedan responder al efecto de esta citoquina 27. No obstante, la expresión de las cadenas complementarias del heterodímero (IL-17RB, IL-17RC, IL-17RE) parece ser restringida a compartimientos de células inmunes y no inmunes 28, con actividad y señalización específica que depende del tejido 29. Aunque se han estudiado los efectos que son dependientes de la IL-17 en las células inmunes como los linfocitos B y las células presentadoras de antígeno (APC), la expression diferencial de las cadenas del receptor es aún un tema en discusión, subyacente en funciones biológicas divergentes 28.
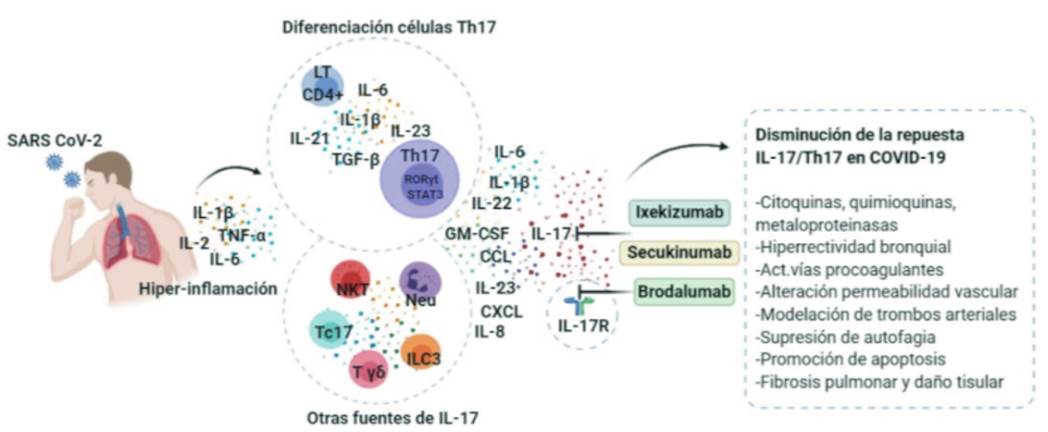
Figura 1 La infección por SARS CoV-2 causa hiper-inflamación y aumento de mediadores como IL-1β, IL-6 y TNF-α en los casos de COVID-19 grave. El microambiente proinflamatorio es propicio para que se induzca la diferenciación de las células Th17; adicionalmente, IL-17 también puede ser secretada por otras células perpetuando la inflamación. El bloqueo de la IL-17 y/o su receptor (IL-17R) por anticuerpos monoclonales (mAb) puede reducir la respuesta de tipo IL-17/Th17 en COVID-19. Fuente: creación propia en Biorender.com
En el síndrome de dificultad respiratoria aguda (SDRA), la evidencia apunta a la activación de cascadas proinflamatorias con algunos mediadores aún desconocidos; se ha identificado que la IL-17 está implicada en las enfermedades pulmonares inflamatorias y, particularmente, se asocia con la activación e infiltración de neutrófilos en el tejido pulmonar. Su carencia conlleva a una susceptibilidad aumentada de patógenos bacterianos, pero su producción excesiva culmina en la enfermedad autoinmune pulmonar 30.
En el SDRA, infección respiratoria grave e insuficiencia respiratoria, se evidencia una relación entre los niveles de IL-17 alveolar, el daño pulmonar, la gravedad de la enfermedad y el estado de disfunción orgánica 7,31. La señalización mediada por la IL-17 participa en los procesos claves en la fibrosis pulmonar, mediante la activación directa de los fibroblastos y de señales procoagulantes que estimulan la fibrogénesis 32. Es possible que la IL-17 induzca fibrosis al promover la síntesis, secreción de colágeno y transición del epitelio mesenquimal de las células epiteliales; además, se ha demostrado que IL-17 puede suprimir mecanismos que regulan la fibrosis pulmonar, como la autofagia de las células epiteliales, 33 y promover la apoptosis de las células del epitelio alveolar 9. La IL-17 también puede modular la formación de trombos arteriales 11 y directamente actuar sobre el músculo liso y el epitelio respiratorio, induciendo hiperreactividad bronquial 34. Se ha descrito también que la IL-17, en asocio con la IL-12, ejercen una regulación positiva en la expression de ARNm de la enzima convertidora de angiotensina 2 (ACE2) en las células epiteliales respiratorias de pacientes con enfermedad pulmonar obstructiva crónica y COVID-19 grave 35 (Figura 1).
Evidencia de IL-17/Th17 en la inmunopatogénesis de COVID-19
Varios estudios han reportado un aumento en los niveles plasmáticos de IL-17 en los casos de COVID-19 grave 35-44. Tras un seguimiento de 4 semanas a los casos leves y graves, se encontraron altos niveles séricos de IL-17 y otras citoquinas como IL-6, IL-12, IL-1β, interferon gamma (IFN-γ) e IL-27 en los casos graves, principalmente en la etapa tardía 39. En consecuencia, se ha propuesto que los niveles séricos elevados de IL-1β y TNF-α, observados en pacientes con COVID-19 que ingresaron a unidad de cuidados intensivos (UCI), pueden ser consecuencia de una respuesta de tipo Th17 que, en conjunto, altera la permeabilidad vascular 25.
Los linfocitos Th17, entre otros grupos celulares, permanecen activados en pacientes con COVID-19 grave, con un aumento de IL-17 y de su receptor IL-17RA 36. Se ha demostrado que los pacientes con COVID-19 grave que requirieron de ingreso a UCI tenían, entre otras alteraciones inmunológicas, un aumento en los marcadores activación y senescencia de las subpoblaciones de células T 45, así como niveles incrementados de IL-17, comparados con pacientes con infecciones no graves y controles sanos 43-45. Algunos de estos hallazgos se acompañaron de una mayor producción de IL-17 in vitro13,45.
El análisis de la sangre periférica y las biopsias post mortem de un paciente con COVID-19 también evidenció un aumento en la frecuencia de células Th17 (CD4+ CCR6+) que explicaría en parte, el grave estado de enfermedad en el paciente 46. La carga viral de SARS CoV-2 se ha asociado positivamente con los niveles de IL-17 y otras citoquinas proinflamatorias 37, entre ellas la IL-6. También se ha correlacionado positivamente con las células Th17, la proteína C reactiva y el fibrinógeno 47. Se ha propuesto que la IL-17 pudiera considerarse un potencial biomarcador asociado con la lesión pulmonar por su fuerte correlación con la puntuación de Murray 12,37.
Particularmente, los factores de riesgo y comorbilidades que se asocian con la infección por el SARS CoV-2 y la mortalidad por COVID-19, tales como sexo masculino, edad > 65 años, diabetes mellitus, obesidad, hipertensión arterial, enfermedad renal crónica y miocarditis 48,49, también tienen una mayor respuesta o señalización de tipo IL-17/Th17 7,12,34.
Asimismo, en el síndrome inflamatorio multisistémico en niños (MIS-C, multisystem inflammatory syndrome in children), relacionado con la infección por SARS-CoV-2, también se han observado altos niveles de IL-17 en la fase aguda 50,51. Si bien en uno de los estudios se encontró que la elevación de IL-17 con otras citoquinas y quimioquinas (CD40, IL-6, CXCL5, CXCL11, CXCL1 y CXCL6) parece distinguir a los pacientes con MIS-C de los pacientes pediátricos con COVID-19, gran parte de la fisiopatología del MIS-C es desconocida hasta el momento 51.
En conjunto, estas evidencias sustentan que el bloqueo de la IL-17 podría ser considerada como un objetivo terapéutico en el COVID-19 45.
Opciones y perspectivas terapéuticas
Dado que no existe un tratamiento específico para el COVID-19 52 y que los casos graves exhiben un CRS con notable aumento de IL-17 y otras citoquinas (IL-1β, IL-6, IL-8, IL-12, TNF-α, IFN-γ, proteína quimioatrayente de monocitos 1 (MCP-1), proteína 10 inducida por interferón γ (IP-10), IL-10, proteína C reactiva, CXCL10, dímero D y ferritina) con efectos proinflamatorios como la migración de neutrófilos y monocitos, la activación de cascadas de señalización de citoquinas y quimioquinas, y la conducción al SDRA 14,53; la utilización de inhibidores de IL-17 podría ser una herramienta adicional para el control temprano del CRS, a su vez que aumentaría la respuesta antiviral de tipo IFN-I, que también se ve afectada por la función proviral de la IL-17 8.
En relación con esto último, también se ha planteado un enfoque alternativo de la terapia anti-IL-17 en los pacientes con COVID-19 y cáncer de pulmón; la IL-6 e IL-17 en sinergia promueven el daño pulmonar y la persistencia viral, inhibiendo la apoptosis de las células infectadas; adicionalmente, IL-17 estimula la producción del factor de crecimiento endothelial vascular (VEGF) en las líneas celulares cancerosas y regula positivamente la secreción de quimioquinas proangiogénicas (CXCL-1-5-6-8) 54,55. Por su parte, en pacientes con psoriasis se demostró que la terapia anti-IL-17 regula negativamente la expresión de ARNm de ACE2 en la piel. Esto podría significar una reducción del riesgo de COVID-19. No obstante, se necesitan más estudios en este campo 56.
Los inhibidores de IL-17 disminuyen los efectos de IL-6 y TNF-α, ofreciendo un mayor espectro terapéutico para el CRS en el COVID-19 10; no obstantes, la consideración de su uso en primera línea y en pacientes con estado clínico grave, o grave en etapa tardía, está por determinarse. Al momento, están disponibles brodalumab, anticuerpo monoclonal (mAb) humano inmunoglobulina G (IgG2) con unión a la subunidad A del receptor de IL-17 (IL-17RA), su bloqueo permite inhibir el efecto biológico de IL-17A, IL-17C, IL-17F y otras isoformas 57; secukinumab, mAb IgG1 anti-IL-17A 58 e ixekizumab, mAb IgG4 anti-IL-17A e IL-17A/F 59, aprobados por la FDA (Food and Drug Administration) para uso en enfermedades como la psoriasis, la artritis psoriásica y la espondilitis anquilosante 7,58. Estos tres biológicos se administran mediante inyección subcutánea 58, que permite utilizarlos conjuntamente con otros medicamentos que hasta ahora han demostrado cierta eficacia, o en pacientes con ventilación asistida. Secukinumab e ixekizumab tienen un tiempo de acción rápido, Buena tolerabilidad, alta eficacia y un perfil de seguridad documentado que no incluye la linfopenia, la cual se ha informado en pacientes con COVID-19 10. Aunque los estudios con medicamentos antivirals han arrojado resultados discrepantes 60, falta por conocerse los de un ensayo clínico controlado y aleatorizado que utilizó Ixekizumab combinado con terapia antiviral para pacientes con COVID-19 (61.
Actualmente, algunos de estos inhibidores de IL-17 ya están siendo estudiados para el tratamiento del COVID-19 (Tabla 1).
Tabla 1 Ensayos clínicos registrados con inhibidores de IL-17 para COVID-19 (hasta el 20 de diciembre de 2020)
| País | N° de registro | Título | Anti-IL-17 | n |
|---|---|---|---|---|
| China | ChiCTR2000030703 | Un ensayo clínico aleatorizado, ciego, controlado y multicéntrico para evaluar la eficacia y seguridad de Ixekizumab combinado con medicamentos antivirales convencionales en pacientes con neumonía por el nuevo coronavirus (COVID-19) | Ixekizumab | 40 |
| Rusia | NCT04403243 | Colchicina versus Ruxolitinib y Secukinumab en un ensayo abierto prospectivo aleatorizado (COLORIT) | Secukinumab | 70 |
| Brasil | RBR-5vpyh4 | Uso de Anti-IL-17 en pacientes con síndrome respiratorio agudo severo (SRAS) asociado con COVID-19 | Secukinumab | 50 |
Fuente: creación propia. Adaptado de: Chinese Clinical Trials Register; Clinical Trials-National Institutes of Health (NIH); Registro Brasileiro de Ensaios Clínicos
CONCLUSIONES
En conclusión, la inmunopatogénesis del COVID-19 es considerablemente compleja y la participación de una respuesta inmune de tipo IL-17/Th17 ha sido parcialmente documentada. La evidencia disponible hasta el momento apuntaría a que el bloqueo de IL-17 podría disminuir e incluso revertir la inflamación y la fibrosis pulmonar en los casos graves. Serán necesarias investigaciones adicionales que permitan dilucidar la participación de IL-17/Th17 en la inmunopatogénesis del COVID-19 en los diferentes estados de la enfermedad y grupos etarios. Un buen punto de partida de investigación a corto plazo sería la exploración de casos de pacientes con infección por COVID-19 que usan anti-IL-17 como terapia para diferentes enfermedades inflamatorias y autoinmunes; además, se hacen necesarios ensayos clínicos que determinen la eficacia y la seguridad de la modulación de esta vía como parte del tratamiento de la enfermedad.














