Introducción
La distonía laríngea o disfonía espasmódica es una distonía caracterizada por contracciones involuntarias de los músculos laríngeos internos [1]. Corresponde a una alteración de una tarea específica, es decir, se desencadena al hablar y afecta la fluencia de la voz. Fue descrita por primera vez en 1871 por Ludwig Traube como una “forma espástica de ronquera nerviosa” [2], y durante muchos años tratada como etiología psicológica o psiquiátrica.
Esta patología es causada por una anormalidad en el procesamiento motor del habla a nivel central y aunque se desconoce con exactitud su fisiopatología, se han demostrado alteraciones estructurales en la organización cerebral de los pacientes que la padecen, como una disfunción de la corteza sensoriomotora y la reducción focal de la densidad axonal y mielina a lo largo del tracto corticobulbar/corticoespinal [3]. A través de una resonancia magnética funcional se ha identificado un mayor grado de activación en las regiones corticales del cerebro responsables del control de la producción de voz, tanto en tareas sintomáticas como asintomáticas; mientras que el grado de activación dentro de las estructuras subcorticales (ganglios basales, tálamo y cerebelo) aumentó solo durante el habla sintomática, pero disminuyó durante las tareas laríngeas asintomáticas [4,5].
Se estima que afecta a 1:100.000 personas. Sin embargo, la dificultad en su diagnóstico, incluso para especialistas, podría provocar una subestimación del valor real. Más del 65 % de los pacientes son mujeres, con una edad promedio de inicio a los 45 años [6]. Se asocia con frecuencia a comorbilidad neurológica como temblor vocal en el 25 % de los casos, y en un 7-11 % a otras distonías.
Su diagnóstico es clínico, mediante la evaluación del habla del paciente, que se caracteriza por quiebres vocales irregulares e incontrolables que afectan la fluencia del habla, especialmente puede evaluarse en la emisión sostenida de una vocal, lo que permite apreciar los espasmos irregulares que determinan una voz entrecortada. No existen test diagnósticos específicos para la distonía laríngea y es necesaria la experiencia para la diferenciación con otras patologías vocales tales como temblor vocal y disfonía músculo tensional [1]. Se requiere la visualización de la laringe de forma endoscópica para confirmar los espasmos laríngeos durante la fonación y excluir otras patologías que interfieran con la producción del habla. Además, pueden utilizarse encuestas perceptuales de la voz, mediciones acústicas y la electromiografía laríngea. Empero, ninguna de estas ha mostrado validez para diferenciar la distonía laríngea de otras alteraciones vocales [7].
Existen dos tipos principales de distonía laríngea: la aductora, caracterizada por espasmos de hiperaducción que interrumpen la fonación de las cuerdas vocales, que produce una voz entrecortada, áspera y con quiebres vocales; y la abductora, con prolongadas consonantes mudas antes del inicio de las vocales que determinan una voz hipofónica, forzada y susurrada [8]. Además, las distonías pueden clasificarse en focales, segmentarias o generalizadas, de acuerdo con la cantidad de estructuras comprometidas [9].
Si bien a la fecha no existe método curativo efectivo, la inyección con toxina botulínica es el tratamiento más usado en pacientes con disfonía espasmódica, teniendo un efecto estimado de tres a cuatro meses [10], aunque podría extenderse hasta seis [11]. Existen varios y validados instrumentos para evaluar la respuesta a la terapia que demuestran reducciones significativas del impacto de la enfermedad, aunque sin lograr normalizar el puntaje [10]. Entre estos cuestionarios se encuentra el índice de discapacidad vocal (VHI, Voice Handicap Index por sus siglas en inglés) y su versión abreviada VHI-10, que ha demostrado tener similar potencia para cuantificar el impacto percibido en la propia función vocal, capacidad física en relación con ella y en las emociones provocadas por la disfonía [12,13].
El objetivo del presente estudio es describir las características clínicas y epidemiológicas de los pacientes con disfonía espasmódica aductora que se mantienen en tratamiento con inyecciones laríngeas de toxina botulínica A y determinar la efectividad de la intervención en cuanto al impacto en la calidad de vida relacionada con la voz.
Materiales y método
Los pacientes con alguna patología vocal que requieren tratamiento con toxina botulínica A son citados a un policlínico exclusivo para este propósito, el cual se realiza de forma mensual. Agrupar a estos pacientes permite la sistematización de la atención y abaratar costos para ellos ya que, debido a las bajas dosis empleadas, un mismo frasco de la toxina puede ser utilizado por distintos pacientes.
El tratamiento se realiza de forma ambulatoria, de acuerdo con el siguiente procedimiento: El frasco de 100 UI (Reage 100 UI, Abbott) se lleva a una dilución 1 UI de en 0,01 ml de agua bidestilada. La infiltración se realiza a través de una jeringa tuberculina, lo que permite que cada graduación de la jeringa corresponda a 1 UI. La administración se realiza a través de una inyección percutánea, en el músculo tiroaritonoídeo, bajo visión endoscópica. La punción generalmente es realizada a través de la membrana cricotiroídea, pero también puede ser sobre la escotadura tiroídea en caso de osificación de la membrana.
Los datos epidemiológicos de los pacientes se obtuvieron, inicialmente, a través de una evaluación vocal y, posteriormente, a un mes de la inyección de toxina, utilizando la encuesta VHI-10 abreviada (Tabla 1).
Tabla 1 Índice de Calidad Vocal Abreviado (VHI-10)
| La gente me oye con dificultad debido a mi voz | 0 | 1 | 2 | 3 | 4 |
| La gente no me entiende en sitios ruidosos | 0 | 1 | 2 | 3 | 4 |
| Mis problemas con la voz alteran mi vida personal y social | 0 | 1 | 2 | 3 | 4 |
| Me siento desplazado de las conversaciones por mi voz | 0 | 1 | 2 | 3 | 4 |
| Mi problema con la voz afecta al rendimiento laboral | 0 | 1 | 2 | 3 | 4 |
| Siento que necesito tensar la garganta para producir la voz | 0 | 1 | 2 | 3 | 4 |
| La calidad de mi voz es impredecible | 0 | 1 | 2 | 3 | 4 |
| Mi voz me molesta | 0 | 1 | 2 | 3 | 4 |
| Mi voz me hace sentir cierta minusvalía | 0 | 1 | 2 | 3 | 4 |
| La gente me pregunta: ¿Qué te pasa con la voz? | 0 | 1 | 2 | 3 | 4 |
Nota. Adaptado de Núñez-Batalla et al., 2007 [13].
Para el análisis estadístico se utilizó el programa SPSS, versión 20. El p value fue considerado significativo menor o igual a 0,05, y para determinar la respuesta mediante el cuestionario VHI-10 se utilizó la prueba t de Student. Los gráficos fueron creados con Prism versión 9. Este estudio se encuentra aprobado por el comité del Hospital Clínico de la Universidad de Chile.
Resultados
El estudio incluyó como muestra un total de 55 pacientes, de los cuales 39 acudieron más de una vez al procedimiento. El 80 % fue de sexo femenino (44) y la edad promedio fue de 58,7 años, con un rango de 19 a 89 años. En la Tabla 2 se resumen los datos obtenidos.
Tabla 2 Datos epidemiológicos y resultados de pacientes con distonía laríngea
| Total pacientes | Mujeres | Hombres | p value | |
|---|---|---|---|---|
| Nº (%) | 55 (100%) | 44 (80%) | 11 (20%) | - |
| Edad promedio | 58,7 | 61,7 | 49,3 | p=0,033 |
| % Comorbilidades (nº) | 27,27% (15) | 27,27% (12) | 27,27% (3) | p=0,99 |
| Total infiltraciones | 218 | 160 | 58 | - |
| Dosis promedio UI | 9,18 | 8,8 | 10,7 | p=0,2592 |
| Intervalo promedio (meses) | 7,4 m | 6,6 m | 10,2 m | p=0,0183 |
| VHI-10 previo | 29,4 | 29,7 | 30,06 | p=0,9873 |
| VHI-10 posterior | 14,96 | 14,85 | 13,77 | p=0,7428 |
| % Efectos adversos (nº) | 3,67% (8) | 4,37% (7) | 1,72% (1) | p=0,6847 |
En total, se realizaron 218 procedimientos en el periodo de estudio, 158 de ellos por el lado izquierdo del paciente (72,5 % de las infiltraciones), 38 bilaterales y solo 22 fueron exclusivamente del lado derecho.
La dosis promedio utilizada por procedimiento fue de 9,18 UI: 10,7 UI aplicadas a hombres, versus 8,8 UI en mujeres. Sin embargo, esta diferencia no fue significativa. A su vez, el intervalo promedio fue de 7,4 meses entre cada dosis, siendo significativamente mayor en hombres que en mujeres, con 10,2 vs 6,6 meses, respectivamente (p=0,0183, t student).
El índice VHI-10 promedio, al momento de la evaluación inicial, fue de 29,4 + 10,3 y posinfiltración fue de 14,96 + 12,48, siendo esta diferencia estadísticamente significativa utilizando la prueba t de Student (p < 0,000001) (Figura 1). No existieron diferencias al separar en grupos por sexo ni tampoco por edad de los pacientes. El VHI-10 es capaz de evaluar el impacto de la patología vocal en el área funcional, física y emocional de los pacientes [13], en nuestros datos analizados no existieron diferencias significativas entre estas esferas (p=0,36, prueba xi-cuadrado).
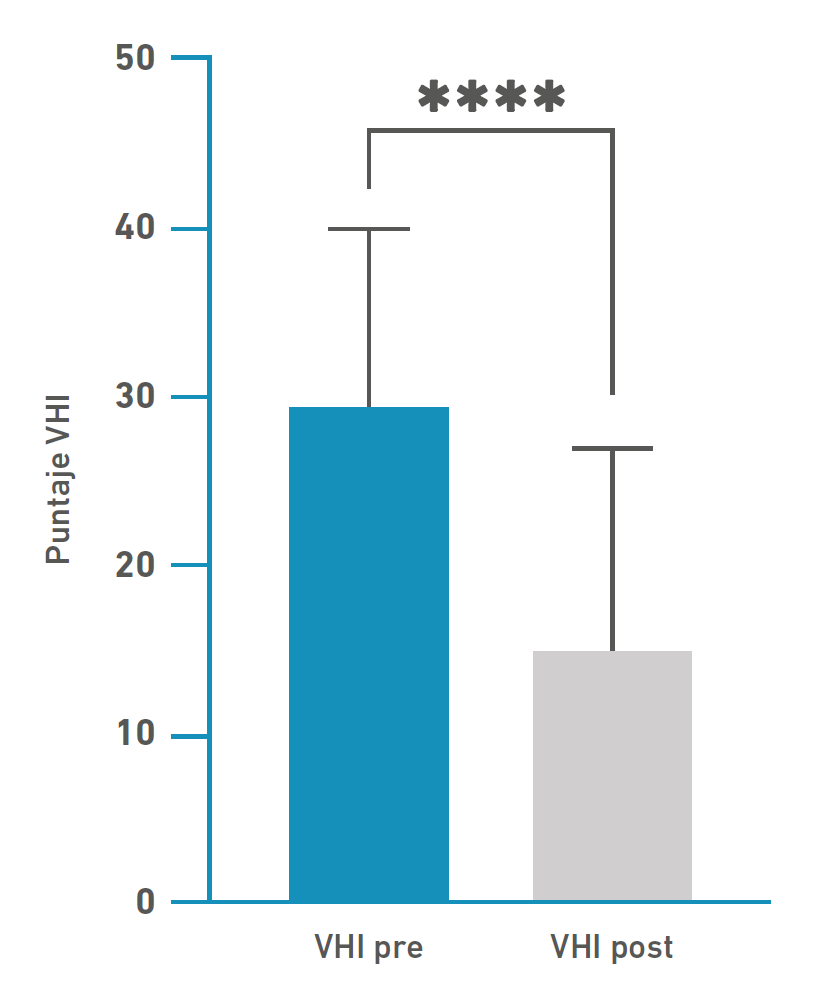
Figura 1 Respuesta a toxina botulínica A medido a través de VHI-10 inicial y posterior, a un mes de inyección. (p<0,0001, t student)
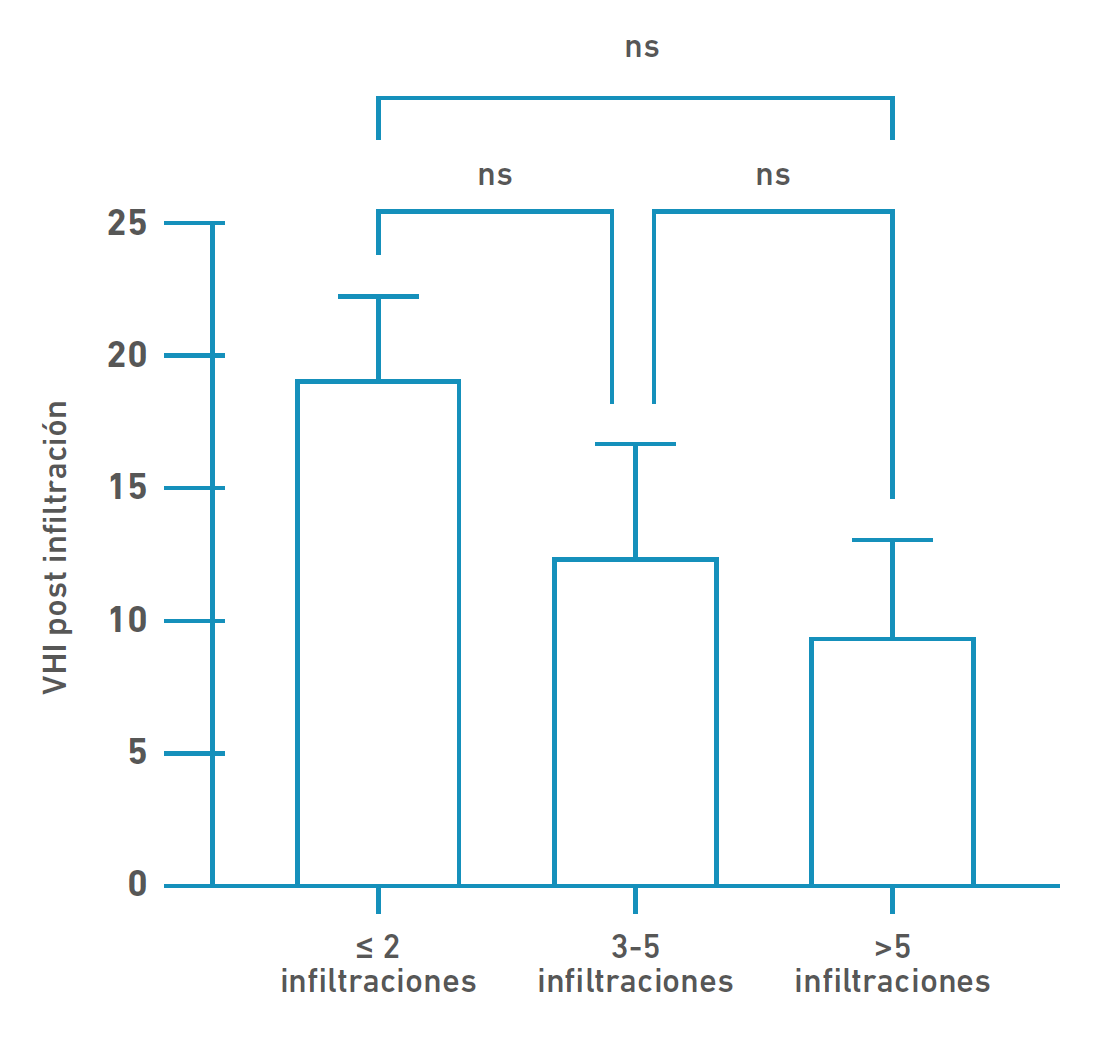
En la Figura 2 podemos observar que los pacientes que tuvieron mayor número de infiltraciones poseen una tendencia a un menor puntaje VHI-10; es decir, una relación inversa entre cantidad de infiltraciones por paciente e índice de discapacidad vocal. Sin embargo, este dato no fue estadísticamente significativo (p= 0,1604, Anova test).
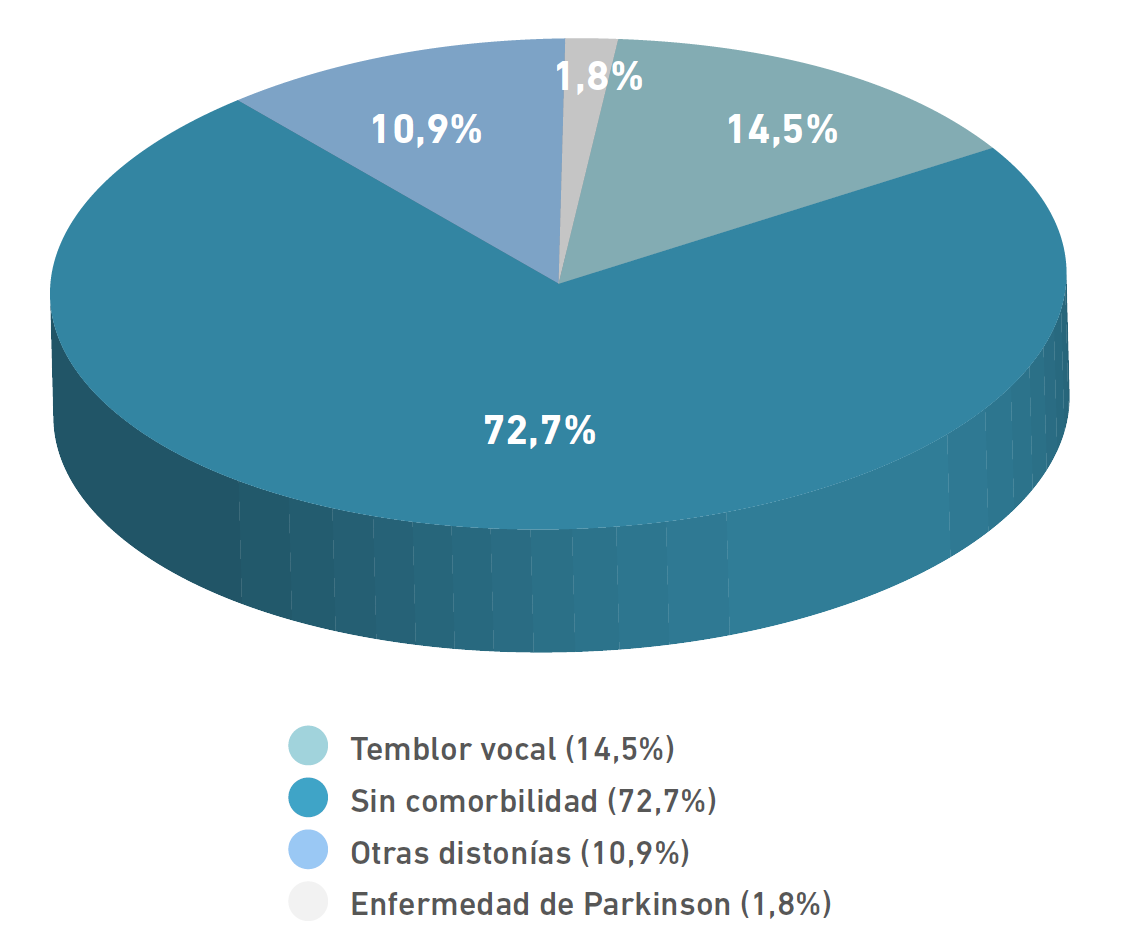
Como se mencionó previamente, es frecuente que los pacientes con distonía laríngea presenten alguna comorbilidad neurológica. En nuestra serie de casos, 15 de ellos tenía asociada alguna patología neurológica (27,27 %), 8 de ellos temblor vocal (14,5 %), 6 otras distonías (10,9 %) y 1 paciente con enfermedad de Parkinson (Figura 3).
De los 218 procedimientos, solo ocho de ellos tuvieron algún evento adverso (3,67 % de complicaciones), cuatro pacientes presentaron disfagia leve a moderada, tres pacientes con voz soplada de más de dos semanas de evolución y una paciente presentó una reacción cutánea alérgica al contacto con el látex de los guantes utilizados en el procedimiento.
Discusión
La disfonía espasmódica aductora es una enfermedad infrecuente, que afecta en gran medida la calidad de vida de los pacientes que padecen esta condición [10]. De acuerdo con las series más extensas publicadas en la literatura, afecta principalmente a mujeres en la edad media de la vida, consistente con nuestra casuística en que el 80 % corresponden a mujeres [14-17].
En ocasiones se puede observar asociado a otras comorbilidades neurológicas, entre ellas temblor vocal, en un 17.6-52.6 %, y otras distonías, en un 5.2-37.5 % [15,18-20]. Nuestra casuística está en consonancia con lo descrito en la literatura, reportando que un 14.5 % de nuestros pacientes tienen temblor vocal asociado y 10.9 % otras distonías, principalmente cervical y oromandibular.
La administración de toxina botulínica inyectada en el músculo tiroaritonoideo es el pilar del tratamiento de la disfonía espasmódica en la actualidad [16,17]. De acuerdo con una encuesta reciente, respondida por laringólogos americanos, la elección de la dosis inicial está basada en el balance de deseo y necesidades de los pacientes y de la fragilidad y el riesgo de aspiración. La gran mayoría de los expertos inicia con inyección bilateral, con un rango de 0,25 a 5 unidades [21], de las cuales aplican 1,25 unidades por lado.
Se ha determinado que la dosis de toxina botulínica alcanzada en la titulación sería mayor en pacientes con mayor índice de masa corporal y con mejor salud global, sin diferencias significativas respecto a la edad ni al género [21,22]. El factor socioeconómico si bien podría afectar el número y frecuencia de las inyecciones, no tendría relación con la dosis requerida [22]. Se ha reportado que, con las inyecciones seriadas, la dosis tendería a disminuir progresivamente [17,23].
En el HCUC, en general, se inicia con cuatro unidades, similar a otras experiencias reportadas [20,23], y se titula la dosis de acuerdo con la evolución de cada paciente. Existe una tendencia a aplicarse mayores dosis en hombres que en mujeres, lo que difiere con lo descrito en la mayoría de la literatura, lo que podría explicarse por una menor adherencia al tratamiento en los hombres, sugerido por el mayor intervalo entre dosis.
En una revisión sistemática y de metaanálisis reciente, se ha visto que tanto la inyección unilateral como bilateral se asocia a efectos significativamente positivos [10]. En el centro clínico de la Universidad de Chile, la mayoría de los pacientes han recibido inyección unilateral en el músculo tiroaritenoideo izquierdo, principalmente por motivos ergonómicos de quienes administran la inyección.
Al igual que en la mayoría de los lugares en donde se aplican inyecciones de toxina botulínica laríngea [24], en el HCUC se extraen múltiples dosis por vial para pacientes distintos, los que son citados en un único día. Según un análisis reciente, se ha estimado que el costo anual de pacientes con uso único del vial sería alrededor de USD 2050, lo que representa un 1118 % mayor al costo estimado en el uso de múltiples dosis de aproximadamente USD 168, lo que no comprometería ni la seguridad ni eficacia del tratamiento [25].
Existen distintos instrumentos para valorar el impacto en la calidad de vida de pacientes con patología de la voz. La primera encuesta en ser publicada, una de las más utilizadas en la actualidad, fue desarrollada por Jacobson et al. y corresponde al “Índice de Discapacidad Vocal” (VHI) [26]. La encuesta consta de treinta ítems y evalúa las consecuencias de los trastornos vocales relacionadas con las esferas emocionales, funcionales y físicas. Posteriormente, Rosen et al. publicaron una versión abreviada denominada VHI-10, que se ocupa únicamente de las diez preguntas más robustas de la encuesta original, cuya aplicación no mostró diferencias estadísticas respecto a la versión extendida y poseer una alta correlación independiente del diagnóstico, proponiéndose su uso debido a su rápida aplicabilidad [12]. Tanto el VHI como el VHI-10 cuentan con traducciones al castellano, habiéndose probado su uso por su validez y fiabilidad [13].
Particularmente, respecto al uso de encuestas de calidad de vida en la evaluación del tratamiento con toxina botulínica en pacientes con distonía laríngea, se ha reportado que el VHI, VHI-10 y la encuesta V-RQOL (por sus siglas en inglés Voice-Related Quality of Life) tienen una alta correlación y reflejan cambios significativos de la intervención, por lo que algunos autores sugieren que el médico realice la encuesta que prefiera [27]. Esto también ha sido observado en otro estudio donde VHI y VHI-10 parecieran tener sensibilidad similar en pacientes con disfonía espasmódica [28].
Los resultados obtenidos en el centro clínico del HCUC son consistentes con otros estudios que han utilizado la encuesta VHI-10 para evaluar los efectos de la inyección de toxina botulínica en pacientes con disfonía espasmódica aductora, variando desde un puntaje previo de 20,86-27,86 a un puntaje de 10,86-20,86 en plazos variables posteriores al procedimiento (Tabla 3) [27-31]. Sin embargo, es necesario complementar estos resultados aplicando el laboratorio de voz en estos pacientes.
Tabla 3 Estudios previos que utilizan VHI-10 para determinación pre y postratamiento
| Estudio | N | VHI-10 previo | VHI-10 posterior | p |
|---|---|---|---|---|
| Promedio [Desviación estándar] | Promedio [Desviación estándar] | |||
| Neumann et al, 2009 [28] | 12 | 24,42 [4,85] | 16,25 [5,23] | 0,019 |
| Novakovic et al, 2011 [29] | 133 | 22,3 | 12,7 | < 0,01 |
| Morzaria et al, 2012 [27] | 37 | 24,54 [7,19] | 15,64 [6,90] | < 0,05 |
| Aguayo et al, 2017 [31] | 14 | 27,86 [5,7] | 10,86 [2,2] | < 0,0001 |
| Yiu et al, 2021 [30] | 190 | 22,58 [7,09] | 20,86 [7,24] | 0,042 |
La inyección de toxina botulínica laríngea se ha asociado a efectos adversos transitorios que en general van de leves a moderados. Se ha reportado una voz soplada en hasta un 50,9 %, con un promedio de duración de 10 días, así como también disfagia a líquidos en hasta 14,2 %, con una duración promedio de 2 días [29]. Además, se ha descrito dolor local, prurito o equimosis relacionadas con la administración percutánea (<1 %) [14]. La administración bilateral podría producir un mejor perfil en la relación efecto y eventos adversos [32]. En los pacientes de este estudio se reportó una tasa de eventos adversos muy baja (3,67 %), siendo leves y transitorias.
Esta casuística corresponde a la mayor publicada en literatura hispanoamericana a la fecha.
Conclusión
La disfonía espasmódica aductora tiene un gran impacto en la calidad de vida de los pacientes que padecen problemas relacionados con la voz. A través de este estudio se demostró que la inyección laríngea de toxina botulínica A es segura y efectiva para el tratamiento de esta condición, lo que se refleja en una mejoría significativa en el VHI-10 posinfiltración de los pacientes. Los datos epidemiológicos de este trabajo no difieren en general con respecto a la literatura publicada. El cuestionario VHI-10 es una herramienta confiable, de fácil aplicación, que ha demostrado ser útil para el seguimiento de estos pacientes