Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.17 no.1 Bogotá Jan./Mar. 2010
ARTÍCULO DE REVISIÓN
New paradigm in spondyloarthritis: Lymphocytes Th-17
C. Romero-Sánchez1,2, J. De A2, J. Londoño1, A. Mora1, JM. Bello1,3, R. Valle-Oñate1
1 Grupo de Espondiloartropatías. Servicio de Reumatología. Hospital Militar Central/Universidad de La Sabana.
2 Instituto UIBO, Universidad El Bosque.
3 Universidad Militar Nueva Granada, Bogotá-Colombia.
Recibido: Diciembre 5 de 2009 Aceptado: Febrero 5 de 2010
Resumen
Las espondiloartritis son un grupo heterogéneo de enfermedades asociadas principalmente al complejo mayor de histocompatibilidad alelo HLA- B 27, y factores ambientales. La evidencia de esos desórdenes reflejan un origen autoinmune mediado por el sistema inmune adaptativo, en donde la composición de las lesiones inflamatorias está representada principalmente por macrófagos activados, linfocitos B y linfocitos T. El fenotipo y naturaleza de esas células T aún no están bien establecidos. Recientes estudios han demostrado que el clásico modelo de las células T CD4 efectoras Th-1/Th-2 en estas patologías debe ser reevaluado y darle espacio a las células Th-17 dentro de las patogenias inflamatorias articulares. Estudios preliminares dirigen la investigación hacia el eje IL-23/IL-17 en espondiloartropatías como una nueva propuesta. Considerar el bloqueo de las moléculas involucradas en esta vía podría ser interesante como nuevos blancos terapéuticos.
Palabras clave: linfocitos Th-17, IL-17, IL-23, espondiloartritis, artritis inducida, inflamación.
Abstract
Spondyloarthritides are a heterogeneous group of diseases which are mainly associated with HLA B 27 and environmental factors. The evidence for these disorders reflects an adaptive immune system-mediated autoimmune origin where inflammatory lesion composition is mainly represented by activated macrophages, B lymphocytes and T lymphocytes. These T-cells phenotype and nature has not been well established. Recent studies have shown that the classical CD4+ Th-1/Th-2 effector-cell model should be reevaluated and Th-17 cells should be introduced in inflammatory joint pathogenesis. Preliminary studies have directed research towards the IL-23/IL-17 axis in spondyloarthropathies as a new proposal. The intervention of the molecules involved in this pathway might be interesting as new therapeutic targets.
Key words: lymphocyte Th-17, IL-17, IL-23, spondyloarthritis, arthritis induced, inflammation.
1. Introducción
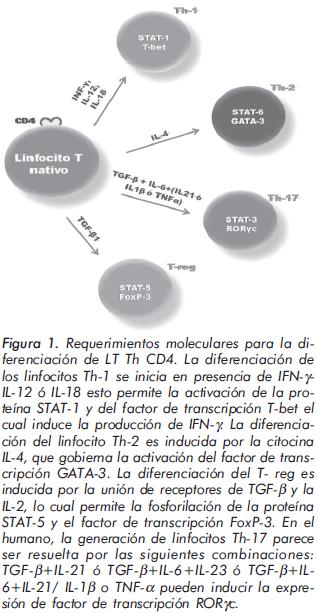
La diferenciación de las células T ayudadoras (Th) se inicia por una combinación de señales provenientes del receptor de la célula T (TCR), moléculas coestimuladoras, receptores de citocinas y factores de transcripción específicos. La diferenciación de los linfocitos T CD4 Th-1 comienza por la activación de las células T en presencia de la IL-12 o la IL-18 y el IFN-γ. Éste último permite la activación de la proteína citosólica STAT-1 y del factor de transcripción Tbet, el cual induce la producción de más IFN-γ y permite la expresión del receptor de la IL-12 (IL-12R) como respuesta a esta misma citocina. La alta producción de IFN-γ es indispensable para la eliminación de patógenos intracelulares; sin embargo, el desequilibrio en su producción se relaciona con el desarrollo de enfermedad autoinmune órgano específica1.
La diferenciación del linfocito Th-2 es inducida por la citocina IL-4, quien gobierna la activación del factor de transcripción GATA-3, lo cual conduce al aumento en la expresión de su receptor (IL-4R). Este proceso permite la fosforilación de la proteína STAT-6, proteína que potencia al promotor de la IL-4 generando aumento de su expresión y estableciendo así un circuito positivo para incrementar y mantener la diferenciación de las células Th-21. Estas células son claves en la respuesta del huésped a microorganismos extracelulares y en la producción de anticuerpos.
Una tercera subpoblación de linfocitos T CD4 corresponde al perfil T-reg, linfocitos T CD4 que poseen propiedades antiinflamatorias, caracterizados por una alta expresión de la molécula CD25 y el factor de transcripción FoxP-3. Su diferenciación es inducida por la unión de receptores de TGF-β (TGF-βR) y la IL-2 (IL-2R) a sus correspondientes citocinas. Esta subpoblación ejerce un mecanismo de regulación que mantiene la estabilidad y la supervivencia de los linfocitos T en periferia2,3.
Recientemente, el paradigma Th-1/Th-2 se ha ampliado con el descubrimiento de una nueva subclase de células T efectoras cuya citocina representativa es la IL-17, lo cual ha generado su denominación "Th-17''. La función primaria de las células Th-17 es la eliminación de patógenos como parásitos extracelulares y hongos que no han sido adecuadamente manejados por linfocitos Th-1 o Th-24. Las células Th-17 han sido señaladas como potentes inductoras de la inflamación asociadas a varias enfermedades autoinmunes experimentales y condiciones inflamatorias como encefalitis autoinmune experimental (EAE), esclerosis múltiple (EM), artritis reumatoide (AR), psoriasis, enfermedad de Chron y artritis inflamatorias4-6.
Las espondiloartropatías son una de las formas de artritis en la cual los niveles de IL17 y citocinas de este perfil están aumentados; hallazgos de polimorfismos de algunas de ellas se han relacionado como factores asociados al desarrollo y susceptibilidad en estas entidades. De manera general, aunque no ha sido fácil determinar con exactitud las concentraciones de citocinas en EAS, con base en los principales hallazgos encontrados la principal propuesta plantea una reducción de los niveles de citocinas Th1 en sangre periférica y un aumento principalmente de IL-10; además, se propone una pérdida de la regulación sistémica de la respuesta inmune en estos pacientes. Teniendo en cuenta la participación actual de los linfocitos Th17 en otras entidades inflamatorias de origen autoinmunes descritas y la relación propuesta entre las citocinas pertenecientes al perfil Th1 y Th 17 en EAS, el propósito de esta revisión es enterar al lector de recientes avances en el desarrollo y función de las células Th-17 y su nuevo aporte dentro de la patogenia actual de las espondiloartritis.
2. Metodología
Se realizó una revisión avanzada de literatura en la base de datos biomedical Pubmed del Centro Nacional para Información Biotecnológica (NCBI) de los Estados Unidos, utilizando los siguientes descriptores en ciencias de la salud: Th17[All Fields] AND ("spondylarthritis"[MeSH Terms] OR "spondylarthritis"[All Fields] OR "spondyloarthritis"[All Fields]) OR spondyloarthropathies[ All Fields] OR ("spondylitis"[MeSH Terms] OR "reactive arthritis"[All Fields] OR "experimental arthritis "[All Fields]) OR arthritis [All Fields]. Todas las referencias que cumplieron con los criterios de búsqueda limitada por tópicos, idioma inglés, tipo de artículo review, sin límite por género y edad fueron tenidas en cuenta para la obtención de los artículos en texto completo formato PDF. Se consultaron las casas editoriales de procedencia de los mismos, a saber, Springler, Blackwell Publishing, Elsevier, además de las bases de datos científicas de revistas indexadas: ScienceDirect y Embase. Se realizó una revisión exploratoria/narrativa de la literatura recopilada.
3. Estructura del perfil Th-17
Desde hace cinco años surge gran cantidad de información sobre la subpoblación Th-17, citocinas relacionadas, receptores y sus efectos4. En el 2006 tres estudios encontraron que la combinación de TGF-β y la citocina pleiotrópica IL-6, es necesaria para inducir la producción de IL-17 sobre células T nativas7-9. Además, las combinaciones de IL-6 o TGF-β más IL-21, de IL-1β más IL-6, o de IL-1β más IL-23, se han propuesto como factores inductores de Th-17 en humanos. Las células Th-17 expresan un único factor de transcripción, el RORγt en ratones cuyo análogo en humanos es el RORγc10. Éste último induce la transcripción del gen de la IL-17 en células T nativas, e induce, además, la expresión del receptor de la IL-23 (IL-23R), indicando que ésta última actúa en este linaje estabilizándolo. Otra citocina involucrada en la inducción de los linfocitos Th- 17 es la IL-21, encargada de la amplificación y la expansión de manera autocrina4,11-13. La coexpresión de receptores para quimiocinas como son las proteínas CCR-4 y CCR-6, son fuertes candidatos para definir a las células Th-1715. Algunas células T de memoria producen IFN-γ (relacionada con el perfil Th-1) e IL-17 (relacionada con el perfil Th-17) simultáneamente, expresando CXCR-3, CCR-4 y CCR-6, receptores que determinan el destino final de esta población celular a los tejidos15, 16. (Figuras 1 y 2).
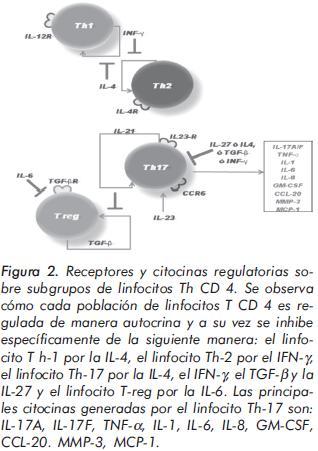
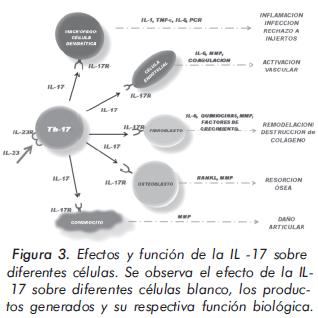
Algunos productos relacionados con las células Th-17 como la IL-17A, IL-17F, IL-6, IL-8, CXCL- 1, CXCL-10, TNF-α, IL-1β, GM-CSF, MMP, entre otras, tienen importantes y diversos efectos sobre células tales como monocitos/macrófagos, células dendríticas, células endoteliales, osteoblastos, fibroblastos, condrocitos, entre otras. Uno de los principales efectos biológicos de estas citocinas es el reclutamiento de diversos tipos celulares en sitios de inflamación15. (Figura 3). En los ganglios linfáticos y en el tejido inflamado, se han descrito células semejantes a los plasmocitos pero productores de IL-17, lo cual sugiere que las células Th-17 adquieren un morfotipo particular en el tejido implicado12,17.
4. Modelos experimentales de células Th- 17 en Artritis
Los antecedentes del eje IL-23/IL-17 inician utilizando modelos murinos de artritis inducida, los cuales previamente se consideraban mediados por una respuesta Th-1 poco controlada. Hoy en día surge un nuevo planteamiento con la intervención de estas nuevas citocinas, siendo el soporte de las futuras investigaciones. El descubrimiento del perfil Th-17, conllevó a continuar con la investigación en artritis reumatoide, hasta finalmente conducir a describir el comportamiento y asociación de estas citocinas en espondiloartropatías.
Estudios recientes han demostrado que las células T CD4 productoras de IL-17 representan un linaje pro inflamatorio diferente en varios modelos experimentales. La evidencia sugiere que en AR y EM consideradas enfermedades autoinmunes inflamatorias, se acumulan células del perfil Th-17, lo cual indica que los productos generados por estas células, podrían ser blancos terapéuticos importantes18.
La IL-23 se describe como una citocina relacionada con los linfocitos Th-17; es un heterodímero compuesto de una subunidad p19 y otra p40, ésta última proteína la comparte con la IL- 12. La IL-23 actúa sobre los linfocitos T de memoria Th-17 y sobre los macrófagos en procesos de inflamación a través de la unión de ésta con su receptor. Análisis han demostrado que la ausencia de la IL-23 es protectora, mientras que la pérdida de la IL-12 exacerba la artritis inducida por colágeno19. En ratones con supresión de IL- 23, se encontró que no desarrollan signos clínicos de artritis y son completamente resistentes a desarrollar patología articular u ósea, lo cual se asocia a la carencia de células T CD 4 productoras de IL-1719.
Otro modelo que se ha relacionado con el perfil Th-17, está basado en la inducción de inflamación articular específica en ratones de la cepa K/BxN en los cuales existe reactividad autoinmune contra una enzima citoplasmática, la "glucosa 6 fosfato isomerasa" (GPI). En este estudio se detectaron niveles elevados de IL-6 e IL-17 y se concluyó que estas citocinas juegan un papel esencial en la inducción de este tipo de artritis, hallazgos que se relacionan con autoantígenos involucrados en la generación de AR en humanos, demostrándose, además, que tratamientos con anticuerpos contra el receptor de IL- 6 (IL-6R), pueden ser excelentes en la supresión de este eje de citocinas20.
Se ha logrado detectar en otro modelo murino la generación de células Th-17 en sitios de inflamación y el drenaje a los ganglios linfáticos, estudio que sugirió que la diferenciación de estas células es iniciada en los ganglios y la producción en sí de la IL-17 está restringida a la sinovia inflamada, generada en respuesta a citocinas locales producidas por los macrófagos21.
Niveles elevados de IL-17 reflejan una respuesta poco regulada de los linfocitos Th-17, lo cual ha sido asociado con procesos de inflamación crónica y varias condiciones inflamatorias severas como la AR y la enfermedad periodontal. En pacientes con AR se han detectado niveles de IL- 17 e IL-23 p19 en suero, líquido sinovial y biopsias de tejido sinovial, mientras que están ausentes en osteoartrosis22-24. En modelos in vitro en cultivos de fibroblastos y sinoviocitos de pacientes con AR, se ha demostrado la expresión de receptores para IL-17 (IL-17R) y se observa que el estímulo con IL-17 en estas células, induce la producción de marcadores inflamatorios como IL-6, IL-1, TNF-α, IL-8, MMP y factores del endotelio vascular26-28, vía NF-kB y PI3-K/Akt25, a través de estos factores pro inflamatorios se puede generar la degradación de matriz celular y la reabsorción ósea29.
Se propone que la IL-17 estimula al osteoblasto a expresar el ligando receptor del factor activador kB (RANK-L), y esto a su vez activa a los osteoclastos, resultando en el aumento de la expresión de la proteína RANK, lográndose la unión de esta proteína con su respectivo receptor, evento requerido para la pérdida de matriz ósea, lo que indica el posible papel de la IL-17 en dichos procesos. Sato, et al., en 2007 describieron que el IFN-γ inhibe fuertemente la osteoclastogénesis y la IL-17 la promueve, situación que pone en duda las hipótesis anteriores en donde se asociaba a la AR con el perfil Th-130. Un estudio prospectivo a dos años, con base en resultados sobre RNAm a partir de biopsias de pacientes con AR concluyó que la IL-17, la IL-1β, el TNF-α y la IL-10 pueden tener una función en la AR y pueden ser utilizados como factores predictivos de destrucción articular, ya que su presencia se relacionó con menor tiempo de evolución de la enfermedad31, dándole gran valor a la participación de las células Th-17 en su patogénesis32. Además, en modelos ex vivo de células mononucleares provenientes de membrana sinovial o de líquido sinovial de pacientes con AR, estimuladas con acetato forbol miristato y con ionomicina, se de demostró marcaje positivo para IL-17 en células con fenotipo CD45RO+/CD4+ sin correlacionarse con el índice de actividad30.
Se consideró importante definir fenotípicamente las células T CD4 Th-17, para esto se investigaron algunas de las principales moléculas de superficie, que son específicamente expresadas sobre ellas y su posible función en la migración hacia el tejido inflamado en AR. Se ha demostrado que las células Th-17 son positivas para la molécula CCR-6, la cual es una proteína considerada como receptor de citocinas quimioatractantes, propuesta como reguladora en la migración y reclutamiento en procesos inflamatorios; además, las células Th-17 producen su ligando, la citocina quimiotáctica CCL-20, proceso que facilita la migración de los linfocitos Th- 17 hacía el tejido articular. Además, en este estudio se confirmó la importancia de esta proteína CCR-6 al encontrar que el principal factor de transcripción RORγt de la IL-17 en ratones, no solamente induce el gen de la IL-17, sino también el de CCR6. Luego, el CCR6 es un marcador importante que contribuye al desplazamiento particular de este linaje celular en procesos articulares16,33.
5. Th-17 y espondiloartritis
Los resultados encontrados en AR condujeron a investigar este perfil en EAS, dado que tanto la AR como las EAS son enfermedades inflamatorias sistémicas de origen desconocido que afectan las articulaciones. Su patogénesis aún no está bien entendida; mientras algunas vías de destrucción articular son comunes como lo han demostrado los tratamientos con anti TNF-α, otras no lo son. La AR y las EAS son entidades distintas que pueden ser diferenciadas por sus características clínicas, radiológicas y serológicas. La composición de las lesiones inflamatorias varía, pero en ambas entidades es consistente la presencia de macrófagos, de linfocitos B y T activados, células que secretan una variedad de citocinas proinflamatorias y regulatorias. Varios análisis han demostrado y han permitido plantear que la relación de citocinas regulatorias o inmunosupresoras asociadas inicialmente al perfil Th-2 como son la IL-4 y la IL-10, se encuentran en niveles mayores que los de citocinas proinflamatorias como TNF alfa e IFN gamma, los cuales se han detectado disminuidos en pacientes con EAS y aún más en individuos HLA-B27, posiblemente regulados por la IL-10 aumentada sugiriendo un imbalance de la respuesta Th-1 y generando una falla en la respuesta inmune. Pero en realidad, la naturaleza y fenotipo de las células comprometidas no están bien definidos. Por eso nueva información sobre citocinas, modelos animales y estudios de asociación con el genoma, sugieren mecanismos que pueden incluir el eje IL-23/IL-17 en la generación de estas dos patologías y modificar el paradigma hasta ahora conocido15.
Independiente del subtipo de EAS, la principal manifestación clínica es el dolor espinal inflamatorio, seguido de la artritis periférica, entesitis y uveítis anterior. Se han reconocido cinco tipos de EAS sobre la base de los criterios diagnósticos propuestos por el Grupo Europeo de Espondiloartropatías: 1. Espondilitis anquilosante (EA), 2. Artritis psoriásica (APs), 3. Artritis reactiva (ARe), 4. Artritis asociada a enfermedad inflamatoria intestinal y 5. Las espondiloartritis indiferenciadas (EASI); entidades en las cuales se han empezado a obtener resultados significativos en estudios de este nuevo eje IL-23/IL-1734.
Hasta el año 2007, los hallazgos de mediciones de citocinas en el líquido sinovial de pacientes con EAS eran limitados. Singh, et al.,5 evaluaron en 51 pacientes con ARe/EASI, mediante técnica de ELISA, la concentración de IL-17, IL-6, IFN-γ, IL- 12p40, IL-10, TGF-β, citocinas con características pro-inflamatorias e inmunorreguladoras. Los resultados demostraron niveles elevados de IL-17, IL-6, TGF-β e IFN-γ en EAS comparados con aquellos mostrados en AR. Se propuso que los niveles de IFN-γ podrían estar regulando la inflamación generada por las células Th-17. Estos resultados también sugirieron que las células Th-1 y Th-17 podrían ser consideradas principales agentes en la inflamación de estas entidades, haciendo énfasis en la necesidad de estudiar el perfil Th-17 en tejido sinovial de estos pacientes5. Un segundo estudio en el 2007, encuentra nuevamente niveles elevados de IL-17 en el suero de 28 pacientes con EA activa, comparado con controles sanos35. Dentro de esos resultados llamó la atención la disminución en marcadores de formación ósea e incremento en los de reabsorción, lo cual hoy en día se podría explicar dada la relación del perfil Th-17 con la inducción de osteoclastos descrita previamente5,31.
Con base en los resultados de evaluación del perfil Th-17 en otras patologías articulares inflamatorias y considerando en ese momento que la IL-23 era uno de los principales inductores de la polarización de las células nativas T CD4 hacia este perfil Th-17, surgió la inquietud de evaluar de forma simultánea en el suero y en el líquido sinovial de pacientes con EAS, la subunidad p40 compartida por las IL-12 y la IL-23, dada su relación con el perfil Th-1 para la primera y Th-17 para la segunda6. Además del interés por la rápida evolución de los tratamientos anti TNF-α; se evaluaron simultáneamente BASDAI, VSG, PCR (proteína C reactiva), IL-17 y MMP-3. Los pacientes fueron evaluados en el momento inicial y a las 10 semanas pos terapia anti TNF-α; No presentaron cambios significativos en los niveles antes y después del tratamiento. Las diferencias no fueron estadísticamente significativas entre pacientes y controles, ni entre el compromiso axial y periférico. Los niveles fueron mayores en pacientes HLA-B27 negativo y, no hubo correlación con ninguna de las otras variables, concluyéndose que estos marcadores no son de ayuda biológica en la medición de actividad de los pacientes con EAS6.
Posteriormente se estudió en una cohorte de 51 pacientes, 22 con APs, 6 con EA, 22 con EASI, y 2 con ARe comparadas con 22 con AR36. Se analizaron muestras pareadas de suero, líquido y biopsias sinoviales, y se midieron los niveles de IL-17, IL-23 y CCL-20 por ELISA, para correlacionarlos con marcadores clínicos de actividad de la enfermedad. Se encontraron niveles mayores de IL-17 en el líquido sinovial de los pacientes con EAS comparados, con APs y AR. Los resultados para la IL-23 fueron similares. La concentración de CCL-20 fue mayor en AR y sus concentraciones más altas en el fluido sinovial que en el suero. En pacientes con AR se evidenció más producción de IL-23 en suero, en correlación directa con el nivel de actividad de la enfermedad36. Estos hallazgos confirman la expresión de citocinas del perfil Th-17 en articulaciones de EAS así como en AR y una regulación diferencial para la IL-23 entre estas dos patologías36.
También se han detectado niveles elevados de IL-17 en el líquido sinovial en artritis relacionada con entesitis (ERA), que es una forma de EAS en niños y en la artritis idiopática juvenil (AIJ) comparados con AR y OA37. Los niveles fueron similares en las patologías de los niños, y la concentración fue mayor en el líquido sinovial frente a los niveles en suero. Se correlacionaron con el número de articulaciones inflamadas, con el número de articulaciones con movimiento limitado y no hubo correlación con la VSG. Este estudio analizó, además, la producción de IL-6, IL-8, MMP-1, MMP-3 y TIMP en sobrenadantes de cultivos de fibroblastos derivados de fluido sinovial de estos pacientes estimulados con IL- 17 y TNF-α. Los resultados sugieren que los niveles de IL-17 en ERA se correlacionan con la actividad de la enfermedad, posiblemente debido a la producción de MMP inducidas por los fibroblastos de manera local37.
En una segunda etapa de estudio en estos pacientes, se investigaron mediante el uso de citometría de flujo, los niveles de IL-1β, IL-6, IL- 21, IL-23 y TGF-β para determinar los fenotipos Th-1, Th-2, Th-17 y T- reg comparándolos con controles sanos a partir de la sangre periférica y del líquido sinovial. No se encontraron diferencias entre los fenotipos en sangre entre pacientes y controles. La concentración de células CD4+/ IL-17+ fue más alta en el líquido sinovial comparado con la sangre periférica. La concentración de células Th-1 y Th-17 fue mayor que la de Th- 2 en el fluido sinovial, concluyéndose que las concentraciones de IL-1β y de IL-6 pueden ser las responsables del aumento de las células Th-17 en tejido sinovial38.
Dentro de la población de células periféricas Th-17, se han descrito algunas denominadas polifuncionales, por su capacidad de producir simultáneamente citocinas de diferentes perfiles como IL-17 e IL-2 ó IL-17 con TNF-α esta expresión simultánea fue considerada con capacidad de representar células patogénicas en pacientes con EAS y APs, y de ser, además, células de memoria en estadios avanzados de diferenciación y expansión33,39.
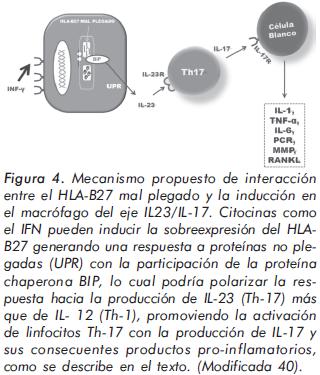
Se ha encontrado previamente una disminución en la concentración del IFN-γ en individuos con EAS, y ahora se propone la capacidad del IFN-γ de controlar el desarrollo de las células Th- 1740. Esta propuesta genera una hipótesis sobre el papel protector de esta citocina; es decir, que la disminución del IFN-γ puede presentarse en individuos susceptibles al desarrollo de EAS. Sin embargo, también se ha sugerido una idea según la cual el efecto del IFN-γ actúa generando un estímulo que puede inducir sobre-expresión de la molécula de HLA clase I, en especial el HLAB27, como consecuencia de la alteración a nivel del plegamiento de proteínas, en este caso particular, del HLA-B27 en el retículo endoplasmático. Este estímulo promueve una respuesta inmune alterada e incrementa la producción de ciertas citocinas involucradas con el perfil Th-17. Datos preliminares sugieren que la IL-23 puede ser una de las consecuencias de esta vía, la cual mantendría la expansión crónica de este linaje Th-17, dada la función planteada de esta citocina41,40. (Figura 4).
6. Conclusión
Estudios recientes demuestran que el modelo clásico de las células T CD4 efectoras Th-1/Th-2 debe ser reinterpretado, dándole espacio a las células Th-17 dentro de las patogenias inflamatorias articulares como las EAS. Hasta el momento, la evidencia permite considerar a los linfocitos Th-17 como células altamente diferenciadas, que expresan las moléculas de superficie CD4+/CD45RO+/ CCR-6+, receptores involucrados en su migración hacia el tejido sinovial generando reacciones inmunes autodestructivas locales, especialmente en articulación, permitiendo el desarrollo de artritis. Una vez en el sitio de la inflamación los sinoviocitos pueden reclutar más linfocitos Th-17 a través de la producción de la quimiocina CCL-20, con lo cual se incrementa la producción de citocinas pro inflamatorias como IL-17, IL-1, IL-6, TNF-α, MMP, entre otras. La disminución encontrada por muchos estudios del IFN-γ y del TNF-α propone una alteración en la regulación del perfil Th1/Th2 en EAS, las cuales pueden estar genéticamente determinadas. Sin embargo, los resultados hoy permiten generar una nueva relación interesante planteada entre el IFN-γ y la IL-17. El IFN-γ demostró que puede controlar la producción de la IL-17 y a su vez disminuir el perfil proinflamatorio, pero desafortunadamente los niveles en pacientes con EAS se encuentran disminuidos, lo que predispone al desarrollo del perfil Th-17, facilitando el proceso inflamatorio poco controlado. La segunda posibilidad de la intervención del IFN-γ es su contribución al inducir alteración en el plegamiento de proteínas y, como consecuencia, incrementar citocinas como la IL-23, la cual mantendría la expansión crónica de estos clones.
Aunque los resultados son limitados hasta ahora, indicios tempranos dirigen la investigación hacia el eje IL-23/IL-17 en EAS como nueva propuesta. Futuras investigaciones sobre la disregulación descrita en estos pacientes pueden aclarar su función y la participación en su patogénesis, lo cual podría generar nuevos blancos terapéuticos.
Agradecimientos
Al Dr. Gersaín Rodríguez, coordinador del departamento de publicaciones de la Universidad de La Sabana, por la revisión del documento.
Al Sr. Jason Garry, por su aporte en la revisión y corrección del inglés.
Abreviaturas
AIJ: artritis idiopática juvenil - APs: artritis psoriásica - AR: artritis reumatoide - ARe: artritis reactiva - BASDAI: Bath Ankylosing Spondylitis activity Index - CCL-20: chemokine (C-C motif) ligand 20- ligando de quimiocina 20 motivo C-C - CCR 6: chemokine receptor 6 - EA: espondilitis anquilosante - EAE: encefalitis autoinmune experimental - EAS: espondiloartropatías o espondiloartritis - EASI: espondiloartropatías indiferenciadas - EM: esclerosis múltiple - ERA: artritis relacionada con entesitis - GATA-3: enhancer binding protein 3- proteína de unión a amplificador 3 - GM-CSF: granulocyte-macrophage colony-stimulating factor-factor estimulante de colonias granulociro-monocito - GPI: glucosa 6 fosfato isomerasa - IL: interleucina - IL-X-R: receptor de interleucina - IFNg: interferón gama - IFNg-R: receptor de IFNg - MCP-1: Monocyte chemotactic protein-1- proteína quinioatractante del monocito 1 - MMP-3: matrix metallopeptidase 3-metaloproteinasa de matriz 3 - PCR: proteína C reactiva - RANK: Receptor Activator for Nuclear Factor k B - receptor activador del factor nuclear kb - RANK-L: Receptor Activator for Nuclear Factor kB Ligand- ligando del receptor activador del factor nuclear kb - RORγc: RAR-related orphan receptor C -receptor huérfano relacionado con RAR - STAT-1-6: Signal transducers and activator of transcription protein 1-6 - proteína activadora de transcripción y transductora de señal -1-6 - T-bet: T-box family of transcription factorsfactor de transcripción de la familia de la caja T. - TCR: T cell receptor -receptor de la célula T - TGF-β: Transforming growth factor beta- Factor transformante de crecimiento b - Th-: Linfocito T helper - TIMP: inhibidor tisular de metaloproteinasa - TNF-α: Tumor necrosis factor alpha- factor de necrosis tumoral alfa - T-reg: linfocitos t reguladores - UPR: Unfolded protein response, repuesta a proteínas mal plegadas - VSG: velocidad de sedimentación globular.
Referencias
1. Dardalhon V, Korn T, Kuchroo VK, Anderson AC. Role of Th1 and Th17 cells in organ-specific autoimmunity. J Autoimmun 2008;31:252-256. [ Links ]
2. Essakalli M, Brick C, Bennani N, Benseffaj N, Ouadghiri S, Atouf O. The latest TH17 lymphocyte in the family of T CD4+ lymphocytes. Pathol Biol 2009 Mar 17. [Epub ahead of print] [ Links ]
3. Annunziato F, Cosmi L, Santarlasci V, Maggi L, Liotta F, Mazzinghi B, et al. Phenotypic and functional features of human Th17 cells. J Exp Med 2007; 204:1849-1861. [ Links ]
4. Korn T, Bettelli E, Oukka M, Kuchroo VK. IL-17 and Th17 Cells. Annu Rev Immunol 2009;27:485-517. [ Links ]
5. Singh R, Aggarwal A, Misra R. Th1/Th17 cytokine profiles in patients with reactive arthritis/undifferentiated spondyloarthropathy. J Rheumatol 2007;34:2285-2290. [ Links ]
6. Wendling D, Cedoz JP, and Racadot E. Serum and synovial fluid levels of p40 IL12/23 in spondyloarthropathy patients. Clin Rheumatol 2009;28:187- 190. [ Links ]
7. Veldhoen M, Hocking RJ, Atkins CJ, Locksley RM, and Stockinger B. TGFbeta in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-Producing T Cells. Immunity 2006;24:179-189. [ Links ]
8. Wynn TA. T(H)-17: a giant step from T(H)1 and T(H)2. Nat Immunol 2005;6(11):1069-1070. [ Links ]
9. Mangan PR, Harrington LE, O'Quinn DB, Helms WS, Bullard DC, Elson CO, et al. Transforming growth factor-beta induces development of the TH17 lineage. Nature 2006;441:231-234. [ Links ]
10. Ivanov II, McKenzie BS, Zhou L, Tadokoro CE, Lepelley A, Lafaille JJ, et al. The Orphan Nuclear Receptor RORgammat directs the differentiation program of proinflammatory IL-17+ T helper Cells. Cells 2006;126:1121-1133. [ Links ]
11. Wei L, Laurence A, Elias KM, and O'Shea JJ. IL-21 is produced by TH17 cells and drives IL-17 production in a STAT3-dependent manner. J Biol Chem 2007;282:34605-34610. [ Links ]
12. Miosecc P, Korn T, Kuchroo VK. Interleukin-17 and type 17 helper T cells. N Engl J Med 2009;361:888- 898. [ Links ]
13. Korn T, Bettelli E, Gao W, Awasthi A, Jäger A, Strom TB, et al. IL-21 initiates an alternative pathway to induce proinflammatory T(H)17 cells. Nature 2007;448:484-487. [ Links ]
14. Deenick EK, Tangye SG. IL-21: a new player in Th17- cell differentiation. Immunol Cell Biol 2007;85:503- 505. [ Links ]
15. Layh-Schmitt G, Colbert RA. The interleukin-23/ interleukin-17 axis in spondyloarthritis. Curr Opin Rheumatol 2008;20:392-397. [ Links ]
16. Hirota K, Yoshitomi H, Hashimoto M, Maeda S, Teradaira S, Sugimoto N, et al. Preferential recruitment of CCR6-expressing Th17 cells to inflamed joints via CCL20 in rheumatoid arthritis and its animal model. J Exp Med. 2007;204:2803-2812. [ Links ]
17. Page G, Sattler A, Kersten S, Thiel A, Radbruch A, Miossec P. Plasma cell -like morphology of Th1- cytokine-producing cells associated with the loss of CD3 expression. Am J Pathol 2004;164:409-417. [ Links ]
18. Furuzawa-Carballeda J, Vargas-Rojas MI, Cabral AR. Autoimmune inflammation from the Th17 perspective. Autoimmun Rev 2007;6:169-175. [ Links ]
19. Murphy CA, Langrish CL, Chen Y., Blumenschein W, McClanahan T, Kastelein RA, et al. Divergent proand antiinflammatory roles for IL-23 and IL-12 in joint autoimmune inflammation. J Exp Med 2003; 198:1951-1957. [ Links ]
20. Iwanami K, Matsumoto I, Tanaka-Watanabe Y, Inoue A, Mihara M, Ohsugi Y, et al. Crucial role of the interleukin-6/interleukin-17 cytokine axis in the induction of arthritis by glucose-6-phosphate isomerase. Arthritis Rheum 2008;58:754-763. [ Links ]
21. Egan PJ, van Nieuwenhuijze A, Campbell IK, and Wicks IP. Promotion of the local differentiation of murine Th17 cells by synovial macrophages during acute inflammatory arthritis. Arthritis Rheum 2008;58:3720-3729. [ Links ]
22. Chen W, Jin W, Hardegen N, Lei KJ, Li L, Marinos N, et al. Conversion of peripheral CD4+CD25- naive T cells to CD4+CD25+ regulatory T cells by TGF-ß induction of transcription factor Foxp3. J Exp Med 2003;198:1875-1886. [ Links ]
23. Betteli E, Carrier Y, Gao W, Korn T, Strom TB, Oukka M, et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature 2006;441:235-238. [ Links ]
24. Sutton C, Brereton C, Keogh B, Mills KH, Lavelle EC. A crucial role for interleukin (IL)-1 in the induction of IL-17-producing T cells that mediate autoimmune encephalomyelitis. J Exp Med 2006;203:1685-1691. [ Links ]
25. Hwang SY, Kim JY, Kim KW, Park MK, Moon Y, Kim WU, et al. IL-17 induces production of IL-6 and IL-8 in rheumatoid arthritis synovial fibroblasts via NF-kappaB- and PI3-kinase/Akt-dependent pathways. Arthritis Res Ther 2004;6:120-128. [ Links ]
26. Park H, Li Z, Yang XO, Chang SH, Nurieva R, Wang YH, et al. A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17. Nat Immunol 2005;6:1133-1141. [ Links ]
27. Fossiez F, Djossou O, Chomarat P, Flores-Romo L, Ait-Yahia S, Maat C, et al. T cell interleukin-17 induces stromal cells to produce proinflammatory and hematopoietic cytokines. J Exp Med 1996;183:2593- 2603. [ Links ]
28. Yao Z, Fanslow WC, Seldin MF, Rousseau AM, Painter SL, Comeau MR, et al. Herpes virus Saimiri encodes a new cytokine, IL-17, which binds to a novel cytokine receptor. Immunity 1995;3:811-821. [ Links ]
29. Chabaud M, Lubberts E, Joosten L, van Den Berg W, Miossec P. IL-17 derived from juxta-articular bone and synovium contributes to joint degradation in rheumatoid arthritis. Arthritis Res 2001;3:168-177. [ Links ]
30. Sato K. Th17 cells and rheumatoid arthritis from the standpoint of osteoclast differentiation. Allergol Int 2008;57:109-114. [ Links ]
31. Kirkham BW, Lassere MN, Edmonds JP, Juhasz KM, Bird PA, Lee CS, et al. Synovial membrane cytokine expression is predictive of joint damage progression in rheumatoid arthritis: a two-year prospective study (the DAMAGE study cohort). Arthritis Rheum 2006;54:1122-1131. [ Links ]
32. Bush KA, Walker JS, Lee CS and Kirkham BW. Cytokine expression and synovial pathology in the initiation and spontaneous resolution phases of adjuvant arthritis: Interleukin-17 expression is upregulated in early disease. Clin Exp Immunol 2001;123:487-495. [ Links ]
33. Yamada H, Nakashima Y, Okazaki K, Mawatari T, Fukushi JI, Kaibara N, et al. Th1 but not Th17 cells predominate in the joints of patients with rheumatoid arthritis. Ann Rheum Dis 2008;67:1299-1304. [ Links ]
34. Zochling J, Brandt J and Braun J. The current concept of spondyloarthritis with special emphasis on undifferentiated spondyloarthritis. Rheumatology 2005;44:1483-1491. [ Links ]
35. Wendling D, Cedoz JP, Racadot E and Dumoulin G. Serum IL-17, BMP-7, and bone turnover markers in patients with ankylosing spondylitis. Joint Bone Spine 2007;74:304-305. [ Links ]
36. Melis L, Vandooren B, Kruithof E, Jacques P, De Vos M, Mielants H, et al. Systemic levels of IL-23 are strongly associated with disease activity in rheumatoid arthritis but not spondyloarthritis. Ann Rheum Dis 2009;5. [Epub ahead of print] [ Links ]
37. Agarwal S, Misra R, Aggarwal A. Interleukin 17 levels are increased in juvenile idiopathic arthritis synovial fluid and induce synovial fibroblasts to produce proinflammatory cytokines and matrix metalloproteinases. J Rheumatol 2008;35:515-519. [ Links ]
38. Mahendra A, Misra R, Aggarwal A. Th1 and Th17 Predominance in the Enthesitis- related Arthritis Form of Juvenile Idiopathic Arthritis. J Rheumatol 2009;36:1730-1736. [ Links ]
39. Jandus C, Bioley G, Rivals JP, Dudler J, Speiser D, and Romero P. Increased numbers of circulating polyfunctional Th17 memory cells in patients with seronegative spondylarthritides. Arthritis Rheum 2008;58:2307-2317. [ Links ]
40. Shen H, Goodall JC, and Hill Gaston JS. Frequency and phenotype of peripheral blood Th17 cells in ankylosing spondylitis and rheumatoid arthritis. Arthritis Rheum 2009;60:1647-1656. [ Links ]
41. DeLay ML, Turner MJ, Klenk EI, Smith JA, Sowders DP, Colbert RA. HLA-B27 misfolding and the unfolded protein response augment interleukin-23 production and are associated with Th17 activation in transgenic rats. Arthritis Rheum. 2009;60:2633-2643. [ Links ]














