Introducción
La presencia de Helicobacter pylori en el estómago humano se describió por primera vez por Robin Warren y Barry Marshall en 19801 y a partir de 1982 se vinculó etiológicamente la infección por la bacteria con el desarrollo de cáncer gástrico2. A pesar de que su papel fue asociado inicialmente como el principal agente en la carcinogénesis gástrica, nuevos estudios encontraron que H. pylori estaba presente en la mitad de la población mundial3, pero tan sólo del 1% al 10% adquirían ulcera duodenal, del 0,1% al 3% carcinoma gástrico y menos del 0,01% linfoma tipo MALT (por las siglas en inglés: mucosa associated lymphoid tissue)4,5.
La relación de H. pylori como un patógeno está bien documentada, en tanto estudios previos condujeron a la Agencia Internacional de Investigación en Cáncer (IARC) a definir la bacteria como carcinógeno tipo I6. Sin embargo, el cáncer gástrico se caracteriza como una enfermedad crónica de etiología multifactorial, lo cual la comunidad científica discute el rol del microorganismo como mutualista o como patógeno asociado a la enfermedad7-9. Partiendo inicialmente que H. pylori es una de las bacterias más ancestrales del ser humano y la evidencia más antigua de la presencia del microbio fue encontrada en la Momia Otzi en los Alpes del este de Italia cuya antigüedad se data desde hace 5300 años10,11; sin embargo, se estima que la colonización por este microorganismo ocurrió desde la especiación y origen del Homo sapiens hace 130,000 años aproximadamente y lo ha acompañado en sus diferentes rutas migratorias desde el este de África desde hace 60.000 años12,13, originando diferentes poblaciones y subpoblaciones de H. pylori acordes a las características geográficas y genéticas del hospedero14.
Las tasas de incidencia y mortalidad por cáncer gástrico varían alrededor del mundo dependiendo de la ubicación geográfica, genética del huésped y el linaje evolutivo de la bacteria. En el año 2018 se reportó 1 millón de casos y 783.000 muertes a causa de esta enfermedad en todo el mundo15 y las más altas tasas de incidencia fueron observadas en las poblaciones del este de Asia con alrededor de 40 a 60 casos por cada 100.000 habitantes (H. pylori: hspEAsia)16. En el este de Europa se estima que la incidencia es de aproximadamente 35 por cada 100.000 habitantes (H. pylori: hpEurope) y en América Latina, varía entre 20 y 30 casos por cada 100.000 personas (H. pylori: hspColombia, hspMexico, hspNicaragua, etc). En algunos países del África (H. pylori: hspWAfrica y hpAfrica) y en Norte América (H. pylori: hpEurope) la incidencia de cáncer gástrico es baja: 0,6/100.000 habitantes y 5 a 6 casos por cada 100.000 habitantes, respectivamente15-19.
En Colombia, donde la prevalencia de H. pylori es del 90%, la incidencia del cáncer gástrico puede variar geográficamente. Se ha demostrado que las poblaciones ubicadas en la región Andina presentan mayor incidencia respecto a los pobladores de las zonas costeras de Colombia18. Por ejemplo, en el departamento de Nariño la incidencia de cáncer gástrico es alta en la región Andina (Túquerres y Juanambú con 150 por cada 100.000 y Pasto con 46 por cada 100.000 habitantes), mientras que en la costa Pacífica y Atlántica de Colombia la incidencia es relativamente baja (Tumaco: 6 por cada 100.000 habitantes y Cartagena: 2 por cada 100.000 habitantes respectivamente)17,18. Estos datos sobre la prevalencia de H. pylori y la incidencia del cáncer gástrico originan como objetivo de investigación el discutir el rol de Helicobacter pylori en el riesgo de cáncer gástrico en Colombia.
Materiales y métodos
Se realizó una revisión exhaustiva de la literatura mediante la búsqueda, selección y análisis de textos científicos publicados en las bases de datos LILACS, SciELO y PubMed. Se realizó búsqueda de artículos de cáncer gástrico en Colombia que incluyeran pacientes adultos que presentaban síntomas de gastritis, con la estrategia: Helicobacter pylori, AND cagA, AND vacA, AND Gastric cancer AND Pathogen, AND Evolution, AND Risk factors, en el idioma inglés. Los autores del presente manuscrito seleccionaron 66 artículos de investigación, dentro de los cuales publicaciones propias y estudios multicéntricos se utilizaron como estrategia de discusión contrastante y concluyente. Se tomaron artículos completos y de revisión que presentaron información detallada de H. pylori, cáncer gástrico en Colombia y el mundo que permitieron la búsqueda de información de caracteres epidemiológicos y básicos entre los años 1980 hasta el 2021.
Resultados
Factores de virulencia de Helicobacter pylori
Islote cagPAI y gen cagA
El desarrollo de la enfermedad está íntimamente relacionado con el genotipo de la bacteria, uno de los principales factores determinantes está presente en los genes de virulencia del microorganismo en el cual se destaca la isla de patogenicidad cagPAI con un locus de 40 kb y que contiene alrededor de 27 a 31 genes que codifica, entre otros un sistema de secreción tipo IV (T6SS)20.
El islote cagPAI contiene un efector antígeno conocido como CagA que se induce dentro de las células gástricas21. Esta citotoxina asociada al gen A (cagA) es uno de los genes más estudiados del islote de patogenicidad, dado que la oncoproteina al entrar en las células del epitelio gástrico se fosforila a través de quinasas del hospedero, afectando la comunicación entre células por el daño del tejido y causando desarreglo en la estructura del citoesqueleto que altera la movilidad de las células del huésped y facilita la proliferación de células cancerígenas22-25.
El gen cagA es conocido por tener alta variabilidad en la región C-terminal, que incluye los aminoácidos Glu-Pro-Ile-Tyr-Ala (EPIYA). El número de motivos EPIYA pueden variar entre cepas de diferente origen filogeográfico, hasta el momento se han descrito cuatro tipos de segmentos: EPIYA -A, -B, -C y -D. Los motivos EPIYA-ABC son característicos de las cepas de origen Europeo, Ámerica del Norte, Australia y América Latina (West cagA), mientras que los motivos EPIYA-ABD están presentes principalmente en cepas de origen del este de Asia (East Asian cagA)26. Se ha encontrado el motivo EPIYA-ABD en los procesos de fosforilación dentro de la célula gástrica, siendo más patógeno que el motivo EPIYA-ABC27-30. En Colombia, en las poblaciones de la regiones Andina y Pacífica, los motivos con mayor frecuencia son EPIYA-ABC31,32; a pesar de que no existe una diferencia entre los motivos EPIYA, la evidencia del alto consumo de sal como ocurre en las poblaciones de alto riesgo (zona Andina), aumenta significativamente la expresión del gen cagA y en consecuencia la patogénesis18,33.
Gen de virulencia vacA
H. pylori secreta una proteína conocida como VacA mediante un autotransportador o ruta de secreción tipo IV34,35. VacA fue reconocida principalmente por su capacidad de causar vacuolas dentro de las células gástricas epiteliales36, estimulación de la autofagia37, acumulación de especies reactivas de oxigeno38 y la muerte celular39,40. Varias familias de alelos de vacA están presentes en el gen, las cuales fueron descritas dependiendo de las regiones designadas como s, i y m39,40. Los tipos de alelos s1, i1 y m1 son más activos vacuolizando las células del hospedero que los alelos de tipo s2, i2 y m239. En Colombia se ha encontrado que los alelos s1 y m1 son más virulentos en individuos que se encuentran en poblaciones con alto riesgo de cáncer gástrico, mientras que los alelos s2 y m2 tienen bajo riesgo para el desarrollo de cáncer gástrico en individuos infectados por H. pylori40,41. En otros genes de la membrana celular como babA2, oipA y del islote de patogenicidad cagE, no se ha observado evidencias que tengan relación con el desarrollo de ulcerogénesis o carcinogénesis gástrica en Colombia42.
Evolución de Helicobacter pylori y asociación con el cáncer gástrico
Desde la migración del ser humano fuera del África hace 60.000 años, los procesos alopatricos contribuyeron significativamente a la formación de las distintas poblaciones bacterianas de H. pylori de acuerdo con la población humana que se encontraba en cada continente. Es así como se clasificarían diferentes poblaciones (hpEuropa, hpAfrica1, hpAfrica2 y hpEAsia), a su vez hpAfrica1 fue dividida en hspWAfrica y hspSAfrica y hpEAsia en subpoblaciones hspAmerindia, hspEastAsia y hspMaori14. Cada cepa de H. pylori adquiría características genéticas propias que serían determinantes en el cáncer gástrico43-45 y el reciente encuentro hace menos de 500 años de diferentes poblaciones humanas provenientes de Europa y África, a la vez implicó el encuentro de diferentes linajes de H. pylori.
En los Andes de Colombia se identificó que las bacterias de H. pylori son aislados que pertenecen a un nuevo linaje conocido como hspColombia, el cual sugiere un nuevo conjunto de interacciónes con su huésped que empezó hace mas de 500 años, mientras que en las cepas en la costa pacífica del país los aislados tienen una ascendencia principalmente Africana (hspWAfrica y hspSAfrica)46,49. En el departamento de Nariño (Colombia), al comparar Túquerres (montañas) y Tumaco (costa), se ha reportado que las personas que se encontraban con alta ancestría amerindia pero que estaban infectadas con una cepa de H. pylori que contenía un porcentaje mayor al 19,8% de ascendencia africana (disrupción coevolutiva), presentaban una lesión gástrica de tipo metaplasia intestinal severa o extensa. Mientras que los individuos residentes en Tumaco con ancestría africana y que estaban infectados con una cepa con ancestría africana (coevolución), tuvieron bajo nivel de desarrollo de lesiones gástricas, lo que permitió comprender que la coevolución y el linaje de la bacteria es un factor determinante en la carcinogénesis49,50.
Factores genéticos del huésped en el desarrollo de cáncer gástrico
En el departamento de Nariño, aunque las diferencias en las tasas de incidencia pueden ser explicadas por las características biológicas de la bacteria, también existen otros procesos que modulan el desarrollo de la enfermedad en estas dos poblaciones. La diferencia en las ancestrías humanas juega un rol importante. Los habitantes de la ciudad de Túquerres tienen entre el 67% y 31% de ancestría amerindia y europea respectivamente y tan sólo el 2% de Africana, mientras que en Tumaco el 58% es Africana, 23% y 19% Nativa Americana y Europea, respectivamente50. Entre estas diferencias se ha observado que la Interleucina 10 (IL10) con una mutación puntual en la posición 1082 que cambia una Adenina por una Guanina y en la interleucina (IL1β) mutaciones en la posición 511 producen mayor riesgo de inflamación gástrica en la población de Túquerres51, además que va acompañado de una respuesta inmune Th1 proinflamatoria, mientras que en los habitantes de la costa, la co-infección por helmintos les ha permitido desarrollar una respuesta inmune Th2 benéfica que no conlleva a la inflamación y lesiones gástricas malignas52.
Factores ambientales asociados a la patogénesis gástrica
Los factores ambientales se han asociado con la patogénesis gástrica. Las diferencias establecidas entre los eventos descritos en la patogénesis gástrica se han asociado además a las dietas en las poblaciones de Nariño estudiadas, por un lado los habitantes de Túquerres tienen un alto consumo de carbohidratos procedentes de papas y habas con bajo contenido en vitaminas y antioxidantes, mientras que en la costa pacífica la dieta es rica en frutas con antioxidantes, vegetales frescos y mariscos, que les confiere un papel protector frente a la carcinogénesis53,54(Figura 1). Finalmente, estilos de vida contemporánea como fumar, la ingesta de alcohol, antecedentes familiares de cáncer gástrico y la infección por el virus Epstein Barr se ha asociado con el desarrollo de cáncer gástrico55-57.
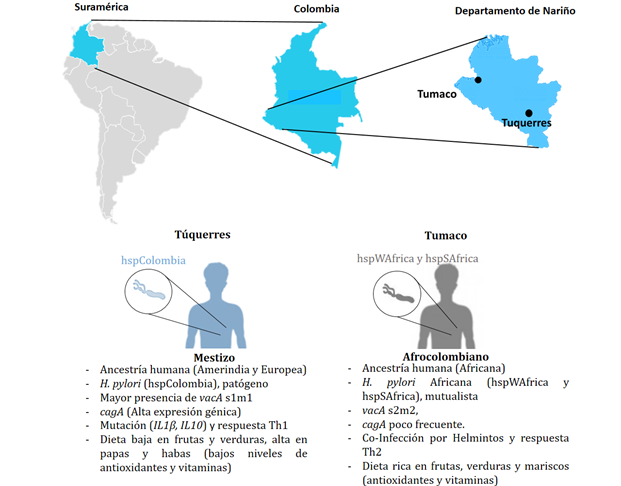
Figura 1 Asociación entre los diferentes factores de riesgo de cáncer gástrico en el departamento de Nariño (Túquerres y Tumaco). El origen evolutivo de H. pylori junto a los demás factores le confieren el papel de mutualista o patógeno entre las dos poblaciones con diferente riesgo de cáncer gástrico (Imagen diseñada en Adobe Illustrator V. 26).
Beneficios y riesgos de la erradicación de Helicobacter pylori
La infección por H. pylori en Colombia es casi ubicua del 90%, donde diferentes factores se han descrito que son mediadores del desarrollo de cáncer gástrico. Sin embargo, la incidencia entre las poblaciones de la zona andina y la costa pacífica en Colombia es contrapuesta. La erradicación de H. pylori en diversas poblaciones del mundo ha demostrado que disminuye la incidencia entre un 40% y 76%58-61, por ende, realizar la erradicación temprana de H. pylori tiene consecuencias benéficas en las poblaciones e individuos que presentan un alto riesgo de cáncer gástrico como es la zona Andina de Colombia61.
Sin embargo, en las zonas donde la incidencia de cáncer gástrico es relativamente baja como en la costa pacífica, erradicar H. pylori en individuos sanos, que han coevolucionado durante miles de años con la bacteria, probablemente traería a futuro consecuencias negativas con enfermedades contemporáneas como el asma, enfermedad por reflujo gastroesofágico (GERD) y el adenocarcinoma de esófago62-64, que ha aumentado en poblaciones donde la prevalencia de H. pylori ha disminuido64.
Discusión
En Colombia H. pylori es uno de los microorganismos más prevalente en las poblaciones humanas y es el principal factor de riesgo en el desarrollo de cáncer gástrico. Sin embargo, la prevalencia de la infección es un factor necesario, pero no determinante para la patogénesis, pues el cáncer de estómago es producto de las múltiples interacciones de factores sociales, dieta, genética del huésped, respuesta inmune, la coevolución humano-H. pylori y los genotipos de virulencia de la bacteria.
El municipio de Tumaco ubicado en la zona pacifica de Colombia además de ser una perfecta población para entender las interacciones ecológicas tanto de colonizador microbiano como de anfitrión, también ofrece un modelo de estudio para entender el rol que juega la dieta en las comunidades microbianas y las implicaciones que tendría la extinción de H. pylori en enfermedades contemporáneas, producto de la pérdida de microorganismos mutualistas que han coevolucionado con el ser humano durante miles de años.
Los estudios en la población de la costa pacífica encuentran que H. pylori posee genotipos de vacA s2m2 y cagA negativo definidos de baja virulencia, H. pylori en coevolución con su huésped y un tipo de respuesta antinflamatoria Th2, sugiriendo que su erradicación no es recomendable en los casos donde el microorganismo se puede considerar como mutualista y no como patógeno31,40,41,46,50,56.
Sin embargo, H. pylori en las poblaciones de la zona andina de Colombia con alto riesgo de cáncer gástrico, desempeña su papel como patógeno y la erradicación es la mejor alternativa conocida hasta el momento para mitigar la alta incidencia de cáncer gástrico. Los estudios en esta población encuentran que H. pylori posee genotipos vacA s1m1 y cagA positivo definidos de alta virulencia. En esta población de alto riesgo de cáncer gástrico, H. pylori se encuentra en disrupción de la coevolución con su huésped, generando un tipo de respuesta inflamatoria (Th1) mediada por linfocitos ante la infección por la bacteria, con sobreexpresión de genes de citocinas IL-1β-5 e IL-10-1082, considerados marcadores de susceptibilidad humana a cáncer gástrico31,40,41,46,50,51,56.
El posible efecto patógeno de la bacteria es el producto del cambio de estilo de vida y la dieta contemporánea por las sociedades actuales en Colombia producto de un sincretismo cultural después de la colonización europea. Para entender con mayor exactitud el rol y los mecanismos que forjan la patogénesis de H. pylori en el ser humano, es necesario ampliar el conocimiento en cuanto a las relaciones ecológicas con el microbioma y sus relaciones evolutivas en futuros estudios65,66.
Conclusiones
La definición de Helicobacter pylori como patógeno o mutualista en Colombia se puede describir a partir del proceso de coevolución del humano y de la bacteria; los alelos de virulencia de genes vacA y motivos EPIYA de cagA; el tipo de respuesta inmune inflamatoria a Helicobacter pylori (Th1) o antinflamatoria (Th2) y la susceptibilidad humana a cáncer gástrico (IL1β, IL10), junto a la dieta y factores ambientales.
Helicobacter pylori tiene un rol mutualista principalmente en poblaciones de bajo riesgo de cáncer gástrico (costas colombianas), no obstante, en poblaciones con alto riesgo de cáncer gástrico (montañas andinas) su papel como patógeno amerita su erradicación, siendo la única estrategia válida para mitigar la alta incidencia de cáncer gástrico en Colombia.















