Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Reumatología
Print version ISSN 0121-8123
Rev.Colomb.Reumatol. vol.27 no.1 Bogotá Jan./June 2020 Epub Dec 15, 2020
Carta al Editor
Hiperactivación del linfocito B y producción de los autoanticuerpos anticentrómero, antitopoisomerasa-I, anti-ARNPol-III en la fisiopatología de la esclerosis sistémica cutánea
a Servicio de Reumatología, Hospital General Universitario Gregorio Marañón, Madrid, Spain
b Instituto de Investigación Biomédica, Hospital Gregorio Marañón, Madrid, Spain
c Friedrich-Alexander-University Erlangen-Nürnberg, Department of Internal Medicine 3 - Rheumatology and Immunology, Erlangen, Alemania
Sr. Editor:
La esclerosis sistémica cutánea (ESC) es un trastorno crónico del tejido conectivo de origen autoinmune, caracterizado por lesiones microvasculares, depósito de colágeno y fibrosis de la piel y las vísceras incluyendo: tracto digestivo, pulmones, corazón, riñones. La detección de autoanticuerpos (AAc) circulantes dirigidos contra antígenos nucleares (ANA) es importante en el diagnóstico de la enfermedad y de sus formas clínicas, ESC difusa y ESC localizada.
A pesar de que estos AAc participan en la fisiopatología de la ESC, no se han descrito los mecanismos específicos que favorecen la desregulación del sistema inmunológico. Actualmente, se postula que: 1) la fibrosis es promovida por linfocitos B hiperreactivos productores de autoanticuerpos, la maduración de los fibroblastos o la inhibición de la degradación de la matriz extracelular, junto a eventos de vasoconstricción y vasculopatía obliterante; 2) los linfocitos B promueven la fibrosis por medio del contacto celular directo con fibroblastos y células dendríticas; 3) la reducción de linfocitos B y T con perfil regulador favorecen la formación de fibrosis tisular; 4) linfocitos T de tipo Th2 producen interleucinas profibróticas IL-4 e IL-13 que inducen la maduración de células dendríticas y retroalimentan este microambiente profibrótico y 5) un incremento en la expresión/activación de genes reguladores del interferón inducen la fibrosis tisular1-3 (fig. 1).
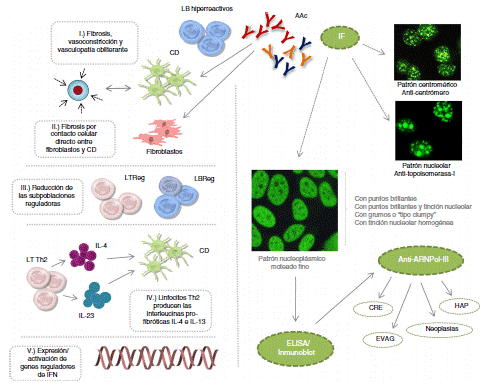
Figura 1 Eventos etiopatogénicos de la ESC, patrones de IF y producción de los autoanticuerpos: anticentrómero, antitopoisomerasa-I y anti-ARNPol-III. AAc: autoanticuerpos; CD: célula dendrítica; CRE: crisis renal esclerodérmica; EVAG: ectasia vascular antral gástrica; HAP: hipertensión arterial pulmonar; IF: inmunofluorescencia; IFN: interferón; IL: interleucina; LB: linfocito B; LT: linfocito T; Reg: regulador.
Los eventos clínicos (fenómeno de Raynaud), histológicos (microvasculopatía), celulares (apoptosis de las células endoteliales) o autoinmunes (desarrollo de AAc) pueden aparecer años antes de la fibrosis cutánea1,2. Entre 80-98% de los pacientes con AAc, presentan en la prueba de ANA alguno de estos patrones de inmunofluorescencia: centromérico, nucleolar o nuclear moteado fino. Se ha descrito que estos AAc van dirigidos específicamente contra proteínas centro-méricas (anticentrómero), enzimas como la topoisomerasa-I (anti-Scl-70) o enzimas encargadas de transcribir el ADN en ARN, como la enzima polimerasa nucleotidiltransferasa del ácido ribonucleico III (anti-ARNPol-III). Otros AAc que pueden aparecer, aunque con menor frecuencia, son los denominados antirribonucleoproteínas Th/To, anti-PM-Scl y antifibrilarina (U3-RNP)4-7.
La importancia de estas especificidades se debe a que la frecuencia de cada uno de estos AAc varía en función del grupo étnico y de la procedencia geográfica de los pacientes, también han sido asociados con distintos perfiles clínicos y no suelen coexistir en el mismo paciente ni cambiar durante el curso de la enfermedad. Motivos estos por los cuales su determinación en el momento del diagnóstico resulta de gran utilidad para predecir tanto la afectación orgánica como la evolución clínica de nuestros pacientes.
Los antitopoisomerasa-I y anticentrómero se asocian con ESC difusa y ESC localizada, respectivamente. Los anticuerpos anti-Th/To, anti-PM-Scl y antifibrilarina se han detectado en pacientes con 1) fibrosis e hipertensión pulmonar o poli-miositis, 2) lupus eritematoso sistémico y 3) síndrome de solapamiento, respectivamente6,8. Lazzaroni et al. en un estudio promovido por European Scleroderma Trials and Research han demostrado que la crisis renal esclerodérmica, la ectasia vascular antral gástrica, la progresión rápida del espesor de la piel, la hipertensión arterial pulmonar y las neoplasias son características clínicas independientes asociadas con la presencia de anti-ARNPol-III9. La importancia de estas asociaciones ha promovido la inclusión de los anti-ARNPol-III en los criterios más recientes de clasificación de la ESC elaborados por un consenso de expertos del American College of Rheumatology y la European League against Rheumatism10. Por lo tanto, en la práctica clínica habitual además de la determinación de AAc antitopoisomerasa-I y anticentrómero, sería de gran utilidad y más que recomendable disponer siempre del ensayo para la detección de anti-ARNPol-III. Igualmente, sería de importancia cardinal su inclusión en el diseño de los ensayos clínicos y en los protocolos de seguimiento de nuestros pacientes.
REFERENCES
1. Ferri C, Sebastiani M, Lo Monaco A, Iudici M, Giuggioli D, Furini F, et patients’ population and review of the literature. Autoimmun Rev. 2014;13:1026-34. [ Links ]
2. Satoh M, Vazquez-Del Mercado M, Chan EK. Clinical interpretation of antinuclear antibody tests in systemic rheumatic diseases. Mod Rheumatol. 2009;19:219-28. [ Links ]
3. Mavropoulos A, Simopoulou T, Varna A, Liaskos C, Katsiari CG, Bogdanos DP, et al. B regulatory cells are decreased and functionally impaired in patients with systemic sclerosis. Arthritis Rheum. 2016;68:494-504. [ Links ]
4. Kuwana M, Kimura K, Kawakami Y. Identification of an immunodominant epitope on RNA polymerase III recognized by systemic sclerosis sera: application to enzyme-linked immunosorbent assay. Arthritis Rheum. 2002;46:2742-7. [ Links ]
5. Parker J, Burlingame R, Webb T, Bunn C. Anti-RNA polymerase III antibodies in patients with systemic sclerosis detected by indirect immunofluorescence and ELISA. Rheumatology. 2008;47:976-9. [ Links ]
6. Kuwana M. A To-Do List at Diagnosis of Systemic Sclerosis with Positive Anti-RNA Polymerase III Antibodies. J Rheumatol. 2017;44:550-2. [ Links ]
7. Steen VD. Autoantibodies in systemic sclerosis. Semin Arthritis Rheum. 2005;35:35-42. [ Links ]
8. Wirz EG, Jaeger VK, Allanore Y, Riemekasten G, Hachulla E, Distler O, et al. Incidence and predictors of cutaneous manifestations during the early course of systemic sclerosis: a 10-year longitudina study from the EUSTAR database. Ann Rheum Dis. 2016;75:1285-92. [ Links ]
9. Lazzaroni MG, Cavazzana I, Colombo E, Dobrota R, Hernández J, Hesselstrand R, et al. Malignancies in patients with anti-RNA polymerase III antibodies and systemic sclerosis: analysis of the EUSTAR cohort and possible recommendations for screening. J Rheumatol. 2017;44:639-47. [ Links ]
10. Van den Hoogen F, Khanna D, Fransen J, Johnson SR, Baron M, Tyndall A, et al. 2013 classification criteria for systemic sclerosis: an American College of Rheumatology/European League against Rheumatism collaborative initiative. Arthritis Rheum. 2013;65:2734-47. [ Links ]











 text in
text in 


