Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Col. Cardiol. vol.11 no.7 Bogota Jan./Feb. 2005
Guías de manejo de enfermedad pericárdica y miocarditis
Pericardial disease and myocarditis: management guide
Jorge E. Marín, MD.; Mauricio Duque, MD.; William Uribe, MD.; Eduardo Medina, MD.
Medellín, Colombia.
Clínica Medellín, Servicio de electrofisiología, arritmias y marcapasos, Medellín, Colombia.
Correspondencia: Jorge Marín, MD.; Clínica Medellín, Servicio de electrofisiología, arritmias y marcapasos, Calle 53 No. 46-38, Telefóno: 5117378, Medellín, Colombia.
El pericardio es una estructura que se ve afectada, de forma primaria, por una serie de agentes de diversa índole, y de forma secundaria, por procesos sistémicos. Su respuesta es inespecífica y generalmente lo constituye un proceso inflamatorio que puede ser agudo, recurrente o crónico. El reconocimiento de estas patologías es de vital importancia para su correcto enfoque terapéutico.
En estas guías se presentan algunas orientaciones básicas para la correcta clasificación, diagnóstico y terapia de los principales síndromes que afectan al pericardio, basados en los aspectos clínicos, etiológicos y de ayudas paraclínicas de los cuales se dispone en la actualidad. También se dan algunas recomendaciones de tratamiento específico para cada una de las principales entidades que normalmente afectan al pericardio.
En la segunda parte del manuscrito se hace una breve mención de algunos aspectos fisiopatológicos de la miocarditis aguda, sus principales causas, y el tratamiento de la falla cardiaca que la enfermedad produce con sus diferencias puntuales, y se profundiza un poco sobre la controversia de su manejo con inmunosupresión y las medidas experimentales para su terapia.
Metodológicamente se trató de seguir, hasta donde fue posible, las recomendaciones de medicina basada en evidencia, con grados de recomendación ya reconocidos en la literatura médica internacional.
Palabras clave: pericarditis, derrame pericárdico, taponamiento cardiaco, pericarditis constrictiva, pericardiocentesis, pericardiectomía, miocardiopatías, miocarditis.
Pericardium is a structure that can be primarily affected by a series of different agents and in a secondary way by systemic processes. Its response is not specific and in general it corresponds to an inflammatory process that can be acute, chronic or recurrent. The recognition of these pathologies is of vital significance in the making of a right therapeutic approach.
Some basic orientations for the correct classification, diagnosis and therapy of main pericardial syndromes, based on clinical and etiological aspects and paraclinical available aids are presented. Likewise, some recommendations for the specific treatment of each one of the main entities usually affecting the pericardium are given.
Next, a brief mention of some physiopathological aspects of acute myocarditis, its main etiologies, and the treatment of the cardiac failure secondary to the disease with its specific differences, is made, and the controversy on its handling with immunosuppressors and the experimental therapy measures are studied in depth.
We intended to follow until possible the recommendations of medicine based on evidence with grades already recognized in international medical literature.
Key words: pericarditis, pericardial effusion, cardiac tamponade, constrictive pericarditis, pericardiocentesis, pericardiectomy, myocardiopathies, myocarditis.
Introducción
Las enfermedades del pericardio constituyen una causa relativamente frecuente de consulta e ingreso a los servicios de cardiología. El manejo de estas enfermedades, al contrario que muchos de los padecimientos cardiovasculares, ha sido escasamente influenciado por los recientes avances en la tecnología. En muchos casos la etiología de la enfermedad pericárdica aparentemente se debe a la presencia de una enfermedad concomitante; sin embargo, en pacientes sin una causa aparente la etiología permanece esquiva, siendo idiopática (probablemente en muchos casos de origen viral) en más del 90% de los casos. El punto de vista es que el «viejo» manejo clínico (historia, examen físico y exámenes de laboratorio de «rutina»), con una indicación juiciosa de procedimientos invasivos es el enfoque apropiado para muchos pacientes.
La clasificación de la enfermedad pericárdica basada en la etiología, comprende: pericarditis infecciosa, pericarditis en enfermedades autoinmunes sistémicas, pericarditis (auto) inmune tipo 2, desórdenes metabólicos, trauma, tumores y quistes pericárdicos (1).
Esta clasificación tiene grandes consecuencias terapéuticas que serán descritas en este artículo mediante un enfoque práctico de manejo de los síndromes pericárdicos y las enfermedades subyacentes específicas.
Aspectos diagnósticos
Síndromes pericárdicos
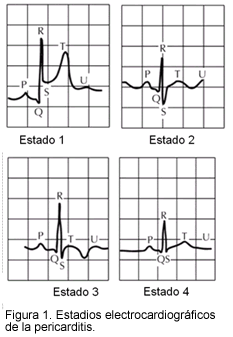
El diagnóstico de pericarditis aguda descansa en hallazgos clínicos, cambios electrocardiográficos y ecocardiografía (Tabla 1, Figuras 1 y 2) (2, 3, 33). La inflamación pericárdica crónica incluye formas constrictivas, adherentes y derrame, que duran al menos tres meses o más. La pericarditis recurrente puede ser intermitente (intervalos libres de síntomas sin tratamiento) o incesante (la descontinuación del tratamiento anti-inflamatorio siempre asegura una recaída).
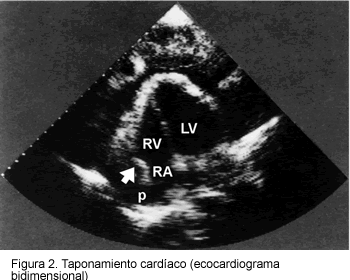
El derrame pericárdico ocurre como un trasudado (hidropericardio), exudado, piopericardio, hemopericardio, o una mezcla de estos. Los grandes derrames generalmente indican una enfermedad más seria y son comunes con neoplasias, tuberculosis, hipercolesterolemia, pericarditis urémica, mixedema y parasitosis (2, 4).
Los pacientes pueden ser asintomáticos si el derrame se desarrolla lentamente. Muchas mujeres gestantes desarrollan un hidropericardio mínimo a moderado que es clínicamente silente, alrededor del tercer trimestre (3).
La ecocardiografía revela el tamaño de los derrames:
1. Pequeño (espacio libre de ecos en diástole < de 10 mm).
2. Moderado (al menos > 10 mm en forma posterior).
3. Grandes (> 20 mm).
4. Muy grandes (> 20 mm con compresión del corazón) (2).
También es posible detectar la presencia de fibrina, coágulos, tumores, aire y calcio. El derrame pericárdico debe diferenciarse del líquido pleural, la ascitis, las atelectasias o la grasa epicárdica. La ecocardiografía trasesofágica es útil en derrames pericárdicos loculados, coágulos intrapericárdicos, metástasis y engrosamiento pericárdico.
El taponamiento cardiaco es una emergencia médica y su diagnóstico es de mayor importancia clínica (Tabla 2) (3). La enfermedad pericárdica de casi cualquier etiología puede producir taponamiento cardiaco por acumulación de derrame e incremento en la presión intrapericárdica. El «taponamiento quirúrgico» (ej.: hemorragia) puede sobrepasar rápidamente los mecanismos compensatorios. El «taponamiento médico» que se desarrolla lentamente, acumula primero un derrame entre 500 y 2.000 mL.
La pericarditis constrictiva causa daño en el llenado de los ventrículos y reducción en la función ventricular (Tabla 3) (3, 4). La tuberculosis, la irradiación mediastinal y la cirugía cardiaca previa son causas frecuentes. El diagnóstico diferencial debe incluir embolismo pulmonar, infarto ventricular derecho, derrame pleural, enfermedad pulmonar obstructiva crónica y cardiomiopatía restrictiva. La mejor manera para distinguir entre pericarditis restrictiva y cardiomiopatía restrictiva es mediante el análisis de los cambios en la precarga con la respiración usando ecocardiografía con doppler tisular. Los hallazgos físicos, la electrocardiografía (EKG), la radiografía de tórax, la tomografía computarizada/resonancia magnética, las medidas hemodinámicas y la biopsia endomiocárdica también son útiles para el diagnóstico.
¿Cómo establecer la etiología?
La pericarditis viral es la enfermedad infecciosa más común del pericardio y es causada por ataque viral directo (enterovirus, adenovirus, citomegalovirus, virus Ebstein - Barr, virus de herpes simple, virus de la influenza, parvovirus B19, virus de la hepatitis C, VIH, etc.), respuesta inmune o ambos (5). La presentación inicial más frecuente es el síndrome de pericarditis aguda, que a menudo se resuelve dentro de dos semanas, pero con más del 50% de recurrencia (3). La forma de derrame agudo, particularmente después del taponamiento, se asocia más con constricción que con pericarditis «seca». La presencia de arritmias o defectos de la conducción indica miocarditis u otra enfermedad cardiaca concomitante. El diagnóstico debe involucrar la evaluación del líquido pericárdico con técnicas específicas para los diferentes virus (reacción de polimerasa en cadena o hibridización in situ). Un aumento de cuatro veces el valor normal de los anticuerpos antivirales es sugestivo pero no diagnóstico per se.
Otra herramienta valiosa para el diagnóstico específico de pericarditis es la pericardioscopia, con la cual se puede observar directamente el espacio pericárdico y extraer líquido para su estudio y tomar biopsias para análisis histoquímica. Se describió y se realizó esta técnica por primera vez en el mundo en 1982, en Colombia . El primer estudio se hizo en una paciente con metástasis al pericardio. También se realizó por primera vez la toma de biopsias bajo visión directa (33).
El diagnóstico de pericarditis auto-reactiva se establece por los siguientes parámetros:
1. Incremento en el número de células mononucleares/linfocitos > de 5000 mm3 (linfocítica auto-reactiva) o la presencia de anticuerpos contra el músculo cardiaco en el líquido pericárdico (mediada por anticuerpos auto-reactivos).
2. Signos de miocarditis en las biopsias endo/epicárdicas (> 14 células/mm2).
3. Exclusión de infección viral activa.
4. Exclusión de tuberculosis, Chlamydia pneumoniae, Borrelia burgdorferi u otra infección bacteriana.
5. No infiltración neoplásica.
6. Exclusión de uremia o síndromes metabólicos sistémicos (6).
Aun con tratamiento la pericarditis purulenta es fatal en más del 40% de los pacientes. Las condiciones que predisponen son: derrame pericárdico preexistente, inmunosupresión y enfermedades crónicas (alcoholismo, artritis reumatoidea, etc.).
Debe estudiarse el líquido pericárdico con Gram, cultivos y concentración de glucosa (relación líquido/sérica) (7).
La pericarditis tuberculosa es vista de manera primaria (desde la última década) en pacientes inmunocomprometidos (SIDA) (8). La constricción pericárdica ocurre en el 30% al 50% de los pacientes y la mortalidad en la enfermedad sin tratamiento se aproxima al 85%. El criterio absoluto para el diagnóstico es la identificación de Mycobacterium tuberculosis en el líquido pericárdico o en el tejido, y la presencia de granulomas de caseificación en el pericardio (3). Sin embargo, la pericarditis en presencia de tuberculosis extracardiaca diagnosticada es un fuerte indicio de que ésta sea la causa. El enfoque diagnóstico múltiple y sistémico es esencial (Gram, tinción para BAAR, BACTEC, etc.). Concentración de ADA > 40 U/l en líquido pericárdico es diagnóstico de pericarditis tuberculosa (93% de sensibilidad y 97% de especificidad) (9).
En la falla renal se distinguen dos formas de pericarditis:
1. Pericarditis urémica: inflamación fibrinosa con adhesiones entre las membranas pericárdicas engrosadas (apariencia de «pan con mantequilla») causada por el alto grado de azohemia (BUN usualmente > 60 mg/dL) en falla renal avanzada antes que la diálisis se inicie o inmediatamente después de la misma.
2. Pericarditis asociada a la diálisis: por diálisis inadecuada o sobrecarga de líquidos.
Después del trasplante renal la pericarditis puede ser causada por uremia o infecciones (ej.: CMV) (10).
El síndrome post-injuria cardiaca se desarrolla dentro de los primeros días a meses después de la injuria pericárdica/cardiaca. A diferencia del síndrome post-IAM, éste provoca una gran respuesta de anticuerpos anticorazón (antisarcolema y antifibrilares), que parecen ser patogénicos o pueden actuar en la presencia de una infección viral concomitante o inactiva.
La pericarditis puede ocurrir «temprano» (epistenocárdica) o en forma «tardía» (síndrome Dressler) después del infarto de miocardio. La pericarditis epistenocárdica, causada por exudado directo, ocurre en los primeros días de casi la mitad de los infartos transmurales, aunque la reperfusión temprana ha disminuido su incidencia. El síndrome de Dressler ocurre desde una semana hasta varios meses después del infarto miocárdico (también en formas subendocárdicas) con manifestaciones similares al síndrome post-injuria miocárdica. Puede ocurrir taponamiento cardiaco relativamente temprano. La constricción tardía es rara mas no sorprendente. Si el diagnóstico de infarto miocárdico es erróneo, la trombólisis puede producir taponamiento desde el pericardio inflamado o una disección aórtica.
La pericarditis neoplásica es 40 veces más a menudo causada por malignidades secundarias que primarias, siendo las más frecuentes, cáncer de pulmón, cáncer de mama, melanoma maligno, linfomas y leucemias. Los derrames pueden ser pequeños o grandes (con inminencia de taponamiento y/o constricción). El diagnóstico se basa en la citología del líquido pericárdico o en los hallazgos en la biopsia. La citología del líquido es positiva en 75% a 87% de los casos y la biopsia pericárdica es positiva en 27% a 65% de los pacientes con enfermedad pericárdica maligna (11). Sin embargo, las biopsias pericárdicas guiadas por pericardioscopia tienen un valor diagnóstico de 93% a 97% (12). El incremento en la concentración de marcadores tumorales específicos (afeto proteína, Ag carcinoembrionario, etc.) también puede sugerir el diagnóstico. Es de anotar que en el 60% de los pacientes con malignidad documentada, el derrame pericárdico es causado por enfermedades no malignas (ej.: pericarditis por radiación o infecciones oportunistas).
La pericarditis fúngica ocurre mayormente en pacientes inmunocomprometidos (Candida, Aspergillus, Blastomyces, Nocardia y Actinomyces sp.) o en el curso de infecciones fúngicas endémicas (Histoplasma) (2). El cuadro clínico compromete todo el espectro de enfermedades pericárdicas incluyendo miocarditis fúngica. El diagnóstico se realiza por tinción y cultivo del líquido pericárdico y/o elevación de anticuerpos antifúngicos séricos.
Quilopericardio hace referencia a la comunicación entre el saco pericárdico y el ducto torácico causado por anomalías congénitas, trauma, linfangiomas mediastinales, hamartomas linfangiomatosos, linfaectasias pericárdicas, obstrucción o anomalías del ducto torácico o causadas en forma iatrogénica durante cirugía. La infección, el taponamiento o la constricción pueden agravar el pronóstico. La naturaleza quilosa del líquido es confirmada por su reacción alcalina, gravedad específica entre 1010 y 1021, tinción positiva con Sudan III para grasas y alta concentración de triglicéridos (5- 50 g/L) y proteínas (22-60 g/L). La tomografía axial computarizada (TAC) de alta resolución, sola o en combinación con linfografía, es una herramienta diagnóstica fiable para identificar no sólo la localización del ducto torácico sino también su conexión linfática al pericardio (3).
Aspectos terapéuticos
Cuando sea posible, el tratamiento debe dirigirse a la etiología subyacente. La hospitalización aplica para la mayoría de los pacientes con el fin de determinar la etiología, observar si hay desarrollo de taponamiento cardiaco y comenzar el tratamiento anti-inflamatorio y sintomático.
Dolor torácico e inflamación pericárdica
Los anti-inflamatorios no esteroideos (AINE) son la piedra angular del tratamiento. Se prefiere ibuprofén (400-800 mg cada 8 horas) por sus relativamente bajos efectos secundarios, efecto favorable en el flujo coronario y gran rango para dosificación (3). Se debe recordar la protección gástrica que se debe proveer a estos pacientes. Existe un gran interés por el uso de la colchicina (0.5 mg dos veces al día) en combinación con los AINE o como monoterapia para el manejo del ataque inicial y para la prevención de recurrencias (13) ya que es bien tolerada y tiene menos efectos secundarios que los AINE; se debe tener especial cuidado en la gestación (contraindicada). El tratamiento con esteroides sistémicos (prednisona o su equivalente 1-1.5 mg/kg/día) está restringido a pericarditis secundaria a enfermedades del tejido conectivo, pericarditis urémica y pericarditis recurrente severamente sintomática que no responde a la colchicina; también pueden añadirse azatioprina o ciclosporina al tratamiento (2). En varios reportes se ha usado la aplicación intrapericárdica de esteroides (triamcinolona) en un intento por evitar los efectos secundarios y se ha reportado como altamente efectiva (13).
Recomendaciones para el tratamiento de la pericarditis aguda y la pericarditis idiopática recidivante
Clase I
1. Reposo en cama durante el brote inflamatorio.
2. Anti-inflamatorios no esteroideos (ácido acetil-salicílico, paracetamol, indometacina, ibuprofén).
Clase IIA
1. Colchicina en la pericarditis idiopática recidivante.
Clase III
1. Corticoides (sólo se administrarán en casos muy excepcionales).
2. Fármacos inmunosupresores.
3. Pericardiectomía en la pericarditis idiopática recidivante (sólo se considerará en casos muy excepcionales).
Derrame pericárdico y taponamiento cardiaco
La pericardiocentesis se indica para taponamiento clínico (Figura 3), sospecha de pericarditis purulenta o neoplásica o para pacientes sintomáticos, aun luego de tratamiento médico por una semana (3). En derrames crónicos que no causan compromiso hemodinámico, la pericardiocentesis está indicada si existe la posibilidad de realizar nuevos exámenes diagnósticos (citología del líquido, biopsia tisular, etc.) para revelar la etiología de la enfermedad y permitir un mejor tratamiento (13-15). La disección aórtica es una contraindicación para realizar pericardiocentesis (3). Contraindicaciones relativas incluyen coagulopatía no corregida, anticoagulantes, trombocitopenia < 50.000 mm3 y pequeños derrames loculados de localización posterior. En hemopericardio traumático agudo y pericarditis purulenta se indica el drenaje quirúrgico.
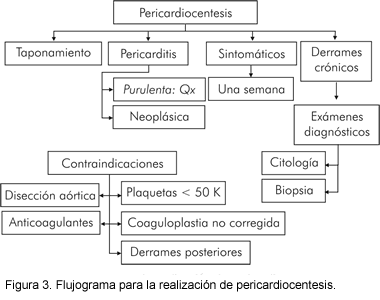
La pericardiocentesis puede realizarse usando fluoroscopia o guía ecocardiográfica, siendo esta última menos demandante técnicamente y con la ventaja que puede hacerse en el lecho del enfermo (17). El cateterismo cardiaco derecho puede hacerse simultáneamente con la pericardiocentesis permitiendo monitoreo hemodinámico y exclusión de enfermedad constrictiva con derrame (16). La aproximación subxifoidea ha sido usada más comúnmente, con una aguja larga con el mandril dirigido hacia el hombro izquierdo en un ángulo de 30° con la piel. Esta ruta es extrapleural y evita las arterias coronarias, pericárdicas y mamarias internas. Se debe intentar, en forma intermitente, aspirar líquido e inyectar pequeñas cantidades del medio de contraste. Una vez hecha la aspiración del líquido la aguja debe ser reemplazada lo más pronto posible con una guía J la cual luego se intercambia por un catéter cola de cerdo de múltiples hoyos. Es prudente drenar el líquido en cantidades escalonadas de menos de un litro cada vez para evitar dilatación ventricular derecha aguda.
La viabilidad de la pericardiocentesis es alta (93%) en pacientes con derrames anteriores de más de 10 mm, mientras que la tasa de éxito es sólo 58% con derrames de localización pequeña y posterior (16). El monitoreo fluoroscópico y hemodinámico contribuye a un mejor pronóstico siguiendo el procedimiento (93.1% vs. 73.3%) en comparación con la punción pericárdica emergente sin control imaginológico (16).
Las más serias pero raras complicaciones son las laceraciones y/o perforaciones del miocardio y los vasos coronarios. Se puede presentar, además, embolismo aéreo, neumotórax, arritmias (bradicardia vasovagal) y punción de la cavidad peritoneal o vísceras abdominales. Pocas veces se han reportado fístulas de la arteria mamaria interna, edema pulmonar agudo y pericarditis purulenta.
Pericarditis constrictiva
La pericardiectomía es el único enfoque terapéutico que puede remover la constricción permanente, resecando el pericardio enfermo hasta donde sea posible. Las indicaciones para cirugía deberían estar basadas en síntomas clínicos, hallazgos ecocardiográficos, TAC/RM y cateterización cardiaca. Hay dos enfoques estándar: toracotomía anterolateral y esternotomía media (de más fácil acceso a la aorta y a la aurícula derecha en caso de ser necesaria la circulación extracorpórea). Las mayores complicaciones incluyen insuficiencia cardiaca perioperatoria aguda y ruptura de la pared ventricular. La mortalidad y morbilidad cardíacas por pericardiectomía generalmente son causadas por la presencia no reconocida prequirúrgicamente de atrofia o fibrosis miocárdica. La fracción de expulsión ventricular izquierda incrementa debido a la mejoría en el llenado ventricular, pero la normalización completa de la hemodinámica cardíaca completa después del procedimiento se ha reportado en sólo 60% de los pacientes (2). El bajo gasto post-operatorio debe ser tratado con aumento de la precarga y catecolaminas y altas dosis de digitálicos, y en los casos más severos, con balón de contrapulsación intra-aórtico.
Recomendaciones para la práctica de la pericardiectomía
Las indicaciones y niveles de evidencias serían los siguientes:
Clase I
1. Pericarditis constrictiva con clínica de insuficiencia cardiaca derecha.
2. Hemopericardio por traumatismo torácico o hematoma pericárdico iatrogénico.
3. Quistes o defectos congénitos del pericardio con síntomas.
Clase IIA
1. Derrame pericárdico crónico masivo recidivante tras la pericardiocentesis.
2. Pericarditis tuberculosa y purulenta. En ausencia de constricción establecida, la pericardiectomía puede estar indicada en casos de taponamiento persistente o recurrente a pesar del tratamiento médico y drenaje pericárdico, y en aquellos pacientes en quienes en el momento del drenaje pericárdico por vía subxifoidea el cirujano encuentra un pericardio muy grueso y con adherencias.
3. Pericarditis urémica: cuando el taponamiento o el derrame severo persisten o recurren después de la pericardiocentesis y del drenaje por vía subxifoidea y, especialmente, si ello causa mala tolerancia a la hemodiálisis.
4. Derrame pericárdico secundario a radioterapia, con taponamiento recidivante o derrame pericárdico severo.
Clase IIB
1. Pericarditis constrictiva con repercusión hemodinámica ligera.
2. Pericarditis constrictiva en pacientes de edad avanzada, pacientes con patologías adicionales o con factores de riesgo quirúrgico, especialmente si los signos de insuficiencia cardiaca se controlan de manera aceptable con tratamiento médico.
3. Pericardiectomía diagnóstica: esta indicación se puede plantear de forma excepcional en pacientes con enfermedad pericárdica severa y persistente, sin diagnóstico, especialmente cuando se sospecha una patología tumoral.
Clase III
1. Pericarditis aguda benigna recidivante.
Modalidades de tratamiento específico
Pericarditis viral
En muchos pacientes la infección viral pericárdica es autolimitada y no es necesario el tratamiento específico. En derrame pericárdico sintomático recurrente o crónico y con infección viral confirmada, se ha propuesto el siguiente tratamiento específico (aún bajo investigación):
1. Pericarditis por citomegalovirus: gammaglobulina hiperinmune una vez al día (4 mL/kg IV los días 1, 4 y 8; 2 mL/kg los días 12 y 16).
2. Pericarditis por virus Coxsackie B: interferón alfa 2.5 x 106 UI/m2 subcutánea tres veces por semana.
3. Miocarditis por adenovirus y parvovirus B19: inmunoglobulina 10 g intravenosa los días 1 y 3 (3).
Pericarditis bacteriana
La pericarditis purulenta es una indicación absoluta para drenaje pericárdico y lavado de la cavidad pericárdica, combinado con altas dosis de tratamiento antibiótico sistémico. Se indica una combinación de antibiótico antiestafilococo y aminoglicósidos como tratamiento empírico, seguidos por antibioticoterapia guiada por resultados de cultivo por cuatro a seis semanas (nivel de recomendación clase I) (3). La instilación intrapericárdica de antibiótico (gentamicina) puede ser útil pero no es suficiente. La irrigación frecuente de la cavidad pericárdica con estreptoquinasa usando catéteres, puede hacer licuefacción del exudado purulento, pero se prefiere el drenaje quirúrgico abierto vía pericardiotomía subxifoidea. La pericardiectomía se requiere en pacientes con múltiples adherencias, derrame purulento, multiloculado, recurrencia del taponamiento siguiendo el drenaje, así como los síntomas persistentes y/o la progresión a pericarditis constrictiva. Se ha reportado mortalidad perioperatoria de más del 8% para la pericardiectomía (2).
Pericarditis tuberculosa
Se debe administrar tratamiento antituberculoso tetracongujado en caso de confirmarse la etiología tuberculosa (por 9 a 12 meses) y en los pacientes con pericarditis granulomatosa (nivel de recomendación clase I). En los pacientes con cuadro clínico sugestivo y con un valor de adenosindeaminasa (ADA) en líquido pericárdico mayor de 45 U/L, se individualizará la indicación de tratamiento (nivel de recomendación clase II A) (18). Se debe administrar prednisona (1 mg/kg) con el tetraconjugado antituberculoso por 5 a 7 días y progresivamente reducir su dosis hasta descontinuarla en 6 a 8 semanas (8). Los esteroides reducen la reacción del huésped a la infección micobacteriana, minimizan el exudado, la deposición de fibrina y la proliferación de tuberculomas; puede además disminuir los síntomas y signos y reducir la mortalidad en pericarditis tuberculosa. Si los síntomas y signos de pericarditis constrictiva permanecen 6 a 8 semanas después del tratamiento tuberculostático y corticosteroideo, se indica pericardiectomía.
Pericarditis urémica
Muchos pacientes responden con 1 a 2 semanas de hemodiálisis o diálisis peritoneal, con resolución del dolor torácico y del derrame pericárdico. Para evitar la hemorragia intrapericárdica se usa hemodiálisis libre de heparina (Figura 4). En pacientes en «pretaponamiento» debe realizarse pericardiectomía antes de la hemodiálisis ya que la remoción líquida aguda con el procedimiento puede llevar a colapso cardiovascular y taponamiento. La diálisis peritoneal, la cual no requiere heparinización, puede ser terapéutica en pericarditis resistente a la hemodiálisis intensificada. Los AINE y los esteroides sistémicos tienen limitado éxito cuando la diálisis intensiva es inefectiva (2).
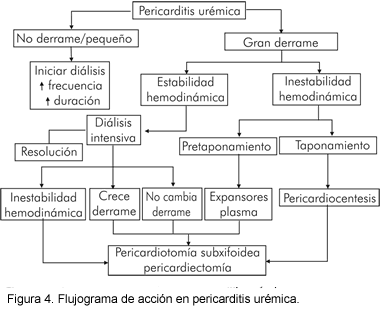
Síndrome postpericardiectomía
Su tratamiento se basa en la administración de AINE o colchicina. La aplicación preventiva de colchicina antes de cirugía cardiaca ha estado bajo investigación pero no hay resultados significativos por el pequeño tamaño de las muestras (3).
Pericarditis postinfarto
El ibuprofén es el agente de elección aunque se ha administrado con éxito ácico acetilsalicílico hasta 650 mg cada 4 horas por 2 a 5 días. Otros AINE ponen en riesgo de mayor adelgazamiento la zona infartada (2). El tratamiento corticosteroideo se usa para síntomas refractarios pero puede retardar la cicatrización del infarto.
Hemopericardio en disección aórtica
En pacientes con disección aórtica con compromiso de la aorta ascendente (De Bakey I ó II y Stanford tipo A) se contraindica la pericardiocentesis, debido al riesgo de intensificar el sangrado (3). La cirugía debe realizarse inmediatamente después de que el diagnóstico sea establecido por ecocardiografía, TAC y/o RM.
Pericarditis neoplásica
No hay estudios aleatorizados que comparen la eficacia y seguridad de diferentes modalidades terapéuticas, sistémicas y/o intrapericárdicas. La prevención de recurrencias que se observa en 40% a 70% de los pacientes con gran derrame pericárdico maligno, puede ser alcanzada con instilación intrapericárdica de agentes esclerosantes, drogas citotóxicas e inmunomoduladoras, balón percutáneo de pericardiotomía, etc. La radioterapia es muy efectiva en controlar el derrame pericárdico maligno en pacientes con tumores radiosensibles como linfomas y leucemia.
Guías de manejo de la miocarditis
Introducción
En un contexto de presentación aguda, la miocardiopatía dilatada idiopática se ha asociado con un proceso de inflamación miocárdica llamado miocarditis. Las presentaciones clínicas de una miocardiopatía dilatada y una miocarditis pueden ser muy variables y en ocasiones no se distinguen con facilidad una de otra (19).
Miocarditis se define clínicamente como una inflamación del músculo cardíaco. El término se introdujo en la literatura médica a principios del siglo XIX y se utilizaba para describir enfermedades del músculo cardiaco no asociadas con anormalidades valvulares. Pasada la mitad del siglo XX, una constelación de observaciones clínicas renovó el interés en la inflamación del músculo cardíaco: la miocarditis fue reconocida en un gran número de estudios postmortem; varios virus fueron aislados de corazones de adultos e infantes con enfermedad cardíaca aguda; la biopsia endomiocárdica proveyó una oportunidad para evaluar la presencia premórbida de inflamación miocárdica en los pacientes (21). Estudios recientes en animales han aumentado nuestro entendimiento de las interacciones complejas entre la injuria viral directa y la respuesta inmune del huésped; así mismo, las técnicas moleculares sensibles han detectado genoma viral en pacientes con sospecha de miocarditis. Esta nueva información ha llevado al reconocimiento de un eslabón causal entre miocarditis viral y desarrollo de cardiomiopatía dilatada (20).
Miocarditis es el término usado para indicar inflamación infecciosa aguda, tóxica o autoinmune del corazón. La miocarditis tóxica reversible ocurre en difteria y algunas veces en endocarditis infecciosa cuando los mecanismos autoinmunes pueden ayudar a contribuir. La infección viral persistente del miocardio fue demostrada por primera vez en la penúltima década del siglo veinte (20). Organismos de lento crecimiento como de Chlamydia y la infección por tripanosomiasis en enfermedad de Chagas son causas de miocarditis crónica. También deben tenerse en cuenta causas no infecciosas como sarcoidosis y enfermedad vascular de colágeno.
La miocarditis aguda y pericarditis aguda no están siempre asociadas y debe hacerse énfasis clínico en una u otra enfermedad. La miocarditis puede ser causada por muchos diferentes tipos de virus y la patogénesis microbiana puede ser compleja. En países occidentales, los enterovirus, especialmente Coxsackie son los más frecuentes (22) (Tablas 4 y 5).


Fisiopatología (Figura 5 y Tabla 6)
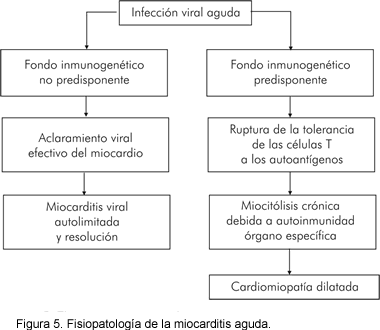
Prevalencia y hallazgos clínicos
La prevalencia de la miocarditis aguda es desconocida porque muchos casos no son reconocidos debido a lo inespecífico de los síntomas o a que son pacientes asintomáticos (algunos cursan con muerte súbita). La miocarditis puede desarrollarse como una complicación de una infección respiratoria superior o gastrointestinal que cursa con síntomas constitucionales, particularmente fiebre, mialgia, malestar y anorexia. Esta respuesta de fase aguda sistémica incrementa la producción de energía pero compromete el desempeño ventricular. La miocarditis puede no desarrollarse hasta pasados varios días o semanas de los síntomas iniciales, incluso después del retorno a la vida diaria.
El diagnóstico es fácil durante epidemias de infecciones por Coxsackie virus pero difícil en casos aislados. Estos pacientes no son vistos por cardiólogo a menos que desarrollen arritmia, colapso hemodinámico o dolor torácico, y la mayoría son dados de alta desde el sistema de salud de primer nivel.
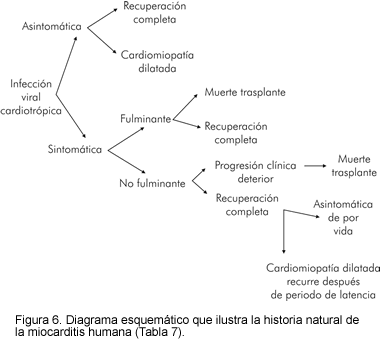
Historia natural (Figura 6)

Exámenes
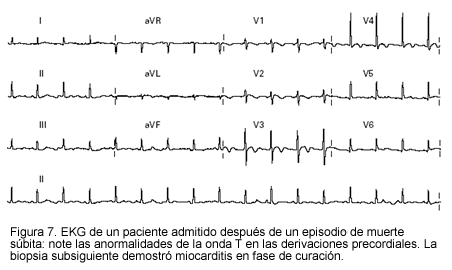
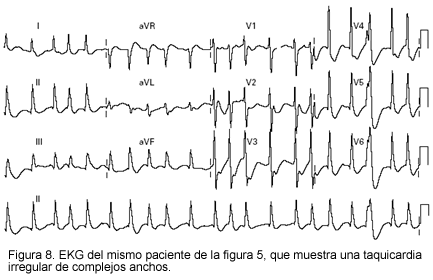
El electrocardiograma puede mostrar taquicardia sinusal, elevación del segmento ST y bloqueos fasciculares, o anormalidades en la conducción atrioventricular. Aunque las anormalidades electrocardiográficas son no específicas, el EKG tiene la virtud de alertar al clínico para iniciar el correspondiente estudio del paciente (Figuras 7 y 8).
La ecocardiografía puede revelar anormalidades generalizadas o segmentarias de la motilidad parietal así como derrames pericárdicos. Permite además excluir otras causas de cambios focales en la motilidad parietal, con el peligro de llevar a confusión con infarto de miocardio ya que ambos se presentan de forma similar (23).
La radiografía de tórax puede ser normal y mostrar cardiomegalia, congestión venosa pulmonar o derrame pleural.
Puede encontrarse evidencia de necrosis de miocitos con un aumento en los niveles de creatinkinasa y/o troponina, indicando miocitólisis. La más alta concentración enzimática ocurre temprano y probablemente retorna a lo normal cerca de una semana después del inicio de los síntomas. Los autoanticuerpos cardíacos pueden demostrarse solamente en la fase tardía del proceso de la enfermedad.
Sólo puede aprobarse un origen viral de la miocarditis si el virus se detecta dentro del miocardio alterado.
El diagnóstico histológico de miocarditis fue clasificado por los criterios de Dallas pero infortunadamente éstos no incluyen inmunohistoquímica.
Criterios diagnósticos de miocarditis (criterios de Dallas)*
Definición de miocarditis
Proceso caracterizado por un infiltrado inflamatorio con necrosis y/o degeneración de miocitos adyacentes no típico del daño asociado a la isquemia de la enfermedad coronaria.
Primera biopsia
- Miocarditis con/sin fibrosis.
- Miocarditis borderline (puede estar indicada una segunda biopsia).
- Ausencia de miocarditis.
Biopsias siguientes
- Miocarditis persistente con/sin fibrosis.
- Miocarditis en resolución con/sin fibrosis.
- Miocarditis resuelta (cicatrizal) con/sin fibrosis.
*Aretz HT et al. A histopathologic definition and classification. Am J Cardiovasc Pathol 1987; 1: 3-14.
El infiltrado inflamatorio se debe clasificar como linfocítico, eosinofílico, neutrofílico, de células gigantes, granulomatoso o mixto; la cantidad de infiltrado inflamatorio de ligero, moderado o grave y focal, confluente o difuso. La cantidad y distribución de la fibrosis, si está presente, se debe especificar como endocárdica, sustitutiva o intersticial.
Tratamiento
El tratamiento de falla cardiaca, arritmias o disfunción ventricular izquierda asintomática asociada con miocarditis aguda, generalmente debe seguir las guías basadas en evidencia estándar (25, 26). Por ejemplo, la iniciación de un IECA más un b-bloqueador es la terapia indicada para el paciente que se presenta con falla cardiaca sistólica debido a miocarditis. Estas terapias se basan en la mala respuesta adaptativa neurohormonal que resulta en falla cardíaca y arritmias y son no dependientes de esta causa específica (miocarditis). Se deben tener en cuenta varias diferencias que son únicas de la miocarditis, (27, 28, 23):
1. Restricción de ejercicio: datos de modelos animales han mostrado que el ejercicio incrementa la inflamación miocárdica y la necrosis, el remodelamiento ventricular izquierdo y la mortalidad en los pacientes con miocarditis. Es así que se recomienda que estos enfermos se abstengan de hacer ejercicio vigoroso por varios meses después del diagnóstico.
2. Anticoagulación: el uso de anticoagulación sistémica permanece controversial en pacientes con falla cardiaca sistólica. El endomiocardio inflamado puede predisponer a trombosis; lo cual ha sido demostrado en modelos murinos, y se ha observado gran frecuencia de trombosis en estudios ecocardiográficos humanos.
3. Arritmias: las soluciones a largo plazo (implante de cardiodesfibrilador, marcapasos permanente) deberían considerarse sólo si hay falla de las medidas temporales dada la naturaleza transitoria de las arritmias en miocarditis y el potencial para la resolución de las arritmias con la recuperación de la función ventricular izquierda.
4. La asistencia mecánica en pacientes en quienes la miocarditis es refractaria, la terapia médica estándar, el soporte médico intensivo y la asistencia mecánica deberían usarse antes de que se considere el transplante miocárdico. Puede ocurrir mejoría espontánea en la función cardíaca aún después de semanas de asistencia mecánica. Aquellos pacientes con miocarditis tienen incremento en las tasas de rechazo del injerto y sobrevida reducida después del transplante cardiaco, y la miocarditis puede recurrir en el aloinjerto (29) (Figura 9).
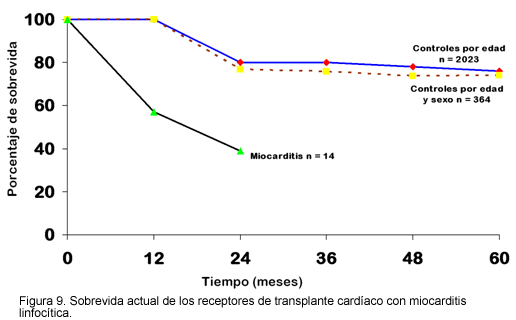
Terapia inmunosupresora
Pocas áreas en la cardiología son más controversiales que el uso de inmunosupresión para el tratamiento de la miocarditis comprobada por biopsia.
Mucha de la incertidumbre alrededor de esta terapia se basa en los resultados disímiles de un gran número de estudios no controlados de terapia inmunosupresora, muchos de los cuales carecen de un adecuado diseño, por lo cual no pueden extraerse conclusiones clínicamente válidas. Debido a la alta tasa de mejoría espontánea en pacientes con miocarditis, cualquier estudio terapéutico debe ser controlado y tener muy bien definidos los puntos finales. El estudio de tratamiento de la miocarditis (30) (Myocarditis treatment trial) es el estudio aleatorizado más grande diseñado específicamente para evaluar la eficacia de la inmunosupresión en miocarditis. Un total de 111 pacientes con miocarditis quienes fueron diagnosticados por biopsia endomiocárdica bajo los criterios de Dallas y con una fracción de expulsión < 45%, fueron aleatorizados a recibir terapia convencional sola o terapia convencional combinada con inmunosupresión (prednisona en todos los pacientes combinados con azatioprina y ciclosporina) por 6 meses. El punto primario fue el cambio en FEVI a las 28 semanas de seguimiento. Los resultados no mostraron diferencia en el cambio en FEVI media (Figura 10) entre los grupos de tratamiento ni diferencia en la sobrevida (Figura 11).
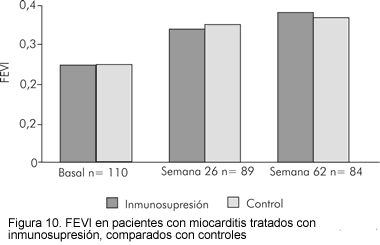
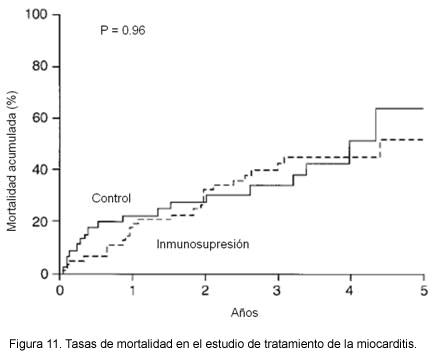
Estos resultados sugieren que no hay un beneficio clínico de la terapia inmunosupresora en miocarditis. De acuerdo con los resultados de este estudio, la terapia inmunosupresora rutinaria no puede recomendarse para el tratamiento de la miocarditis.
Tales resultados han tenido influencia significativa con respecto a la evaluación de la miocarditis. La frecuencia de biopsia endomiocárdica ha disminuido significativamente, llegando a argumentar en varios centros, que la confirmación histológica de la miocarditis no es necesaria porque el plan de tratamiento raramente es alterado por la identificación de inflamación miocárdica (31).
Aunque no hay grandes estudios que soporten el uso de terapia inmunosupresora en miocarditis, este tópico permanece controversial dada la naturaleza inmune de la enfermedad, particularmente cuando el curso clínico es una miocarditis fulminante. Actualmente, aunque no hay guías establecidas, muchos médicos aún inician inmunosupresión en pacientes con miocarditis comprobada por biopsia en quienes el deterioro clínico continúa luego después de que se ha instaurado el tratamiento estándar para la falla cardiaca. El soporte para este enfoque es en gran parte anecdótico, pero probablemente está justificado en pacientes que empeoran cada día.
Terapias en investigación
Se están usando modelos de miocarditis murina para definir mejor los mecanismos inmunológicos precisos de la enfermedad. Éstos permitirán los refinamientos puntuales en la inmunosupresión y un blanco inmune deletéreo más específico. A pesar de que los mecanismos inmunológicos aún no han sido bien definidos, se continúan haciendo estudios que usan varios de estos refinamientos de terapia inmunosupresora para miocarditis humana y cardiomiopatías de reciente inicio. La terapia inmunomoduladora con inmunoglobulina intravenosa mostró estar asociada con mejoría en la función cardiaca en una pequeña cohorte de pacientes adultos con miocarditis y cardiomiopatía aguda (32).
Conclusiones
El diagnóstico y manejo de la miocarditis aguda permanece como un reto mayor para los cardiólogos y todavía hoy en día puede ser considerada más un arte que una ciencia. El diagnóstico a menudo se sospecha pero raramente se confirma y aún si éste se realiza correctamente, no hay guías para el tratamiento específico. Así, los médicos a menudo deben manejar la cardiomiopatía aguda de manera estándar con la esperanza de que el paciente experimente recuperación espontánea o al menos se estabilice. Raras veces se encuentran pacientes que exhiban continuo deterioro clínico llevando a la consideración de terapias inmunosupresoras no soportadas metodológicamente en la literatura, soporte mecánico y en última instancia transplante cardiaco.
Bibliografía
1. Maisch B, Ristic AD. The classification of pericardial disease in the age of modern medicine. Curr Cardiol Rep 2002; 4: 13-21. [ Links ]
2. Spodick DH. Pericardial diseases. In: Braunwald E, Zipes DP, Libby P, eds. Heart disease, 6th ed. Philadelphia: WB Saunders, 2001. p. 1823-76. [ Links ]
3. Maisch B, Adler Y, Erbel R, et al. Scientific statement of the European Society of Cardiology: diagnosis and management of pericardial diseases. Eur Heart J 2004; 1-28. [ Links ]
4. Glockner J. Image of pericardial disease. Magn Reson Imaging Clin N Am 2003; 11: 149-162. [ Links ]
5. Maisch B, Bethge C, Drude L, et al. Pericardioscopy and epicardial biopsy: new diagnostic tools in pericardial and perimyocardial diseases. Eur Heart J 1994; 15(suppl C): 68-73. [ Links ]
6. Maisch B, Ristic AD, Pankuweit S. Intrapericardial treatment of autoreactive pericardial effusion with triamcinolone: the way to avoid side effects of systemic corticosteroid therapy. Eur Heart J 2002; 23: 1503-8. [ Links ]
7. Meyers DG, Meyers RE, Prendergast TW. The usefulness of diagnostic tests on pericardial fluid. Chest 1997; 111: 1213-21. [ Links ]
8. Hakim JG, Ternouth I, Mushangi E, et al. Double blind randomised placebo controlled trial of adjunctive prednisolone in the treatment of effusive tuberculous pericarditis in HIV seropositive patients. Heart 2000; 84: 183-8. [ Links ]
9. Koh KK, Kim EJ, Cho CH, et al. Adenosine deaminase and carcinoembryonic antigen in pericardial effusion diagnosis, especially in suspected tuberculous pericarditis. Circulation 1994; 89: 2728-35. [ Links ]
10. Alpert M, Ravenscraft M. Pericardial Involvement in End-Stage Renal Disease. Am J Med Sci 2003; 325(4): 228-236. [ Links ]
11. Gupta K, Mathur V. Diagnosis of Pericardial Disease Using Percutaneous Biopsy. Case Report and Literature Review. Tex Heart Inst J 2003; 30: 130-3. [ Links ]
12. Seferovic P, Ristic A, Maksimovic R, et al. Diagnostic value of pericardial biopsy: improvement with extensive sampling enabled by pericardioscopy. Circulation 2003; 107: 978-83. [ Links ]
13. Maisch B, Ristic AD, Pankuweit S. Intrapericardial treatment of autoreactive pericardial effusion with triamcinolone: the way to avoid side effects of systemic corticosteroid therapy. Eur Heart J 2002; 23: 1503-8. [ Links ]
14. Nugue O, Millaire A, Porte H et al. Pericardioscopy in the etiologic diagnosis of pericardial effusion in 141 consecutive patients. Circulation 1996; 94: 1635-41. [ Links ]
15. Seferovic PM, Ristic AD, Maksimovic R, et al. Diagnostic value of pericardial biopsy: improvement with extensive sampling enabled by pericardioscopy. Circulation 2003; 107: 978-83. [ Links ]
16. Seferovic PM, Ristic AD, Maksimovic R, et al. Therapeutic pericardiocentesis: up-to-date review of indications, efficacy, and risks. In: Seferovic PM, Spodick DH, Maisch B, eds, Maksimovic R, Ristic AD, associate eds. Pericardiology: contemporary answers to continuing challenges. Belgrade: Science, 2000. p. 417-26. [ Links ]
17. Tsang TS, Enriquez-Sarano M, Freeman WK, et al. Consecutive 1127 therapeutic echocardiographically guided pericardiocentesis: clinical profile, practice patterns, and outcomes spanning 21 years. Mayo Clin Proc 2002; 77: 429-36. [ Links ]
18. Sagristá J, Bonet L, Ferrer J,et al. Guías de práctica clínica de la Sociedad Española de Cardiología en patología pericárdica. Rev Esp Cardiol 2000; 53: 394-412. [ Links ]
19. Basilio E, Manterota F, Ballester M. Guías de práctica clínica de la Sociedad Española de Cardiología en miocardiopatías y miocarditis. Rev Esp Cardiol 2000; 53: 360-393. [ Links ]
20. Kawai C. From myocarditis to cardiomyopathy: mechanisms of inflammation and cell death: learning from the past for the future. Circulation 1999; 99: 1091-100. [ Links ]
21. Feldman A, McNamara D. Myocarditis. N Engl J Med 2000; 343: 1388-1398. [ Links ]
22. Bowles NE, Towbin JA. Molecular aspects of myocarditis. Curr Op Cardiol 1998; 13: 179-84. [ Links ]
23. Herskowitz A, Ansari AA. Myocarditis. In Braunwald E, ed: Atlas of Heart Diseases. Current Medicine, Philadelphia 1995; Vol 2:9.2-9.24. [ Links ]
24. Mason JW: Distinct forms of myocarditis. Circulation 1991; 83: 1110-1111. [ Links ]
25. Williams JF, Bristow MR, Fowler MB, et al. Evaluation and management of heart failure: ACC/AHA Task Force Report. J Am Coll Cardiol 1995; 26: 1376-1398. [ Links ]
26. Packer M, Cohn JN. Consensus recommendations for the management of chronic heart failure: on behalf of the membership of the advisory council to improve outcomes nationwide in heart failure. Am J Cardiol 1999; 83(2A):1A-38A. [ Links ]
27. OConnell JB: Diagnosis and medical treatment of inflammatory cardiomyopathy. In Topol EJ, ed: Textbook of Cardiovascular Medicine. Lippincott-Raven, Philadelphia 1998;2309 –2336. [ Links ]
28. Baughman KL, Hruban RH: Treatment of myocarditis. In Smith TW, ed: Cardiovascular Therapeutics: A Companion to Braunwalds Heart Disease. W.B. Saunders, Philadelphia 1996;243–253. [ Links ]
29. OConnell JB, Dec GW, Goldenberg IF, et al: Results of heart transplantation for active lymphocytic myocarditis. J Heart Transplantation 1990;9:352 [ Links ]
30. Mason JW, OConnell JB, Herskowitz A, et al. A clinical trial of immunosuppressive therapy for myocarditis. The Myocarditis Treatment Trial Investigators. N Engl J Med 1995; 333:269-275. [ Links ]
31. McNamara DM, Starling RC, Dec GW, et al. Intervention in myocarditis and acute cardiomyopathy with immune globulin: results from the randomized placebo controlled IMAC trial. Circulation 1999; 100(suppl):I1–I21. [ Links ]
32. McNamara DM, Rosenblum WD, Janosko KM, et al. Intravenous immune globulin in the therapy of myocarditis and acute cardiomyopathy. Circulation 1997; 95: 2476 -2478. [ Links ]
33. León-Galindo J, Uribe-Vélez C. Pericardioscopy: a new diagnostic technique for pericardial disease. Am J Cardiol 1982; 49:960. [ Links ]