Introducción
El coronavirus es un virus ARN con un tamaño de 27-32 kilobases, de la familia Coronaviridae, que ha sido descrito como un agente zoonótico que afecta el tejido entérico y respiratorio de los animales infectados. En los humanos produce alteraciones respiratorias, la mayoría de las veces autolimitadas, y cada año es causa de un 15-30% de las infecciones de vías respiratorias altas1. Los coronavirus se pueden diferenciar en cuatro géneros, alfa, beta, delta y gamma; de ellos, hasta el momento se sabe que los alfa y los beta son los que infectan a los humanos.
El coronavirus asociado al síndrome respiratorio agudo grave (SARS-CoV) fue descubierto en 2002 en Guangdong (China) como agente etiológico de la enfermedad a la debe su nombre. Posteriormente, en 2012, se describió el virus relacionado con el síndrome respiratorio de Oriente Medio (MERS-CoV), el cual presentó una tasa de mortalidad del 50% hasta que la epidemia se controló en 2014. En 2019 apareció el SARS-CoV-2, un agente que originó el síndrome respiratorio agudo grave y que se expandió de Wuhan (China) al resto del mundo, declarándose como emergencia de salud pública el 30 de enero de 2020 y 3 meses después, el 11 de marzo, como pandemia mundial por la Organización Mundial de la Salud1. En el momento de escribir esta revisión, Colombia reportaba ya 1,686,131 infectados y 44,187 fallecidos, con un número reproductivo efectivo que pasó de 2.28 al principio de la pandemia a 1.11 y una tasa de letalidad que pasó del 5% al 3.18%.
Justificado por las estadísticas mundiales y de Colombia, donde la mortalidad por la infección está relacionada con la comorbilidad de los pacientes (hipertensión arterial 23%, diabetes mellitus 23%, enfermedades respiratorias 15%, enfermedades cardiovasculares 8% y obesidad 8%), el objetivo de esta revisión es describir las alteraciones metabólicas y la relación entre la diabetes mellitus, la obesidad, el síndrome metabólico y la dislipidemia con la morbilidad y la mortalidad vinculadas a la COVID-19.
Obesidad y adiposidad como predictores de desenlaces de la COVID-19
La obesidad se ha asociado a un curso clínico más grave de las infecciones virales, entre ellas la influenza asiática, la influenza de Hong Kong y la pandemia por virus H1N1 de 1957, 1968 y 2009, respectivamente2.
Para comprender la asociación de la COVID-19 y la obesidad es necesario recordar los mecanismos de entrada del SARS-CoV-2 al organismo, que dependen de la fusión de la membrana viral y de la membrana celular del huésped, mediada por trímeros de la proteína S del virus (S1 y S2) que se unen al heterodímero de la enzima convertidora de angiotensina 2 (ECA2)2,3, dando como resultado la liberación de ARN viral al citoplasma4. Los mayores grados de expresión de la ECA2 se realizan en el intestino delgado, los testículos, los riñones, el corazón, la tiroides, el tejido adiposo, el pulmón, el colon, el hígado, la vejiga y las glándulas adrenales, dejando por último los tejidos con menor expresión de la enzima, entre los que se encuentran el bazo, la médula ósea, el cerebro, el músculo y los vasos sanguíneos. Esto explica la afectación multisistémica de la enfermedad5.
Posterior a la integración del virus en la célula huésped, la infección resulta en un aumento de la apoptosis celular y un reclutamiento de células inflamatorias, causando la apoptosis de células CD3, CD4 y CD8, lo que desencadena la tormenta de citocinas, caracterizada por la elevación de las interleucinas (IL) 6, 7 y 2, el factor de necrosis tumoral alfa (TNF-a), el ligando CXC de quimiocinas, la proteína quimioatrayente de monocitos 1 (MCP-1) y otras moléculas inflamatorias. En presencia de obesidad, los adipocitos hipertróficos producen gran cantidad de citocinas, como IL-8 e IL-6, inhibidor del activador de plasminógeno 1, leptina y MCP-1/CCL2, lo que lleva a un aumento en el reclutamiento de macrófagos, especialmente M1, que a su vez producen moléculas inflamatorias similares a las descritas previamente (IL-1b, IL-6, IL-8, TNFa y MCP-1)2.
Todo lo anterior lleva a una alteración de la inmunidad innata en estos pacientes, pero la inmunidad adaptativa también se encuentra afectada, con disminución de las células T reguladoras y tendencia hacia líneas proinflamatorias Th1, Th17 y Th222,6. El efecto final es el solapamiento de un aumento de citocinas desencadenado en la infección por SARS-Cov-2, sobre la base proinflamatoria de estos pacientes.
Los eventos previos en los pacientes con síndrome metabólico, obesidad y diabetes mellitus empeoran en presencia de infección por SARS-CoV-2; algunos de ellos se describen en la tabla 1 7.
Tabla 1 Eventos desencadenados en el síndrome metabólico, la diabetes mellitus y la COVID-19
| Patología/eventos | Síndrome metabólico y diabetes mellitus | COVID-19 |
|---|---|---|
| Inflamatorios | Inflamación crónica | Tormenta de citocinas |
| Cardiometabólicos | Hipertensión, hiperglucemia, disfunción endotelial, alteraciones metabólicas | Daño multiorgánico, hipercoagulación, hipoxia muscular, alteraciones electrolíticas |
| Renales | Lesión renal crónica | Infección directa, hipoxia, lesión renal aguda |
| Pulmonares | Fibrosis, alteración del surfactante, alteración del movimiento diafragmático | Daño de la barrera alveolar, neumonía, edema, alteración en la difusión de oxígeno, alteración de la composición y la cantidad de surfactante |
| Nerviosos | Alteración cognitiva de origen vascular, demencia, ataque cerebrovascular, alteración de la glucemia, convulsiones | Ataque cerebrovascular, convulsiones, alteración cognitiva |
Adaptada de Ayres7.
Posterior a la infección por SARS- CoV-2 se han observado complicaciones a largo plazo, entre las que se encuentran alteración en la sensibilidad a la insulina, daño en los islotes pancreáticos con reducción en la secreción de insulina, debilidad y atrofia muscular con cambios en la capacidad para realizar ejercicio, cambios en la composición corporal con aumento de la masa grasa, y elevación de los triglicéridos y de los ácidos grasos circulantes; todas ellas podrían conducir finalmente a un aumento del riesgo de eventos cardiovasculares futuros7.
Se ha asociado la presencia de obesidad con peores desenlaces clínicos de la COVID-19. En un estudio realizado en Nueva York con más de 4000 pacientes, el principal predictor para la hospitalización fue la edad mayor de 75 años (odds ratio [OR]: 66.8; intervalo de confianza del 95% [IC95%] 44.7-102.6), seguida del índice de masa corporal (IMC) > 40 kg/m2 (OR: 6.2; IC95%: 4.2-9.3)8. El estudio del Bronx, que incluyo 200 participantes, concluyo que el IMC > 35 kg/m2 es una variable independiente asociada a mortalidad en pacientes hospitalizados (OR: 3,78; IC95%: 1.45-9.83; p < 0.006)9.
En un metaanálisis que incluyó 14 estudios se reportó que un IMC > 25 kg/m2 (OR: 3.68; IC95%: 1.54-8.83; p = 0.003), la presencia de comorbilidad grave (OR: 1.84; IC95%: 1.61-2.09; p < 0.00001), necesitar soporte ventilatorio (OR: 6.98; IC95%: 5.37-9.07; p < 0.00001) y desarrollar enfermedad grave (OR: 2.03; IC95%: 1.75-2.36; p < 0.00001) se asociaron a mayor mortalidad en los pacientes con infección por SARS-CoV-210.
Por otro lado, la distribución de la grasa corporal también está relacionada con efectos no deseables. En un estudio realizado en Alemania se reportó que cada centímetro adicional de circunferencia abdominal aumenta 1.25 veces la probabilidad de ventilación mecánica (p = 0.008) y 1.13 veces la probabilidad de ingreso en la unidad de cuidados intensivos (p = 0.009)11.
Relación entre diabetes mellitus tipo 2 y COVID-19
La diabetes mellitus tipo 2 se ha considerado un factor de riesgo para adquirir la infección por coronavirus. Históricamente, la hipertensión arterial y la diabetes han sido identificadas como la comorbilidad más común para otras infecciones por coronavirus, tales como el SARS-CoV y el MERS-CoV12.
Dependiendo de la región y de las series analizadas, la prevalencia y el riesgo de complicaciones cambian en forma importante. La prevalencia media de diabetes en pacientes diagnosticados de infección por SARS-CoV-2 es del 7-10%, y llega hasta el 35%13 (Tabla 2)14.
Tabla 2 Desenlaces en personas con COVID-19 de acuerdo con el control glucémico
| Autores | Tipo de estudio | Población | Prevalencia de diabetes | Parámetros | Desenlace | HR y OR ajustadas |
|---|---|---|---|---|---|---|
| Williamson, et al. | Estudio de cohorte | 17,425,445 | 10% | HbA1c ≥ 7.5% | Mortalidad | 2.36 (2.18-2.56) |
| Holman, et al. | Estudio de cohorte | 2,889,210 | 100% DM2 | HbA1c ≥ 7,5% | Mortalidad | 1.62 (1.48-1.79) |
| Li, et al. | Estudio retrospectivo | 269 | 19% | Hiperglucemia durante hospitalización | Mortalidad | 1.77 (1.11-2.84) |
| Chen, et al. | Estudio retrospectivo | 904 | 15% | Hiperglucemia | Mortalidad | 1.08 (1.01-1.16) |
| Zhu, et al. | Estudio retrospectivo | 818 | 100% | Glucemia media durante estancia hospitalaria 6-4 mmol/l (RIQ: 5.2-7.5) | SDRA | 0.41(0.25-0.66) |
| Zhu, et al. | Estudio retrospectivo | 818 | 100% | Glucemia media durante estancia hospitalaria 6-4 mmol/l (RIQ: 5.2-7.5) | Lesión miocárdica | 0.21 (0.07-0.59) |
DM2: diabetes mellitus tipo 2; HbA1c: hemoglobina glucosilada; HR: hazard ratio; OR: odds ratio; RIQ: rango interquartílico; SDRA: síndrome de dificultad respiratoria aguda.
Adaptada de Apicella, et al.14
¿Aumenta la diabetes mellitus tipo 2 el riesgo de complicaciones y de muerte por COVID-19?
De acuerdo con diferentes reportes, los pacientes con diabetes mellitus tipo 2 y síndrome metabólico tienen mayor riesgo de muerte, siendo estas afecciones predictoras independientes de morbilidad y mortalidad12.
En su metaanálisis de mortalidad y morbilidad, Kumar, et al.15 incluyeron 16,003 pacientes con diagnóstico de COVID-19 de 33 estudios. La prevalencia de diabetes mellitus tipo 2 en los pacientes con COVID-19 fue del 9.8% (IC95%: 8.7-10.9). La diabetes se asoció a mortalidad con una OR de 1.9 (IC95%: 1.37-2.64; p < 0.01), e igualmente con la gravedad con una OR de 2.75 (IC95%: 2.09-3.62; p < 0.01) y un aumento en el desenlace combinado de mortalidad o gravedad con una OR de 2.16 (IC95%: 1.74-2.68; p < 0.01)15.
Mantovani, et al.16, en su metaanálisis de gravedad y mortalidad intrahospitalaria, incluyeron 78,874 pacientes hospitalizados tomados de 83 estudios con diagnóstico confirmado de COVID-19. La prevalencia en pacientes con diabetes mellitus tipo 2 fue del 14.3% (IC95%: 12.6-16.0). Llama la atención que la prevalecia de diabetes mellitus tipo 2 fue mayor en los no asiáticos (23.3 vs 11.0%) y en los mayores de 60 años (23.3 vs 8,79%). La preexistencia de diabetes se asoció a dos veces más riesgo de tener COVID-19 grave (OR: 2.1; IC95%: 1.71-2.5; I2 = 41.5%) y tres veces más riesgo de morir (OR: 2.68; IC95%: 2.0-3.4; I2 = 46%).
Huang, et al.17, en un metaanálisis y metarregresión, evaluaron la diabetes mellitus tipo 2 en relación con el aumento de la mortalidad y la gravedad de la COVID-19 en presencia de neumonía. Incluyeron 6452 pacientes de 30 estudios. El metaanálisis mostró que la diabetes se asoció a un pobre desenlace compuesto (riesgo relativo [RR]: 2.38; IC95%: 1.88-3.03; p < 0.001), un aumento en la mortalidad (RR: 2.12; IC95%: 1.44-3.11; p < 0.001) y mayor gravedad (RR: 2.45; IC95%: 1.79-3.35; p < 0.001), y significativamente aumentó la probabilidad de síndrome de dificultad respiratoria aguda (RR: 4.64; IC95%: 1.44-3.11; p < 0.001) y de progresión de la enfermedad (RR: 3.31; IC95%: 1.08-10.14; p < 0.001). La metarregresión mostró que la asociación con el pobre desenlace compuesto fue influenciada por la edad (p = 0.003) y la hipertensión (p < 0.001)16 (Tabla 3)17.
Tabla 3 Desenlaces en personas con COVID-19 y diabetes preexistente
| Autores | Tipo de estudio | Población | Prevalencia de diabetes | Desenlace | HR y OR ajustadas |
|---|---|---|---|---|---|
| Kumar, et al. | Metaanálisis | 16,003 | 9.8% | Enfermedad grave | 2.75 (2.09-3.62) |
| Kumar, et al. | Metaanálisis | 16,003 | 9.8% | Mortalidad | 1.90 (1.37-2.64) |
| Li, et al. | Metaanálisis | 1525 | 9.7% | Admisiones a UCI | 2.21 (0.88-5.57) |
| Fadini, et al. | Metaanálisis | 1687 | No datos | Enfermedad grave | 2.26 (0.98-4.82) |
| Fadini, et al. | Metaanálisis | 355 | 35.5% | Mortalidad | 1.75 |
| Roncon, et al. | Metaanálisis | 1382 | No datos | Admisiones a UCI | 2.79 (1.85-4.22) |
| Roncon, et al. | Metaanálisis | 471 | No datos | Mortalidad | 3.21 (1.82-5.64) |
HR: hazard ratio; OR: odds ratio; UCI: unidad de cuidados intensivos.
Adaptada de Apicella, et al.14
Factores metabólicos de riesgo para desenlaces adversos
La informacion más importante fue generada por el estudio CORONADO18, un estudio multicéntrico obsevacional realizado en pacientes con diabetes hospitalizados por COVID-19 en 53 centros. El desenlace primario combinado fue intubación orotraqueal o muerte en los 7 días luego de la hospitalización, con la intención de determinar las variables clínicas y biológicas relacionadas con el desenlace. El análisis final fue aplicado en 1314 participantes, de los que el 88% tenían diabetes mellitus tipo 2, el 64% eran hombres, la edad media era de 69.8 años y el IMC medio era de 28.4 kg/m2. El desenlace primario ocurrió en el 29% (IC95%: 26.6-31.5; p < 0.005) y el 10.6% de los participantes fallecieron. En el análisis multivariado, las características previas al ingreso asociadas de manera significativa con el desenlace primario fueron el sexo masculino, el IMC y el tratamiento previo con bloquedores del sistema renina-angiotensina-aldosterona. No influyeron la edad, el tipo de diabetes, la hemoglobina glucosilada (HbA1c), las complicaciones previas relacionadas con la diabetes ni el tipo de terapia previa para esta. En el análisis multivariado con covariables previo a la admisión, solo el IMC permanecía positivamente asociado con el desenlace primario (OR: 1.28; IC95%: 1.10-3.35; p < 0.005). El riesgo de muerte al séptimo día fue evaluado en variables independientes, encontrando asociación con la edad (OR: 2.48; IC95%: 1.74-3.53; p < 0.005), el tratamiento para apnea del sueño (OR: 2.80; IC95%: 1.46- 5.38; p < 0.005) y las complicaciones microvasculares (OR: 2.14; IC95%: 1.16-3.94; p < 0.005) y macrovasculares (OR: 2.54; IC95%: 1.44-4.50; p < 0.005)18.
Los valores de HbA1c no influyeron en los desenlaces en el estudio CORONADO, pero en otros sí se ha encontrado asociación. Wang, et al.19 realizaron un estudio retrospectivo de 132 pacientes con COVID-19 asignados a tres grupos según la cifra de HbA1c, con mediciones simultáneas de saturación arterial de oxígeno y de marcadores de inflamación sistémica. El grupo A tenía una HbA1c media del 5.7%, el grupo B del 6.4% y el grupo C del 7.5%. Los grupos B y C tenían valores más altos de proteína C reactiva (PCR), velocidad de sedimentación globular (VSG), fibrinógeno, IL-6 y feritina sérica (p < 0.05). El análisis de correlación mostró una relación lineal negativa entre la saturación arterial de oxígeno y los valores de HbA1c (p = 0.01), y una relación lineal positiva con los valores de ferritina, PCR, fibrinógeno y VSG (p < 0.05)19.
Relación endocrinológica directa
La ECA2 tiene como función la transformación de angiotensina I en angiotensina 1-9 y de angiotensina II en angiotensina 1-7, actuando como el punto regulatorio clave para el sistema de la angiotensina. La combinación de una actividad de la ECA-1 incrementada y de la ECA-2 inhibida eleva la angiotensina II intacta, favorece una respuesta proinflamatoria y estimula la secreción de aldosterona. Este efecto no solo aumenta la presión arterial y modifica los niveles de potasio, sino que también incrementa la permeabilidad vascular y aumenta el riesgo de síndrome de dificultad respiratoria agudo. La angiotensina 1-7 tiene el efecto contrario, con potenciales efectos antiinflamatorios y antifibróticos. Se ha postulado que los individuos con formas más graves de COVID-19 tienen un disbalance en la activación de estas vías, con un incremento en la activación de la angiotensina II que actúa sobre el receptor de la angiotensina 1 (AT1), lo cual ocurre en presencia de diabetes mellitus tipo 2, hipertensión y estados de resistencia a la insulina12.
Los mecanismos específicos que explican la asociación entre diabetes mellitus tipo 2 y SARS-CoV-2 podrían estar relacionados con:
—Los valores elevados de glucosa pueden aumentar directamente las concentraciones de glucosa en las secreciones de la vía aerea. Los estudios in vitro muestran que la exposición a valores de glucosa elevados en el epitelio pulmonar aumenta de manera significativa la infección por el virus de la influenza y su replicación. En general se acepta que los pacientes con diabetes mellitus tipo 2 cursan con mayores cargas virales o desarrollan formas más graves en caso de infección por virus respiratorios6.
—La hiperglucemia crónica afecta la función pulmomar. En modelos animales se han documentado un aumento de la permeabilidad de la membrana alveolocapilar y un colapso del epitelio alveolar6.
—El páncreas endocrino expresa el receptor ECA2, y la unión del SARS-CoV-2 al receptor le permite entrar a las células de los islotes pancreaticos y causar disfunción aguda de las celulas beta, lo cual puede generar hiperglucemia aguda o modificar el control glucémico previo12.
—Los pacientes con diabetes mellitus tipo 2 presentan mayor riesgo de infección, principalmente por defectos en la inmunidad innata que afectan a la fagocitosis, la quimiotaxis de neutrófilos y la inmunidad celular13.
—En humanos se ha demostrado que la hiperglucemia aguda regula al alta la expresión del receptor ECA2, facilitando que el virus penetre en la célula. La presencia de ECA2 inducida en otros tejidos, incluyendo pulmón, hígado y corazón, podría favorecer la inclusión del virus en las células, con un aumento en la probabilidad de falla multiorgánica13.
—Por el contrario, en la hiperglucemia crónica se observa una reducción en la expresión de ECA2, con cambio en la relación angiotensina II/angiotensiona 1-7, como ya se explicó. Este fenómeno favorecería el evento inflamatorio generado por el virus, agravando la inflamación crónica de bajo grado preexistente en los pacientes con diabetes mellitus tipo 2, obesidad y síndrome metabólico, y empeorando el síndrome de liberación de citocinas con una respuesta inflamatoria aumentada y no controlada13,20.
—Incremento en los valores de plasmina y de furina, que igualmente están involucradas en la entrada del virus a la célula21.
La ECA2 convierte la angiotensina I y la angiotensina II en angiotensina 1-9 y angiotensina 1-7, respectivamente. La ECA2 se expresa en el pulmón, el riñón, el corazón y el páncreas, y actúa como facilitador para la entrada del SARS-CoV-2 en la célula. Estas facilidades en la expresión viral durante la entrada del virus a la célula del huésped causan lesiones orgánicas y deficiencia de insulina, contribuyendo así a la hiperglucemia. El incremento de la ECA2 podría convertir la angiotensina II en angiotensina 1-7, que actúa sobre el receptor Mas1 para desencadenar efectos antiinflamatorios e inhibe el receptor AT1, favoreciendo la vasodilatación. Sin embargo, al menos en los usuarios de fármacos inhibidores de la ECA (IECA), los valores de angiotensina II serán bajos y el beneficio neto de la regulación positiva de ECA2 es incierto. La infección por SARS-CoV-2 regula a la baja la expresión de ECA2, lo que disminuye la angiotensina 1-7, reduciendo sus efectos antiinflamatorios y potencialmente empeorando la vulnerabilidad del órgano a la infección (Fig. 1).
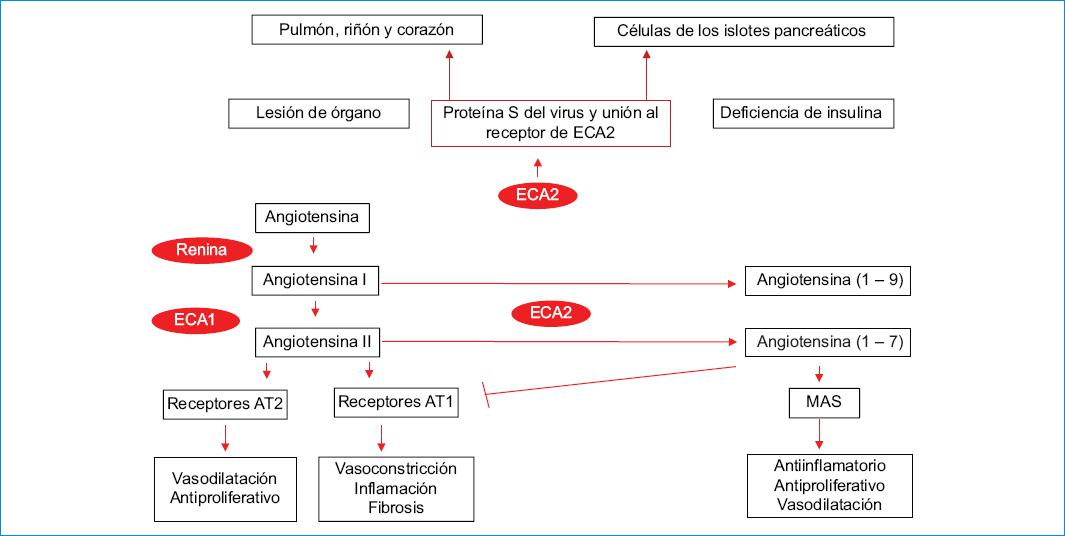
Figura 1 Relación entre el SARS-CoV-2 y SRAA. AT1: receptor tipo 1 de la angiotensina II; AT2: receptor tipo 2 de la angiotensina II; ECA1: enzima convertidora de angiotensina 1; ECA2: enzima convertidora de angiotensina 2; MAS: receptor acoplado a la proteína G; SRAA: sistema renina angiotensina aldosterona.
Las diferentes sociedades científicas del mundo, a pesar de todo lo mencionado, recomiendan que los pacientes que vienen utilizando IECA y antagonistas de los receptores de la angiotensina II (ARA II) para la hipertensión arterial o para la insuficiencia cardiaca no los suspendan, ya que pueden generar más daño que beneficio. En el congreso de la Sociedad Europea de Cardiología de 2020 se presentó el estudio BRACE-CORONA, que refuerza que no hay justificación para suspender los IECA y los ARA II en los pacientes que los vienen tomando y presentan COVID-19.
Dislipidemia y COVID 19
Aparte de promover el transporte reverso del colesterol desde la periferia hasta el hígado, la lipoproteína de alta densidad (HDL) tiene otras propiedades, como la neutralización del lipopolisacárido y el ácido lipoteicoico presentes en agentes patógenos, y propiedades antiinflamatorias, antitrombóticas, protectoras antioxidantes y antiapoptosis, y de protección del endotelio22,23.
La interacción de los receptores Toll like de macrófagos y células T con las moléculas de apolipoproteína A-I y M (ApoE y ApoC-III en menor medida) de HDL participan en la respuesta a estados como sepsis, neumonía y primoinfección por el virus de la inmunodeficiencia humana (VIH)24 considerándose parte importante de los mecanismos moduladores del sistema inmunitario22.
El estado inflamatorio generado por la respuesta a la infección por SARS-CoV-2 induce respuestas que son modificadas por la HDL mediante las ApoA-I y Apo-E, por su actividad inmunomoduladora y antioxidante22,23. Por medio de las ApoE y ApoC-III presentes en la HDL se genera una disminución de la actividad de la lipoproteína lipasa. La señalización de radicales libres, la cual está elevada en las células huésped con una infección viral, acelera la degradación de HDL y de lipoproteínas de baja densidad (LDL) en el contexto de infección por SARS-CoV-225, lo que conduce a la acumulación de moléculas de lipoproteínas de muy baja densidad (VLDL) y de triglicéridos22.
Por otro lado, durante el proceso inflamatorio, la LDL y su principal lipoproteína la ApoB se oxidan en LDL oxidada, mediante la vía de receptores de lectina tipo C22,23, lo que disminuye los niveles de LDL. Se ha postulado que esto contribuye al aumento de la permeabilidad vascular causado por la infección por SARS-CoV-2 y favorece la fuga de LDL en los espacios alveolares para formar exudado, el cual contiene gran cantidad de proteínas y colesterol25,26.
El estímulo continuo de la cascada inflamatoria genera una disminución de la esterificación del colesterol, con disminución del retorno de los ésteres de colesterol al hígado, ya sea directamente por la interacción con el receptor eliminador hepático de clase B tipo 1 o indirectamente después de la transferencia a LDL por la proteína de transferencia de éster de colesterol y la inclusión por los receptores de LDL hepáticos22.
Adicionalmente, el daño hepático generado por la infección por SARS-CoV-2 podría interferir con el consumo de LDL, lo cual reduciría la biosíntesis de este y la disminución de ApoA-I en la molécula de HDL. El aumento de citocinas proinflamatorias, como el TNF-a, la IL-6 y la IL-1b, en la infección por este virus puede alterar la función hepática, afectando el transporte y la regulación del colesterol, lo que podría estar reflejado por la elevación de las transaminasas descrita en esta población23,25-28.
Hu, et al.29 describieron que en personas con neumonía por SARS-CoV-2 ocurre un descenso del colesterol total, del colesterol HDL y del colesterol LDL hasta el noveno día de instauración de los síntomas, y que posteriormente aumentan hasta el día 16 en los sujetos del estudio que egresaban del hospital29.
La infección por SARS-CoV-2 genera una inflamación sistémica con el consecuente consumo de lipoproteínas. Esta relación entre inflamación y lipoproteínas fue descrita por Li, et al.23, quienes documentaron que las relaciones PCR/HDL y PCR/ApoAI están asociadas con la gravedad de la enfermedad evaluada mediante el índice SOFA (R: 0.519 y 0.516; p < 0.001). Wei, et al.26 encontraron una correlación inversa entre las cifras de PCR y las de LDL, colesterol total y HDL (R: −0.290, −0.332 y −0.0351; p < 0.001), y una relación inversa entre la IL-6, el colesterol LDL y el colesterol total (R: −0176 y P: 0.032; R: 0,170 y P: 0.038), siendo un determinante de gravedad en este grupo de sujetos.
Conclusiones
La infección por SARS-CoV-2 ha generado innumerables investigaciones y publicaciones, y hasta el momento no terminamos de conocer todas las manifestaciones del virus en el organismo. Estamos a la espera de una amplia vacunación, pero mientras terminan los estudios, el número de casos y de muertes sigue en aumento, y por lo tanto hay que recomendar y acatar el distanciamiento social, el adecuado uso del tapabocas y el lavado de manos como las estrategias fundamentales. Es importante mencionar que el Ministerio de Salud colombiano, en su plan de priorización de la población a vacunar, en la fase 1 incluirá pacientes con comorbilidad, y dentro de esta se han seleccionado las enfermedades hipertensivas, la diabetes mellitus, la enfermedad renal crónica, la enfermedad pulmonar obstructiva crónica, el asma, la infección por VIH, el cáncer, la tuberculosis y la obesidad.
En esta revisión hemos analizado las principales manifestaciones en el metabolismo, incluyendo el sobrepeso, la obesidad, la diabetes mellitus y la dislipidemia como factores de riesgo importantes para la morbilidad y la mortalidad de las personas con COVID-19.














