Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Universitas Scientiarum
Print version ISSN 0122-7483
Univ. Sci. vol.18 no.2 Bogotá May/Aug. 2013
Conductividad iónica en nuevos compósitos (PEO)10(CF3COONa)-X% Al2O3
Ionic conductivity of (PEO)10(CF3COONa)-X % Al2O3 composites
Condutividade iónica em compósitos (PEO)10 (CF3COONa)-X % Al2O3
Nori M. Jurado1* , I. Delgado2, R. A. Vargas2
*Edited by Rafael Baquero & Alberto Acosta
1Departamento de Física, Universidad del Tolima A.A. 546, Ibagué-Colombia
2Departamento de Física, Universidad del Valle, A.A. 25360, Cali-Colombia
Received: 20-03-2013 Accepted: 11-07-2013 Published on line: 30-07-2013
Para citar este artículo / To cite this article
Jurado NM, Delgado I, Vargas RA (2013) Conductividad iónica en nuevos compositos (PEO)10(CF3COONa)-X % Al2O3. Universitas Scientiarum 18(2): 173-180 doi: 10.11144/Javeriana. SC18-2.cinc
Resumen
Se incrementó la conductividad iónica del electrolito sólido polimérico (PEO)10CF3COONa mediante formación de nuevos compositos, adicionando partículas de óxido de aluminio (Al2O3) como relleno. Los compositos fueron preparados por disolución en solvente líquido y la caracterización por espectroscopia de impedancias (EI) con configuración de electrodos Pt/electrolito/Pt Reducción de hasta dos órdenes de magnitud en la resistencia, se observó en diagramas de Nyquist; combinando polióxido de etileno (PEO) con trifluoroacetato de sodio (CF3COONa). Al agregar partículas de Al2O3, la reducción en resistencia llego a ser hasta de tres órdenes de magnitud, a temperatura ambiente. Los gráficos de conductividad DC en función de la concentración, mostraron incremento de conductividad iónica a bajas concentraciones de alúmina. El composito conductor iónico sintetizado mostró conductividad de 2.00x10-5 Scm-1 temperatura ambiente y 7.70x10-4 Scm-1, temperatura de 383 K. Se presentó comportamiento Arrhenius en dos regiones de diagramas de conductividad con temperatura, indicando proceso térmicamente activado. Para altas concentraciones de Al2O3 se observó comportamiento Vogel-Tamman-Fulcher (VTF). Las variaciones de conductividad con concentración de Al2O3, están asociadas con número de sitios involucrados en trasporte iónico, a través de interacciones Lewis ácido—base, entre partículas de Al2O3 y especies iónicas del electrolito.
Palabras clave: Electrolitos sólidos; espectroscopia de impedancias; compositos; polímeros.
Abstract
To increase the ionic conductivity of solid polymer electrolyte, (PEO)10CF3COONa, we formed new composites by adding alumina particles as a filler. We prepared these composites by dissolving them in a liquid solvent, and characterized them through impedance spectroscopy (IS), using a Pt/electrolyte/Pt electrode configuration. The combination of polyethylene oxide (PEO) with sodium trifluoroacetate (CF3COONa) produced a reduction in resistance of up to two orders of magnitude in Nyquist plots, and up to three orders of magnitude when we added AUO3 particles at room temperature. DC conductivity concentration graphs show an increase in the ionic conductivity with low alumina concentrations. The new synthesized ionic conductor composite presented conductivity values of 2.00x10-5 Scm-1 at room temperature and of 7.70x10-4 Scm-1 at a temperature of 383 K. Two sections of the conductivity diagrams also evidenced a temperature induced Arrhenius behavior, indicating a thermally activated process. Higher concentrations of AbO3 induced a Vogel-Tamman-Fulcher (VTF) behavior. Conductivity variations produced by AUO3 concentration are linked to the number of sites involved in ion transport between AbO3 ionic electrolyte species through Lewis acid-base interactions.
Keywords: Solid electrolytes; impedance spectroscopy; composites; polymer.
Resumo
Foi Aumentada a condutividade iónica do eletrólito de polímero sólido (PEO)10CF3COONa, através da formação de um novo compósito, adicionando partículas de óxido de alumínio (AL2O3). Os compósitos foram preparados por dissolução num solvente líquido e a caracterização foi feita por espectroscopia de impedância (EI) com a configuração utilizando eletrodo de platinum - Pt/eletrólito/ Pt. A redução de até duas ordens de grandeza na resistência é observada em diagraamas de Nyquist quando se combina poli (óxido de etileno) (PEO) com trifluoroacetato de sodio CF3COONa. Quando as partículas de AL2O3 são adicionadas ao composição, é observado uma redução na resistência de três ordens de grandeza à temperatura ambiente. Os gráficos do logaritmo da condutividade dc em função da concentração, mostra um aumento da condutividade para baixas concentrações de alumina. Do compósito condutor de íons sintetizado, apresenta valores de condutividade 2.00x10-5 Scm-1 à temperatura ambiente e 7,70x10-4 Scm-1 a uma temperatura de 383 K. Um comportamento do tipo Arrhenius é apresentado em duas regiões dos diagramas de condutividade com a temperatura, indicando um processo termicamente ativado. Para concentrações elevadas de Al2O3, uma mudança de comportamento para Vogel-Tamman-Fulcher (VTF) foi observado. As variações na condutividade com a concentração de Al2O3, está associada a alteração do número dos sítios envolvidos no transporte de ions através de interações do tipo ácido-base de Lewis entre partículas de AL2O3 e espécies iónicas.
Palavras-Chave: Eletrólitos sólidos; espectroscopia de impedância; compósitos; polímeros.
Introducción
La producción y almacenamiento de energía mediante baterías recargables y celdas combustibles para diferentes dispositivos electroquímicos, han generado gran interés en el estudio de electrolitos sólidos poliméricos (ESP) con propiedades óptimas para su funcionamiento en las diferentes condiciones de trabajo a las que están sometidas (Zhou et al. 2013). A diferencia de los electrolitos líquidos, generalmente usados en dichos dispositivos, los electrolitos sólidos presentan algunas ventajas entre las que se encuentran: la posibilidad de múltiples formas, tamaños y la disminución de riesgos por derrame del líquido en el manejo.
La limitada cantidad de electrolitos sólidos con altos valores de conductividad iónica y las reacciones químicas que se presentan en las interfaces electrodo electrolito de los sistemas electroquímicos, ha incrementado el costo de electrolitos sólidos comerciales (Lim et al. 2011). Por lo tanto es necesaria la síntesis y caracterización de nuevos electrolitos sólidos y compositos, de bajo costo o de fácil fabricación, con mejores propiedades eléctricas, mecánicas y térmicas.
Las propiedades requeridas en conductores iónicos, se han obtenido incorporando partículas de Al2O3 TiO2 o SiO2, entre otros, en sales y ESP. En estas combinaciones denominadas compositos, interesa conocer las concentraciones de los componentes y las condiciones en las que se alcanzan dichas propiedades óptimas, junto con las diferentes interacciones que se presentan entre los precursores. Determinadas cantidades de cada uno de los componentes, lleva a una adecuada proporción de fase amorfa en estos sistemas, lo cual favorece el trasporte iónico con iguales y en algunos casos mejores propiedades mecánicas que el electrolito precursor. (Hanemann et al. 2010, Aslan et al. 2012, Thomas et al. 2010)
Los electrolitos poliméricos basados en Polióxido de etileno (PEO), consisten generalmente en una mezcla de fase amorfa y cristalina, lo que significativamente influye en el trasporte iónico. Se ha observado que la movilidad de los iones está relacionada con el movimiento segmental y es usualmente restringido a la fase amorfa (Thomas et al. 2010, Berthier et al. 1983). Polímeros cristalinos exhiben conductividades iónicas bajas, en comparación con polímeros amorfos; pero se han encontrado varias excepciones a esta regla, entre estos están el electrolito cristalino PEO6LiXF6 (X=P, As, y Sb) y ciertos complejos de sales de litio con cadenas cortas de PEO, que muestran mayores valores de conductividad que su contraparte amorfa, a temperaturas superiores de la temperatura de transición vítrea Tg. (Thomas et al. 2010, Zlatka et al. 2001, Zhang et al. 2007).
El incremento de la conductividad de los electrolitos sólidos poliméricos con la adición de partículas nanométricas como Al2O3, ha sido explicado argumentando que la presencia de las partículas inorgánicas adicionadas, disminuye la cinética de cristalización del polímero, obteniéndose así una mayor fracción de material amorfo con más alta movilidad que la contraparte cristalina (Thomas et al. 2010, Prasanth 2010 et al., Ahmad 2009 et al.).
Si la interface entre las partículas de relleno y el polímero cristalino es amorfa, y es predominante en el composito, el trasporte iónico se interpreta como un estado modelo amorfo, el cual se asemeja a los modelos de carga espacial desarrollados para compositos sal—cerámicos (Pritula et al. 2013, Castillo et al. 2009). En estos modelos, la adición de partículas cerámicas, lleva a la formación de caminos de alta conducción en la interface amorfa y la conductividad se incrementa.
En esta investigación se sintetizaron nuevos compositos poliméricos, mecánicamente estables, formados por la adición de diferentes cantidades de Al2O3 en el ESP (PEO)10CF3COONa, los cuales no se han encontrado reportados en la literatura. Los compositos estudiados en este trabajo se analizan con el fin de obtener mayores valores de conductividad iónica en los sistemas polímero-sal, para posibles aplicaciones en dispositivos electroquímicos como baterías y ventanas electrocrómicas. Los análisis de las propiedades eléctricas fueron obtenidos por espectroscopia de impedancia electroquímica.
Materiales y métodos
La preparación de las muestras se realizó con base en PEO de peso molecular (Pw) 5x106 y CF3COONa, de la compañía Aldrich, los que se secaron al vacío y se mantuvieron en un desecador con sílica gel durante 5 días. Estos compuestos se pesaron estequiométricamente en una relación de 10:1 (PEO:CF3COONa), y se disolvieron separadamente en acetonitrilo, mediante agitación magnética durante cuatro horas, a presión atmosférica y a una temperatura de 333K, para luego mezclarse y agitarse por un tiempo de 12 horas a temperatura ambiente. Cuando la combinación adquirió las propiedades de líquido viscoso, por evaporación lenta del solvente, se adicionó una cantidad (en porcentaje de masa con relación a la masa total PEO+sal) de Al2O3 básica, (mesh∼150 tamaño de poro 58 Å, área superficial 150 m2/g), en concentraciones de: 0.0%, 3.0%, 6.0%, 10.0%, 20.0% y 30.0%. Las combinaciones se depositaron en petric de vidrio, y se mantuvieron en atmosfera seca para evaporar completamente el solvente.
Las medidas se realizaron con un analizador de impedancias 6420 Precision Impedance Analyzer and LCR Meter Weyneker en un rango de frecuencias de 20Hz y 5MHz, con una configuración de electrodos Pt/composito/Pt. El rango de temperaturas escogido para el análisis, fue de 298K a 433K, ya que entre estas temperaturas, ocurren transiciones de fase tanto para el PEO, como en la sal CF3COONa y el complejo formado entre ellos (Castillo J et al. 2001).
Resultados
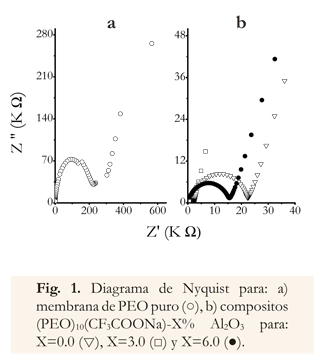
Los diagramas de Nyquist (Figura 1), muestran el cambio en la resistencia de las muestras, cuando se comparan los diagramas del PEO puro (Figura 1a), con los del electrolito (PEO)10CF3COONa y las combinaciones con AbO3 (Figura 1b). En estos diagramas se pueden diferenciar dos regiones: a bajas frecuencias (20 - 110Hz), se observa una línea recta, y a altas frecuencias (120Hz - 5MHz) un semicírculo, la resistencia se considera como la intersección del semicírculo con la línea recta (Dane Sotta et al. 2010, Kumar D et al. 2012).
Se muestran gráficos (Figura 2) de conductividad real (σ'), en función de la frecuencia (f) para diferentes isotermas (entre 248 K y 403 K), del composito (PEO)10(CF3COONa) - X% Al2O3 para la concentración X = 3.0%. La conductividad real σ', fue calculada con la relación:
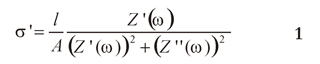
Donde, l es el espesor de la muestra, A el área del electrodo, ω la frecuencia angular, Z' y Z" la impedancia real e imaginaria respectivamente. En estos gráficos pueden diferenciarse tres regiones, con un incremento en la conductividad en la región de bajas frecuencias, a frecuencias intermedias el valor de la conductividad permanece constante y a altas frecuencias un leve incremento en la conductividad.
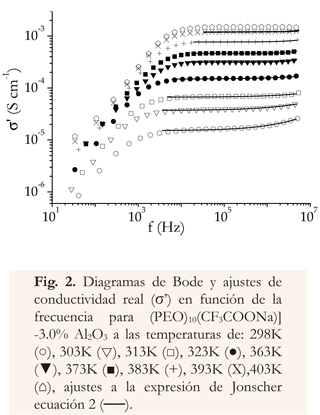
En las regiones de frecuencias intermedias y altas frecuencias, se ha realizado un ajuste Jonscher (Funke 2006; ver ecuación 2).
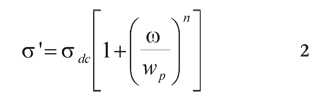
Donde, σdc, es la conductividad iónica para la cual no se presenta cambios con la frecuencia angular ω, Wp es la frecuencia angular característica de la conductividad que marca el cambio de régimen, es decir, de la región potencial a la región constante.
El parámetro n es un exponente fraccionario menor a 1, y es una medida del grado de correlación entre los iones móviles, y la red polimérica (Jonscher 1983, Kiran 2012). Para el composito (PEO)10(CF3COONa) -X% Al2O3, los parámetros n del ajuste Jonscher, varían entre 0.52 y 0.98.
Se muestran gráficos de log σdc, en función de 1000/T (Figura 3a, 3b) en los que se observa un rápido incremento de la conductividad con la temperatura. En este gráfico se diferencian tres regiones: en la región I (entre 300K y 335K) se observa un comportamiento lineal, en la región II (entre 335K y 390K) hay un comportamiento irregular en todas las concentraciones, y en la región III (entre 390K y 430K) se observa nuevamente un comportamiento lineal excepto para concentraciones altas de alúmina (X%, X=20.0, 30.0; Figura 3b).
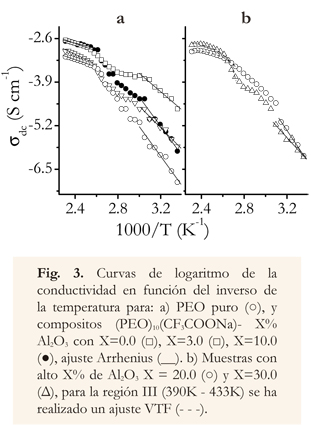
Las regiones lineales se ajustaron con la relación de Arrhenius (ecuación 3).
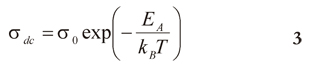
donde σdc es un factor preexponencial, EA energía de activación, kB constante de Boltzmann y T la temperatura (Johan et al. 2011). Para altas concentraciones de alúmina y altas temperaturas, se realizó un ajuste Vogel Tammann y Fulsher (VTF; ver ecuación 4).
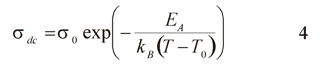
Donde To es una temperatura relacionada con la transición vítrea del complejo polimérico y Ea se asocia con una energía de pseudoactivación (Suriani 2012).
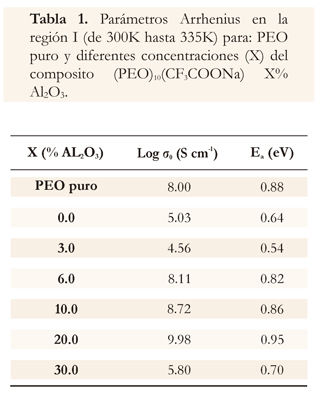
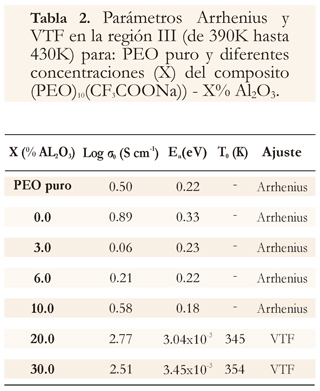
Los parámetros Arrhenius y VTF para las membranas, se muestran a continuación (Tabla 1 y 2).
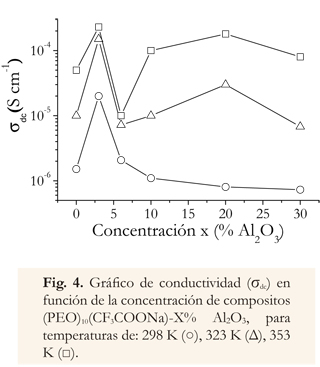
En el gráfico de conductividad versus concentración (Figura 4), se muestra un rápido incremento de la conductividad a bajas concentraciones de alúmina, alcanzando un valor de 2.00 x 10-4 S cm-1 para X = 3.0%, a una temperatura de 353 K. para concentraciones más altas de Alúmina, la conductividad decrece como sea observado en otros sistemas polímero-Al2O3. (Johan et al. 2011, Borgohain et al. 2010).
Discusión
La síntesis y caracterización del composito PEO: CF3COONa:Al2O3 son novedosas porque no se encuentran reportes en la literatura; además se incrementa la conductividad en un orden de magnitud, con respecto al electrolito PEO: CF3COONa (Castillo et al. 2001).
En los gráficos de conductividad con el inverso de la temperatura (Figura 3) y conductividad con la concentración de alúmina (Figura 4), se puede observar que la conductividad se incrementa con bajas fracciones de alúmina, hasta alcanzar un máximo de 2x10-5 Scm-1 a temperatura ambiente, y con una concentración de X=3.0. La variación de la conductividad con la concentración de sal es debida a reacciones de Lewis acido—base que forman el complejo entre el electrolito y las partículas cerámicas, formando centros de entrecruzamientos en la matriz polimérica y disminuyendo la cristalinidad del sistema (Castillo et al. 2009, Syzdek et al. 2010).
El proceso térmicamente activado, observado en gráficos de conductividad versus el inverso de la temperatura (Figura 3) obedece a un aumento de la flexibilidad en las cadenas del polímero, es característica de sistemas poliméricos conductores iónicos (Castillo et al. 2001, Karaoglua et al. 2011). Con la particularidad de que este composito presenta dos regiones con un comportamiento tipo Arrhenius, entre las cuales existe una región intermedia la cual muestra un comportamiento anómalo entre temperaturas para las que se presentan cambios de fase en el sistema (fusión de PEO y fusión de PEO:CF3COONa; Castillo et al. 2001, Johan et al. 2011, Ramanjaneyulu et al. 2012). Las energías de activación obtenidas pueden observarse en la tabla 2.
La activación térmica de la conductividad es atribuida al predominio de la interacción de los iones móviles con la matriz polimérica, indicando que este efecto es mayor a altas concentraciones de alúmina, o sea cuando la estructura es más rígida por lo que a mayores concentraciones la conductividad decae y la energía de activación aumenta (Agrawa et al 2011, Morenoa et al. 2010).
La presencia de un semicírculo en los diagramas de Nyquist (Figura 1), representa un proceso de relajación del composito, mientras que la línea recta a bajas frecuencias es debida a migración de iones y a la inhomogeneidad de los electrodos bloqueadores o efectos de doble capa en la interface platino/electrolito (Vera 2010, Zhao et al. 2010).
En los diagramas de Bode (Figura 2), a frecuencias menores que 6x104 Hz, se observa una dispersión en la conductividad, característica del efecto de electrodos bloqueadores. A frecuencias más elevadas la conductividad σ' permanece constante, lo que corresponde a la conductividad de largo alcance o dc (σdc) del electrolito, valor que puede obtenerse mediante el ajuste de las diferentes isotermas mostradas en el gráfico, con la relación de Jonscher denominada respuesta dieléctrica universal (Jonscher 1983, Ravi et al. 2011). Finalmente, a altas frecuencias, una región de crecimiento exponencial característico de la reorientación de los portadores de carga localizados, como lo describe la ecuación 2 (Chen et al. 2010).
El análisis eléctrico mediante espectroscopia de impedancias en el sistema PEO10CF3COONa-X%Al2O3, hace prever la formación del composito conductor iónico por el incremento en los valores de conductividad. Sin embargo, para una caracterización complementaria dedicho composito, son requeridos análisis complementarios tales como calorimetría diferencial de barrido (DSC) para determinar puntos de fusión, temperaturas de transición vítrea y entalpias de fusión. De igual forma análisis de espectroscopia Raman junto con espectroscopia infrarroja por trasformada de Fourier (FTIR) darían a conocer interacciones ion—polímero, ion—ion o ion—partícula de AbO3. Análisis de difracción de rayos X (XRD) junto con medidas de DSC, proporcionarían confirmación del desorden estructural ocasionado por la presencia de Al2O3 además de una estimación del índice de cristalinidad para las diferentes combinaciones.
Conclusión
Se han formado nuevos compositos mediante la dispersión de partículas de Al2O3 en el electrolito sólido PEO:CF3COONa, logrando obtener valores de conductividad del orden de 10-4 Scm-1 a bajas concentraciones de alúmina (3.0% AUO3). Los resultados de conductividad obtenidos son producidos por el entrecruzamiento de las cadenas del polímero, ocasionado por la presencia de material cerámico lo que cambia las condiciones dinámicas del trasporte iónico, mejorando la movilidad de portadores (Çelik et al. 2013). Dados los altos valores de conductividad iónica y con algunas optimizaciones mediante la adición de plastificantes para reducir los valores de energía de activación, los sistemas obtenidos pueden ser aplicables en dispositivos electroquímicos como baterías recargables.
Agradecimientos
Este trabajo fue financiado por la Universidad del Tolima mediante la oficina de Investigaciones con el proyecto 30108. Los autores agradecen al grupo de Transiciones de Fase en Sistemas no Metálicos de la Universidad del Valle por la utilización de los equipos y a los revisores por sus valiosas sugerencias.
Conflicto de intereses
Los autores no presentan ningún conflicto de intereses.
Referencias
Agrawa RC, Mahipal YK., Ashrafi R (2011) Materials and ion transport property studies on hot-press casted solid polymer electrolyte membranes: PEO: X KIO3]. Solid State Ionics 192:6-8 [ Links ]
Ahmad S, Agnihotry SA (2009) Effect of nano V-AL2O3 addition on ion dynamics in polymer electrolytes. Current Applied Physics 9(1):108-114 [ Links ]
Aslan A, Bozkurt A (2012) Nanocomposite polymer electrolyte membranes based on poly (vinylphosphonic acid)/sulfated nano-titania. Journal of Power Sources 217:158-163 [ Links ]
Berthier C, Gorecki W Minier M, Armand M B, Chabagno J M, Rigaud P (1983) Microscopic investigation of ionic conductivity in alkali metal salts-poly(ethylene oxide) adducts. Solid State Ionics 11(1):91-95 [ Links ]
Borgohain MM, Joykumar T, Bhat SV (2010) Studies on a nanocomposite solid polymer electrolyte with hydrotalcite as a filler. Solid State Ionics 181:964-970 [ Links ]
Castillo J, Delgado I, Chacón M, Vargas RA (2001) New solid ionic conductor based on poly(ethylene oxide) and sodium trifluoroacetate. Electrochimica Acta 46 (10-11):1695-1697 [ Links ]
Castillo J, Materón E M, Castillo R, Vargas R A, Bueno P R, Varela JA (2009) Electrical relaxation in proton conductor composites based on (NH4)H2PO4/ TiO2. Ionics 15(3):329-336 [ Links ]
Çelik S Ü, Bozkurt A (2013) PEG crosslinked poly(vinylbenzene boronic acid) polymer electrolytes for Li-ion batteries. Current Applied Physics, In Press, Accepted Manuscript. [ Links ]
Chen R.H, Tseng CM, Shern C S, Fukami T (2010) Ionic conductivity and dielectric relaxation studies of LiNaSO4 single crystal. Solid State Ionics 181:877-882 [ Links ]
Dane S, Bernard J, Sauvant V (2010) Application of electrochemical impedance spectroscopy to the study of ionic transport in polymer-based electrolytes. Progress in Organic Coatings 69:207- 214 [ Links ]
Funke K, Banhatti R D (2006) Ionic motion in materials with disordered structure. Solid State Ionics 177 (19-25):1551-1557 [ Links ]
Hanemann T, Vinga SD (2010) Polymer-Nanoparticle Composites: From Synthesis to Modern Applications. Matenab 3:3468-3517 doi:10.3390/ma3063468 [ Links ]
Johan MR, Shy OH, Ibrahim S, Mariah S, Yassin M, Hui TY (2011) Effects of AbO3 nanofiller and EC plasticizer on the ionic conductivity enhancement of solid PEO-LiCF3SO3 solid polymer electrolyte. Solid State Ionics 196(1):41-17 [ Links ]
Jonscher K (1983) Dielectric Relaxation in Solids, Chelsea Dielectrics Press, London. [ Links ]
Karaoglua E, Baykala A, Deligozb H. Senel M, Sozeric H, Toprakd MS (2011) Synthesis and characteristics of poly(3-pyrrol-1-ylpropanoic acid) (PPyAA)-Fe3O4 nanocomposite, Journal of Alloys and Compounds 509:8460-8468 [ Links ]
Kiran K, Ravi M., Pavani Y, Bhavani S, Sharma A.K, Narasimha R (2012) Electrical conduction mechanism in NaCl complexed PEO/PVP polymer blend. Electrolytes Journal of Non-Crystalline Solids 358:3205-3211 [ Links ]
Kumar DA, Selvasekarapandian S, Baskaran R, Savitha T, Nithya H (2012) Thermal, vibrational and Ac impedance studies on proton conducting polymer electrolytes based on poly(vinyl acetate), Journal of Non-Crystalline Solids 358:531-536 [ Links ]
Lim SJ, Kang YS, Kim DW (2011) Dye-sensitized solar cells with quasi-solid-state cross-linked polymer electrolytes containing aluminum oxide. Electrochimica Acta 56:2031-2035 [ Links ]
Moreno M, Santa Ana M, Gonzalez G, Benaventea E (2010) Poly(acrylonitrile)-montmorillonite nanocomposites Effects of the intercalation of the filler on the conductivity of composite polymer electrolytes. Electrochimica Acta 55:1323-1327 [ Links ]
Prasanth R, et al. (2010) Electrochemical performance of electrospun poly(vinylidene fluoride-co-hexafluoropropylene)-based nanocomposite polymer electrolytes incorporating ceramic fillers and room temperature ionic. Electrochimica Acta 55(4):1347-1354 [ Links ]
Pritula IM et al. (2013) Optical properties of KDP crystals doped with pyrenetetrasulfonic acid salt. Journal of Physics and Chemistry of solids 74:452-456 [ Links ]
Ramanjaneyulu K, Bar N, Shah SA, Manorama SV, Basak P (2012) Semi-interpenetrating polymer networks as solid polymer electrolytes: Effects of ion-dissociation, crosslink density and oligomeric entanglements on the conductivity behavior in poly(ethylene oxide)epolyurethane /poly(acrylonitrile) matrix. Journal of Power Sources 217:29-36 [ Links ]
Ravi M., Pavani Y., Kiran K., Bhavani S, Sharma A.K., Narasimha VV (2011) Studies on electrical and dielectric properties of PVP:KBrO4 complexed polymer electrolyte films. Matenals Chemistry and Physics 130:442-448 [ Links ]
Suriani I, Mohd S, Meng Ng, Ahmad R, Mohd R (2012) Conductivity, thermal and infrared studies on plasticized polymer electrolytes with carbon nanotubes as filler, Journal of Non-Crystalline Solids 358 (2):210-216 [ Links ]
Syzdek J, Armand M, Marcinek M, Zalewska A, Zukowska G, Wieczorek W (2010) Detailed studies on the fillers modification and their influence on composite, poly(oxyethylene)-based polymeric electrolytes. Electrochimica Acta 55:1314-1322 [ Links ]
Thomas K J, Wüllen L (2010) Cation-anion coordination, ion mobility and the effect of Al2O3 addition in PEO based polymer electrolytes. Solid State Ionics 181:489-495 [ Links ]
Vera E (2010) uso de métodos electroquímicos como herramientas para evaluar parámetros de interfase en sistemas heterogéneos metal/medio acuoso. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales 34 (131):241-251 [ Links ]
Zhang C, Andreev Y G, Bruce P G (2007) Crystalline Small-Molecule Electrolytes. Angewandte Chemie International Edition 4:2848-2850 [ Links ]
Zhao J, Wang L, He X, Wan C, Jiang C (2010) Kinetic investigation of LiCOO2 by electrochemical impedance spectroscopy (EIS). International Journal of Electrochemical Science 5:478-488 [ Links ]
Zhou D, Fan L, Fan H, Shi Q (2013) Electrochemical performance of trimethylolpropane trimethylacrylate-based gel polymer electrolyte prepared by in situ thermal polymerization. Electrochimica Acta 89 (1):334-338 [ Links ]
Zlatka G, Tunstall D P, Bruce P G (2001) Ionic conductivity in crystalline polymer electrolytes. Nature 412:520-523 [ Links ]













