Introducción
Los hongos faloides pertenecen al orden Phallales (Magnago et al., 2013; Sandoval-Leiva et al., 2014) y agrupa a seis familias: Clathraceae Chevall., Claustulaceae G. Cunn., Lysuraceae Corda, Phallaceae Corda, Protophallaceae Zeller, y Trappeaceae P.M. Kirk (Hosaka et al., 2006; Kirk et al., 2008). Según Kirk et al. (2008) la familia Phallaceae está comprendida por 21 géneros y 77 especies que se distribuyen mayoritariamente en los trópicos y subtrópicos (Kirk et al., 2008; Sandoval-Leiva et al., 2014).
Este grupo de hongos, conocido como cuernos hediondos, producen una estructura ovoide en la inmadurez que al fructificar se transforma en una gleba usualmente mucilaginosa y fétida, cuyo olor característico a carroña o estiércol producto de la combinación de sulfuro de hidrógeno y metil mercaptano, atrae a los insectos (List & Freund, 1968; Gogoi & Parkash, 2014). Así, estos hongos usan a algunos invertebrados como agentes dispersores de esporas (Oliveira & Morato, 2000; Shaw & Roberts, 2002; Maldonado-Ramírez & Torres-Pratts, 2005; Sandoval-Leiva Et Al., 2014; Pinzón-Osorio et al., 2017; Swapna et al., 2010). Los Phallales contienen especies con receptáculos multipileados (Gäumann, 1952), enrejados, huecos, esféricos o tubulares que surgen del tejido basal dentro de la volva (Miller & Miller, 1988). La gleba delicuescente, generalmente se desarrolla en el interno del receptáculo (Dring, 1980) y microscópicamente poseen basiodiosporas elípticas a cilíndricas y lisas (Ingold, 1971; Dring, 1980; Pegler et al., 1995).
Para Colombia, Phallaceae esta representa con cinco géneros y seis especies (Vasco-Palacios & Franco-Molano, 2013; Pinzón-Osorio et al., 2017): Laternea triscapa Turpin. (Dumont & Umaña, 1978; Guzmán & Varela, 1978), L. pusilla Berk. & M.A. Curtis (Pinzón-Osorio et al., 2017), Lysurus gardneri Berk. (Guzmán & Varela, 1978), Mutinus caninus (Huds.) Fr., (Saldarriaga et al., 1988), Phallus indusiatus Vent. (Saldarriaga et al., 1988; Franco-Molano et al., 2005; Vasco-Palacio et al., 2005; Betancur et al., 2007) y Clathrus columnatus Bosc, único representante del género Clathrus P. Micheli ex L., que había sido reportado en el país como Colonnaria columnata (AMVA, 2000). En Colombia no hay reporte de otro representante de este género. Por lo tanto, el objetivo de este estudio es registrar a Clathrus archeri (Berk.) Dring., una especie considerada invasora que prolifera en los Cerros Orientales de Bogotá, en condiciones de alta montaña.
Método
Área de estudio
Se realizó una exploración micológica en julio de 2016 y agosto de 2017, en la quebrada La Vieja (Figura 1), un ecosistema categorizado como bosque húmedo montano bajo (bh-MB) de acuerdo con la clasificación de zonas de vidas de Holdridge et al. (1971). El bosque se localiza en los Cerros Orientales, Noreste de Bogotá, departamento de Cundinamarca, Colombia, coordenadas 4°38’53.78” N - 74°02’44.72” W, a 2.761 msnm (Pinzón-Osorio et al., 2017). La zona se caracteriza por presentar una temperatura promedio anual de 14°C y promedios de precipitación anual de 1100 mm, con un régimen de distribución bimodal (Rodríguez-Barrios & Ospina, 2007).
Figura 1 Mapa de localización de C. archeri en Colombia. A. Colombia, departamento de Cundinamarca. B. Bogotá, área de colecta.
El ecosistema tiene un buen estado de conservación (Rodríguez Barrios & Ospina, 2007), con una vegetación representada principalmente por los géneros Barnadesia (Asteraceae), Cavendishia (Ericaceae), Clusia (Clusiaceae), Drimys (Winteraceae), Miconia (Melastomataceae), Ophrys (Orchidaceae), Oreopanax (Araliaceae), Palicourea (Rubiaceae), Passiflora (Passifloraceae), Siparuna (Monimiaceae) y Weinmannia (Cunoniaceae) (Pinzón-Osorio et al., 2017).
Recolección y determinación
Los basidiomas se rastrearon y recolectaron mediante un muestreo oportunista siguiendo el sendero del bosque. Los ejemplares frescos fueron fotografiados y descritos de acuerdo con Miller & Miller (1988) y Calonge (1998). Para la citación de los colores se utilizó el atlas de Kornerup & Wanscher (1983). Las mediciones y observaciones microscópicas se realizaron con un microscopio de luz Olympus CX31 y DMS 653 (sistema digital), donde las muestras se obtuvieron mediante cortes a mano alzada de las estructuras fúngicas y se acompañaron de solución KOH 3%, Floxina 3% y rojo Congo. El análisis estadístico de las basidiosporas se realizó según Bates (2004), donde (n) corresponde al número de esporas medidas al azar, (x) es el ancho promedio y longitud de las mismas, (±) es la desviación estándar y el (Qm) el cociente entre la longitud y la anchura media, midiendo mínimo 25 basidiosporas por basidioma (Franco-Molano et al., 2000). Para la identificación de las especies se utilizaron los trabajos de Dring (1980), Miller & Miller (1988) y las claves taxonómicas de Sáenz et al. (1974), Dring (1980), Pegler & Gómez (1994) y Sandoval-Leiva et al. (2014). El material estudiado fue herborizado y se depositó en la colección del Herbario de la Universidad Pedagógica Nacional (Hupn), sede Bogotá. La citación del nombre científico correspondió a la información aportada por el sistema de clasificación Index Fungorum (http://www.indexfungorum.org).
Resultados
Descripción: Clathrus archeri (Berk.) Dring, Kew Bull. 35(1): 29 (1980) (Figura 2).
Basidioma inmaduro: epigeo, ovoide a ligeramente subgloboso, 51 mm de altura x 42 mm de diámetro, al corte se observan pequeñas columnas color rosado (8A5) con una masa marrón grisáceo (3D7); exoperidio glabro, membranoso, frágil, escuamuloso, color marrón amarillento (5F4); peridio membranoso, liso a furfuráceo, color blanco (8A1) a blanco marrón (6D3); al contacto o corte se tiñe de color púrpura (8E7), se rompe apicalmente formando una volva en la base del basidioma; endoperidio color blanco amarillento (4A2), con varios rizomorfos blancos grisáceos (8B2), a menudo teñidos de púrpura en la punta (8E7) (Figura. 1A). Basidioma maduro: epigeo, 64-97 mm de alto, volva 35-41 mm de longitud; exoperidio con las mismas características del basidioma inmaduro (Figura 2B-C). Receptáculo: 43-94 mm, cilíndrico, formado por cuatro, cinco, siete y ocho columnas unidas en la base, libres en la parte apical, superficie esponjosa, con consistencia gelatinosa a ligeramente mucilaginosa (Figura 2B-C). Columnas: 41-92 mm de largo, 14-25 mm de ancho en la base, ligeramente curvas a rectas, estriadas a reticuladas, surco central, longitudinal, estrechándose gradualmente hasta una punta roma, en algunas ocasiones unidos apicalmente, cuando maduran se abren hacia fuera proyectando las puntas hacia el suelo, color gris rojizo (8B2) hacia el ápice, blanco rojizo (8A2), rosado (8A5) a blanco anaranjado (6A2), recubiertas con múltiples masas de esporas viscosas color marrón verdoso (5E7); al corte transversal de cada columna se observa un aspecto multitubular, con diez a doce cámaras no conectadas entre sí que se extienden longitudinalmente dentro de las columnas (Figura 2D). Seudoestipite: 67-102 mm de largo x 31-38 mm de grosor, esponjoso, hueco, más ancho en el punto donde las columnas de anclan, color rojo (7C7) a rosado (7A7) hacia la parte superior, rojo blanquecino hacia la base (8A3); contexto delgado, frágil. Gleba: color marrón verdosa oscura (5E7) cuando fresco, negra (6F1) al madurar, mucilaginosa, olor fétido, no se limita a un glebifero. Basidiosporas: 2,0-2,5 x 4,2-5,4 μm [x = 2,3 ± 0,5 x 4,7 ± 0,5 μm, Qm= 1,1, n= 67], elípticas a ligeramente cilíndricas, hialinas, lisas (Figura 2E). Columnas: células pseudoparenquimatosas, 18-42,5 μm de diámetro, hialinas, paredes ligeramente engrosadas.
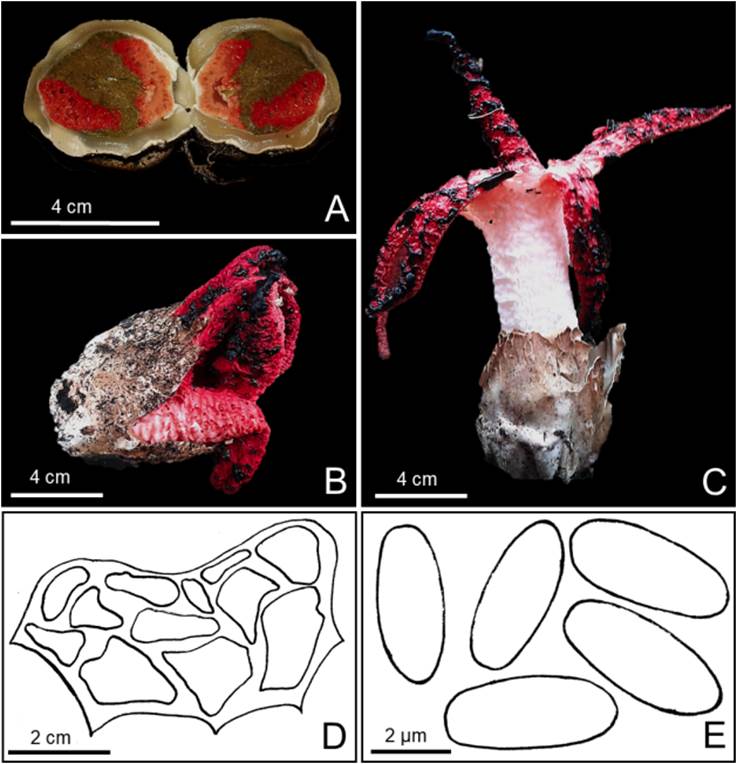
Figura 2 Clathrus archeri. A. Primordio en corte longitudinal. B. Basidioma juvenil en proceso de fructificación. C. Basidioma maduro con detalle del receptáculo. D. Columna de receptáculo en corte transversal. E. Basidiosporas.
Nombre común. Dedos de diablo.
Hábito y hábitat. Crece solitario a gregario sobre suelo en bosque húmedo montano bajo.
Material examinado. COLOMBIA. Cundinamarca: Bogotá D.C, Quebrada la Vieja, Norte 04º38’48.56” y Oeste 74º02’41.73”, 2800 m, (5 de mayo de 2016), C. Pinzón-O. (HUPN 231). Norte 04º38’48.52’’ y Oeste 74º02’38.42’’, 2820 m, (12 de octubre de 2017), C. Pinzón-O. (HUPN 252). Norte 04º38’30.92’’, Oeste 74º02’31.10’’, 2901 m (12 de octubre de 2017), C. Pinzón-O. (HUPN 253).
Distribución. C. archeri tiene una distribución amplia. Se ha reportado en Australia, Nueva Zelanda, Tasmania, África del Sur y del Este (Dring, 1980). Se introdujo en Europa en 1914 probablemente por la importación de lana ovina desde Australia y Nueva Zelanda (Parent & Thoen, 1986; Kreisel, 2006; Salcedo et al., 2006) o por el transporte de suministros militares en la Primera Guerra Mundial (Desprez-Loustau & Rizzo, 2011). De acuerdo con Desprez-Loustau & Rizzo (2009) se ha extendió por toda Europa, donde se ha registrado en Austria (Lohwag, 1949), Bélgica, Checoslovaquia, Inglaterra, Francia, Alemania, Italia, Noruega, Suiza (Dring, 1980; Wojewoda & Karasinski (2010); Bîrsan et al., 2014), Península Ibérica (Sarrionandia et al., 2010), Polonia (Pietras et al., 2016), Rumania (Tanase & Pop, 2005; Bîrsan et al., 2014), Noruega (Stengl-Rejthar & Wojewoda, 1985), Bulgaria (Gyosheva et al., 2006), Ucrania (Didukh, 2009) y Bélgica (Piérart & Girard, 1969; Fraiture, 2010). En Norteamérica se registró en Estados Unidos (Arora & Burk, 1982). En Centro América se reportó como Anthurus sp., en México (López et al., 1981). No hay reporte de la especie en Suramérica. Este es el primer registro de C. archeri en Colombia, ampliando la distribución de C. archeri para la región neotropical.
Observaciones taxonómicas. C. archeri se caracteriza por tener un receptáculo con 4 a 8 columnas (raramente 12), de color rojo a ligeramente rosadas, robustas, esponjosas, reticuladas, libres en el ápice y unidas en la base; la gleba se localiza en la porción apical y no se limita a un glebifero, sino que se extiende parcialmente en el ápice; microscópicamente presenta basidiosporas elípticas a ligeramente cilíndricas, hialinas, lisas, con dimensiones que oscilan entre 4-7.5 x 2-2.5 μm (Dring, 1980; Arora & Burk, 1982). A pesar de lo anterior, la especie puede confundirse con Pseudocolus fusiformis (E. Fisch.) Lloyd; sin embargo, esta última tiene menor número de columnas (3 a 5, ocasionalmente hasta 6) (Blanton & Burk, 1980; Quadraccia, 1983) que en la mayoría de los casos no se separan en el ápice del receptáculo; las basidiosporas son elípticas a ovoides y más grandes (2,8-3,2 x 4.9-5,6 µm) (Akata & Hüseyin-Dogan, 2011), respecto a C. archeri (2,1-2,5 x 4,2-5,4 μm). De acuerdo con las descripciones e ilustraciones presentadas por Dring (1980), Arora & Burk (1982) se concluye que los especímenes colectados corresponden a C. archeri.
Comentarios ecológicos. Los basidiomas se colectaron en épocas de lluvia. De 15 basidiomas, dos estaban cerrados, lo que podría indicar que el exoperidio se abre en condiciones de alta humedad. Sin embargo, se requiere extender los periodos de muestreo durante los diferentes meses del año para determinar el patrón fenológico de fructificación de C. archeri.
Al parecer C. archeri no tiene requerimientos ecológicos amplios ni preferencias especiales de hábitat (Sarrionandia et al., 2010), debido a que se ha identificado dentro de una amplia gama altitudinal y en una gran variedad de hábitats (Jülich, 1989; Zykova, 2007; Halama et al., 2010). Si bien, la expansión de la especie está condicionada por factores climáticos y edáficos, C. archeri no prolifera en regiones demasiado secas o frías, con déficit hídrico y suelos calcáreos (Kreisel, 2006). Raramente se desarrolla en cotas superiores a los 700 msnm (Sarrionandia et al., 2010) o 900 msnm (Parent et al., 2000). No obstante, en esta ocasión, la especie se halló en un ecosistema con humedades relativas muy altas y bajas temperaturas, en una cota máxima de 2901 msnm.
En la actualidad C. archeri se considera invasora debido a que presenta una gran capacidad reproductiva y gran capacidad de expansión en el territorio (Sarrionandia et al., 2010). En la mayoría de los casos C. archeri crece en plantaciones de Eucalyptus L’Hér., Pinus L. (Vellinga et al., 2009) y en bosques nativos relativamente bien conservados y de gran valor ecológico (Sarrionandia et al., 2010), condición que coinciden con el bh-MB de la quebrada La Vieja (Rodríguez-Barrios & Ospina, 2007).
Los impactos ecológicos de este gasteroide introducido en Colombia han sido ignorados. Por lo tanto, es importante investigar si se ha integrado eficientemente a las redes ecológicas de interacción competitiva y si su establecimiento ha alterado la dinámica de interacción de otros gasteroides con los insectos dispersores de esporas. Es el caso de L. pusilla, una especie que se restringe a la región neotropical y que hace unos años fue reportada para el país (Pinzón-Osorio et al., 2017), creciendo en la zona donde se halló a C. archeri. Dados los posibles efectos negativos sobre la micota gasteroide de los andes colombianos, es necesario evaluar la capacidad reproductiva de C. archeri y su expansión en el territorio. Teniendo en cuenta las características climáticas de Colombia y el potencial invasor de esta especie, puede que se encuentre en otros ecosistemas forestales de alta y baja montaña. Este trabajo registra por primera vez a C. archeri como nuevo representante del género en Colombia y se incrementan a siete las especies pertenecientes a la familia Phallaceae en el país.
Clave de especies de Phallales presentes en Colombia
1. Gleba confinada en un glebifero………….………………………………......3
1. Gleba no confinada aun glebifero…………………………………………….4
2. Gleba confinada en el ápice del pseudoestipite, receptáculo nte………………5
2 Gleba confinada en el píleo reticulado, receptáculo presente…….…………….6
3. Receptáculo con 3-4 ó 5 columnas lisas, nunca crestadas, color rojizo a rosado, columna transversal ausente……..............…. Laternea triscapa
3 Receptáculo con 2-3 ó 4 columnas crestadas, color rojizo a rosado........ Laternea pusilla
4. Receptáculo con 4, 5, 6, 7 y 8 columnas unidas en la base, libres en la parte apical, color rojo intenso, gleba en forma de masa esparcida en la parte apical de las columnas……………………...……............…........Clathrus archeri
4 Receptáculo con 3 a 6 columnas, color anaranjado rojizo, libres en la base pero unidas en el ápice por una columna transversal, gleba en forma de masa esparcida en el interior del ápice de las columnas……...Clathrus columnatus
4 Estípite cilíndrico, con pequeñas columnas verticales que se unen en el ápice formando una corona, gleba en el interior y las caras laterales de la parte superior de las columnas…………………………..……. Lysurus gardneri
5 Pseudoestipite fusiforme, hasta de 55 mm de altura, rosado, gleba cubre alrededor de 1/3 del pseudoestipite.................. Mutinus caninus
6 Pseudoestipite cilíndrico, 100-125 mm de altura, blanco, receptáculo campanulado con indusio con poros hexagonales, colgante, color blanco….. Phallus indusiatus.














