INTRODUCCIÓN
Los microorganismos hemotrópicos, comúnmente denominados hemoparásitos en felinos, son agentes infecciosos que varían desde nematodos (Dirofilaria immitis), protozoos (Cytauxzoon spp., Hepatozoon canis, Babesia spp. y Leishmania spp.) y bacterias (Bartonella spp., Borrelia spp., Mycoplasma sp., Ehrlichia spp., Rickettsia spp., Anaplasma spp. y Francisella spp.) (Otranto et al. 2010) que se transmiten principalmente por vectores artrópodos a una gran variedad de huéspedes mamíferos y con un gran potencial zoonótico, que podrían generar un impacto en la salud pública humana (Varou et al. 2007). Estos agentes ingresan a la sangre del hospedero durante la alimentación del vector infectado, en el caso de Hepatozoon spp., este ingresa por la ingesta de garrapatas infectadas, aunque se deben realizar más estudios sobre la transmisión, epidemiología y patogenia en gatos (Rubin et al. 2006). La transmisión también puede darse por el uso de agujas contaminadas, transfusiones (Gary et al. 2006), transmisión vertical (Tasker 2010) y predación como un modo plausible de transmisión en el caso de Babesia sp. (Ayoob et al. 2010).
Posterior a la transmisión del agente infeccioso, estos agentes se diseminan por circulación sanguínea y linfática (Schäfer et al. 2020), se pueden encontrar invaginados en la membrana celular o internalizados en el citoplasma de eritrocitos o células del sistema mononuclear fagocítico, libres o dentro de vesículas (Razin et al. 1998). Es importante mencionar que algunos agentes hemotrópicos inhiben algunas funciones vitales de los neutrófilos, como la motilidad, fagocitosis, liberación de ROS y su interacción con las células endoteliales (Rikihisa 2006). Posteriormente colonizan otros órganos, en particular tejidos vascularizados (Angelakis E et al. 2014). Además, la unión de organismos patógenos a los eritrocitos expone antígenos eritrocíticos ocultos, con una respuesta posterior del huésped de producir anticuerpos antieritrocitos (Greene 2012), lo que conlleva una anemia hemolítica intravascular o secuestro esplénico (Willi et al. 2005).
Los signos clínicos dependen de varios factores como el tipo de agente, la especie asociada, el estadio de la infección y si hay enfermedades o infecciones concurrentes (Tasker 2010). La severidad del cuadro clínico puede variar desde asintomático hasta potencialmente mortal, esto depende de manera parcial de la susceptibilidad del huésped (Messick 2004). Aquellos que se recuperan de la fase aguda permanecen como portadores, donde el agente evade el sistema inmunológico del huésped, lo que genera frecuentemente una infección crónica o subclínica, con posible reactivación de la enfermedad (Sykes 2010).
El diagnóstico puede basarse en el examen citológico de un frotis de sangre, que tiene una sensibilidad y especificidad del 0-1% y del 84-99,2%, respectivamente (Tasker 2003), y presenta una alta tasa de falsos positivos (Sushma et al. 2021). La detección de anticuerpos indica exposición al agente infeccioso, estos tienen una alta sensibilidad y especificidad, pero se pueden presentar reacciones cruzadas (Pennisi et al. 2017) y no se dispone hasta el momento de pruebas serológicas para otros hemotrópicos. Los ensayos de PCR son ahora el método de elección para el diagnóstico de hemotrópicos, pues son un método mucho más sensible y específico (Tasker et al. 2018). Es importante señalar que la especificidad y la sensibilidad del ensayo de PCR dependen del diseño del cebador, y es posible que algunos ensayos no amplifiquen el ADN de algunas de las especies de M. haemofelis o Candidatus M. haemominutum que circulan en los gatos domésticos (Tasker et al. 2003), lo cual genera posibles falsos negativos.
La frecuencia de presentación de hemotrópicos está ligada a varios factores como la ausencia del control integral de ectoparásitos y que se brinden las condiciones ambientales y geográficas para la presencia de estos. Latinoamérica es una las regiones más biodiversas del mundo, y en las últimas décadas una combinación de circunstancias antropogénicas ha llevado a la persistencia de vectores y patógenos en el medio ambiente y cambios en la transmisión de agentes infecciosos (Panti-May et al. 2020). Estudios de detección molecular de agentes bacterianos y protozoarios transmitidos por vectores en el sur de Portugal a 649 gatos mostraron que el 29,9% fue positivo para al menos uno de los agentes; el 9,9% fue positivo a Leishmania spp.; 8,6%, a Hepatozoon spp.; 6,6%, a Babesia spp.; 5,4% a Anaplasma spp. y Ehrlichia spp.; 2,9% a Bartonella spp., y 2,2% a B. burgdorferi s. (Maia et al. 2014). En España, se detectó una prevalencia para Mycoplasma haemofelis, Candidatus Mycoplasma haemominutum y Candidatus Mycoplasma turicensis de 3,7%, 9,9 % y 0,5, respectivamente (Roura et al. 2010). En Estados Unidos, se conocen seroprevalencias para A. phagocytophilum que oscilan entre 4,3% y 37,6 % (Schäfer et al. 2020). En Río de Janeiro, en 2008, se evaluó la prevalencia de hemoplasmas en felinos domésticos, donde se evidenció una prevalencia del 36% en pacientes con VIF, principalmente debido a Candidatus M. haemominutum (32 %) y una prevalencia más baja de 5,1% para felinos con VILEF (Macieira et al. 2008).
En Colombia, se han obtenido prevalen-cias para algunos hemotrópicos mediante diferentes técnicas diagnósticas, en 2018 se publicó un estudio de la frecuencia de hemotrópicos en caninos y felinos de un centro veterinario de Medellín mediante serología y PCR, donde se evidenció una prevalencia del 27,8% para Mycoplasma sp. en felinos (Rodríguez et al. 2018), en 2019 se reportó un estudio sobre la prevalencia de Mycoplasma haemofelis en gatos en Pereira, a través de extendidos de sangre venosa, con una prevalencia resultante del 88,35% (Mayorga et al.2019). Sin embargo, actualmente en Colombia no se cuenta con estudios donde se evalúen varios agentes hemotrópicos mediante qPCR en felinos, por lo que el objetivo de este estudio es evaluar la frecuencia de 9 agentes hemotrópicos en felinos de la ciudad de Medellín mediante qPCR y correlacionar la presencia de uno o más agentes infecciosos con los hallazgos en los hemoleucogramas y/o presencia de manifestaciones clínicas.
MÉTODOS Y MATERIALES
Consideraciones éticas
El estudio renunció a la revisión y aprobación de un comité de ética, ya que solo hace uso de las bases de datos del laboratorio Testmol SAS y las historias clínicas de los pacientes, brindadas por los médicos veterinarios que realizaron la toma de muestras cumpliendo con todos los protocolos de ética profesional en Colombia para la manipulación de animales en el ejercicio médico veterinario bajo la ley 576 del 2000 y la ley 84 de 1989.
Base de datos felinos
El estudio se realizó con una base de datos de 1.418 muestras de felinos remitidas al laboratorio Testmol de Medellín entre julio de 2021 y marzo de 2022. Del total de muestras analizadas por qPCR, la historia clínica y hemoleucogramas provinieron de 15 felinos remitidos por tres centros veterinarios
Base de datos de hemograma
Tres centros veterinarios suministraron los datos, que se tabularon en Excel para su análisis posterior en SPSS versión 22. Las muestras hematológicas de esas bases de datos fueron analizadas usando el equipo Abacus (Abacus Vet Junior, Diatron MI Ltd, Budapest, Hungary) (Pieper et al. 2016), calibrado para la especie felina, para determinar 15 parámetros hematológicos, incluyendo las tres poblaciones y el conteo diferencial directo. El equipo se calibró cada vez con los blancos y calibradores proporcionados por los fabricantes. Se registraron los siguientes analitos: recuento RBC, concentración HGB, PCV (o HCT), MCV, MCH, MCHC, RDW, conteo plaquetas (PLT), conteo de WBC y niveles de neutrófilos, linfocitos, mono-citos, eosinófilos, basófilos, fibrinógeno y proteínas totales TP. Se realizaron conteos absolutos y relativos.
El volumen de células empaquetadas (PCV) se midió usando el método estándar de microhematocrito (Van Assendelft et al. 2001). El plasma restante de la centrifugación se depositó en un refractómetro (Atago Co. Ltd., Tokyo, Japan), con el cual se realizó el análisis de proteínas totales plasmáticas, como indica el proceso estándar (Walker et al. 1990).
En el hemograma se interpretó anemia cuando el hematocrito estaba por debajo del valor mínimo del rango normal (<37%), la severidad se determinó así: leve (30-37%), moderada (20-29%), severa (13-19%), muy severa (<13%). El porcentaje de reticulocitos corregido con base en el hematocrito del paciente y el valor normal de 45% se empleó para determinar si la anemia era regenerativa (>1%) o no regenerativa (<1%). El leucograma inflamatorio se consideró si existía una o varias de las siguientes alteraciones: eosinofilia (>1000/µL), monocitosis (>1350/µL), leucocitosis (≥30.000/µL), presencia de neutrófilos tóxicos. Se consideró que había trombo-citopenia cuando las plaquetas estaban disminuidas (<200.000/pL).
Procedimiento de extracción de ADN utilizado en el laboratorio
Los resultados de las bases de datos se obtuvieron de la base de datos del laboratorio Testmol, los resultados de la extracción, por el método automatizado con el equipo de extracción abierta Kingfisher™ Duo (Thermo Fisher Scientific Inc.) y el kit de purificación de ácido nucleico MagMAX ™ CORE M Express-96 system (Thermo Fisher Scientific, Waltham, MA, USA), de acuerdo con condiciones establecidas del fabricante para muestras de sangre con EDTA.
Resultados de base de datos de qPCR y las condiciones de ensayo utilizado en el laboratorio
Los resultados para qPCR obtenidos en la base de datos se obtuvieron de procesos con cebadores específicos (Macrogen, Corea) para cada agente evaluado, los cuales iban dirigidos a los genes bacterianos 16S y parasitarios 18S. Todos los controles positivos provinieron del laboratorio Testmol-Centro de investigación y diagnóstico. Se usó agua de grado PCR como control negativo. Para control de extracción e interno, se utilizaron cebadores específicos para genes de Citocromo B en mamíferos.
El ensayo de PCR en tiempo real fue realizado en un (Mic 4 channels, Biomolecular systems, Australia), con protocolos propios del laboratorio.
Análisis estadístico
Las evaluaciones estadísticas se realizaron mediante la prueba exacta de Fisher y la prueba de chi-cuadrado; p < 0,05 se consideró estadísticamente significativo. Los cálculos se realizaron utilizando Estadísticas de Ciencias Sociales. (http://www.socscistatistics.com/).
RESULTADOS
Al evaluar las bases de datos de felinos positivos mediante diagnóstico molecular qPCR en Medellín (Colombia), para uno o más microorganismos hemotrópicos se evidenció una frecuencia del 70% (996/1.418). El número de animales infectados con uno, dos o tres agentes fue del 56% (795/1.418), 14% (202/1.418), y 2,3% (33/1.418), respectivamente (tabla 1). A su vez, la frecuencia evidenciada para cada uno de los agentes, de menor a mayor presencia: Rickettsia spp. 0,21% (3/1.418), Babesia spp. 0,35% (5/1.418), Ehrlichia spp. 0,49% (7/1.418), Dirolifaria spp. 0,64% (9/1.418), Anaplasma spp. 0,7% (10/1.418), Hepatozoon spp. 5,4% (77/1.418), Mycoplasma spp. 24,4% (347/1.418) y Bartonella spp. 37,9% (538/1.418). Las coinfecciones más frecuentes de dos agentes hemotró-picos de mayor a menor presencia son: Bartonella spp. y Mycoplasma spp. 7,9% (112/1.418), Bartonella spp. y Hepatozoon spp. 2,1% (30/1.418), Mycoplasma spp. y Hepatozoon spp. 2% (29/1.418) y Ehrlichia spp. y Anaplasma spp. 0,5% 8/1.418). Las coinfecciones de tres o más agentes hemotrópicos evidenciadas en el estudio son: Mycoplasma spp., Bartonella spp. y Hepatozoon spp 0,99% (14/1.418), Ricketsiales, Mycoplasma spp. y Bartonella spp. 0,6% (9/1.4l8), Mycoplasma spp., Filarias y Bartonella spp. 0,07% (1/1.418), Ricketsiales, Mycoplasma spp. y Hepatozoon spp. 0,28% (4/1.418), Ricketsiales, Bartonella spp. y Hepatozoon spp. 0,21% (3/1.418), y Ricketsiales, Mycoplasma spp., Bartonella spp. y Hepatozoon spp. 0,14% (2/1.418).
TABLA 1 Frecuencia de hemotrópicos y coinfecciones identificadas por qPCR en gatos de la ciudad de Medellín (n= 1418 gatos muestreados)
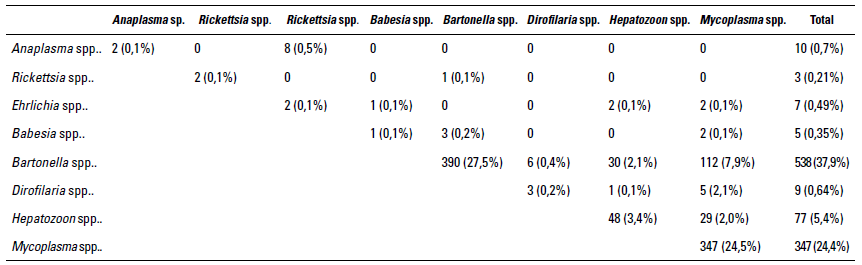
Fuente: elaboración propia con apoyo en las bases de datos de 1.418 muestras de felinos remitidos al laboratorio TestMol de Medellín entre julio de 2021 y marzo de 2022 para diagnóstico de hemotrópicos mediante qPCR.
Los datos de los hemogramas de quince felinos infectados con uno o más agentes hemotrópicos se muestran en la tabla 2. Once de ellos fueron positivos por un solo agente infeccioso, cuatro en coinfección con Mycoplasma spp. y Bartonella spp. y un felino con Rickettsia spp. y Bartonella spp. De los individuos positivos, once de ellos tenían hemogramas sin alteraciones de los rangos de referencia, aunque tres de ellos presentaban coinfecciones con otro agente. Dos de los felinos positivos, uno para Mycoplasma spp. y otro para Mycoplasma spp. y Bartonella spp., tenían anemia moderada (hematocrito 20,6%) y severa (hematocrito 14,9%) y reticulocitos de 0,9% y 0,4%, respectivamente. Solo un individuo positivo para Mycoplasma spp. presentaba trombocitopenia (plaquetas 180.000), tres tenían plaquetas en limites inferiores (<250.000 plaquetas).
TABLA 2 Perfil hemático de 15 gatos infectados con uno o más microorganismos hemotrópicos en la ciudad de Medellín
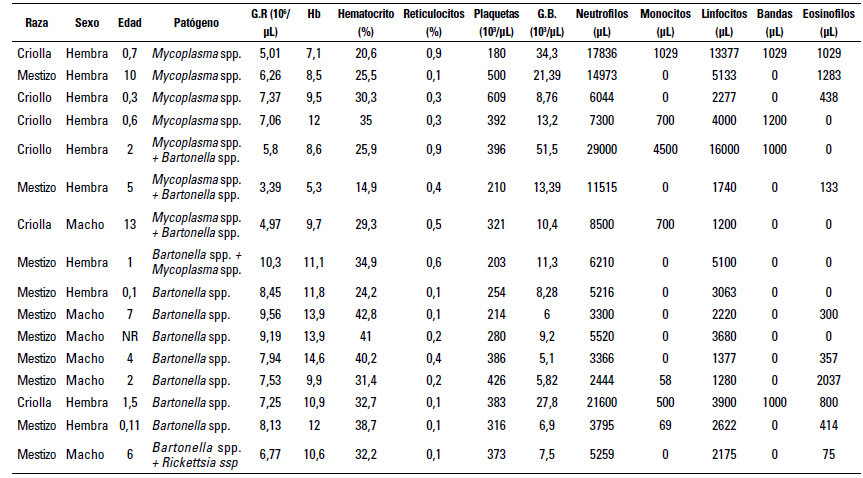
Fuente: elaboración propia con apoyo en las bases de datos de 15 hemoleucogramas de felinos positivos remitidos al laboratorio TestMol de Medellín entre julio de 2021 y marzo del 2022. *GR: glóbulos rojos, Hb: hemoglobina, GB: glóbulos blancos. **. Negrilla para valores fuera de los parámetros normales en felinos.
Al evaluar los leucogramas de los quince felinos positivos, cuatro de ellos mostraban aumentos de los glóbulos blancos (leucocitos), de los cuales uno estaba en coinfección y con la leucocitosis más severa de 51,5 103/µL, solo tres presentaban neutrofilia de 17.836 Neu/ µL, 29.000 Neu/ µL y 21.600 Neu/ µL, respectivamente. Además, hubo tres con linfocitosis reportadas en: 13.377 Linf/ µL, 5.133 Linf/ µL y 16.000 Linf/ µL. Sin embargo, aunque algunos individuos presentaran alteraciones en los hemoleuco-gramas, estos no manifestaban alteraciones en el examen clínico general y sus tutores mencionaron no haber evidenciado alguna modificación de su estado normal en casa, ya que comían con avidez, se veían activos y sus procesos fisiológicos se llevaban a cabo con normalidad y sin dificultad, cabe agregar que a estos individuos se les tomaron los exámenes de sangre y qPCR como protocolo prequirúrgico para orquiectomía y ovariohisterectomía (OVH), según el caso.
DISCUSIÓN
El presente análisis retrospectivo se realizó a partir de resultados moleculares obtenidos en un centro de diagnóstico especializado TestMol utilizando PCR en tiempo real cuantitativa, la cual utiliza como target las subunidades 16S y 18S de rDNA. Es sabido que, si bien las regiones del rDNA son extremadamente conservadas, lo cual puede llevar a problemas de inespecificidades en las pruebas basadas en PCR, es posible encontrar regiones que permitan diferenciar géneros como especies a partir de pruebas moleculares (White 1993).
Al determinar la frecuencia de pacientes felinos positivos a uno o más agentes hemotrópicos de los 9 evaluados mediante diagnóstico molecular basado con qPCR en muestras de pacientes remitidos de diferentes centros veterinarios de Medellín, el 70% (996/1418) fue positivo para uno o más agentes infecciosos, datos comparables con los reportados en gatos domésticos de Tailandia, donde se evidenció una prevalencia de 82,9% (63/275) mediante evaluación del gen 16 rRNA (Maruyama et al. 2001), y en otro reporte de gatos domésticos que circulan libres en Brasil, se demostró que el 89% (33/37) fue positivo para uno de los agentes evaluados mediante PCR (André et al. 2014).
Al evaluar la frecuencia de cada uno de los agentes hemotrópicos en este estudio, se evidenció una frecuencia para Rickettsia spp. de 0,21% (3/1.418), en comparación con estudios en Estados Unidos donde se demostraron anticuerpos en el 5,6% para R. felis, pero el DNA no fue amplificado mediante PCR en felinos con presencia de pulgas y fiebre (Bayliss et al. 2009), similar a otro estudio en este país, donde evaluaron mediante PCR convencional en muestras de sangre de felinos y sus pulgas, y se demostró que el 67,4% (62/92) de las pulgas fueron positivas para Rickettsia felis, aunque el resultado fuera negativo para todas las muestras de sangre, donde los autores mencionan que la causa factible es quizás la baja carga del agente circulante en el momento de la toma de la muestras, por lo que sugieren el uso de qPCR para futuros estudios (Hawley et al. 2007). En cuanto a Babesia spp. se evidenció una frecuencia de 0,35% (5/1.418), datos que distan de lo reportado en Brasil, donde se ha demostrado una prevalencia de 19% (7/37) mediante PCR en felinos domésticos de libre circulación (André et al. 2014), y de Portugal, que reportan una prevalencia de 9,4% (30/320) (Vilhena et al. 2013).
En cuanto a Ehrlichia spp. se observó una frecuencia del 0,49% (7/1.418), aunque existen pocos reportes de Ehrlichia spp. en felinos, en el norte de Estados Unidos, algunos estudios han evidenciado una prevalente de 3,2% (13/406) (Hegarty et al. 2015), y en Brasil se conocen datos con una alta prevalencia del 9,4% (20/122) en gatos domésticos (Braga et al. 2014). La frecuencia de Dirolifaria spp. en este estudio es del 0,64% (9/1.418), datos comparables con lo reportado en múltiples áreas de este país mediante evaluación de antígeno, donde se observó una prevalencia del 0,5% (12/2.181) (Miller et al. 2000). En cuanto a Anaplasma spp., se demostró una frecuencia del 0,7% (10/1.418), similar a estudios en Portugal que reportan una prevalencia de 0,6% (2/320) (Vilhena et al.2013), sin embargo, en Estados Unidos se conoce una prevalencia más alta con valores de 3,2 % (13/406) (Hegarty et al. 2015) y en Brasil se ha reportado hasta el 8% (3/37) (André et al. 2014). La frecuencia que en este estudio se evidencia para Hepatozoon spp. es del 5,4% (77/1.418), datos comparables con lo reportado en Italia con una prevalencia de 5,1% (10/196) (Gianelli et al. 2017) y que dista de lo reportado en Estados Unidos, donde la prevalencia fue del 2,4% (2/84) (Qurollo et al. 2018).
La frecuencia de Mycoplasma spp. (este es uno de los agentes hemotrópicos frecuentemente aislado en felinos en el mundo) en este estudio es del 24,4%, datos similares a lo observado en Brasil en felinos domésticos de libre circulación, donde se reporta una frecuencia de 32% (12/37) (André et al. 2014), y a un estudio en 2018 en la ciudad de Medellín donde evaluaron la frecuencia de varios hemo-trópicos en caninos y felinos mediante diferentes técnicas diagnósticas, entre ellas PCR, donde se reporta una frecuencia del 27,8% (5/32) (Rodríguez et al. 2018).
Por último, el agente hemotrópico con mayor frecuencia de presentación en este estudio es Bartonella spp., con un 37,9% (538/1.418), similar a lo reportado en ciertas zonas de Estados Unidos, donde en las llanuras centrales se han obtenido de seroprevalencias en promedio de 36,6% e incluso en Hawái del 47,4% (Jameson et al. 1995), contrario a otros estudios en Brasil, donde se han reportado prevalencias del 17,02% (8/47) (Staggemeier et al. 2010).
Entre las coinfecciones evidenciadas en este estudio, las más frecuentemente encontradas son Bartonella spp. y Mycoplasma spp. 7,9% (112/1.418), seguido de Bartonella spp. y Hepatozoon spp. 2,1% (30/1.418) y Mycoplasma spp. y Hepatozoon spp. 2% (29/1.418), si bien no se conocen estudios de prevalencias de coinfecciones de diferentes agentes hemotrópicos, sí se han obtenido como reportes de caso, como la coinfección con Anaplasma platys, Bartonella henselae, Bartonella koehlerae y Candidatus Mycoplasma haemominutum en un gato diagnosticado con plasmocitosis esplénica y mieloma múltiple, el cual presentaba en su hemoleucograma anemia, trombocitopenia y eosinofilia en Norteamérica (Qurollo et al. 2014), en otro estudio de 3 gatos con signos inespecíficos e inclusiones sugestivas de hemotrópicos en el frotis de sangre en Brasil, se evidenció Cytauxzoon felis, Candidatus Mycoplasma haemominutum y Ehrlichia sp. estrechamente relacionado con Ehrlichia canis y Anaplasma spp. en dos de los tres gatos muestreados, los cuales no mostraron anomalías hematológicas ni bioquímicas (André et al. 2017), situación evidenciada también en los individuos de este estudio donde se evaluaron los hemoleucogramas e historias clínicas. Por lo anterior, es importante recordar que muchos hemotrópicos en felinos pueden desarrollar signos clínicos que varían en severidad, y algunos estar de forma asintomática, y las variables que influyen en el grado de enfermedad corresponden a la vía de infección, estadio de la enfermedad (aguda, subclínica o crónica), el genotipo del patógeno, la respuesta inmunológica del huésped e incluso la presencia de coinfecciones con otros agentes hemotrópicos o algunos retrovirus.
Este estudio evidenció la frecuencia de 9 agentes hemotrópicos de las bases de datos del laboratorio TestMol en Medellín, hasta el momento no existe reporte de tantos agentes infecciosos transmitidos por vectores en felinos en el país mediante diagnóstico molecular (qPCR), lo que contribuye a la epidemiología de agentes con potencial zoonótico en el país, ya que existen reportes de caso de Ehrlichia monocítica humana (Botero et al. 2014), coinfección de babesiosos y erlichiosis en Cartagena (Farah et al. 2012) y se conocen estudios de seroprevalencia en habitantes urbanos y rurales del Caribe colombiano para Anaplasma, Babesia, Bartonella y Coxiella (Máttar et al. 2006; Buelvas et al. 2008).
Si bien los datos son similares en muchos de los casos a los reportados como prevalencias en otros países de Europa, Asia y América, estos datos no pueden ser extrapolables al total de la población, ya que no son muestras aleatorizadas de pacientes sanos o sintomáticos y se carece de información actualizada de la población total de felinos que permitan correlacionar los datos con una prevalencia, sin embargo, es posible identificar en pacientes semiológicamente sanos la presencia de agentes hemotrópicos, situación descrita en estudios previos (Sakura et al. 1992; Bauer et al. 2008), que podrían en algún momento ser de importancia clínica frente a algún estímulo inmunológico en el huésped, lo que evidencia la importancia del diagnóstico molecular en este tipo de agentes que pueden tener un curso asintomático (André et al. 2017).
Frente a los hallazgos encontrados en este estudio, es importante evaluar la frecuencia de los mismos agentes en otras zonas del país que podrían variar de acuerdo con condiciones medioambientales y considerar otros agentes hemotrópicos reportados en otros países como Coxiella burnetti (De Oliveira et al. 2022) y considerar estudios con más individuos y posibles coinfecciones con retrovirus.
CONCLUSIÓN
El presente trabajo enfatiza la importancia y necesidad de confirmación molecular de infecciones de agentes hemotrópicos y coinfecciones por múltiples enfermedades transmitidas por vectores en felinos que presentan signos clínicos inespecíficos, hemoleucogramas con o sin alteraciones e inclusiones de estructuras compatibles con agentes infecciosos hemotrópicos en frotis de sangre. Además, muchos individuos positivos para uno o más agentes patógenos transmitidos por vectores pueden permanecer subclínicos por mucho tiempo, sin embargo, frente a cualquier estímulo inmunológico, se puede desencadenar una fase aguda o estar generando una enfermedad crónica con manifestaciones clínicas a futuro, por lo que se requiere evaluar de manera individual la pertinencia de realizar tratamiento en un paciente en una zona no endémica de la enfermedad, ya que la ausencia de tratamiento expone al huésped a una complicación médica a futuro, y que además este se comporta como un reservorio para otros animales, e incluso para la especie humana, lo que puede dificultar el control de enfermedades transmitidas por vectores.















