Introducción
Streptococcus agalactiae, conocido también como estreptococo del grupo B, es una bacteria grampositiva, que causa enfermedad invasiva principalmente en los recién nacidos, mujeres embarazadas, etapa posparto 6-8 y adultos mayores con factores de riesgo. Este microorganismo saprofito coloniza habitualmente los tractos genitourinario y gastrointestinal del ser humano 3. Se estima, además, que esta bacteria es una causa importante de morbilidad infecciosa materna y un patógeno oportunista en adultos con enfermedades crónicas predisponentes 9,10.
En ausencia de medidas de prevención, una madre colonizada por Streptococcus agalactiae tendrá el 50 % de probabilidad de colonizar a sus hijos recién nacidos y entre estos, el 1 y 2 % durante los siete primeros días, posteriores al parto, desarrollan una infección precoz (sepsis neonatal temprana) 11-14. Este cuadro tiene un curso muy agresivo en el recién nacido y se manifiesta sistémicamente con sepsis, causa neumonía congénita o compromiso del sistema nervioso central como meningitis o presencia de abscesos cerebrales. Es importante recordar que en la gran mayoría de casos se presenta durante las primeras 24 horas de vida 15-18.
El S. agalactiae, principal representante de los estreptococos del grupo B, se caracteriza por su polisacárido capsular, presenta adhesinas de unión a fibronectina, hemolisinas, la prueba de camp y un sinnúmero de proteasas y factor de virulencia que permiten la invasión de este microorganismo en los tejidos del hospedero 19,20. Las características antigénicas únicas de su polisacárido capsular permiten clasificarlo en diez serotipos: Ia, Ib, ll, III, IV, V, VI, VII, VIII y IX21.
Aunque la información disponible confirma la susceptibilidad de este microorganismo a la penicilina y a otros antibióticos betalactámicos, numerosos estudios han informado, en el último tiempo, la emergencia de resistencia a eritromicina y clindamicina, antibióticos de uso alternativo en la quimioprofilaxis intraparto de pacientes alérgicas a penicilina 22-24.
Factores de riesgo para enfermedad perinatal
Diversas condiciones aumentan la probabilidad de que un recién nacido desarrolle la infección de inicio temprano. Se destaca la colonización materna por S. agalactiae que incrementa el riesgo más de 29 veces, en comparación con los recién nacidos de madres con cultivo negativo 25,26.
Clasificación de la infección por SGB
Enfermedad de inicio temprano: se presenta en los primeros seis días de vida y los serotipos Ia, II, III y V del SGB son los causantes de la mayoría de los casos 27-29. Este tipo de infección puede ocasionar sepsis neonatal grave, alteraciones cardiovasculares, manifestaciones respiratorias, meningitis y variaciones en el neurodesarrollo 30.
Enfermedad de inicio tardío: se presenta en los primeros noventa días después de la primera semana de vida; aunque ocurre más frecuentemente en pacientes sin antecedentes obstétricos y neonatales relevantes puede afectar a recién nacidos tanto de término como de pretérmino 31-33. Este tipo de infección puede cursar con sepsis, meningitis e infección focal; además, se asocia con lesiones cerebrales neonatales o la muerte 30.
Enfermedad de inicio tardío: se presenta después de los noventa días de vida y es causada principalmente por los serotipos Ia, III y V; la presentación clínica es similar a la de la enfermedad de inicio tardío y puede aparecer como una bacteriemia sin foco, meningitis, osteoartritis, celulitis y adenitis 34.
Se estima que del 10 al 20 % de las mujeres embarazadas están colonizadas con egb, que aproximadamente el 50 % de los recién nacidos serán colonizados y el que el 1 % de estos desarrollará enfermedad grave, que se clasificará según el tiempo en el que se presente la infección 34 (figura 1).
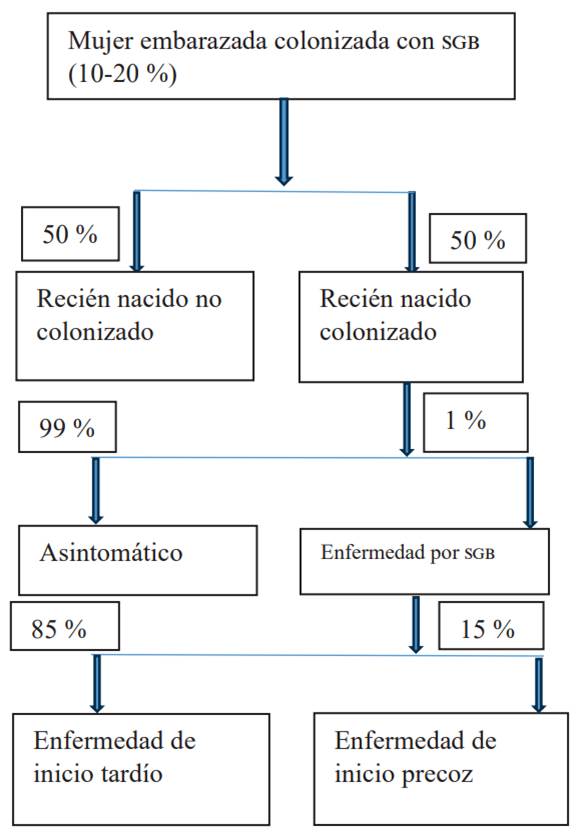
Fuente: Palacios Gerardo C. et al, 2017.
Figura 1 Diagrama de flujo de la transmisión perinatal 27,35
Tamizaje
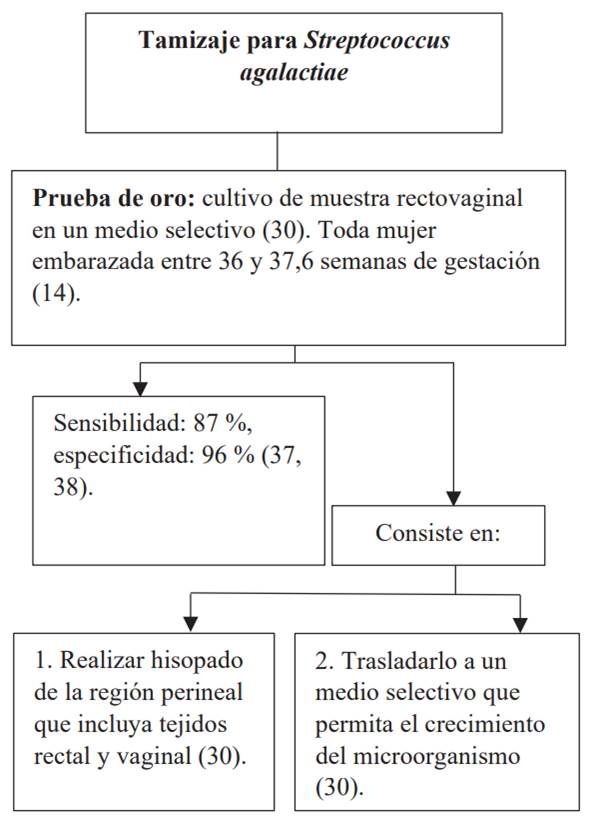
El primer paso para evitar la infección por S. agalactiae es contar con un sistema de tamizaje entre las semanas 36 y 37,6 de embarazo que permita identificar la población gestante colonizada, para iniciar de forma oportuna la profilaxis antibiótica intraparto (PAI) al inicio del trabajo de parto 14,36 (figura 2).
Otro medio utilizado es el subcultivo en agar sangre y la identificación del microorganismo por el test de CAMP, que consiste en la betahemólisis tras la interacción de las sustancias producidas por el S. agalactiae y el Staphylococcus aureus en el medio; presenta sensibilidad entre el 54 y el 87 % y los resultados pueden tardar hasta 72 horas 32.
Técnicas de diagnóstico rápido para detección del estreptococo del grupo B en gestantes
Se han hecho importantes progresos en el desarrollo de pruebas rápidas de detección del EGB basadas en la amplificación de ácidos nucleicos (NAAT) 39. Estas ofrecen una alternativa razonable y potencialmente más sensible a un cultivo para la detección preparto y algunos laboratorios y, aunque son una minoría, informan el uso de estas pruebas más nuevas para la detección preparto de rutina 40. La NAAT de base molecular no aísla el organismo como lo hace el cultivo y, por tanto, no permite las pruebas de susceptibilidad a los antibióticos necesarios para optimizar la pai en mujeres alérgicas a la penicilina; sin embargo, pueden ser útiles para indicar o no pai en gestantes sin factores de riesgo con embarazo a término, cuyo estado de colonización por EGB se desconoce 11,14,41.
Indicaciones de profilaxis antibiótica intraparto para prevenir la enfermedad estreptocócica neonatal de inicio temprano del grupo B
Tabla 2 Indicaciones para el manejo de la profilaxis antibiótica intraparto (PAI) para el estreptococo del grupo B
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fuente: Committee Opinion, 2020.
Tratamiento
La resistencia bacteriana es considerada un problema actual, que se debe tener en cuenta en la prevención de la colonización e infección por SGB, además de ser un factor importante a la hora de elegir el tratamiento que se indicará durante el embarazo y el parto 30 (figura 3).
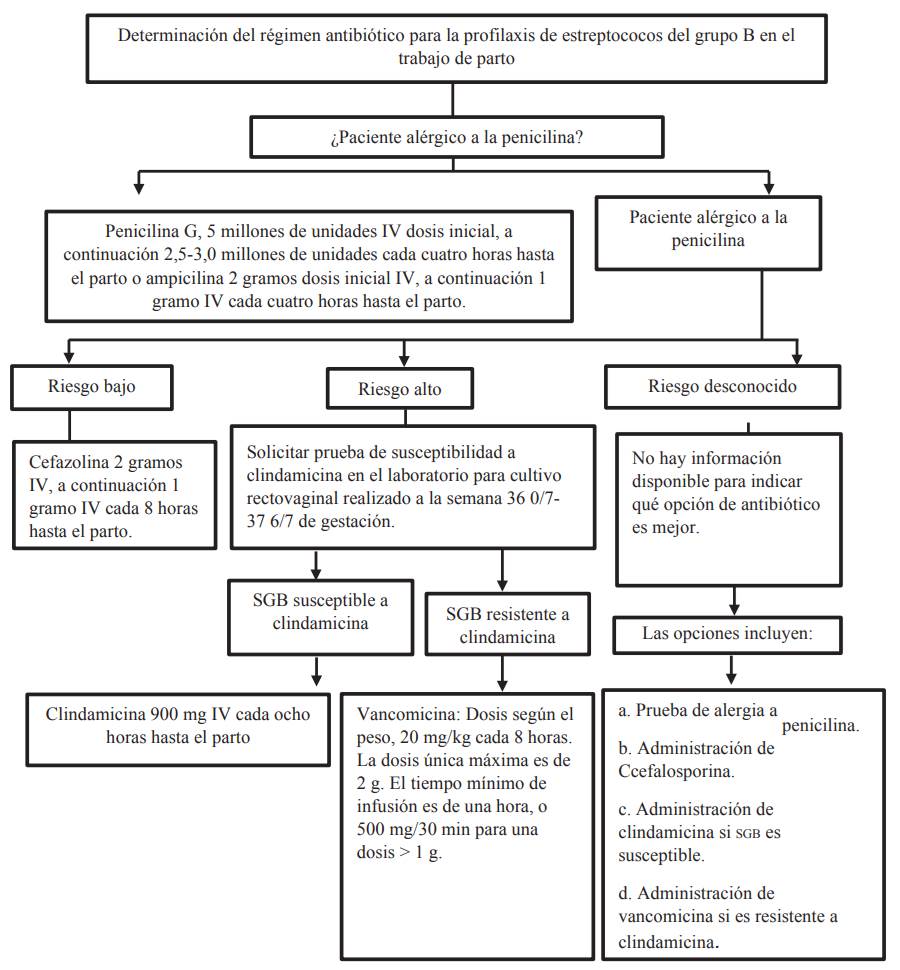
Fuente: Committee Opinion, 2020. Abreviaturas: SGB, Estreptococo del grupo B; IV, intravenosa.
Figura 3 Esquema recomendado para determinar la profilaxis antibiótica intraparto de la prevención en la enfermedad de inicio temprano causada por estreptococo del grupo B
Actualmente, las tasas de resistencia del SGB a la eritromicina han ido aumentando hasta un 44,8 %. Además, la eritromicina no atraviesa bien la placenta y no produce niveles terapéuticos de drogas ni en el líquido amniótico ni en la sangre fetal, lo que confirma, aún más, que esta es una mala elección para la profilaxis del SGB intraparto 44-48.
Por otro lado, las tasas de resistencia del SGB a clindamicina representan el 20 % o más, por lo que su indicación es posible si existe un cultivo que demuestre sensibilidad in vitro en paciente, generalmente con alergia mayor a los betalactámicos 44,45,47.
En las mujeres que reportan alergia a la penicilina, la elección del antibiótico intravenoso inicial administrado para la profilaxis del SGB se guiará por dos factores: antecedentes de alergia a la penicilina para determinar si tiene un riesgo bajo o alto de anafilaxia (tabla 3) y resultados de susceptibilidad a antibióticos del cultivo de SGB (49-51.
Vacunación
La relevancia de los estudios previamente mencionados radica en que se ha demostrado que a mayor concentración de IGG anticps hay menos desarrollo de la enfermedad tardía y temprana por estreptococo del grupo B; no obstante, existen diferentes distribuciones de los serotipos según el tiempo y ubicación geográfica, lo que hace más complejo el cubrimiento adecuado de todos los pacientes 52.
En ausencia de una vacuna SGB con licencia, el cribado universal y la profilaxis antibiótica intraparto continúan siendo las piedras angulares de la prevención temprana de la enfermedad SGB (22.
Materiales y métodos
En este estudio de tipo descriptivo observacional de corte retrospectivo, se obtuvo una muestra de 58 resultados positivos para S. agalactiae, según cultivos rectovaginales, datos aportados por el laboratorio del Hospital Raúl Orejuela Bueno de Palmira, tomados en mujeres gestantes en el periodo comprendido entre el primero de enero de 2018 y el 31 de diciembre de 2019. Los cultivos se desarrollaron siguiendo la metodología planteada por los Centros para el Control y Prevención de Enfermedades (CDC, por sus siglas en inglés) y se agregó agar chromID. La prueba de susceptibilidad antimicrobiana a ampicilina, levofloxacino, moxifloxacino, quinupristina/dalfopristina, linezolid, vancomicina y tetraciclina se realizó utilizando el método automatizado VITEK®-2.
A continuación, se describen los criterios de inclusión y exclusión.
Criterios de inclusión: cultivos rectovaginales positivos para Streptococcus agalactiae en mujeres gestantes.
Criterios de exclusión: paciente con tratamiento local tópico con óvulos o cremas vaginales al momento de tomar la muestra.
Resultados de cultivos rectovaginales con aislamiento microbiológico diferente al de S. agalactiae.
Recolección de la información
Se realizó búsqueda de cultivos rectovaginales positivos para Streptococcus agalactiae, generada por el sistema operativo Whonet 5.6 del laboratorio del Hospital Raúl Orejuela Bueno en el tiempo comprendido para el estudio, que cumplieran con los criterios de inclusión, diligenciando un formato de recolección en Excel 2013, que arroja un número consecutivo a cada paciente para el registro de la información.
Técnica de análisis de cultivo rectovaginal
Los cultivos se desarrollaron siguiendo la metodología recomendada por los CDC.
Para determinar los perfiles de sensibilidad se emplearon las normas estandarizadas del Clinical and Laboratory Standard Institute (CLSI).
Resultados
Según el aislamiento microbiológico del S. agalactiae y según su perfil de susceptibilidad se encontró sensibilidad en un 100 % para ampicilina, levofloxacino y moxifloxacino para quinupristina/ dalfopristina, linezolid y vancomicina un 98 % y finalmente resistencia para tetraciclina en un 67 %.
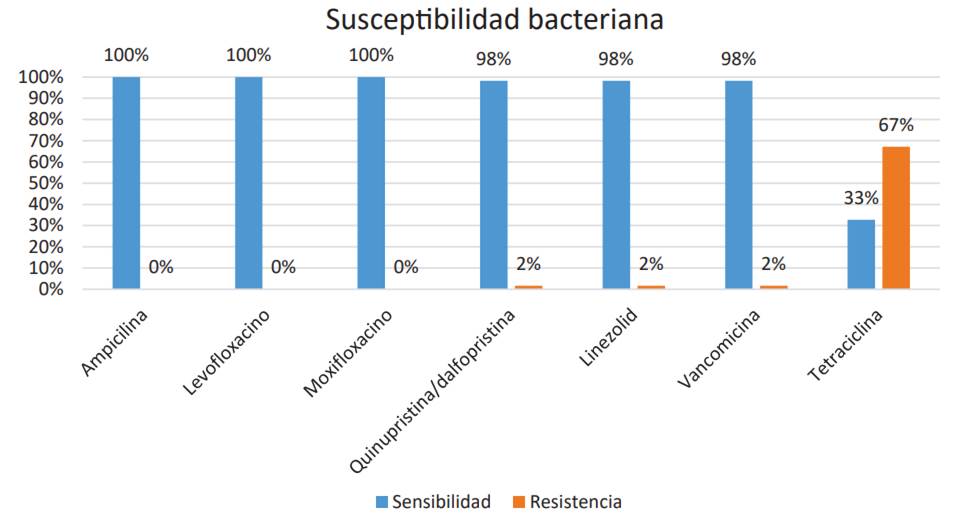
Fuente: elaboración propia.
Figura 4 Susceptibilidad antimicrobiana de cepas de Streptococcus agalactiae de colonización rectovaginal en mujeres embarazadas en un Hospital de Palmira
Tabla 4 Susceptibilidad antimicrobiana de cepas de Streptococcus agalactiae de colonización rectovaginal en mujeres embarazadas en un Hospital nivel II de Palmira, Valle, Colombia, en el periodo 2018-2019
| Fármaco | Sensibilidad | Resistencia | N.° de pacientes sensibles | N.° de pacientes resistentes |
|---|---|---|---|---|
| Ampicilina | 100 % | 0 % | 58/58 | 0/58 |
| Levofloxacino | 100 % | 0 % | 58/58 | 0/58 |
| Moxifloxacino | 100 % | 0 % | 58/58 | 0/58 |
| Quinupristina/dalfopristina | 98 % | 2 % | 57/58 | 1/58 |
| Linezolid | 98 % | 2 % | 57/58 | 1/58 |
| Vancomicina | 98 % | 2 % | 57/58 | 1/58 |
| Tetraciclina | 33 % | 67 % | 19/58 | 39/58 |
Fuente: elaboración propia.
Discusión
Stylianopoulos, Weisner, Fernandez, Pearlman, et al. 55 coincidieron en la elevada sensibilidad del EGB in vivo e in vitro a los betalactámicos, particularmente a la penicilina G. Por otra parte, la vancomicina ha mostrado una sensibilidad del 100 %; sin embargo, muchos obstetras muestran objeciones a su utilización principalmente debido a la posibilidad de emergencia de bacterias grampositivas resistentes a vancomicina como Enterococcus y Staphylococcus aureus y a la complejidad en su administración y a su toxicidad 57.
Existen coincidencias en reportes continuos sobre la resistencia a macrólidos realizados y expuestos por Wiesner, Fernandez, Pearlman y Berliu 27,54,55,58; sin embargo, el estudio realizado por González et al. 59 resalta que la resistencia a aminoglucósidos y a las sulfas oscila entre el 5 y 20 % de los probados.
En España la resistencia a eritromicina del 12,45 % y a clindamicina del 11,8 % hace difícil recomendar empíricamente la administración intraparto de estos antibióticos a aquellas mujeres colonizadas por el egb y alérgicas a penicilina y, por tanto, obliga, como sí se recomienda en los nuevos protocolos de profilaxis (59, 60); así, en un estudio multicéntrico realizado por Lin, Azimi, Weisman, Philips III, Regan y Clark et al. 64, la resistencia a eritromicina y clindamicina en California fue del 32 y del 12 %, respectivamente. En Florida fue del 8,5 y 2,1 % 57, del 7 al 18 % de resistencia a eritromicina, publicado en EE. UU., del 15 al 21% reportado en Europa, 33 % en Taiwán y 44 % en Corea 23,24,54,55,62-66.
Teniendo en cuenta que la clindamicina se considera un inductor débil a largo plazo, es importante detectar este mecanismo de resistencia en estos aislamientos, antes de administrarla, pues estos antibióticos se emplean como tratamiento en la profilaxis intraparto y, a su vez, es necesario caracterizar las cepas aisladas en este estudio ya que podría tener como consecuencia la falla terapéutica. Para Ardanuy et al. 70 y Díaz et al. 71, el hecho de que el egb mantenga la susceptibilidad a la penicilina G hace que este antibiótico continúe siendo el de elección para el tratamiento de primera intención ante la sospecha de una infección ocasionada por este agente.
En Colombia, Crespo et al. 72 realizaron un estudio en la Fundación Valle del Lili en Cali, durante casi dos años, tiempo durante el cual se aislaron 16 cepas del EGB con sensibilidad a ciprofloxacina y resistencia de entre el 8 y el 80 % a la gentamicina y a la tetraciclina.
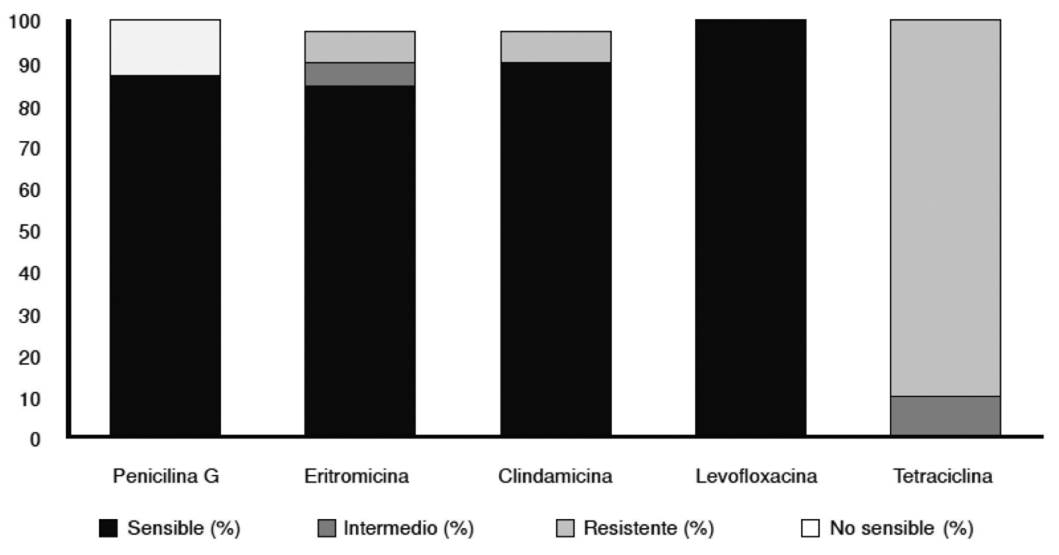
La profilaxis intraparto se ha convertido en una estrategia eficaz que ha logrado disminuir la infección neonatal temprana por S. agalactiae70. Cabe destacar que el 12,5 % de las cepas encontradas en un estudio realizado por Kimura et al. 74 no fueron sensibles a la penicilina (figura 5); debe tenerse en cuenta que los estreptococos siempre se han considerado sensibles a los antibióticos betalactámicos y que hasta el momento el Clinical and Laboratory Standard Institute (CLSI)70 no ha establecido criterios de resistencia de este microorganismo contra estos fármacos.
Conclusiones
A la luz de los resultados del estudio se encuentran frecuencias semejantes a las descritas en revisiones desarrolladas en centros médicos locales e incluso internacionales.
La sensibilidad del SGB a betalactámicos y quinolonas es del 100 % y es importante advertir la alta resistencia del SGB al grupo antibiótico de las tetraciclinas.