Introducción
El agua es esencial para la supervivencia de las plantas, por lo cual, el déficit hídrico limita el crecimiento y rendimiento de los cultivos (Tardieu et al., 2018). Con la variabilidad climática se presenta una alteración en los patrones de precipitación que aumenta la frecuencia y duración de los periodos de sequía (Miranda-Apodaca et al., 2018), cuyos efectos dependen de la especie, etapa fenológica y magnitud de la sequía, lo que implica riesgos para la seguridad alimentaria (Tardieu et al., 2018).
En condiciones de déficit hídrico, las raíces responden a los cambios de humedad en el suelo, lo que aumenta la síntesis de ácido abscísico (ABA), que a su vez lleva al cierre estomático como una respuesta rápida para evitar la deshidratación (Gupta et al., 2020). Por otro lado, la disminución de la conductancia estomática causa un desbalance entre las fases de la fotosíntesis debido a la restricción en la difusión de CO2 (Kaur et al., 2021) esto ocasiona un aumento en la producción de especies reactivas de oxígeno (ROS), que causan peroxidación lipídica de las membranas e incrementan su permeabilidad (Hossain et al., 2012). También se presentan cambios en la partición de asimilados y en la reducción del tamaño de las hojas, lo que resulta en menor radiación interceptada (Wijewardana et al., 2018).
Algunos compuestos usados para mitigar los efectos del déficit hídrico incluyen sustancias orgánicas e inorgánicas (Abdel-Rahman et al., 2018). Estudios en varias especies han mostrado los efectos benéficos de la aplicación de calcio (Ca), pues incrementan la tolerancia al déficit hídrico (Hosseini et al., 2019), lo cual ha sido asociado con el papel del Ca en vías de señalización en respuesta al estrés (Xu et al., 2013). Además, el Ca participa en la fotosíntesis (Hochmal et al., 2015), regula el movimiento estomático (Atif et al., 2019), reduce la generación de ROS, aumenta los niveles de clorofilas, fortalece la estructura de la pared celular, facilita la absorción de otros nutrientes (Hosseini et al., 2019) y mantiene la integridad de las membranas celulares (Guimarães et al., 2011).
En Zea mays L. se ha reportado el incremento del potencial hídrico foliar, de la conductancia estomática y del rendimiento del grano con aplicación foliar asocia con la presencia de un sistema radical de baja densidad y poco profundo (Wishart et al., 2014), debido a ello, las etapas de emergencia e inicio de tuberización son las más afectadas (Ramírez et al., 2016). La papa es el tercer cultivo de mayor consumo en el mundo y es fundamental para la seguridad alimentaria (Goyer, 2017). En este contexto y con el aumento en la ocurrencia de las sequías, producto del calentamiento global (Miranda-Apodaca et al., 2018), es necesario encontrar estrategias de mitigación del estrés hídrico (Tigkas et al., 2020).
Asimismo, se ha reportado que periodos sin suministro de agua mayores a 17 días en inicio de tuberización, en S. tuberosum L. grupo Phureja cultivar (cv) criolla Colombia, generan una disminución en el rendimiento mayor al 37 % (Ariza et al., 2020). En papa son escasos los trabajos que evalúan el efecto de fuentes de Ca para mitigar el déficit hídrico, por tanto, el objetivo de este estudio fue evaluar el efecto de la aplicación de Ca, tanto edáfica como foliar, sobre parámetros fisiológicos y de rendimiento en condiciones de déficit hídrico en papa cv. criolla Colombia.
Materiales y métodos
Material vegetal y diseño experimental
Esta investigación se realizó entre junio y octubre de 2018 en invernadero (temperatura mínima: 6 ºC-12 °C, temperatura máxima: 27 ºC-38 °C; humedad relativa: 29 %-87 %) en la Facultad de Ciencias Agrarias de la Universidad Nacional de Colombia - Sede Bogotá (4°38’10.1”N y 74°05’23.0”W). Los tubérculos-semillas de 4-6 cm de diámetro del cultivar criolla Colombia fueron sembrados en bolsas plásticas con 7 kg de suelo franco-arenoso, pH: 5. Se realizó fertilización edáfica a la siembra con base en el análisis de suelo (franco-arenoso, pH: 5.0, CICE: 5.71 meq 100g-1, Ca: 3.03 meq 100g-1, Mg: 1.2 meq 100g-1 y K: 0.39 meq 100g-1) aplicando 20 g planta-1 de fertilizante compuesto NPK (10-20-30).
A los 45 días después de siembra (dds) se realizó la aplicación de forma edáfica de Ca como un suplemento adicional al requerimiento del cultivo, en las siguientes formulaciones: CaCl2 de 3 y 4.5 g planta-1, Ca(NO3)2 de 4.5 y 7.0 g planta-1 y de Ca(NO3)2 + B de 6.0 y 9.0 g planta-1, y se fraccionaron estas dosis en dos momentos (45 y 50 dds). Asimismo, se aplicó Ca foliar correspondiente a CaCl2 de 10 y 20 mM planta-1, y Ca(NO3)2 de 10 y 20 mM planta-1 a los 46, 48, 50, 52 y 54 dds (Tabla 1).
Tabla 1 Tratamientos (T) con aplicaciones edáficas (E) y foliares (F) de Ca en plantas de S. tuberosum L. grupo Phureja cv. criolla Colombia sometidas a déficit hídrico
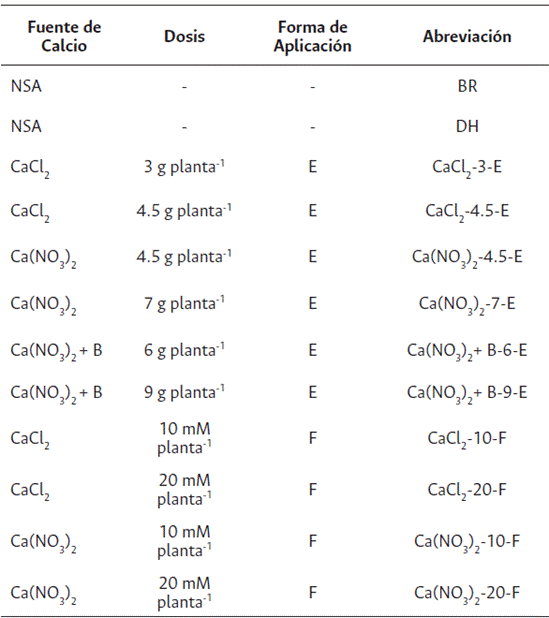
NSA: no se aplicó suplemento de Ca; DH: déficit hídrico por siete días; BR: riego continuo.
Para la aspersión foliar se adicionó coadyuvante (poliéter polimetilsiloxano copolímero: 1019.21 g/L) y se asperjaron 130 ml de solución por planta. El suelo se mantuvo a capacidad de campo hasta el inicio de la etapa de tuberización (55 dds), cuando fueron sometidas a dos regímenes hídricos: i) riego continuo (BR) y ii) déficit hídrico por suspensión de riego durante siete días (DH). Al finalizar el periodo de estrés hídrico se reinició el riego hasta el final del ciclo del cultivo.
Se utilizó un diseño completamente aleatorizado, con cuatro plantas por unidad experimental. Los tratamientos se muestran en la Tabla 1. Las mediciones de variables fisiológicas se realizaron durante el periodo de déficit hídrico y en el periodo de recuperación, cuatro días después de iniciar el riego (ddr), sobre el foliolo terminal de una hoja completamente expandida del tercio superior de la planta.
Estado hídrico foliar
El estado hídrico foliar se determinó a través del contenido relativo de agua (CRA) y del potencial hídrico foliar (Ψh) en horario entre las 3:00-5:00 a.m. Para determinar el CRA se tomó el peso fresco (Pf), el peso a saturación hídrica (Psh) y el peso seco (Ps) de un foliolo, y luego se aplicó la fórmula:(Pieczynski et al. 2013). Las diferencias presentadas en magnitud entre los tratamientos con DH y las plantas BR fueron calculadas para determinar el tipo de estrés presentado de acuerdo con Hsiao (1973). El Ψh se midió con una bomba de presión de Scholander (Model 615 PMS Instrument Co., Albany, USA).
Estabilidad de las membranas
La estabilidad de las membranas se determinó mediante la pérdida de electrolitos (PE), siguiendo a Savić et al. (2012), con algunas modificaciones. Se tomaron 10 discos de hoja de 5 mm de diámetro, se colocaron en 10 ml de agua desionizada y luego de seis horas de incubación, se determinó la conductividad eléctrica inicial (EC1) con un conductímetro (HI 9835 Hanna®-ICT, SL). Posteriormente, las muestras se calentaron por 15 min a 100 ºC, se dejaron enfriar a temperatura ambiente y se determinó la conductividad eléctrica final (EC2), la PE se calculó como: .
Rendimiento
El rendimiento se determinó al final del ciclo del cultivo (110 dds) en seis plantas por tratamiento, a través del número y peso fresco de tubérculos por planta.
Análisis de datos
Los resultados se analizaron con el software SAS 9.4 mediante el procedimiento Proc Mixed con medias repetidas en el tiempo, previa revisión de estructuras para la matriz de error, seleccionando el modelo de Simetría Compuesta por mejor ajuste, de acuerdo con el criterio BIC. Las variables de rendimiento se evaluaron con ANOVA en una vía. Previa verificación de supuestos de normalidad y del efecto de los tratamientos, se determinó mediante la prueba de comparación múltiple de Tukey (p≤0.05).
Resultados
Estado hídrico foliar
A los 4 ddt las plantas BR, Ca(NO3)2+B-9-E y Ca(NO3)2-4.5 presentaron CRA entre 86.2 y 92.4 %, mientras que los demás tratamientos registraron valores inferiores a 82.7 %. El CRA se redujo en 21.7 % en plantas con DH respecto a las plantas BR a los 7 ddt, sin embargo, el pretratamiento con Ca permitió mantener el CRA a valores superiores (>76.5 %), con mayor porcentaje de aumento para CaCl2-20-F (17.92 %), Ca(NO3)2-20-F (14.77 %), CaCl2-3-E (12.68 %) y CaCl2-4.5-E (12.27 %) en comparación con las plantas DH sin Ca. Después de la rehidratación el CRA presentó valores superiores a 85.6 % para todos los tratamientos (Figura 1).
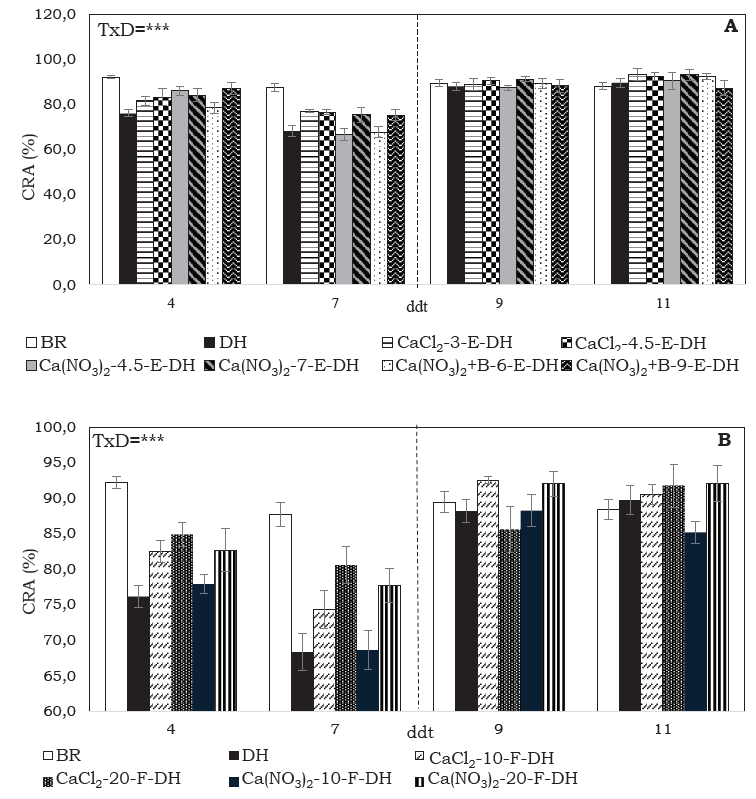
Figura 1 Contenido relativo de agua (CRA) de plantas de S. tuberosum L. grupo Phureja cv. criolla Colombia, bien regadas (BR) o con déficit hídrico (DH), sin y con aplicación de Ca de forma (A) edáfica (E): CaCl2 (3 g planta-1), CaCl2 (4.5 g planta-1), Ca(NO3)2 (4.5 g planta-1), Ca(NO3)2 (7 g planta-1), Ca(NO3)2 + B (6 g planta-1) y Ca(NO3)2 + B (9 g planta-1), y (B) foliar (F): CaCl2 (10 mM planta-1), CaCl2 (20 mM planta-1), Ca(NO3)2 (10 mM planta-1) y Ca(NO3)2 (20 mM planta-1). n= 4. La línea punteada vertical indica el inicio del riego (7 ddt). Las barras se presentan con la desviación estándar. Los valores de probabilidad obtenidos del modelo lineal mixto generalizado indican significancia a P≤0.001 (***).
El Ψh disminuyó con el aumento del periodo de déficit hídrico, en el cual fue significativa la interacción tratamiento (T) día (D) (p<.0001). El primer día, tras la suspensión hídrica, se presentaron valores entre -0.45 y -0.63 MPa para los tratamientos BR y Ca(NO3)2-4.5-E, respectivamente. A los 4 ddt, las plantas con DH presentaron potenciales cercanos a -1 MPa, con excepción de los tratamientos BR (-0.41 MPa) y CaCl2-10-F (-0.64 MPa). Al finalizar el periodo de déficit hídrico, el Ψh alcanzó -1.5 MPa para DH y los tratamientos con suplemento de Ca (DH-Ca). Después de la rehidratación todos los tratamientos alcanzaron valores cercanos a -0.5 MPa (Figura 2).

Figura 2 Potencial hídrico foliar (Ψh) de plantas de S. tuberosum L. grupo Phureja cv. criolla Colombia, bien regadas (BR) o con déficit hídrico (DH) sin y con aplicación de Ca de forma (A) edáfica (E): CaCl2 (3 g planta-1), CaCl2 (4.5 g planta-1), Ca(NO3)2 (4.5 g planta-1), Ca(NO3)2 (7 g planta-1), Ca(NO3)2 + B (6 g planta-1) y Ca(NO3)2 + B (9 g planta-1), y (B) foliar (F): CaCl2 (10 mM planta-1), CaCl2 (20 mM planta-1), Ca(NO3)2 (10 mM planta-1) y Ca(NO3)2 (20 mM planta-1). n= 4. La línea punteada vertical indica el inicio del riego (7 ddt). Las barras se presentan con la desviación estándar. Los valores de probabilidad obtenidos del modelo lineal mixto generalizado indican significancia a P≤0.001 (***).
Estabilidad de las membranas
A los 4 ddt la PE en plantas con DH fue de 17.9 % y a los 7 ddt de 27.34 %, sin embargo, la aplicación de Ca redujo la PE significativamente con Ca(NO3)2- 20-F (16.1 %), Ca(NO3)2-7-E (21.7 %), Ca(NO3)2+B-9-E (35.6 %) y CaCl2-20-F (38.8 %) a los 7 ddt, respecto a las plantas de DH sin Ca. A 2 dds, la PE disminuyó presentando valores cercanos a 20 % en las plantas con DH y DH-Ca, mientras que a los 4 ddr alcanzó valores entre 13-18 % similares a las plantas BR (Figura 3).
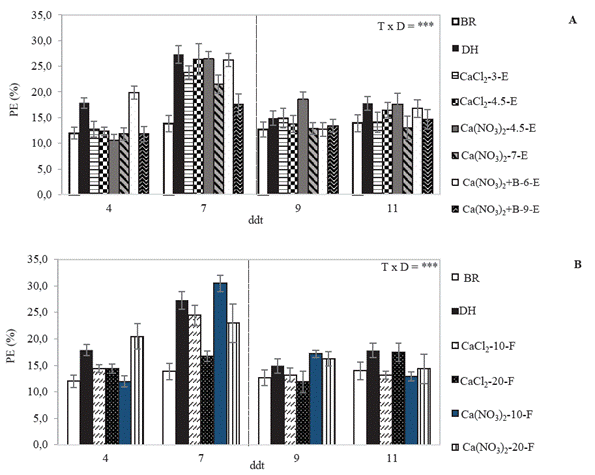
Figura 3 Efecto de la aplicación de Ca en la pérdida de electrolitos (PE) de plantas de S. tuberosum L. grupo Phureja cv. criolla Colombia bien regadas (BR) o con déficit hídrico (DH) sin y con aplicación de Ca de manera (A) edáfica edáfica (E): CaCl2 (3 g planta-1), CaCl2 (4.5 g planta-1), Ca(NO3)2 (4.5 g planta-1), Ca(NO3)2 (7 g planta-1), Ca(NO3)2 + B (6 g planta-1) y Ca(NO3)2 + B (9 g planta-1), y (B) foliar (F): CaCl2 (10 mM planta-1), CaCl2 (20 mM planta-1), Ca(NO3)2 (10 mM planta-1) y Ca(NO3)2 (20 mM planta-1). n= 4. La línea punteada vertical indica el inicio del riego (7 ddt). Las barras se presentan con la desviación estándar. Los valores de probabilidad obtenidos del modelo lineal mixto generalizado utilizado indican significancia a P≤0.001 (***).
Rendimiento
Las plantas BR presentaron en promedio 19 tubérculos con peso fresco de 143.99±30.16 g planta-1. En los demás tratamientos, al presentarse una menor disponibilidad de agua (Figura 1) y mayor pérdida de electrolitos (Figura 3), se redujo el rendimiento del tubérculo en peso fresco, mas no el número de tubérculos por planta (Tabla 2). La reducción en el rendimiento en las plantas con DH fue del 26.7 % en comparación con BR; no obstante, con la aplicación de CaCl2-20-F, Ca(NO3)2-20-F, Ca(NO3)2-7-E, CaCl2-4.5-E, Ca(NO3)2+B-6-E y Ca(NO3)2+B-9-E, se reportó la menor reducción en el rendimiento (4.7-15.3 %) (Tabla 2).
Tabla 2 Rendimiento de tubérculo en plantas de S. tuberosum L. grupo Phureja cv. criolla Colombia sometidas a déficit hídrico (DH), sin suspensión de riego (BR) y fertilizadas con diferentes fuentes de calcio aplicadas de manera foliar (F) y edáfica (E). Los valores se presentan con la desviación estándar
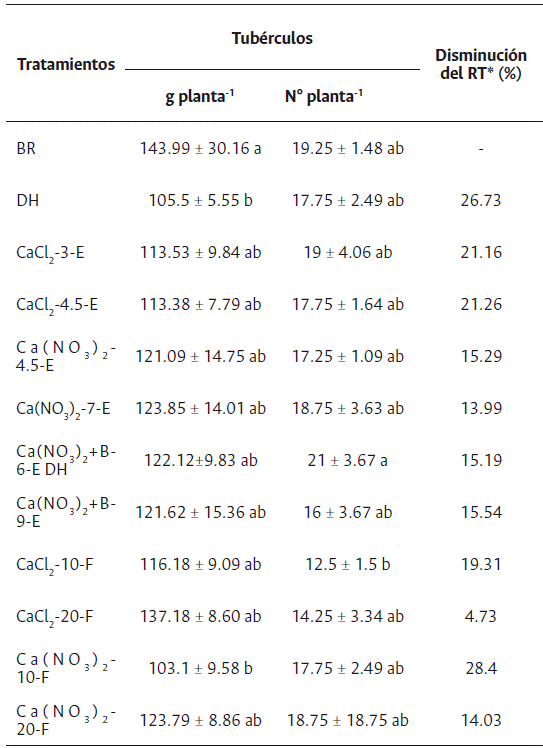
*Disminución del rendimiento de tubérculo (RT) en peso (g planta-1) respecto a BR. Medias con la misma letra no presentan diferencias significativas según el test de Tukey y p<0,05. n= 6.
Discusión
El déficit hídrico afecta negativamente el rendimiento y calidad del tubérculo en papa (Soltys-Kalina et al., 2016). Debido al cambio climático se espera que los eventos de estrés hídrico se presenten con una alta recuencia (Miranda-Apodaca et al., 2018), por lo cual, es necesario identificar estrategias de manejo que eviten la reducción del rendimiento en el cultivo de papa. En esta investigación las aplicaciones, tanto foliares como edáficas de algunas fuentes de Ca, aliviaron los efectos del déficit hídrico en plantas de papa cv. criolla Colombia, al mejorar el estado hídrico foliar y la estabilidad de las membranas.
En el CRA se observó que las plantas con DH -Ca(NO3)2-4.5-E, Ca(NO3)2+B-6-E y Ca(NO3)2-10-F, presentaron una disminución mayor al 20 % respecto a las plantas BR, lo que corresponde a un déficit hídrico severo a los 7 ddt. Asimismo, a los 7 ddt el CRA fue inferior a 75 % para los tratamientos de Ca(NO3)2-4.5-E (66.7 %), Ca(NO3)2+B-6-E (67.9 %), DH (68.9 %), Ca(NO3)2-10-F (70.7 %) y CaCl2-10-F (74.3%), lo que sugiere un efecto negativo en la fotosíntesis (Lawlor y Cornic, 2002). Los demás tratamientos con DH presentaron una disminución en el CRA entre el 10 y 20 % respecto a las plantas BR, lo que corresponde a un déficit hídrico moderado según la frecuencia (Miranda-Apodaca et al., 2018), por lo cual, es necesario identificar estrategias de manejo que eviten la reducción del rendimiento en el cultivo de papa. En esta investigación las aplicaciones, tanto foliares como edáficas de algunas fuentes de Ca, aliviaron los efectos del déficit hídrico en plantas de papa cv. criolla Colombia, al mejorar el estado hídrico escala propuesta por Hsiao (1973). Las alteraciones en el balance hídrico de la planta observadas en el CRA, causan la reducción del potencial de turgor y, por tanto, de la conductancia estomática (Anjum et al., 2011), lo que limita el crecimiento de las plantas (Harb et al., 2010).
La disminución en el Ψh con aplicación de CaCl2 - 20 F y Ca(NO3)2-20-F, CaCl2h-3-E y CaCl2-4.5-E (Figura 2), asociada a un CRA mayor en comparación con las plantas DH sin Ca (Figura 1), podría deberse con la síntesis de osmolitos, lo cual fue reportado en esta variedad en condiciones de déficit hídrico (Ariza et al., 2020). El Ca favorece el ajuste osmótico por su participación en vías de señalización en respuesta a estrés (Atif et al., 2019), lo que incrementa la concentración de osmolitos orgánicos, como el malato (Naeem et al., 2018). Sin embargo, es necesario hacer un estudio más detallado evaluando el contenido de osmolitos en las plantas con estos tratamientos. Asimismo, el Ca como osmolito inorgánico puede favorecer el ajuste osmótico (Amede et al., 2003). El Ψh se redujo a medida que se incrementó la intensidad del déficit hídrico (Figura 3), con una tendencia similar a la presentada en el CRA (Figura 2), tal como lo reportado en papa por Liu et al. (2005). Los valores del CRA (>85 %) y Ψh (<-0.47 MPa) presentados tras la rehidratación (Figuras 2 y 3) evidencian una rápida recuperación de las plantas al estrés.
En papa el incremento en PE en condiciones de déficit hídrico se considera un indicador de la pérdida de la estabilidad de las membranas causada por las ROS (Szalonek et al., 2015). Aquí se observó una menor PE en las plantas con Ca(NO3)2+B-7-E y Ca(NO3)2+B-9-E, CaCl2-10-F, CaCl2-20-F y Ca(NO3)2-20-F, respecto a DH (Figura 3). Esto indica un aumento en la integridad y la funcionalidad de las membranas, lo que podría explicarse por el incremento en la concentración de prolina, como se reportó para esta cultivar en condiciones de déficit hídrico (Ariza et al., 2020), pues se sabe que el Ca participa en la regulación de la síntesis de prolina (Knight et al., 2003).
Otros mecanismos que podrían explicar la reducción de la PE con aplicación de Ca (Figura 3) se pueden relacionar con la función del Ca como señalizador en la inducción de la actividad antioxidante, lo cual reduce la peroxidación lipídica (Evans et al., 2005). Igualmente el Ca puede aumentar la función de las proteínas sinaptotagminas dependientes de Ca, que actúan en la reparación de las membranas pues facilitan su recuperación tras lesiones inducidas por estrés osmótico (Schapire et al., 2009). La mejora en la estabilidad de las membranas fue reportada con aplicación foliar de CaCl2 en Zoysia japonica (Xu et al., 2013) y Zea mays L. (Naeem et al., 2018), en condiciones de déficit hídrico.
La disminución observada en el rendimiento para las plantas con DH (Tabla 2) se atribuye a que el estrés fue severo, de acuerdo con el CRA (Figura 2) y con la etapa fenológica en la cual se presentó, pues en el inicio de tuberización la escasez de agua restringe el crecimiento y desarrollo de la planta y limita la formación de estolones, lo que modifica la distribución de compuestos de carbono y conlleva la reducción del índice de cosecha (Tourneux et al., 2003). Asimismo, la reducción del Ψh a valores inferiores de -0.6 MPa reducen la conductancia estomática y la tasa fotosintética (Basu et al., 1998), lo que causa la inhibición de la expansión foliar y del crecimiento de los tubérculos (Jefferies, 1995).
Las plantas con aplicaciones de Ca(NO3)2-7-E , Ca(NO3)2+B-6-E, CaCl2-20-F y Ca(NO3)2-20-F presentaron menor disminución en el rendimiento (Tabla 2) debido al incremento del CRA (Figura 1) y menor PE (Figura 3). Lo anterior permitió que las plantas tuvieran un mayor contenido de agua y mayor estabilidad en las membranas, lo que mantiene el turgor celular para procesos de crecimiento y elongación (Ashraf et al., 2011). Del mismo modo, el mantenimiento del CRA por encima del 75 % posiblemente evitó cambios significativos en la fotosíntesis, lo que mantuvo la producción de asimilados (Lawlor y Cornic, 2002). El aumento en la tolerancia de las plantas de papa al déficit hídrico puede relacionarse con el papel del Ca en vías de señalización al estrés (Xu et al., 2013) y en la regulación del movimiento estomático (Atif et al., 2019), así como en el mantenimiento de la integridad y en la reparación de las membranas celulares (Schapire et al., 2009; Guimarães et al., 2011) y del aparato fotosintético (Hochmal et al., 2015).
Conclusiones
La papa amarilla diploide (S. tuberosum L. grupo Phureja) cv. criolla Colombia es un cultivo sensible al déficit hídrico, plantas con déficit hídrico moderado y severo redujeron el rendimiento de tubérculo, debido a la alteración de variables fisiológicas relacionadas con el estado hídrico foliar y la estabilidad de las membranas. Los resultados sugieren que las aplicaciones de CaCl2 -20-F, Ca(NO3 )2 -20-F, Ca(NO3 )2 - 7 E, CaCl2-4.5-E, Ca(N O3)2 3 2+B-6-E y Ca(NO3)2 +B-9 E mitigaron en parte los efectos negativos del déficit hídrico, al presentar menor reducción en el rendimiento de tubérculo. Las plantas tratadas con CaCl2-20-F, CaCl2-4.5-E y Ca(NO3)2-7-E, presentaron menor pérdida de electrolitos (<21.2 %) y mayor contenido relativo de agua (>12.6), lo que les permitió obtener menor reducción en el rendimiento (>15.6 %) respecto a las plantas con DH. No obstante, debido a que este es un trabajo inicial se requiere de la evaluación de otras variables para entender los mecanismos que aliviaron los efectos del estrés por déficit hídrico en este cultivo.














