Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347On-line version ISSN 2256-2087
Rev. colomb. anestesiol. vol.52 no.2 Bogotá Apr./June 2024 Epub Mar 07, 2024
https://doi.org/10.5554/22562087.e1099
Revisión sistemática
Respuesta hemodinámica a dosis subanestésicas de ketamina en dolor posoperatorio: revisión sistemática
a Servicio de Medicina del Dolor, Hospital Universitario San Vicente Fundación, Facultad de Medicina, Universidad de Antioquia. Medellín, Colombia.
b Servicio de Anestesiología, Hospital Universitario San Vicente Fundación, Facultad de Medicina, Universidad de Antioquia. Medellín, Colombia.
Introducción:
Las infusiones en dosis bajas de ketamina han mostrado eficacia analgésica en el manejo del dolor posoperatorio. El impacto de las infusiones en dosis bajas de ketamina en la respuesta cardiovascular es dosisdependiente y requiere un mejor conocimiento de sus efectos en esta población.
Objetivo:
Realizar una revisión sistemática para describir los cambios en la presión arterial sistólica, presión arterial diastólica, presión arterial media, frecuencia cardiaca a las 24, 48 y 72 horas del posoperatorio.
Métodos:
Se revisaron ensayos controlados aleatorizados en Cochrane Library, PubMed, EM-BASE, SciELO, Lilacs y literatura gris de infusiones en dosis bajas de ketamina para las variables del estudio. La calidad de los estudios se evaluó usando la herramienta de riesgo de sesgos de Cochrane.
Resultados:
Se incluyeron seis ensayos controlados aleatorizados con 641 pacientes. Se encontró evidencia de baja calidad sugestiva de ausencia de certeza de diferencias significativas en las variables presión arterial sistólica a las 24 horas (diferencia de medias estandarizada -1,00, IC95 %: -7,27 a 5,27). Para las 24 horas se halló una media de frecuencia cardiaca mayor en el grupo de infusiones en dosis bajas de ketamina, estadísticamente significativa (diferencia de medias estandarizada 1,64 IC95 %: 0,38 a 2,90) sin alcanzar significancia clínica. Se encontró menor nivel de dolor y consumo de opioides en el grupo de infusiones en dosis bajas de ketamina.
Conclusiones:
Se encontró evidencia de baja calidad, sugestiva de que las infusiones en dosis bajas de ketamina no se asocian a cambios significativos en la presión arterial o frecuencia cardiaca a las 24-48 horas en el posoperatorio. Es importante individualizar el riesgo cardiovascular para cada caso previo al inicio del tratamiento.
Palabras clave: Ketamina; Dolor posoperatorio; Hemodinámicos; Presión arterial; Frecuencia cardiaca; Opioides; Psicomiméticos; Anestesiología
Introduction:
Low-dose ketamine infusions have shown analgesic effectiveness for the management of postoperative pain. The impact of low-dose ketamine infusions on cardiovascular response is dose-dependent and requires a better knowledge about its effects on this population.
Objective:
To conduct a systematic review to describe changes in systolic, diastolic and mean arterial pressure, and heart rate 24, 48 and 72 hours after surgery.
Methods:
Randomized, controlled trials were reviewed in the Cochrane Library, PubMed, EMBASE, SciELO, Lilacs and grey literature on low-dose ketamine infusions for the study variables. The quality of the studies was assessed using the Cochrane's risk of bias tool.
Results:
Six randomized, controlled trials with 641 patients were included. Low-quality evidence was found suggestive of a lack of certainty of any significant differences in the systolic blood pressure variables at 24 hours (mean standard deviation -1.00, 95 % CI: -7.27 to 5.27). A statistically significant higher mean heart rate at 24 hours was identified in the low-dose ketamine infusion group, (mean standard deviation 1.64 95 % CI: 0.38 to 2.90) which did not reach clinical significance. A lower pain level and less use of opioids was identified in the low-dose ketamine infusion group.
Conclusions:
Low quality evidence was found, suggesting that low-dose ketamine infusions are not associated with significant changes in blood pressure or heart rate 24 - 48 hours after surgery. It is important to individualize cardiovascular risk for each case, before initiating treatment.
Keywords: Ketamine; Postoperative pain; Hemodynamics; Blood pressure; Heart rate; Opioids; Psychomimetic; Anesthesiology
¿Qué sabemos acerca de este problema?
No se encontraron revisiones sistemáticas ni metaanálisis que evalúen los cambios hemodinámicos en pacientes con el uso de dosis bajas de ketamina en el posoperatorio.
No hay evidencia que sugiera que las de dosis bajas de ketamina se asocian significativamente con alteraciones de la frecuencia cardiaca o la presión arterial en los pacientes con dolor agudo posoperatorio tratados con esta opción analgésica.
¿Qué aporta este estudio de nuevo?
Considerando que los efectos cardiovasculares de ketamina en dosis anestésicas contraindican su uso en pacientes con enfermedad cardiovascular, estos hallazgos de ketamina en dosis bajas en infusión aportan nueva información que permite considerar su uso en una mayor población de pacientes con riesgo cardiovascular, por su conocido efecto ahorrador de opioide y analgesia en casos de dolor complicado con hiperalgesia/tolerancia a opioides.
INTRODUCCIÓN
La ketamina es eficaz en la analgesia en dolor agudo posoperatorio. Su efecto antagonista en el receptor NMDA reduce la sensibilización central en el asta dorsal durante la nocicepción, como también por la vía monoaminérgica promueve la inhibición descendente del dolor 1,2. El uso de infusiones en dosis bajas de ketamina (LDKI, por la iniciales en inglés de low-dose ketamine infusion) se ha incrementado en modelos de dolor posoperatorio asociados con dolor severo 3,4.
La ketamina se asocia con efectos adversos dosisdependiente, como los psico-miméticos, que en los diferentes estudios publicados no parecen afectar la recuperación 4,5. Los efectos cardiovasculares son menos frecuentes, pero en pacientes de alto riesgo pueden ser una contraindicación.
Hay poca información de los efectos cardiovasculares, la mayoría reportados para dosis anestésicas de ketamina durante el perioperatorio. Los efectos cardiovasculares de las LDKI se describen en la literatura en su mayoría en pacientes sanos, con escasa información del impacto en pacientes de alto riesgo o con enfermedad cardiovascular. La toxicidad cardiopulmonar es rara, asociada a altas dosis de ketamina, con efectos limitados en la activación simpática transitoria 6-8.
Un reciente consenso muestra que la analgesia se relaciona con concentraciones plasmáticas de 100-200 ng/mL 1. También se plantean las diferencias farmacocinéticas y farmacodinámicas individuales para LDKI. Esto se debe principalmente al modelo bicompartimental de la ketamina, que explica la pobre respuesta a dosis únicas en el perioperatorio 9.
En el tratamiento del dolor agudo posoperatorio es poco conocido el impacto de infusiones de LDKI en estudios primarios para los cambios hemodinámicos asociados a dicha intervención. Esto es importante en la toma de decisiones en pacientes con enfermedades cardiovasculares frecuentes.
El objetivo de este estudio fue realizar una revisión sistemática de ensayos clínicos que comparen LDKI con el placebo en escenarios posoperatorios, con énfasis en los efectos cardiovasculares. Se buscó determinar si el uso de ketamina en infusión continua en dosis analgésicas en el posoperatorio genera cambios hemodinámicos en presión arterial y frecuencia cardiaca en las primeras 24 horas de iniciada la infusión comparada con placebo. Adicionalmente, se comparó el uso de la ketamina en dosis analgésicas con el placebo en los siguientes desenlaces clínicos: presión arterial sistólica, media y diastólica, frecuencia cardiaca, escala visual análoga del dolor en intervalos de 24, 48 y 72 horas, así como el consumo equivalente de morfina a las 24 horas y la incidencia de síntomas psico-miméticos a las 24 horas.
MÉTODOS
Se realizó una revisión sistemática de la literatura. Se incluyeron ensayos clínicos aleatorizados sin restricción de idioma que evaluaron el tratamiento con ketamina o esketamina en el manejo del dolor posoperatorio con infusión mayor o igual a 24 h en dosis subanestésicas, publicados desde el 1 de enero del 2007 hasta el 31 de diciembre de 2022, incluyendo estudios terminados y publicados. Se excluyeron estudios con gestantes, dosis de ketamina no subanestésicas (>0,3 mg/kg) y estudios duplicados.
Fuentes de información y estrategias de búsqueda
Se realizó una búsqueda de artículos elegibles sin restricción de idioma, desde el 1 de enero de 2007 hasta 31 de diciembre de 2022 en las bases de datos de Cochrane, PubMed, EMBASE, SciELO, Lilacs, utilizando combinación de términos controlados como Medical Subject Heading (MeSH), Emtree y términos de texto libre con varios sinónimos en inglés. Se utilizaron los términos "pain, postoperative"; "postoperative pain"; "post-surgical pain"; "acute postoperative pain"; "ketamine"; "esketamine". La estrategia realizada fue de alta sensibilidad (anexo). Adicionalmente, se realizó búsqueda manual y de la literatura gris empleando las fuentes de congresos de Anestesiología y Reanimación-Dolor. También, una búsqueda de los últimos 15 años de congresos internacionales de anestesia, y se realizó análisis de los títulos de los estudios clínicos presentados en los respectivos congresos. Igualmente, se revisaron los siguientes recursos La Referencia (https//www.lareferencia.info/es), RedCol (https://redcol.minciencias.gov.co/vufind/), OpenAIRE (http://explore.openaire.eu/).
Proceso de selección de los estudios
Se utilizó el gestor bibliográfico Zotera. Se realizaron dos fases para la selección de los estudios. En la primera, los títulos y resúmenes fueron seleccionados para su elegibilidad por dos revisores independientes y se descartaron los duplicados. Se calculó el acuerdo por los dos investigadores.
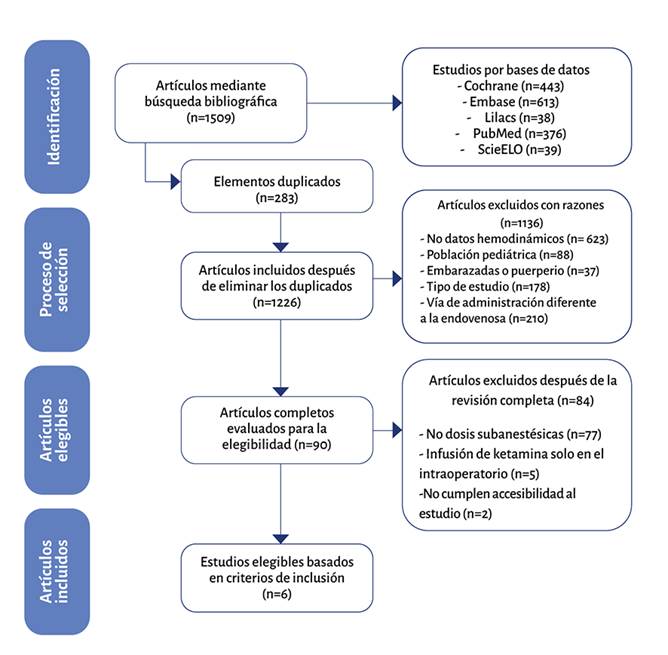
En la segunda fase se realizó una lectura completa de los estudios incluidos y se mencionaron los excluidos. Los desacuerdos que se presentaron en estos niveles de detección se resolvieron en una discusión de consenso y revisión por un tercero. Los motivos de exclusión quedaron consignados en un flujograma de estudios (Figura 1).
Proceso de extracción y lista de los datos
Se realizó por dos investigadores independientes y por duplicado mediante un formulario electrónico en Excel, para obtener los datos de todos los artículos incluidos. La información extraída se verificó posteriormente entre los revisores. Los desacuerdos que se presentaron en estos niveles de detección se resolvieron en una discusión de consenso y/o la revisión por un tercero.
Las características de los estudios evaluadas fueron: autores, año del estudio, año de publicación, revista, diseño del estudio. Características de la población de estudio: tamaño de la población del estudio, edad, sexo. Intervención: dosis, tiempo de dosificación, grupo control. Modelo quirúrgico. Presión arterial sistólica (PAS) inicial (media y desviación estándar). Cambio máximo en la PAS (media y desviación estándar). Presión arterial diastólica (PAD) inicial (media y desviación estándar), cambio máximo en la PAD (media y desviación estándar); frecuencia cardiaca inicial (FC) (media y desviación estándar), cambio máximo en FC (media y desviación estándar). Punto temporal a lo largo de la infusión cuando se observaron la PAS, la PAD y la FC máximas. Medición del dolor con la escala numérica análoga (ENA), consumo acumulado de opioides. Síntomas psicomiméticos.
Evaluación del riesgo de sesgo de los estudios individuales
Dos investigadores realizaron de forma independiente la evaluación del riesgo de sesgos de los estudios incluidos usando la herramienta de la colaboración Cochrane para la evaluación de Riesgo de sesgos (Review Manager versión 5-4-1), para ensayos clínicos aleatorios. Las discrepancias que se presentaran en el juicio del riesgo de sesgos o la justificación de estas, se resolvieron mediante diálogo hasta llegar a un consenso, con el arbitraje de un tercer autor.
Se evaluaron los dominios sesgos que surgen del proceso de aleatorización, sesgos debido a desviaciones de las intervenciones planeadas, sesgos debido a datos de desenlace omitidos, sesgos de medición del desenlace, sesgos en selección de resultados publicados.
Se realizó una tabla de riesgo de sesgos para cada uno de los estudios incluidos que formó parte del formato de recolección de datos. Además, se hizo un resumen del riesgo de sesgo para todos los estudios mediante figuras de riesgo y gráficos de semáforo, teniendo en cuenta que si el dominio cumplía los estándares, sería verde; en caso de que el estado del dominio fuera cuestionable o no se cumpliera, los colores serían amarillo y rojo, respectivamente.
Medidas del efecto
Para el análisis y síntesis de las variables desenlace de interés se emplearon diferentes medidas del efecto dependiendo del tipo de variable. Las variables cuantitativas, ya fueran continuas o discretas, se analizaron por medio de las diferencias de medias estandarizadas (DME), con sus respectivos intervalos de confianza; mientras que las variables cualitativas se analizaron mediante la diferencia de proporciones y el cálculo de RR (Razones de Riesgo), con sus respectivos intervalos de confianza.
Métodos de síntesis
Para el análisis y síntesis de la información se utilizaron diferentes modelos estadísticos dependiendo del grado de heterogeneidad encontrados en los datos de cada variable de interés por analizar. Para las variables cuantitativas con baja heterogeneidad se emplearon cálculos de diferencias de medias mediante el uso de modelos de efectos fijos; en el caso opuesto (heterogeneidad significativa) se desarrollaron modelos de efectos aleatorios. Para las variables cualitativas dicotómicas se utilizó el método de Mantel-Haenszel (MH), que implica un modelo de efectos fijos, para el cálculo de las medidas del efecto ya mencionadas para el caso.
Evaluación del sesgo en la publicación
Se realizó mediante dos formas: una gráfica a través del funnel plot, empleando el riesgo relativo de cada estudio y el error estándar de uno de ellos; y la segunda forma, con la prueba estadística de Egger (regresión lineal ponderada) en donde se consideró estadísticamente para sesgo de publicación un p menor de 0,05.
Evaluación de la calidad de la evidencia
Se evaluó la evidencia a través de cada desenlace por medio del sistema propuesto por el Grading of Recommendation Assessment, Development and Evaluation (GRADE) Working Group, y se clasificó esa evidencia así: alta, moderada, baja y muy baja. Se analizaron varios factores tradicionales del sistema GRADE: riesgo de sesgos, imprecisión, inconsistencia, ausencia de evidencia directa y sesgos de publicación. Para este proceso se utilizó la plataforma Guideline Development Tool.
RESULTADOS
Selección de estudios
Se identificaron en las bases de datos 1509 resultados, se hallaron 283 duplicados, que fueron descartados, para un total de 1226 publicaciones. Se revisaron los criterios de elegibilidad y se excluyeron 1136 por falta de datos hemodinámicos, poblaciones de embarazadas o en puerperio inmediato, pacientes pediátricos, vía de administración diferente a la endovenosa y tipo de estudio. De los 90 artículos elegibles, se excluyeron 84 por no llenar los criterios de inclusión, por ejemplo, usar dosis subanestésicas de ketamina o administrar infusiones solo en el intraoperatorio. Se incluyeron finalmente un total de seis estudios en la revisión sistemática (Figura 2). Las características de los estudios seleccionados se muestran en la Tabla 1. Los hallazgos muestran heterogeneidad clínica en el modelo quirúrgico y heterogeneidad metodológica que impiden sumar el efecto de LDKI en un metaanálisis para las variables hemodinámicas en una población de pacientes con dolor posoperatorio (POP).
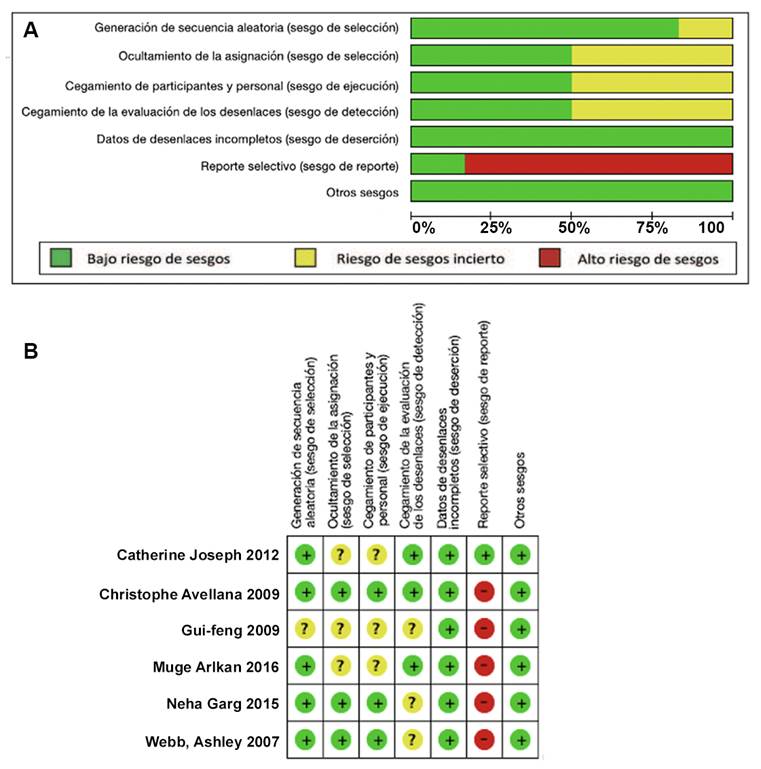
A) Sesgos a través de los estudios. B) Sesgos para cada estudio. Fuente: Autores.
Figura 2 Resumen de sesgos entre los estudios y reporte de los sesgos para cada estudio.
Tabla 1 Características de los estudios seleccionados para la revisión sistemática.
| Referencia | Tipo de estudio | Intervención | Dosis infusión posoperatoria | Tamaño de la población | Edad promedio (años) | Modelo quirúrgico | Resultado estudiado |
|---|---|---|---|---|---|---|---|
| Webb et al. 10 | ECA, controlado con solución salina | Infusión de ketamina intra- venosa | 0,1 mg/kg/h por 48 horas | 120 | 63 ± 15 | Cirugía abdo- minal mayor | PAS, FC |
| Aveline et al. 11 | ECA, controlado con solución salina y grupo nefopam | Infusión de ketamina intra- venosa | 0,06 mg/kg/h por 48 horas | 75 | 72 | Reemplazo total de rodilla | Presencia de taquicardia |
| Deng et al. 12 | ECA, controlado con solución salina | Infusión de ketamina intra- venosa | 0,01-0,1 mg/kg/h por 24 horas | 200 | 49 ± 6,1 | Reducción de fracturas de miembros inferiores | PAM, FC |
| Joseph et al. 13 | ECA, controlado con solución salina | Infusión de ketamina intra- venosa | 0,09 mg/kg/h por 48horas | 60 | 60 | Toracotomía abierta | Presencia de hipotensión |
| Garg et al. 14 | ECA, controlado con solución salina y grupo dexmedetomi- dina | Infusión de ketamina intra- venosa | 0,25 mg/kg/h por 24 horas | 66 | 36,45± 13,39 | Cirugía de columna | PAM, FC, PAS |
| Arikan et al. 15 | ECA, controlado con solución sali- na y magnesio | Infusión de ketamina intra- venosa | 0,05 mg/kg/h por 48 horas | 120 | 59,35 ± 4,96 | Histerectomía abdominal total | Presencia de hipotensión y bradicardia |
ECA: ensayo clínico aleatorizado; FC: frecuencia cardiaca; PAM: presión arterial media; PAS: presión arterial sistólica.
Fuente: Autores.
Características de los estudios
Se incluyeron seis ensayos clínicos aleatorizados (ECA) con un total de 641 pacientes. Webb et al. realizaron un ECA con 120 pacientes sometidos a laparotomía electiva administrando un bolo de 0,3 mg/kg in-traoperatorio y una infusión de ketamina a 0,1 mg/kg/h con un grupo control de solución salina normal. Todos los pacientes recibieron tramadol intraoperatorio (3 mg/kg), y una infusión de tramadol (0,2 mg/kg/h) durante 48 h después de la operación y tenían disponible analgesia controlada por el paciente con morfina para la analgesia de rescate 10.
Aveline et al. realizaron un ECA con 75 pacientes, a quienes se les realizó un reemplazo total de rodilla, comparando un grupo con ketamina bolo de 0,2 mg/kg e infusión intraoperatoria de 0,12 mg/kg/h, seguido de infusión posoperatoria de 0,06 mg/ kg/hora por 48 horas, en comparación con el grupo de infusión de nefopam de 60 ug/kg/ hora por 48 horas y un tercer grupo con solución salina con las mismas infusiones 11.
Deng et al. realizaron un ECA con 200 pacientes con fracturas de miembros inferiores que se sometieron a la cirugía, con 4 grupos de intervención, 3 con un bolo de 0,5 mg/kg seguido de infusión de 0,1 mg/kg/hora, 0,05 mg/kg/h, 0,01 mg/kg/h por 24 horas y un cuarto grupo que recibió un volumen equivalente de solución salina normal. Además, todos los grupos recibieron PCA (analgesia controlada por el paciente) de remifentanilo con una infusión basal y bolos según demanda. Para efecto de esta revisión se compararon de manera independiente los tres grupos de infusiones de ketamina, toda vez que fueron independientes y todos con dosis subanestésicas 12.
Joseph et al. realizaron un ECA con 60 pacientes sometidos a toracotomía. Todos los pacientes recibieron un catéter epidural torácico colocado antes de la cirugía y anestesia general. Además, fueron asignados a dos grupos para recibir ketamina con bolo inicial de 0,5 mg/kg, infusión intraoperatoria de 0,18 mg/kg/h, e infusión posoperatoria de ketamina a 0,09 mg/ kg/h en las 48 horas o un placebo intravenoso. El grupo placebo recibió una combinación de infusión intravenosa continua de solución salina y PCA con ropivacaína 1,5 mg/mL durante el posoperatorio de la toracotomía 13.
Garg et al. realizaron un ECA con 76 pacientes sometidos a cirugía de columna distribuidos en tres grupos: el primero, con bolo de ketamina 0,25 mg/kg, infusión de 0,25 mg/kg/h y midazolam en bolo de 10 µg/kg, seguido de infusión de 10 µg/kg/h a través de la misma bomba de infusión. El segundo grupo recibió un bolo de dexmedetomidina de 0,5 µg/kg durante 10 minutos, seguido de una infusión a 0,3 µg/kg/h. El tercer grupo recibió un bolo de infusión de solución salina en volumen equivalente 14.
Arikan et al. realizaron un ECA con 120 pacientes sometidas a histerectomía abdominal total, asignadas en tres grupos con las intervenciones de infusión de ketamina a 0,05 mg/kg/h, un segundo grupo con bolo de sulfato de magnesio 50 mg/kg seguido de una infusión de 10 mg/kg/hora y un tercer grupo con solución salina 15.
Riesgo de sesgo de los estudios individuales
En cinco de los estudios incluidos en la revisión los pacientes lograron ser asignados a los diferentes grupos de manera aleatoria; en un estudio no fue posible establecer este factor.
Todos los estudios proporcionaron datos completos de los desenlaces. El 50 % de los estudios incluidos cumplieron el criterio de ocultamiento de la asignación, cegamiento de participantes/personal y de los desenlaces y en el otro 50 % no fue posible establecer estos factores. El 83 % de los ensayos tuvo sesgo de reporte. Solo un estudio reportó el registro del protocolo.
En la Figura 2a se observa el resumen de sesgos entre los estudios y en la figura 2b se reportan los sesgos para cada estudio.
RESULTADOS DE LOS ESTUDIOS INDIVIDUALES Y SÍNTESIS
Cambios hemodinámicos PAS, PAD, PAM, FC a las 24 horas
En cuanto a la PAS a las 24 horas se encontró el estudio de Webb et al. 10 que mostró una diferencia de medias estandarizada (DME) -1,00 (IC del 95 %: -7,27 a 5,27) (Figura 3A), no se considera estadísticamente significativa y no fue posible realizar un análisis de la heterogeneidad por no tener estudios para comparar. En la búsqueda se encontró el estudio de Garg et al. 14, pero no proporcionaron datos completos, por lo cual no se realizó análisis de medias ni desviaciones estándar; sin embargo, establecen que no se evidenció alteraciones en la PAS a las 24 horas, en comparación con el grupo placebo. Ningún paciente requirió fármacos de rescate para mantener la estabilidad hemodinámica.
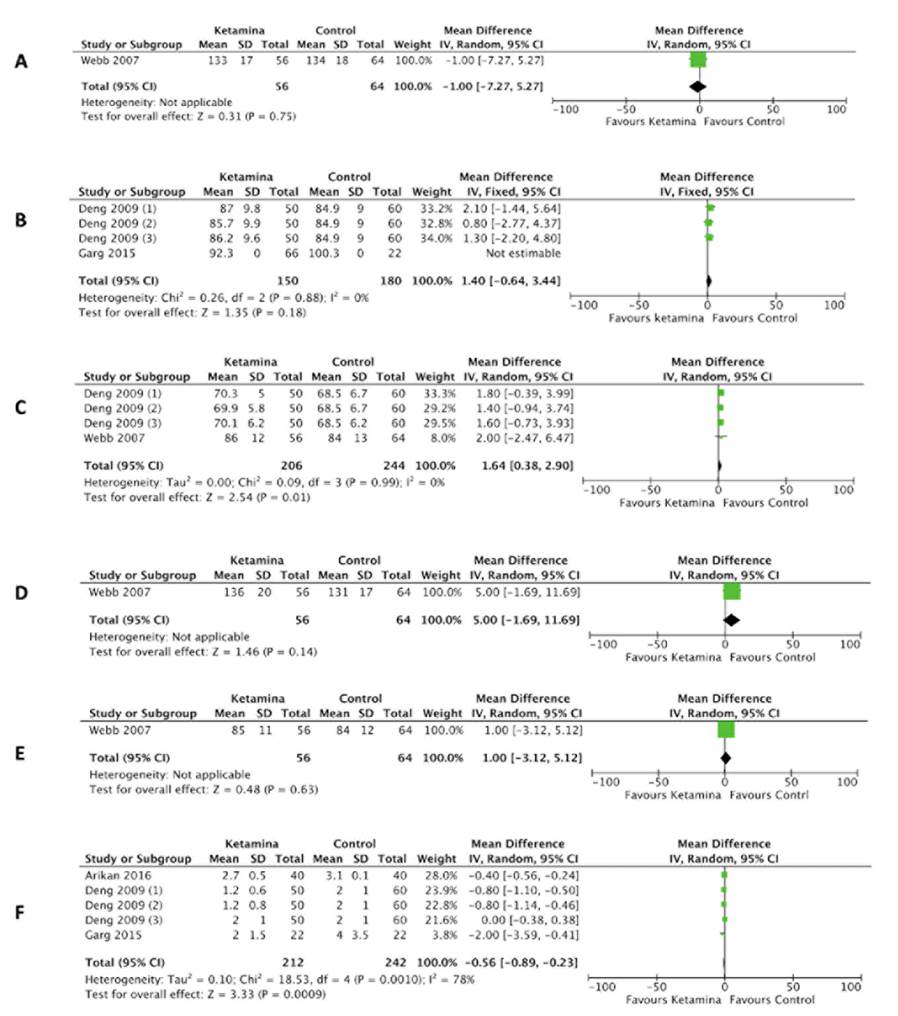
A) Presión arterial sistólica a las 24 horas. B) Presión arterial media a las 24 horas. C) Frecuencia cardiaca a las 24 horas. D) Presión arterial sistólica a las 48 horas. E) Frecuencia cardiaca a las 48 horas. F) Dolor a las 24 horas. Fuente: Autores.
Figura 3 Forest plot de variables hemodinámicas y dolor a las 24 horas.
Para el desenlace de PAM a las 24 horas, Deng et al. 12 mostraron una DM 1,40 (IC del 95 %: -0,64 a 3,44) sin diferencia estadísticamente significativa entre ketamina y grupo control (Figura 3B). Con una heterogeneidad no representativa entre los tres grupos de ketamina, evidenciado por una P para el Chi2 de 0,88 y un I2 de 0 %.
Para el desenlace FC a las 24 horas, se mostró DME 1,64 (IC del 95 %: 0,38 a 2,90), el cual es estadísticamente significativo a favor del grupo control 10,12. La heterogeneidad no fue representativa, evidenciado por una P para el Chi2 de 0,99 y un P de 0 % (Figura 3C).
PAS, PAD, PAM, FC a las 48 horas
Para el desenlace PAS a las 48 horas, Webb et al. mostraron una DME 5 (IC del 95 %: -1,69 a 11,69) (Figura 3D). No hay diferencia estadísticamente significativa y no fue posible valorar heterogeneidad por no tener estudios para comparar 10. La búsqueda y selección arrojó tres estudios que aportaron datos incompletos, por lo cual no pudieron ser incluidos en el análisis estadístico; sin embargo, individualmente se encontró que Josep et al. describieron hipotensión durante las 48 horas posteriores al inicio de la infusión, definida como PAS <80 mm Hg, en el 32 % de la población del grupo ketamina en comparación con un 8 % en el grupo placebo (p 0,063), sin considerarse estadísticamente significativo para los autores 13. Arikan et al. reportaron hipotensión en un 7,5 % en el grupo control y 2,5 % en el grupo magnesio, en las 48 horas posoperatorias, mientras que en el grupo ketamina no se presentó hipotensión. Sin embargo, no establecen los parámetros para definir esta variable 15. En el estudio de Garg et al. no se evidenciaron alteraciones en la PAS a las 48 horas, en comparación con el grupo placebo. Ningún paciente requirió fármacos de rescate para mantener la estabilidad hemodinámica 14.
Para el desenlace FC a las 48 horas, Webb et al. mostraron una DME 1 (IC del 95 %: -3,1 a 5,12) (Figura 3E). No hubo diferencia estadísticamente significativa y no fue posible valorar heterogeneidad por no tener estudios para comparar 10.
La búsqueda y selección arrojó dos estudios que aportaron datos incompletos por lo cual no pudieron ser incluidos en el análisis estadístico; sin embargo, individualmente se encontró que Arikan et al. reportaron bradicardia del 2,5 % en el grupo magnesio y 5 % en el grupo control, en las 48 horas posoperatorias, mientras que en el grupo ketamina no se presentó hipotensión ni bradicardia. Sin embargo, no definen los parámetros de esta variable 15. El estudio de Aveline et al., reportó presencia de taquicardia a las 48 horas (FC mayor a 100 latidos por minuto por 5 minutos continuos) en un 4 % en el grupo ketamina, en 12,5 % en el grupo de nefopam y en 8,3 % en el grupo placebo, hallazgos que no fueron estadísticamente significativos según sus autores 11.
Ningún estudio aportó datos de PAD a las 24, 48 horas y tampoco se encontraron datos de PAS, PAD, PAM y FC a las 72 horas.
Dolor a las 24 horas del posoperatorio
Para el desenlace dolor a las 24 horas, la combinación de los resultados de tres estudios mostró una DME -0,56 (IC del 95 %: -0,89 a -0,23), con significancia estadística, con un P para el Chi2 de 0,0010 y un P 78 %, mostrando una heterogeneidad representativa, la cual se podría explicar por la heterogeneidad clínica dada por diferencia en el modelo quirúrgico, uso de fármacos adyuvantes, técnica anestésica, diferente dosis analgésica y heterogeneidad metodológica asociada a diferencia en el tamaño de la población, tiempos de valoración del dolor, ocultamiento del cegamiento (Figura 3F) 12,14,15. La búsqueda y selección mostró tres estudios que aportaron datos incompletos, por lo cual no pudieron ser incluidos en el análisis estadístico. Webb et al. y Aveline et al. evaluaron dolor en reposo y en movimiento, para el presente análisis se tomaron los valores en reposo. Aveline et al. mostró que las puntuaciones de EVA en reposo fueron significativamente más bajas en los pacientes que recibieron ketamina en comparación con los que recibieron nefopam a las 24 horas (p < 0,0001). El estudio de Webb et al. reportó que puntuaciones de dolor (EVA) fueron más bajas en reposo (P = 0,01) y con movimiento (P = 0,02) durante las 24 horas y en el estudio de Joseph et al., el consumo epidural acumulado de ropivacaína fue similar entre los grupos a las 24 horas tras la cirugía. Las puntuaciones de EVA fueron idénticas en reposo y al toser a las 24 horas, sin diferencia significativa 10,11,13.
Dolor a las 48 horas del posoperatorio
Para el desenlace dolor a las 48 horas, la combinación de los resultados de dos estudios mostró una DME -0,38 (IC del 95 %: -0,73 a -0,02) con significancia estadística, con una P para el Chi2 de 0,23 y un P 32 % con una heterogeneidad no representativa (Figura 4A) 14,15.
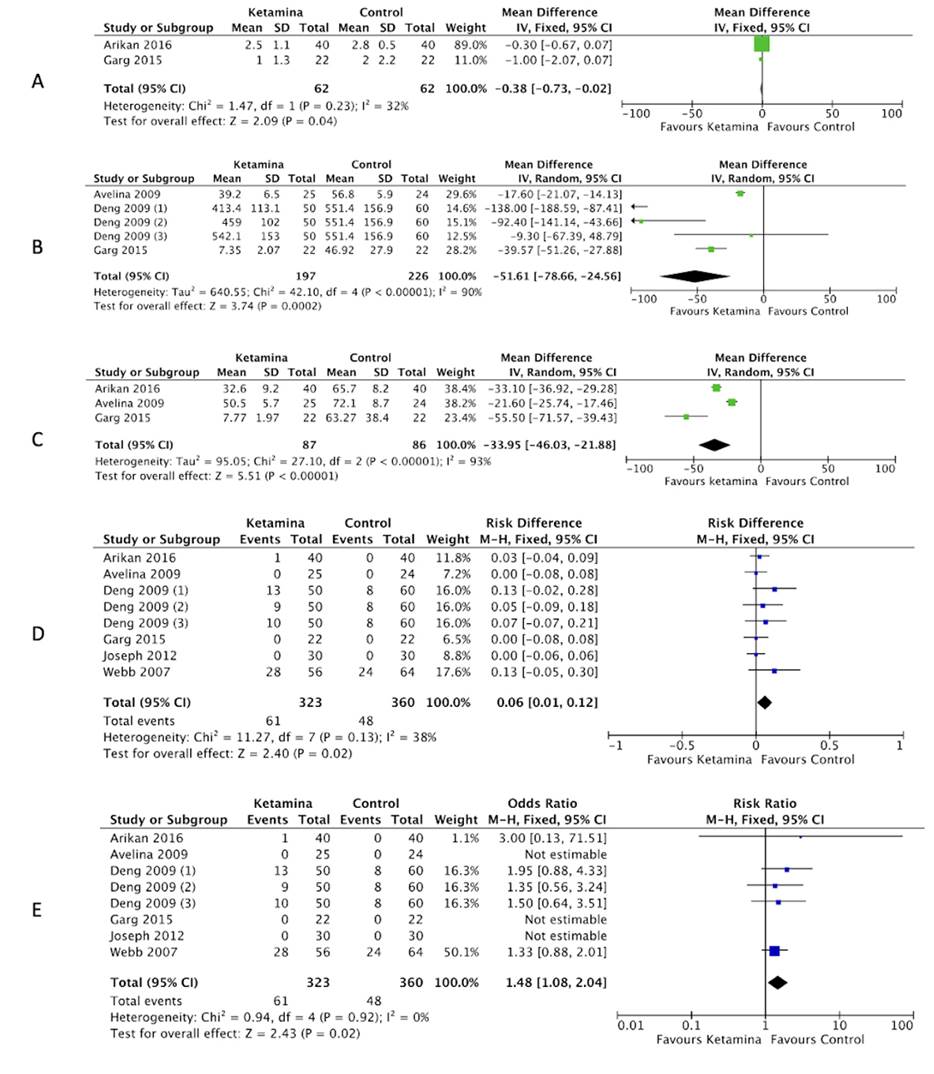
A) Dolor a las 48 horas. B) Consumo de morfina a las 24 horas. C) Consumo de morfina a las 48 horas. D) Síntomas psicomiméticos (diferencia de proporciones). E) Síntomas psicomiméticos. RR: Riesgo relativo. Fuente: Autores.
Figura 4 Forest plot de dolor, consumo de opioides y síntomas psicomiméticos.
La búsqueda y selección arrojó tres estudios que aportaron datos incompletos, por lo cual no pudieron ser incluidos en el análisis estadístico. Sin embargo, el estudio de Aveline et al. mostró que las puntuaciones de EVA en reposo fueron significativamente más bajas en los pacientes que recibieron ketamina en comparación con los que recibieron nefopam a las 48 horas (P < 0,0001). 11 El estudio de Webb et al. determinó que las puntuaciones de EVA fueron más bajas en reposo (P = 0,01) y con movimiento (P = 0,02) durante las 48 horas 10 y el estudio de Joseph et al. mostró que el consumo epidural acumulado de ropivacaí-na fue similar entre los grupos a las 48 horas tras la cirugía. Las puntuaciones de EVA fueron idénticas en reposo y al toser a las 48 h, sin diferencia significativa 13. Para el desenlace dolor a las 72 horas, los estudios no aportaron datos.
Consumo de opioides a las 24, 48 y 72 horas
Para el desenlace consumo de morfina a las 24 horas, la combinación de los resultados de tres estudios mostró una DME -51,61 (IC del 95 %: -78,66 a -24,56), por lo que se considera que el consumo de morfina disminuyó en los grupos de ketamina en comparación con el grupo control con una diferencia estadísticamente significativa, con una heterogeneidad representativa dada por una P para el Chi2 0,00001 y un I2 90 % (Figura 4B) 11,12,14. La búsqueda y selección arrojó el estudio de Webb et al. el cual se analizó individualmente por datos incompletos, pero reportó que el uso de PCA-morfina fue un 46 % mayor en el grupo de control (33,5 mg) que en el grupo de ketamina (23 mg) durante el periodo de 0 a 24 horas (P = 0,003) 10.
Las intervenciones analgésicas, definidas como la necesidad de aumentar el bolo de PCA-morfina o agregar una infusión de morfina basal, fueron más frecuentes en los pacientes control (21 intervenciones) que en los pacientes con ketamina (4 intervenciones) en el período de 0 a 24 horas (P = 0,01). Para el desenlace consumo de morfina a las 48 horas se mostró una DME -33,95 (IC del 95 %: -46,03 a -21,88) evidenciando una disminución del requerimiento de morfina en todos los grupos a los que se administró ketamina, en comparación con el grupo control, con significancia estadística. Con una heterogeneidad representativa dada por una P para el Chi2 0,00001 y un I2 93 % (figura 4C). 11,14,15 La búsqueda y selección arrojó el estudio de Webb et al., el cual se analizó individualmente por datos incompletos, reportando que el uso de PCA-morfina fue un 150 % mayor en el grupo de control (30 mg) que el grupo keta-mina (12 mg) en el periodo de 24-48 horas (P = 0,001). Las intervenciones analgésicas, definidas como la necesidad de aumentar el bolo de PCA-morfina o agregar una infusión de morfina basal en el período de 2448 horas tuvo 9 intervenciones en pacientes control y 3 en pacientes con ketamina (P = 0,13) 10). Para el desenlace de consumo de opioide a las 72 horas ningún estudio aportó datos. El estudio de Joseph et al. no proporcionó datos específicos del consumo de opioide, por lo cual no fue posible incluirlo en este análisis 13.
Incidencia de síntomas psicomiméticos
Para el desenlace síntomas psicomiméticos se realizó una combinación de los seis estudios incluidos en esta revisión mostrando una diferencia de proporciones de 0,06 (IC del 95 %: 0,01 a 0,12) y un RR de 1,48 (IC del 95 %: 1,08, 2,04 determinando el uso de ketamina como un factor de riesgo para la presentación de dichos síntomas, con una P para el Chi2 0,92 y un I2 0 %, mostrando una heterogeneidad no representativa (figuras 4D y 4E) 10-15.
Sesgos en la publicación
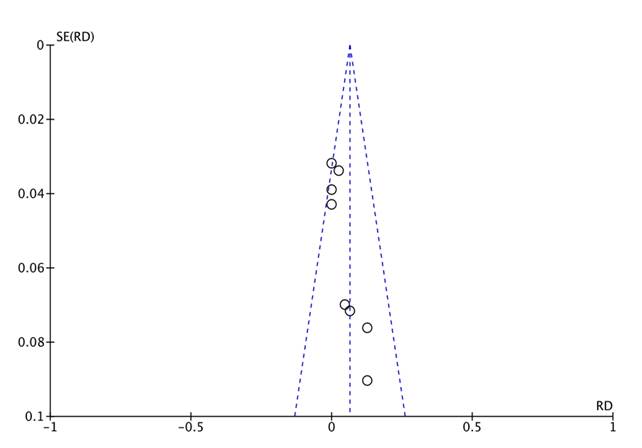
En la gráfica de funnel plot se observa simetría en la distribución de los estudios, conservando la forma de embudo, evidenciándose en la parte superior los estudios con mayor muestra, por lo cual se considera un bajo riesgo de sesgo de publicación (figura 5). Por la mínima cantidad de estudios encontrados, no fue posible realizar prueba de Egger.
Para cada desenlace se la calidad de información que se muestra en la tabla 2, con el resumen de la certeza de la evidencia de acuerdo con el sistema GRADE.
Tabla 2 Calidad de la evidencia a través de GRADE para cada desenlace.
| Evaluación de certeza | Impacto | Certeza | Importancia | ||||||
|---|---|---|---|---|---|---|---|---|---|
| N.° de estudios | Diseño de estudio | Riesgo de sesgo | Inconsistencia | Evidencia indirecta | Imprecisión | Otras consideraciones | |||
| Cambios hemodinámicos (evaluado con: frecuencia cardiaca, presión arterial sistólica, presión arterial diastólica, presión arterial media) | |||||||||
| 6 | Ensayos aleatorios | Serio a | Serio b | Muy serio c | Muy serio d | Ninguno | Dada la alta heterogeneidad clínica y estadística existente entre todos los estudios es imposible realizar un efecto resumen común para definir los cambios hemodinámicos producidos por la infusión de ketamina en dosis analgési- cas comparada con placebo. | ⨁◯◯◯ Muy baja | Crítico |
| Dolor a las 24, 48 y 72 horas (seguimiento: rango 24 horas a 72 horas; evaluado con escala numérica análoga) | |||||||||
| 6 | Ensayos aleatorios | Serio e | No es serio | No es serio | Serio f | Ninguno | Dada la alta heterogeneidad clínica y estadística existente entre todos los estudios, no se puede generalizar el efecto sobre el dolor posoperatorio de la infusión de ketamina en dosis analgésicas comparada con placebo. | ⨁⨁◯◯ Baja | Importane |
| Consumo de opioides 24, 48 y 72 horas del posoperatorio (seguimiento: rango 24 horas a 72 horas; evaluado con equivalentes de morfina día) | |||||||||
| 5 | Ensayos aleatorios | Serio g | No es serio | Muy serio h | Muy serio i | Ninguno | Dada la alta heterogeneidad clínica y estadística exis- tente entre todos los estudios, no se puede generalizar el efecto sobre el consumo de opioides en pacientes con infusión de ketamina en dosis analgésicas comparada con placebo. | ⨁◯◯◯ Muy baja | Importante |
| Incidencia de síntomas psicomiméticos (seguimiento: rango 24 horas a 72 horas; evaluado con presentación de pesadillas, terrores, delirio, alucinaciones o agitación) | |||||||||
| 6 | Ensayos aleatorios | Serio j | Muy serio k | Muy serio l | No es serio | Ninguno | Dado que la heterogeneidad no fue representativa para este desenlace se considera que la infusión de ketamina en dosis analgésicas comparada con el placebo se asocia con mayor incidencia de síntomas psicomiméticos. | ⨁◯◯◯ Muy baja | Importante |
a. Algunos estudios revisados no proporcionaron datos de cambios hemodinámicos, además no aportan información clara de la forma de aleatorización, cegamiento y no establecen el número de registro del protocolo.
b. Por ausencia de información de las variables objetivo de estudio
c. Estos resultados fueron hallazgos secundarios en todos los estudios y no fue posible recolectar todos los datos planteados.
d. Por ausencia de información de las variables objetivo de estudio.
e. Algunos estudios revisados no proporcionan datos de escalas de dolor a las 72 horas de la intervención. Algunos estudios no proporcionan información clara de la forma de aleatorización, cegamien-to y no proporcionan número de registro del protocolo.
f. No se encontraron datos de escalas de dolor a las 72 horas, lo cual era un objetivo de estudio
g. Algunos estudios revisados no proporcionaron datos de consumo de opioides a las 72 horas, además no aportan información clara de la forma de aleatorización, cegamiento y no establecen el número de registro del protocolo.
h. Estos resultados fueron hallazgos secundarios en todos los estudios y no fue posible recolectar todos los datos planteados.
i. Por ausencia de datos del consumo de opioide a las 72 horas de la intervención.
j. Algunos estudios no aportan información clara de la forma de aleatorización, cegamiento y no establecen el número de registro del protocolo. k. Por diferencia en los resultados de la incidencia de síntomas psicomiméticos en los diferentes estudios. l. Estos resultados fueron hallazgos secundarios en todos los estudios.
Fuente: Autores.
DISCUSIÓN
El objetivo de este estudio fue realizar una revisión sistemática de los efectos hemodinámicos de la infusión de ketamina en dosis subanestésicas (< 0,3 mg/kg/h intavernosa) como analgésico coadyuvante en dolor POP.
Se encontró baja calidad de la evidencia, sugestiva de no asociación de LDKI con alteraciones hemodinámicas en comparación con el grupo control. No se observaron diferencias significativas para las variables de presión arterial o frecuencia cardiaca entre los grupos LDKI y control. Como hallazgo para destacar, solo dos ensayos mostraron en el grupo control una media de FC menor al compararla con el grupo LDKI a las 24 horas (DME 1,64, IC del 95 %: 0,38 a 2,90), sin catalogarse como taquicardia (> 90 latidos por minuto), lo cual se considera sin relevancia clínica 10,12.
En los resultados descriptivos de los estudios evaluados no se informaron cambios en la hemodinamia que requirieran tratamiento, sugiriendo una relativa seguridad cardiovascular con el uso de LDKI, en los modelos quirúrgicos estudiados 14.
Los resultados de esta revisión contrastan con el efecto de taquicardia e hipertensión de dosis en bolo o mayores a 0,5 mg/kg reportadas en la literatura 7. El concepto de LDKI se introdujo en la práctica clínica hace más de dos décadas. Schmid et al. describen el efecto analgésico de LDKI en una revisión que incluyó modelos quirúrgicos relacionados con dolor severo 16. La vida media corta de ketamina y la falta de efecto preventivo del dolor de las dosis únicas en el perioperatorio han generado un uso creciente de LDKI en analgesia POP. Jouguelet et al. reportan el efecto analgésico de LDKI hasta las 48 horas en al menos ochoensayos 2. Desenlaces como reducción de EVA y consumo de opioides fueron descritos por el autor en favor de LDKI.
Por otro lado, se encontró una reducción de la EVA con LDKI a las 24 y 48 horas del POP. Lo anterior está en concordancia con su efecto analgésico descrito ampliamente en la literatura 3,5,17. Similarmente se encontró reducción en el consumo de opioides, lo cual se podría explicar por la estrategia multimodal en el control del dolor, hallazgos ya informados en estudios previos 4,18-20. Si bien las LDKI tienen un claro valor en el consumo de opioides y prevención de tolerancia/hiperalgesia inducida por opioides, existe muy poca información de sus potenciales efectos cardiovasculares en dosis inferiores al bolo o las usadas en el perioperatorio. En cuanto a los síntomas psicomiméticos, se encontró que la ketamina en dosis analgésicas en comparación con el placebo presenta mayor riesgo en su incidencia, efecto ya reportado la literatura 4; esto no constituye una contraindicación para su uso y se debe valorar en forma individualizada.
Actualmente, las contraindicaciones para ketamina incluyen enfermedad cardiovascular no controlada y disfunción hepática 1; sin embargo, los criterios para seleccionar LDKI en pacientes con afecciones cardiovasculares, como la hipertensión no controlada o la enfermedad coronaria, no están bien definidos en la literatura. En general, la recomendación es evitar fenómenos como taquicardia o hipertensión para el caso del infarto reciente 21.
Los resultados del presente estudio aportan información importante para la toma de decisiones con el uso de LDKI. Los cambios en el segmento ST en descripciones previas se observaron en dosis única de ketamina, por encima de 0,5 mg/kg 22. Los autores consideran que se requieren ensayos que incluyan datos hemodinámicos basales y en diferentes tiempos con el uso de LDKI para evaluar el comportamiento de dichas variables en el ámbito perioperatorio.
CONCLUSIÓN
Esta revisión sistemática sugiere que la analgesia con LDKI no modifica significativamente el comportamiento hemodinámico de los pacientes tratados por dolor agudo POP, lo cual permite considerar esta opción analgésica en pacientes con riesgo cardiovascular El uso creciente de LDKI como estrategia en la analgesia multimodal amerita realizar ensayos clínicos que evalúen el comportamiento hemodinámico de LDKI de manera más precisa.
Registro y protocolo
Se inscribió el protocolo en el registro Prospero (NIHR), con el nombre Hemodynamic response to subanesthesic doses of keta-mine in patients with postoperative pain. Systematic review and meta-analysis, con el número de registro 411659.
Responsabilidades éticas
El diseño de este estudio fue una investigación secundaria, donde la unidad de análisis no son pacientes. De acuerdo con la Resolución 8430 de 1993 por la cual se establecen los lineamientos científicos y técnicos de la investigación en humanos, esta es una investigación sin riesgo, por tanto no se requiere ningún tipo de consentimiento informado, ni aprobación por comité de ética de la investigación institucional.
REFERENCIAS
1. Schwenk ES, Viscusi ER, Buvanendran A, Hurley R, Wasan A, Narouze S, et al. Consensus guidelines on the use of intravenous ketamine infusions for acute pain management from the American Society of Regional Anesthesia and Pain Medicine, the American Academy of Pain Medicine, and the American Society of Anesthesiologists. Reg Anesth Pain Med. 2018;43(5):456-66. doi: https://doi.org/10.1097/AAP.0000000000000806 [ Links ]
2. Jouguelet-Lacoste J, La Colla L, Schilling D, Chelly JE. The use of intravenous infusion or single dose of low-dose ketamine for postoperative analgesia: a review of the current literature. Pain Med. 2015;16(2):383-403. doi: https://doi.org/10.1111/pme.12619 [ Links ]
3. Zhou L, Yang H, Hai Y, Cheng Y. Perioperative low-dose ketamine for postoperative pain management in spine surgery: A systematic review and meta-analysis of randomized controlled trials. Pain Res Manag. 2022;2022:1507097. doi: https://doi.org/10.1155/2022/1507097 [ Links ]
4. Brinck EC, Tiippana E, Heesen M, Bell RF, Straube S, Moore RA, Kontinen V. Perioperative intravenous ketamine for acute postoperative pain in adults. Cochrane Database Syst Rev. 2018;12(12):CD012033. doi: http://doi.org/10.1002/14651858.CD012033.pub4 [ Links ]
5. Gorlin AW, Rosenfeld DM, Ramakrishna H. Intravenous sub-anesthetic ketamine for perioperative analgesia. J Anaesthesiol Clin Pharmacol. 2016;32(2):160-7. doi: https://doi.org/10.4103/0970-9185.182085 [ Links ]
6. Domino EF. Taming the ketamine tiger. 1965. Anesthesiology. 2010;113(3):678-684. doi: https://doi.org/10.1097/ALN.0b013e3181ed09a2 [ Links ]
7. Strayer RJ, Nelson LS. Adverse events associated with ketamine for procedural sedation in adults. Am J Emerg Med. 2008;(26):985-1028. doi: https://doi.org/10.1016/j.ajem.2007.12.005 [ Links ]
8. Vankawala J, Napoles G, Ávila-Quintero VJ, Ramirez K, Flores J, Bloch M, Dwyer J. Meta-Analysis: hemodynamic responses to sub-anesthetic doses of ketamine in patients with psychiatric disorders. Front Psychiatry. 2021;12:549080. doi: https://doi.org/10.3389/fpsyt.2021.549080 [ Links ]
9. Kamp J, Jonkman K, Van Velzen M, Aarts L, Niesters M, Dahan A, Olofsen E. Pharmacokinetics of ketamine and its major metabolites norketamine, hydroxynorketamine, and dehydronorketamine: a model-based analysis. Br J Anaesth. 2020;125(5):750-61. doi: https://doi.org/10.1016/j.bja.2020.06.067 [ Links ]
10. Webb AR, Skinner BS, Leong S,Kolawolw H, Crofts T, Taverner M, Burn S. The addition of a small-dose ketamine infusion to tramadol for postoperative analgesia: a double-blinded, placebo- controlled, randomized trial after abdominal surgery. Anesth Analg. 2007;104(4):912-17. doi: https://doi.org/10.1213/01.ane.0000256961.01813.da [ Links ]
11. Aveline C, Gautier JF, Vautier P, Cognet F, Hetet HL, Attali JY, Leconte V, Leborgne P, Bonnet F. Postoperative analgesia and early rehabilitation after total knee replacement: a comparison of continuous low-dose intravenous ketamine versus nefopam. Eur J Pain. 2009;13(6):613-9. doi: https://doi.org/10.1016/j.ejpain.2008.08.003 [ Links ]
12. Deng GF, Zheng JP, Wang S, Tian B, Zhang SG. Remifentanil combined with low-dose ketamine for postoperative analgesia of lower limb fracture: a double-blind, controlled study. Chin J Traumatol. 2009;12(4):223-27. doi: https://doi.org/10.3760/cma.j.issn.1008-1275.2009.04.007 [ Links ]
13. Joseph C, Gaillat F, Duponq R, Lieven R, Baumstarck K, Thomas P, Penot-Ragon C, Kerbaul F. Is there any benefit to adding intravenous ketamine to patient-controlled epidural analgesia after thoracic surgery? A randomized double-blind study. Eur J Cardiothorac Surg. 2012;42(4):e58-e65. doi: https://doi.org/10.1093/ejcts/ezs398 [ Links ]
14. Garg N, Panda NB, Gandhi KA, Bhagat H, Batra YK, Grover VK, Chhabra R. Comparison of small dose ketamine and dexmedetomidine infusion for postoperative analgesia in spine surgery--a prospective randomized double-blind placebo controlled study. J Neurosurg Anesthesiol. 2016;28(1):27-31. doi: http://doi.org/10.1097/ANA.0000000000000193 [ Links ]
15. Arıkan M, Aslan B, Arıkan O, Horasanlı E, But A. Comparison of the effects of magnesium and ketamine on postoperative pain and morphine consumption. A double-blind randomized controlled clinical study. Acta Cir Bras. 2016;31(1):67-73. doi: https://doi.org/10.1590/S0102-865020160010000010 [ Links ]
16. Schmid RL, Sandler AN, Katz J. Use and efficacy of low-dose ketamine in the management of acute postoperative pain: a review of current techniques and outcomes. Pain. 1999;82(2):111-25. doi: https://doi.org/10.1016/S0304-3959(99)00044 [ Links ]
17. Kaur S, Saroa R, Aggarwal S. Effect of intraoperative infusion of low-dose ketamine on management of postoperative analgesia. J Nat Sci Biol Med. 2015;6(2):378-82. doi: https://doi.org/10.4103/0976-9668.160012 [ Links ]
18. Wang X, Lin C, Lan L, Liu J. Perioperative intravenous S-ketamine for acute postoperative pain in adults: A systematic review and meta-analysis. J Clin Anesth. 2021;68:110071. doi: https://doi.org/10.1016/j.jclinane.2020.110071 [ Links ]
19. Zakine J, Samarcq D, Lorne E, Moubarak M, Montravers P, Beloucif S, Dupont H. Postoperative ketamine administration decreases morphine consumption in major abdominal surgery: a prospective, randomized, double-blind, controlled study. Anesth Analg . 2008;106(6):1856-61. doi: https://doi.org/10.1213/ane.0b013e3181732776 [ Links ]
20. Gupta A, Mo K, Movsik J, Al Farii H. Statistical fragility of ketamine infusion during scoliosis surgery to reduce opioid tolerance and postoperative pain. World Neurosurg. 2022;164:135-42. doi: https://doi.org/10.1016/j.wneu.2022.04.121 [ Links ]
21. Picariello C, Lazzeri C, Attanà P, Chiostri M, Gensini GF, Valente S. The impact of hypertension on patients with acute coronary syndromes. Int J Hypertens. 2011;2011:563657. doi: https://doi.org/10.4061/2011/563657 [ Links ]
22. Goddard K, Simpson C, Bedy SM, Ghadban R, Stilley J . Effect of ketamine on cardiovascular function during procedural sedation of adults. Cureus. 2021;13(3):e14228. doi: https://doi.org/10.7759/cureus.14228 [ Links ]
Disponibilidad de datos, códigos y otros materiales Se dispone de un documento de anexos con las estrategias de búsquedas bibliográficas de cada base de datos.
Recibido: 30 de Junio de 2023; Aprobado: 10 de Enero de 2024; : 12 de Febrero de 2024











 text in
text in