Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.53 no.3 Bogotá July/Sept. 2002
* Profesor titular, Departamento de Obstetricia y Ginecología, Universidad del Valle. Jefe del Servicio de Ginecología y Obstetricia del Hospital universitario del Valle. Director General del Centro de Biomedicina Reproductiva, FECUNDAR. Director del Programa de entrenamiento de Cirugía Endoscópica Ginecológica, Clínica Los Andes, Cali, Colombia. Presidente de la Sociedad Colombiana de Cirugía Endoscópica; Secretario para Colombia de la Sociedad Iberoamericana de Endoscopia Ginecológica e Imagenología.
RESUMEN
El síndrome de hiperestimulación ovárica es una complicación iatrogénica de la inducción de la ovulación con gonadotropinas y puede resultar en una grave amenaza para la vida por sus complicaciones; como son: accidente cerebro-vascular debido a trombosis venosa, disfunción hepática, falla renal aguda, complicaciones respiratorias y torsión anexial. El mayor factor predisponente de la forma severa del SHO es el ovario poliquístico.
El síndrome se caracteriza por una salida del fluido del espacio intravascular, con acumulación de líquido en espacio peritoneal y pleural, produciéndose hipotensión y una disminución del flujo sanguíneo renal y, por consiguiente, una disminución del volumen urinario. El aumento de la permeabilidad capilar es la hipótesis más aceptada para el inicio de la fisiopatología del evento. El factor de crecimiento endotelial y la presencia de otras citoquinas es crucial en la patogénesis del SHO.
La clasificación del síndrome nos permite realizar esquemas de tratamiento lógicos, así tenemos que el SHO leve únicamente amerita reposo e hidratación oral. El SHO moderado se trata conservadoramente con observación ambulatoria, analgésicos, antieméticos, monitorización ecográfica, evaluación de la función renal, hepática, hematocrito y coagulación. El SHO severo, sin cambios anormales del perfil bioquímico, es tratado con aspiración del líquido ascítico, suministro de líquidos endovenosos sobre la base de los cuidados diarios del tratamiento. En caso de SHO con disbalance hidroelectrolítico u otras complicaciones, la paciente debe ser hospitalizada para un manejo apropiado. El manejo quirúrgico se reserva para casos de torsión o ruptura de quiste, o tratamiento de embarazo ectópico.
Palabras clave: gonadotropinas, hiperestimulación ovárica, clasificación, tratamiento.
SUMMARY
Ovarian hyperstimulation syndrome (OHSS) is an iatrogenic complication of ovulation induction by gonadotropins. The syndrome can result in serious life threatening complications, which include cerebrovascular accidents due to venous thrombosis, liver dysfunction, acute renal failure, respiratory complications and adnexal torsion. It is known that the most important predisposing factor for the development of severe forms of OHSS is polycystic ovarian disease.
The syndrome is characterized by leakage of fluid from the intravascular compartment, with accumulation of fluid in the peritoneal and pleural cavities, resulting in hypotension and a decrease in renal blood flow and volume of urine. Increase capillary permeability is the most accepted hypothesis for the initial pathophysiological event.
Vascular endothelial growth factor and other cytokines are pivotal in the pathogenesis of OHSS.
The classification of the syndrome, let us make logic treatment schemes, therefore, the mild OHSS requires only rest and oral hydration. The moderate OHSS is treated with ambulatory observation, bed rest, analgesics, sonographic surveillance, evaluation of the renal and hepatic function, and vigilance of the hematocrit and coagulation factors. Severe OHSS, without an abnormal biochemical profile, is treated by ascitic fluid aspiration and intravenous fluid therapy on the basis of day care treatment. Cases of severe OHSS with electrolyte imbalance or other complications must be admitted to the hospital for appropriate treatment. Surgical treatment is reserved for torsion or rupture of adnexal cystic or treatment of ectopic pregnancy.
Key words: Gonadotropins, ovarian hyperstimulation, classification, treatment.
INTRODUCCIÓN
Casi todas las complicaciones del tratamiento con gonadotropinas se deben a estimulación ovárica, desarrollo folicular múltiple y luteinización (ovulación de numerosos folículos).
Las principales complicaciones son: a) alta incidencia de embarazo múltiple, el cual puede terminar en serias complicaciones gestacionales y perinatales como prematurez y una alta incidencia de operación cesárea; b) síndrome de hiperestimulación ovárica (SHO).
El síndrome de hiperestimulación ovárica es una respuesta suprafisiológica del ovario, desencadenada casi siempre por la administración exógena de hormona gonadotropina coriónica (hCG) después de la estimulación de la ovulación.
La hCG provoca una luteinización folicular masiva, con liberación de mediadores intraováricos que inducen a un aumento de la permeabilidad capilar asociada a un aumento en la angiogénesis.
El aumento de la permeabilidad capilar produce una extravasación de líquido al tercer espacio, con la consiguiente hemoconcentración y ascitis, produciéndose, además, una depleción de albúmina al espacio extravascular, con aumento de la presión oncótica y salida de líquido al tercer espacio.
Con la expansión de los centros de reproducción asistida en Colombia y el uso inadecuado de las gonadotropinas por ginecólogos no expertos en este campo, se ha incrementado el SHO, el cual es un desorden iatrogénico; la incidencia de dicho desorden se puede disminuir en forma significativa planificando una estimulación ovárica flexible, controlada en forma meticulosa, y el resultado final se puede mejorar dramáticamente con una terapia apropiada.
CLASIFICACIÓN DEL SÍNDROME DE HIPERESTIMULACIÓN OVÁRICA
En 1967 se estableció por primera vez una clasificación del SHO(1) en seis grados, basada esta en la severidad de los síntomas y hallazgos del laboratorio. Posteriormente fue modificada y se clasificó en tres grados (Tabla 1).
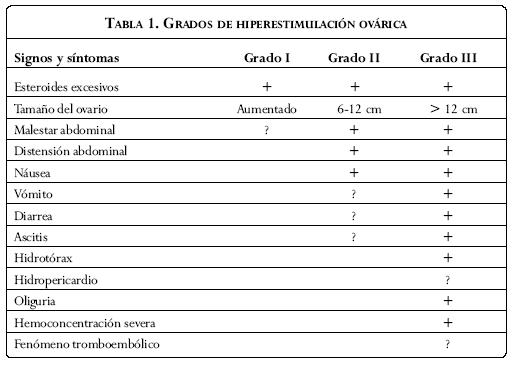
Grado I (hiperestimulación leve) esta se caracteriza por aumento de tamaño de los ovarios con presencia de múltiples quistes foliculares y cuerpos lúteos que miden hasta 5x5 centímetros. Los hallazgos séricos de laboratorio incluyen un estradiol mayor de 1.500 pg/ml, y niveles de progesterona mayores de 30 ng/ml en la fase inicial de la fase lútea.
Grado II (hiperestimulación moderada). Se caracteriza por aumento de tamaño de los ovarios hasta 12x12 centímetros, acompañado de malestar abdominal y síntomas gastrointestinales tales como náuseas, vómito, diarrea. Un aumento súbito de peso por encima de 3 kg, y presencia de ascitis por ecografía.
Grado III (hiperestimulación severa). Se caracteriza por evidencia clínica de ascitis y/o hidrotórax, hematocrito mayor de 30% o 45%, leucocitosis mayor de 15.000, oliguria, aumento de la creatinina (1,0-1,5 mg/ml), disminución de la aclaración de creatinina hasta 50 ml/min, disfunción hepática y anasarca.
Dentro del SHO se pueden presentar situaciones críticas, con amenaza vital, y que ameritan una actuación inmediata: ascitis a tensión y/o derrame pericárdico, hematocrito mayor de 55%, leucocitosis mayor de 25.000, oliguria con falla renal, creatinina por encima de 1,6 mg/dl, aclaramiento de creatinina menor de 50 ml/min, tromboembolismo, síndrome de dificultad respiratoria aguda.
La incidencia del SHO moderado y severo (recopilado en más de 11.300 ciclos de tratamiento reportados en la literatura) varía desde 3,1% a 6% y de 0,25% hasta 1,8% respectivamente (3). La tasa del SHO severo ha disminuido probablemente debido a la introducción del ultrasonido en la monitoría de la inducción de la ovulación.
En el SHO es frecuente encontrar ciclos positivos de embarazo. Hanning y cols. (4) encontraron que el SHO es cuatro veces más frecuente en ciclos de embarazo que en los ciclos de no embarazo. Tulandi y cols. (5) encontraron que la tasa de embarazo en ciclos hiperestimulados es tres veces mayor que en los ciclos no hiperestimulados.
La tasa de embarazo reportada en series de hiperestimulación varía de 34,6% a 91%, observándose también una alta incidencia de embarazo múltiple entre 10% y 42%. Sin embargo, no es frecuente la asociación reportada entre SHO con embarazo heterotópico (6,7).
Hay un acuerdo general de que la hiperestimulación ovárica ligera (desarrollo multifolicular) está asociada con un incremento en la tasa de embarazo. Esto indica que el producir un SHO ligero puede ser benéfico para incrementar las tasas de embarazo.
La inducción de la ovulación con una ligera hiperestimulación - llamada en forma correcta como "súper ovulación" o estimulación ovárica controlada -, es hoy día utilizada en protocolos para fertilización in vitro y combinada con inseminación intrauterina en el tratamiento de infertilidad inexplicada y ciertas formas de infertilidad masculina.
FISIOPATOLOGÍA DEL SHO
La base de la hiperestimulación ovárica es el desarrollo de múltiples folículos. En un ciclo ovulatorio espontáneo, mecanismos de retroalimentación eficientes aseguran el reclutamiento de un número limitado de folículos antrales tempranos dentro de una cohorte, y el completo desarrollo de un solo folículo dominante capaz de ovular en respuesta al pico de la hormona luteinizante (LH) a mitad del ciclo.
En ciclos estimulados con gonadotropinas este control endógeno no existe y no puede ser completamente reemplazado aun por la más meticulosa monitoría. Para asegurar una terapia exitosa se administran dosis farmacológicas de gonadotropinas. Esto resulta en un reclutamiento y mantenimiento de un número de folículos antrales, varios de los cuales se desarrollan como folículos dominantes capaces de luteinización y ovulación.
La maduración final y luteinización de múltiples folículos resultan en una producción exagerada del factor vascular de crecimiento endotelial (FVCE).
Se ha demostrado que este péptido ejerce dos clases de acciones (8-10):
1. Sirve como un potente promotor de la neovasculogénesis.
2. Aumenta la permeabilidad de las paredes de los vasos sanguíneos, conduciendo a una disrupción de la integridad funcional del lecho vascular.
Así, tenemos que la aparición del SHO se puede percibir como una respuesta exagerada de un proceso fisiológico. Sus estados sucesivos son:
1. Reclutamiento de un gran número de pequeños folículos antrales dentro de una cohorte funcional.
2. Desarrollo sostenido de grandes folículos antrales hasta la ovulación o luteinización.
3. Producción excesiva de factor vascular de crecimiento endotelial (FVCE) por los grandes folículos en desarrollo.
4. Exagerada neovascularización perifolicular, algunos de los nuevos vasos sanguíneos presentan una permeabilidad aumentada.
5. Salida, a través de los vasos sanguíneos, de líquido folicular y perifolicular a la cavidad peritoneal, conteniendo gran cantidades de FVCE, y su subsiguiente absorción por el lecho vascular general.
6. Daño funcional del lecho vascular general.
7. Desplazamiento masivo del fluido intravascular al tercer espacio.
8. Hipovolemia intravascular, concomitante con desarrollo de edema, ascitis, hidrotórax y/o hidropericardio.
9. Daño cardiaco, renal, pulmonar y hepático.
La hiperestimulación ovárica ocurre después de una luteinización folicular masiva. Por consiguiente, se manifiesta únicamente después de la administración de hCG o del pico espontáneo de LH inducido por la producción elevada de estrógenos secundaria al desarrollo folicular múltiple. La producción de hCG endógena durante el embarazo también puede producir la aparición del síndrome o agravar sus signos clínicos y de laboratorio.
Se pueden distinguir dos tipos de SHO, en función del momento de aparición de los signos clínicos (11).
1. SHO temprano: Se inicia de tres a diez días después de la administración de hCG.
2. SHO tardío: Se inicia de 12 a 17 días después de la administración de hCG, más relacionado con la aparición del embarazo.
El cuadro clínico se limita una a dos semanas, siempre y cuando la paciente no quede embarazada; con la aparición de la menstruación el síndrome pasa rápidamente.
La duración del síndrome es más larga y sus hallazgos clínicos son más intensos cuando la paciente queda embarazada, persistiendo sus manifestaciones hasta cuando descienden los títulos de hCG endógena, aproximadamente entre los 60-70 días de gestación.
El hecho de que la ovulación (luteinización) sea necesaria para que ocurra el SHO sugiere el compromiso de reguladores intraováricos en la patogénesis de este síndrome.
Polishuk y Schenker (12) encontraron que altas dosis de HMG producían aumento de los ovarios y ascitis en conejas. Ellos concluyeron que la secreción de los ovarios es responsable de aumento de la permeabilidad capilar, causando un desplazamiento de fluidos al espacio extraperitoneal. En efecto, se han encontrado niveles altos de hormonas ováricas en los casos clínicos de hiperestimulación, esto incluye estradiol, estriol, progesterona, 17 hidroxiprogesterona, pregnanediol, pregnanetriol, testosterona, 17 hidroxicorticosteroides y 17-cetosteroides (13).
Hasta el momento, el factor o los factores responsables del aumento de la permeabilidad capilar han sido objeto de debates vehementes.
Schenker y Polishuk (14) han propuesto a las prostaglandinas en este papel. Esta hipótesis está sustentada en el hecho de que antiprostaglandinas tales como la indometacina alivian la formación de ascitis. En sus experimentos en conejos Pride (15) demostró que la ascitis no mejoraba con la supresión de las prostaglandinas ováricas, y esto sugiere que las prostaglandinas no son mediadores obligatorios del desplazamiento de líquido al tercer espacio.
Algunos hallazgos soportan el papel de los estrógenos en aumento de la permeabilidad capilar (16,17), pero otros autores cuestionan esta hipótesis. Por ejemplo la administración de grandes dosis de estrógenos no causa el síndrome (18).
A pesar de todo, la etiología del síndrome implica un aumento de la permeabilidad capilar que resulta en ascitis masiva e hipovolemia, esta última está asociada a hemoconcentración, disminución de la presión venosa central, disminución de la presión sanguínea y taquicardia. La hipovolemia severa también causa una disminución de la perfusión renal, lo que conduce a un incremento de la reabsorción de sodio y agua en el túbulo proximal (12), produciendo oliguria y baja excreción de sodio en la orina. El recambio de hidrógeno y potasio por sodio en el túbulo distal es reducido, resultando en una acumulación de H+ y K+ que causa hipercalemia y tendencia a la acidosis (19).
Los factores adicionales que conducen a un incremento en la retención de sodio en pacientes con SHO son:
a) Aumento de la producción de renina.
b) Aumento de la secreción de aldosterona.
c) Aumento de los andrógenos.
Sims (20) propuso que el incremento de progesterona en estas pacientes produce un efecto natriurético, el cual podría estimular un aumento de la secreción de aldosterona. Este efecto puede combinarse con los andrógenos elevados, lo cual puede aumentar la retención de agua y Na+ en humanos (21).
Se ha sugerido que citoquinas tales como la interleuquina-1B o la interleuquina-6 (IL-6) son posibles actores en el SHO ya que ellas tienen efecto sobre la permeabilidad vascular. Se han encontrado cantidades significativamente altas de IL-6, tanto en suero como en líquido ascítico en mujeres con SHO, comparados con sueros y fluidos peritoneales de control(21). Hasta el momento no se ha establecido una relación significativa de causa-efecto entre las citoquinas y la incidencia o severidad de SHO.
Varios autores han propuesto que la secuencia de eventos que conducen a la hiperestimulación ovárica clínica es iniciada por la excesiva activación del sistema renina-angiotensina. Navot y colaboradores (22) reportaron que la actividad de la renina plasmática está significativamente elevada en ciclos hiperestimulados.
Por otro lado, algunos signos o componentes del síndrome de hiperestimulación tales como ascitis, hipovolemia y el agrandamiento de los ovarios pueden estimular la producción de renina (20,23).
Como se señaló al principio, la teoría preeminente ahora es que el factor vascular de crecimiento endotelial (FVCE) de origen folicular es el principal responsable del desarrollo del SHO.
El FVCE es miembro de la familia de las proteínas ligada a la heparina que actúa directamente sobre las células endoteliales para producir proliferación y angiogénesis (24). En vivo, FVCE es un poderoso mediador de la permeabilidad vascular (25).
Está fuertemente implicado en la iniciación y el desarrollo de la angiogénesis del embrión en desarrollo (26) y en tejidos adultos que experimentan profunda angiogénesis como es el tejido endometrial cíclico (27) y el folículo luteinizado (28).
Además de su papel fisiológico, el FVCE es un factor angiogénico crítico en el desarrollo de la vascularización tumoral (29) y neovascularización excesiva en condiciones tales como la artritis reumatoide (30). Sus niveles también se encuentran elevados en el fluido peritoneal de pacientes con endometriosis comparada con grupos controles normales (31,32).
El FVCE también puede jugar un papel importante en la regulación cíclica de la angiogénesis ovárica, y su capacidad para aumentar la permeabilidad vascular puede ser un factor importante en la producción del fluido de la trompa de Falopio y de los quistes ováricos.
En el tejido ovárico normal el FVCE se encuentra localizado dentro de las células tecales de los folículos sanos y, en una mínima cantidad, en las células de la granulosa. El FVCE no se expresa en los folículos atrésicos ni en el cuerpo lúteo en regresión. No obstante se ha observado una intensa immunofluorescencia dentro de los cuerpos lúteos altamente vascularizados (33).
Gordon y cols. (33) han concluido que durante la vida reproductiva el FVCE juega un papel importante en el crecimiento y mantenimiento de los folículos ováricos y del cuerpo lúteo a través de la angiogénesis.
Adicionalmente, el FVCE incrementa la permeabilidad vascular del epitelio intraluminal de la trompa de Falopio y modula las secreciones intratubáricas.
Yan y colaboradores (34) fueron los primeros en demostrar la presencia del ARNm del FCVE en las células humanas luteinizadas de la granulosa. Neulen y colaboradores (35) demostraron que la expresión de ARNm de FVCE se aumenta con relación a la dosis de hCG, alcanzando su máxima expresión a las tres horas.
McClure y colaboradores (36) encontraron fuertes evidencias del papel del FVCE en el SHO:
1. Estudios de hibridización han demostrado la expresión de ARNm de FVCE en el ovario, pero predominantemente después del pico de la LH (37). Este pico es esencial para el desarrollo del SHO.
2. El tratamiento de la fase lútea con agonista de la GnRH para suprimir LH, diminuye la expresión del ARNm del FVCE, implicando que tal expresión es dependiente de LH (36). De manera similar, la suplementación de la fase lútea con progesterona, preferiblemente a la hCG, diminuye la probabilidad del SHO.
3. Normalmente la angiogénesis ovárica está restringida a un solo folículo. Por tanto, el agente responsable de la permeabilidad capilar folicular puede no estar dentro de cada folículo individualmente, pero puede diseminarse sobre la cavidad peritoneal.
4. Se ha demostrado que el FVCE es el mayor factor de aumento de la permeabilidad capilar en la ascitis del SHO. Dichos resultados condujeron a que estos autores concluyeran que el mayor agente de la permeabilidad capilar en el líquido ascítico del SHO es el FVCE.
La ascitis extensiva se refleja en ganancia de peso de la paciente. La ganancia de peso después de la administración de hCG puede ser mayor de 3 kg y se debe considerar como un serio aviso de presencia del SHO, justificando una vigilancia continua de la paciente. La paciente con un SHO severo puede ganar entre 15 y 20 kg.
Uno de los efectos colaterales del SHO bastante peligroso pero de rara ocurrencia es el fenómeno tromboembólico. La causa del mismo no esta completamente establecido, pero es probable que la hemoconcentración este asociada con los niveles altos de estrógenos (38).
Philips (39) reportó niveles altos de factor V, plaquetas, fibrinógeno, inhibidores fibrinolíticos, y un incremento de generación de tromboplastina en pacientes con SHO.
MANEJO
Predicción del SHO
El conocimiento de los factores de riesgo y una estrecha observación de las condiciones clínicas son útiles para predecir qué pacientes son susceptibles de presentar una hiperestimulación ovárica severa. Los siguientes son los factores que se deben considerar:
1. Edad: las mujeres jóvenes tienen un mayor riesgo de SHO, mientras que la edad avanzada se asocia a un menor riesgo, aunque probablemente con mayor riesgo de complicaciones tromboembólicas (40,41). La menor reserva de hormona de crecimiento (GH) en este grupo de edad podría ser uno los factores relacionados con bajo riesgo de SHO.
2. Fenotipo: las mujeres delgadas o con bajo índice de masa corporal tienen una mayor predisposición al desarrollo del síndrome (41).
3. Características ecográficas: el signo del collar, caracterizado por la presencia de múltiples folículos pequeños preantrales (2 a 8 mm de diámetro) dispuestos como un collar alrededor de la periferia del ovario junto con un estroma central abundante. Aunque este signo se encuentra frecuentemente en pacientes con ovarios poliquísticos, también puede aparecer en pacientes que ovulan normalmente sin ninguno de los estigmas fenotípicos del ovario poliquístico (42).
4. Monitoría endocrina: existe una correlación positiva entre los niveles altos de estradiol sérico, la presencia de múltiples folículos inmaduros e intermedios y el desarrollo del SHO (41,43-46). Es difícil establecer un punto de corte para los niveles de estradiol y los hallazgos ecográficos a partir del cual aumenta el riesgo de SHO. Hanning y colaboradores (47) encontraron que cuando los niveles de estradiol eran <1.000 pg/ml no se producía SHO; estos autores consideraron que el nivel por encima del cual se debía suspender la administración de hCG, era 4.000 pg/ml, ya que cuando los niveles de estradiol eran de >4.000pg/ml se producía SHO en todos los embarazos. Varios autores han reportado casos severos de SHO con niveles séricos de estradiol por debajo de 1.500 pg/ml (48,49).
5. Síndrome de ovario poliquístico: el SHO es mas frecuente en las pacientes anavulatorias del grupo II (clasificación de la OMS) (40,50-52). En estas pacientes se han detectado niveles bajos de proteínas de unión IGF-1BP, especulándose que los niveles excesivamente altos de IGF-1 libres podrían incrementar la sensibilidad ovárica a la estimulación con gonadotropinas, incrementado el riesgo de hiperestimulación.
6. Influencia de las drogas usadas en la estimulación ovárica: la hCG es el fármaco asociado con mayor frecuencia al SHO, especialmente en sus formas más graves (50). La utilización de los análogos de la GnRH combinados con los agentes inductores de ovulación aumenta la incidencia del SHO, ya que éstos aumentan el reclutamiento folicular y permiten prolongar la estimulación, produciendo así un gran número de folículos (49,53-54). Se cree que la hormona folículo estimulante pura confiere una protección relativa frente al SHO (56-56).
Prevención
Rizk (57) sugiere el uso de diez mandamientos para la prevención del SHO.
1. Suspender de la aplicación de la hCG. Rizk y cols. (58) encontraron que suspender la aplicación de hCG es el método utilizado con mayor frecuencia para prevenir el SHO en pacientes susceptibles de desarrollar síndrome de hiperestimulación. El nivel de estrógenos por encima de los cuales se debe suspender la aplicación de hCG varía ampliamente entre los investigadores (58), Hanning y cols.(47) aceptan 4.000 pg/ml como límite superior. Forman y cols. (53) sugieren que se debe suspender la aplicación de hCG cuando los niveles de estradiol exceden de 2.000 pg/ml en asociación con un total de más de 15 folículos, cada uno con un diámetro mayor 12 mm. El agonista de GnRH se continúa, y la hCG se inicia a dosis bajas después de un periodo de desensibilización amplio.
2. Retardar la aplicación de la hCG. Algunos autores han reportado éxito en reducir la severidad del SHO al retardar la aplicación de la hCG (59-61). Rabinovici y cols. (59) fueron los primeros en reportar su experiencia en 12 pacientes susceptibles de desarrollar hiperestimulación. La aplicación de la hCG fue suspendida y la duración de la pausa en el tratamiento varió entre dos y diez días. En nueve de las pacientes (incluyendo seis que se hiperestimularon) los niveles de estradiol declinaron a pesar de continuar el crecimiento de la mayoría de los folículos. Ninguna de las nueve pacientes concibió después de aplicar la hCG. En los embarazos que ocurrieron en tres de las pacientes se observó una elevación continua de los niveles de estradiol hasta el día de la aplicación de la hCG. Los autores concluyeron que aunque es posible, algunas veces, rescatar el ciclo sobre estimulado, lograr el embarazo parece asociarse a una continuación en la elevación de estradiol durante el periodo de la pausa en el tratamiento (59).
Benadiva y cols. (62) reportaron que la suspensión de la administración de gonadotropina es una alternativa efectiva para prevenir el desarrollo del SHO severo en la población de alto riesgo. Aunque no se elimina el riesgo de cancelación en forma completa, esta estrategia puede suministrar una tasa alta de embarazo, sin necesidad de repetir múltiples ciclos de congelación y descongelación.
3. Uso de a-GNRH para producir la ovulación. Gonen y cols. (63) e Itskovitz y cols. (64) usaron el efecto inicial de "flare- up" del agonista para producir la ovulación y subsiguiente embarazo. En pacientes con riesgo de SHO se ha utilizado buserelina intranasal en dosis de 200 mg en intervalos de ocho horas para producir la ovulación, resultando en una tasa de embarazo de 22%, sin ningún caso de SHO (65). Imoedemhe y cols. (66) utilizaron a-GnRH en 38 pacientes en riesgo de SHO, con niveles de estradiol >4000 pg/ml, y obtuvieron 11 embarazos, sin un solo caso de SHO. La mayor limitación de a-GnRH es que no puede ser usada en ciclos donde la estimulación ovárica con HMG se produjo después de que la de sensibilización hipofisiaria se ha realizado con a-GnRH (32).
4. Aspiración folicular. En un estudio retrospectivo Aboulghar y cols. (67) encontraron que la aspiración folicular no evita el desarrollo del SHO. Ellos estudiaron la incidencia de SHO moderado y severo después de un protocolo de superovulación en 182 pacientes a quienes se aspiró, comparado con 137 pacientes que no fueron aspiradas. La infertilidad anovulatoria (particularmente el síndrome de ovario poliquístico) fue el principal factor predisponente en el SHO, y la aspiración folicular no tuvo ningún efecto protector.
5. Soporte de la fase lútea con progesterona. Rizk y Smitz (71) demostraron que el uso de HCG para soporte de la fase lútea incrementa la incidencia de SHO. Por tanto se debe usar progesterona ya sea intravaginal o intramuscular para soporte de fase lútea en pacientes con riesgo de SHO.
6. Criopreservación y posterior transferencia. La posibilidad de congelar embriones ha hecho posible que un ciclo no se pierda y ha permitido la obtención de embarazo por la trasferencia de embriones congelados-descongelados en un ciclo posterior; este procedimiento es adecuado en la prevención del SHO (68-70).
7. Aspiración selectiva de oocitos en ciclos de concepción espontánea. La aspiración selectiva de oocitos se ha utilizado para prevención de SHO y embarazos múltiples en concepción espontánea, mediante la punción de la mayoría de los folículos, 35 horas después de la administración de hCG como en los programas de FIV. Los folículos restantes que queden intactos pueden dar como resultado un embarazo único o gemelar (72).
8. Administración de glucocorticoides. No se ha encontrado un efecto preventivo del uso de glucocorticoides en pacientes con riesgo de SHO (73).
9. Utilización de bajas dosis de gonadotropinas en pacientes con ovarios poliquísticos. Rizk y Smitz (71) resaltan que la estimulación ovárica en pacientes con ovarios poliquísticos conlleva un riesgo muy alto de desarrollar una forma severa de SHO. La prevención de este síndrome en este grupo de pacientes es bastante difícil porque hay un margen muy estrecho entre la dosis requerida para producir una estimulación razonable y la dosis que induce SHO. Establecer un protocolo de baja dosis de HMG o FSH es seguro, tanto para estimulación no FIV como si la hiperestimulación va a ser realizada para FIV (74-75).
10.Administración de albúmina humana. Ash y cols. (76) administraron albúmina humana a pacientes propensos a desarrollar SHO al momento de la aspiración de los oocitos e inmediatamente después. De las 36 mujeres tratadas ninguna desarrolló SHO. La albúmina es efectiva para corregir la inestabilidad hemodinámica y balancea la hipovolemia. Además, tiene una gran capacidad de absorción y por este mecanismo reduce la cantidad circulante de FVCE; de esta forma remueve el principal factor dañino para la integridad de los vasos sanguíneos. De otra parte, Fisher y cols (77) propusieron reemplazar la albúmina por una infusión a 10% de almidón hidroxietílico, el cual se puede conseguir con facilidad en el comercio, es barato y libre de factores de riesgo de los productos sanguíneos.
TRATAMIENTO DEL SHO CLÍNICO
El tratamiento del SHO depende de su gravedad, por tanto es muy importante identificarlo y clasificarlo correctamente.
SHO leve
Su manejo es reposo en cama e hidratación oral.
SHO moderado
Requiere observación ambulatoria, monitoreo ecográfico y monitoreo de los siguientes parámetros de laboratorio: hematocrito, proteinemia, función renal (urea y creatinina), función hepática (transaminasas), iones (sodio, potasio) y pruebas de coagulación. Hay que evitar las relaciones sexuales y el tacto vaginal. Se pueden producir rupturas de quistes y hemorragia intraabdominal. Vigilar la ganancia de peso excesiva y la diuresis.
Un aumento excesivo del peso y una disminución de la diuresis, brusca o progresiva es una indicación de agravamiento del síndrome. En caso de embarazo se agravan los síntomas y el síndrome. Tratamiento asintomático: analgésicos, antieméticos, buena hidratación, reposo.
SHO grave
Puede tener un manejo ambulatorio si se tiene experiencia en esta patología, de lo contrario la paciente debe ser hospitalizada. Para una valoración adecuada del SHO grave, debemos realizar los siguientes exámenes:
Radiografía de tórax, para evaluar la presencia de derrame pleural.
Ecografía abdominal, para valorar el tamaño de los ovarios y la presencia de ascitis.
Exámenes sanguíneos: albúmina sérica, proteínas totales, urea, creatinina, hemograma completo, electrólitos, pruebas de coagulación y enzimas hepáticas.
Vigilar estado hemodinámico.
Control diario de peso y diuresis.
Hemoconcentración (Hematocrito >45% o aumento de 30%).
Hemoconcentración
El hematocrito elevado parece tener la mayor correlación de la severidad del SHO (78). El nivel de hematocrito refleja directamente un agotamiento del volumen intravascular y un incremento de la viscosidad sanguínea. Ambos pueden influenciar la prefunción renal y la tendencia hacia fenómenos tromboembólicos. Una medida adicional de la hemoconcentración es la magnitud de la leucocitosis: se pueden encontrar recuentos hasta de 35.000/mm; esta masiva neutrofilia también puede ser secundaria al estrés generalizado.
Debido a la marcada hiperpermeabilidad y al alto contenido proteico acumulado en el tercer espacio, las soluciones cristaloides solas son raramente suficientes para restaurar el volumen sanguíneo. Debido a la tendencia a la hiponatremia, el ClNa con o sin glucosa es el principal cristaloide de reemplazo. El volumen diario de reemplazo puede variar de 1,5 a más de 3 por día.
Los cinco parámetros cruciales para mantener el equilibrio de líquidos son: la pérdida urinaria, el peso corporal, el hematocrito, la circunferencia abdominal, la ingesta oral o líquidos IV. La reposición de líquidos intravenosos debe mejorar la perfusión renal, antes de que esta pase a la cavidad peritoneal y pleural. De esta forma, la hemodilución puede terminar en un aumento de la ascitis.
Cuando el equilibrio de líquidos no se puede mantener sólo con soluciones cristaloides, tenemos que utilizar expansores del plasma. La albúmina humana, soluciones cristaloides (Hemacel) y el manitol, han sido utilizados con éxito para restaurar la presión oncótica (79-81).
La terapia con plasma fresco, en esta época de alta prevalencia del SIDA, debe evitarse.
El Dextran, un coloide sintético de la gran molécula de almidón ha sido usado en algunos casos de SHO severo (82) sin embargo, las reacciones de hipersensibilidad que pueden acabar en choque anafiláctico y el posible efecto adverso sobre la función renal con detención de tapones en los túbulos renales limitan su uso rutinario.
Hasta el momento, la experiencia con el manitol, es extremadamente limitada (81).
La albúmina humana es probablemente el expansor de volumen de elección. La albúmina es la proteína que se traslada del espacio intravascular al tercer espacio; no es tóxica y es libre de contaminantes virales. La albúmina a dosis de 50 a 100 gramos (50 a 100 ml IV), repetida cada dos a doce horas, es un expansor de plasma muy efectivo en el SHO. Con la albúmina IV el hematocrito alcanza rápidamente valores normales y la diuresis se restaura(79,82).
Ascitis
Hay una relación recíproca entre la hemoconcentración y la acumulación de volumen extravascular. La ascitis asintomática no debe tratarse específicamente, ya que su presencia es común y se cataloga como un SHO moderado. Estos casos se deben vigilar en forma ambulatoria. La acumulación de líquido ascítico puede producir aumento de la presión intraabdominal que compromete el retorno venoso, y el gasto cardiaco, con la siguiente disminución de la perfusión periférica.
Cuando se ha logrado la hemodilución y la paciente persiste con oliguria, la administración de furosemida IV puede ser beneficiosa. En la práctica, la asociación de albúmina-furosemida al parecer produce mejores resultados. La administración de 100 mg de albúmina seguida de 20 mg de furosemida IV es lo ideal (83-84). La furosemida debe evitarse en caso de hemoconcentración o hipotensión.
La aspiración del líquido ascítico mediante aspiración transvaginal, guiada por ecografía, es la vía de elección y está indicada en casos de:
Necesidad de aliviar dolor, insomnio, disnea (aun sin derrame pleural).
Ascitis a tensión.
Oliguria.
Aumento de la creatinina.
Hemoconcentración que no responde al tratamiento médico.
La aspiración del líquido ascítico está contraindicada en casos de.
Ausencia de control ecográfico.
Pacientes hemodinámicamente inestables.
Sospecha de hemoperitoneo.
Manejo de las complicaciones específicas del SHO
La forma más grave del SHO puede complicarse con trastornos sistémicos múltiples. Los mayores peligros del SHO son la falla renal, los fenómenos tromboembólicos y el síndrome de dificultad respiratoria aguda. Como es obvio, las pacientes con estas manifestaciones deben ser vigiladas en una unidad de cuidado intensivo.
Falla renal: los primeros signos de falla renal inminente son oliguria, descenso gradual de aclaración de creatinina, y aumento de la creatinina sérica, generalmente asociados con acumulación de ascitis a tensión. Cuando todas las medidas usadas para tratar la forma del síndrome hayan fracasado en el restablecimiento de la función renal adecuada, la perfusión de dopamina mejora significativamente la función renal (85). Cuando se presenta la falla renal franca, puede ser necesaria la hemodiálisis y, en este estado, se debería considerar la penosa alternativa de interrumpir el embarazo.
Complicaciones tromboembólicas: la terapia anticoagulante está indicada si hay evidencia clínica de complicaciones tromboembólicas o evidencia de laboratorio de hipercoagulabilidad (86,87,88). Se sugiere la administración de heparina profiláctica durante todo el periodo de manejo del SHO severo.
Ruptura de quistes ováricos: la baja de la hemoglobina o del hematocrito, sin regresión de otros signos de SHO, es un indicador importante de hemorragia intraperitoneal. La cirugía debe ser conservadora al máximo y efectuada por un ginecólogo experimentado.
Torsión anexial: la torsión de un ovario poliquístico se produce cuando los quistes son pequeños como los casos leves del síndrome. Debido al malestar que presenta la paciente, a veces es difícil distinguir entre una torsión ovárica y la sensibilidad abdominal asociada a los ovarios hiperestimulados.
La aparición o el aumento repentino de la sensibilidad y el dolor junto con la existencia de un diámetro ovárico relativamente pequeño ayudan al diagnóstico de torsión. La interrupción del flujo sanguíneo ovárico diagnosticado por doppler puede ser de gran ayuda para establecer el diagnóstico. Si se hace un diagnóstico cuidadoso, es posible restablecer el riego sanguíneo del ovario mediante cirugía endoscópica, puesto que no existe contraindicación para la laparoscopia (89).
REFERENCIAS BIBLIOGRÁFICAS
1. Rabau E, Serr DM, David A, Mashiach S, Lunenfeld B. Human menopausal gonadotropins for anovulation and sterility. Am J Obstet Gynecol 1967;96:92-98. [ Links ]
2. World Health Organization: Agents stimulating gonadal function in human. 1973 WHO Technical Report Series no 514. [ Links ]
3. Lunenfeld B, Isler V, Glezerman M. Diagnosis and treatment of functional infertility. 3rd ed. Berlin: Blackwell; 1993. [ Links ]
4. Hanning RV Jr, Austin CW, Carlson IH. Plasma estradiol is superior to ultrasound and urinary estriol glucuronide as predictor of ovarian hyperstimulation during induction of ovulation with menotropins. Fertil Steril 1983;40:31-36. [ Links ]
5. Tulandi T, McInnes RA, Arronet GH. Ovarian hyperstimulation syndrome following ovulation induction with hMG. Int J Fertil 1984;29:113-117. [ Links ]
6. Rizk B, Tan SL, Morcos S. Heterotopic pregnancies after in vitro fertilization and embryo transfer. Am J Obstet Gynecol 1991;164:161-164. [ Links ]
7. Reyad RM, Aboulghar MA, Serour GI. Bilateral ectopic pregnancy with an intact intrauterine pregnancy following an ICSI procedure. Middle East Fertil Soc J 1996;3:91-94. [ Links ]
8. Yan Zh,Weich HA, Bernardt W, Breckwolt M, Neulen J. Vascular endothelial growth factor (VEGF) messenger ribonucleic acid (mRNA) expression in luteinized human granulose cells in vitro. J Clin Endocrinol Metab 1993;77:1723-1725. [ Links ]
9. McLure N, Healy DL, Royers PA, Sullivan J, Beaton L, Hanning RV, Connoly DT, Roberson DM. Vascular endothelial growth factor as capillary permeability agent in ovarian hyperstimulation syndrome. Lancet 1994;344:235-237. [ Links ]
10. Shweiki D, Itin A, Neufeld G, Gitay- Goren H, Keshet E. Patterns of expression of vascular endothelial growth factor (VEGF) and VEGF receptors in mice suggest a role in hormonally regulated angiogenesis. J Clin Invest 1993;91: 2235-2243. [ Links ]
11. Dahl CA, Wheeler CA, Frishman GN, Seifer DB, Hanning RV Jr. Early and late presentation of the ovarian hyperstimulation syndrome: Two distinct entities weigh different risk factors. Hum Reprod 1994;9:792-799. [ Links ]
12. Polishuk WZ, Schenker JG. Ovarian over stimulation syndrome. Fertil Steril 1969;20:443-448. [ Links ]
13. Schenker JG, Schumert Z, Shifrin A, Spitz I. Steroid pattern in experimental hyperstimulation syndrome and the response to indomethacin. Presented at the Second International Congress of Human Reproduction; October 1977; Tel Aviv. [ Links ]
14. Schenker JG, Polishuk WZ. The role of prostanglandins in ovarian hyper stimulation syndrome. Eur J Obstet Gynecol Reprod 1976;6:47-52. [ Links ]
15. Pride SM, Yuen BH, Young SM, Leung PCS. Relationship of gonadotropin releasing hormone, danazol and prostaglandin blockade to ovarian enlargement and ascitis formation or the ovarian hyperstimulation syndrome in rabbit. Am J Obstet Gynecol 1986;154:1155-1160. [ Links ]
16. Davis JS. Hormonal control of plasma and erythrocyte volume of rat uterus. Am J Phsysiol 1960;154:1155-1160. [ Links ]
17. Cecil HC, Hannun JA Jr, Bitman J. Quantitative characterization of uterine vascular permeability changes with estrogen. Am J Physiol 1966;211:1099-1104. [ Links ]
18. Schenker JG, Polishuk WZ. An experimental model of ovarian hyperstimulation syndrome. In: Tischer M, Pilch J, editors. Proceedings of the International Congress on Animal Reproduction; 1976; vol 4 Drukarnia Naukowa, Cracow. P.635-645. [ Links ]
19. Engel J, Jewelewicz R, Dyrenfurth I, Speroff L, Vande Wiele RL. Ovarian hyperstimulation syndrome. Report of case notes on pathogenesis and treatment. Am J Obstet Gynecol 1972;112:1052-1058. [ Links ]
20. Sims EA. Renal function in normal pregnancy. Clin Obstet Gynecol 1967;11:961-966. [ Links ]
21. Mudge GH, Welt LG. Agents affecting volume and composition of body fluids. In: Goodman LS, Gilman A, editors. The pharmacological basis of therapeutics, 5th edn. New York: Macmillan; 1975; p.733-781. [ Links ]
22. Navot D, Margalioth EJ, Laufer N, Birkenfeld A, Relou A, Rosler A, Schenkedr JG. Direct correlation between plasma rennin activity and severity of the ovarian hyperstimulation syndrome 1987;48:57-61. [ Links ]
23. Landau RL, Lugibihl K. Inhibition of the sodium-retaining influence of aldosterone by progesterone. J Clin Endocrinol Metab 1958;18:1237-1242. [ Links ]
24. Ferrara N, Houck K, Jakeman L, et al. Molecular and biological properties of the vascular endothelial growth factor family of proteins. Endocr Rev 1992;13:18-32. [ Links ]
25. Keck PJ, Hauser SD, Krivi G, et al. Vascular permeability factor, an endothelial cell mitogen related to PDGF. Science 1989;246:1309-1312. [ Links ]
26. Millauer B, Wizigmann-Voos S, Schnurch H, et al. High affinity VEGF binding and developmental expression suggest FLK-1 as a major regulator of vasculogenesis and angiogenesis. Cell 1993;72:835-846. [ Links ]
27. Charnock Jones DS, Sharley AM, Rajput-Williams J, et al. Identification and localization of alternately spliced mRNAs for vascular endothelial growth factor in human uterus and estrogen regulation in endometrial carcinoma cell line. Biol Reprod 1993;48:1120-1160. [ Links ]
28. Ravindranath N, Little-Ihrig LL, Phllions HS, et al. Vascular endothelial growth factor messenger ribonucleic acid expression in primate ovary. Endocrinol 1992;131:254-260. [ Links ]
29. Kim KJ, Li B, Winer J, et al. Inhibition of vascular endothelial growth factor induced angiogenesis suppresses tumor growth in vivo. Nature 1993;362:841-844. [ Links ]
30. Koch AE, Harlow LA, Haines GK, et al: Vascular endothelial growth factor: a cytokine modulating endothelial function in rheumatoid arthritis. J Immunol 1994;152:4149-4156. [ Links ]
31. McLaren J, Prentice A, Charnock-Jones DS, et al. Vascular endothelial growth factor (VEGF) concentrations are elevated in peritoneal fluid with endometriosis. Hum Reprod 1996;11: 220-223. [ Links ]
32. Abdalla HI, Rizk B. Pathogenesis of endometriosis. In: Abdalla HI, Rizk B, editors. Endometriosis. Abingdon, Oxford: Health Press, 1998; p.42-44. [ Links ]
33. Gordon JD, Mesiano S, Zaloudek CJ, et al. Vascular endothelial growth factor localization in human ovary and fallopian tubes: possible role in reproductive function and ovarian cyst formation. J Clin Endocrinol Metab 1996;81:353-359. [ Links ]
34. Yang Z, Weich HA, Bernart W, et al. Vascular endothelial growth factor (VEGF) messenger ribonucleic acid (mRNA) expression in luteinized human granulose cells in vitro. J Clin Endocrinol Metab 1993:1723-1725. [ Links ]
35. Neulen J, Yan Z, Raczeck S, et al. Ovarian hyperstimulation syndrome: vascular endothelial growth factor/vascular permeability factor from luteinized granulosa cells is the pathophysiological principal. In: Abstracts of the 11th Annual Meeting of the ESHRE. Hamburg, 1995. [ Links ]
36. McClure N, Healy DL, Rogers PA, et al. Vascular endothelial growth factor as capillary permeability agent in ovarian hyperstimulation syndrome. Lancet 1994;344:235-236. [ Links ]
37. Krasnow JJ, Berga SL, Guzick DS, et al. Vascular permeability factor and vascular endothelial growth factor in ovarian hyperstimulation syndrome. Fertil Steril 1996;65:552-555. [ Links ]
38. Moses M, Bogowsky H, Anteby E, Lunenfeld B, et al. Thromboembolic phenomena after ovarian stimulation with human menopausal gonadotrophins. Lancet 1965;2:1213-1215. [ Links ]
39. Phillips LL, Glanstone W, VandeWiele R. Studies of the coagulation and fibrinolytic systems in hyperstimulation syndrome after administration of human gonadotrophins. J Reprod Med 1975;14:138-143. [ Links ]
40. Schenker JG, Weinstein D. Ovarian hyperstimulation syndrome: a current survey. Fertil Steril 1978;30:255-268. [ Links ]
41. Navoth D, Relou A, Birkenfeld A et al. Risk factors and prognostic variables in the ovarian hyperstimulation syndrome. Am J Obstet Gynecol 1988;159:210-215. [ Links ]
42. Salat-Baroux J, Tibi L, Álvarez S, Gómez A, et al. Ultrasonographic prediction of ovarian hyperstimulation after IVF. In: Mashiach S, Ben-Rafael Z, Laufer N, Schenker JG, editors. Advances in assisted reproductive technologies. New York: Plenum Publishing; 1990; p. 559-565. [ Links ]
43. Blankstein J, Shalev J, Saadon T, Kukia EE, et al. Ovarian hyperstimulation syndrome: prediction by number and size of preovulatory ovarian follicles. Fertil Steril 1987;47:597-602. [ Links ]
44. Haning RV Jr, Boehnlein LM, Carlson IH, Kuzma DL, Zweibel DJ. Diagnosis-specific serum 17 B-estradiol (E2) upper limits for the treatment with menotropins using a 125-I direct E2 assay. Fertil Steril 1987;42:882-889. [ Links ]
45. Tal J, Paz B, Samberg Y, Lazrov N, et al. Ultrasonographic and clinical correlates of menotropins versus sequential clomiphene citrate: menotropin therapy for induction of ovulation. Fertil Steril 1985;44:342-349. [ Links ]
46. Bryce RL, Ricker RH, Saunders DM: Ultrasound in gonadotropin therapy: a better predictor of ovarian hyper stimulation? Aust N Z J Obstet Gynecol 1981;21:237-241. [ Links ]
47. Hanning RV Jr, Austin CW, Carlson IH, et al. Plasma estradiol is superior to ultrasound and urinary estriolglucoronide as a predictor of ovarian hyperstimulation during induction of ovulation with menotropins. Fertil Steril 1983;40:31-36. [ Links ]
48. Schenker JG. Prevention and treatment of ovarian hyperstimulation. Hum Reprod 1993;8:653-659. [ Links ]
49. Navot D, Bergh PA, Laufer N. Ovarian hyperstimulation syndrome in novel reproductive technologies: prevention and treatment. Fertil Steril 1992;58:249-261. [ Links ]
50. Tulandi T, Meinnes RA, Arronet GH. Ovarian hyperstimulation syndrome following ovulation induction with hMG. Int J Fertil 1984;29:113-117. [ Links ]
51. Kemmann E, Tavakoli F, Shelden RM, Jones JR. Induction of ovulation with menotropins women with polycystic ovary syndrome. Am J Obstet Gynecol 1981;141:58-64. [ Links ]
52. Caspi E, Levin S, Bukovsky Y, Weintraub Z. Induction of pregnancy with human gonadotropins after clomiphene failure in menstruating ovulatory infertility patients. Isr J Med Sci 1974;10:249-255. [ Links ]
53. Forman RG, Frydman R, Egan D, Ross C, Barlow DH. Severe ovarian hyperstimulation syndrome using agonists of gonadotropin-realising hormone for in vitro fertilization: a European series and a proposal for prevention. Fertil Steril 1990;53:502-509. [ Links ]
54. Golan A, Ron-El, Herman A, Caspi E. Ovarian hyperstimulation syndrome following D-Trp-6-luteinizing hormone-realizing hormone microcapsules and menotropin for in vitro fertilization. Fertil Steril 1988;50:912-916. [ Links ]
55. Crooke AC, Butt WR, Palmer RF, Morris R, Edward RL, Andson CJ. Clinical trial of human gonadotrophins. J Obstet Gynecol Br Commonw 1963;70:604-631. [ Links ]
56. Raj SJ, Berger MJ, Grimes EM, Taymor ML. The use of gonadotropins for the induction of ovulation in women with polycistic ovarian disease. Fertil Steril 1977;28:1280-1284. [ Links ]
57. Rizk B. Prevention of ovarian hyperstimulation syndrome: the Ten Commandments. Presented at the 1993 European Society of Human Reproduction and Embryology Symposium. Tel Aviv, Israel; 1993. p. 1-2. [ Links ]
58. Rizk B, Aboulghar M. Modern management of ovarian hyperstimulation syndrome. Hum Reprod 1991;56:1077-1083. [ Links ]
59. Rabinovici J, Kushnir O, Shalev J, et al. Rescue of menotropin cycles prone to develop ovarian hyperstimulation. Br J Obstet Gynecol 1987;94:1098-1210. [ Links ]
60. Urman B, Pride SM, Ho Yuen B. Management of overstimulated gonadotrophin cycles with a controlled drift period. Human Reprod 1992;7:213-217. [ Links ]
61. Sher G, Salem R, Fernman M, et al. Eliminating the risks of life endangering complications following overstimulation with menotropin fertility agents: a report on women undergoing in vitro fertilization and embryo transfer. Obstet Gynecol 1993;81: 1009-1020. [ Links ]
62. Benadiva CA, Davis O, Kilgman I, et al. Withholding gonadotrophin administration is an effective alternative for the prevention of ovarian hyperstimulation syndrome. Fertil Steril 1997;67:724-727. [ Links ]
63. Gonen Y, Balakier H, Powell, et al. Use of gonadotrophin releasing hormone agonist to trigger follicular maturation for in vitro fertilization. J Clin Endocrinol Metab 1990;918-922. [ Links ]
64. Itskovitz J, Boldes R, Levron J, et al. Induction of preovulatory luteinizing hormone surge and prevention of hyperstimulation syndrome by gonadotrophin releasing hormone against. Fertil Steril 1991;56:213-220. [ Links ]
65. Emperaire JC, Ruffie A. Triggering ovulation with endogenous luteinizing hormone may prevent ovarian hyperstimulation syndrome. Fertil Steril 1991;56:506-510. [ Links ]
66. Imoedemhe DAG, Chan RCW, Signe AB et, al. A new approach to the management of patients at risk of ovarian hyperstimulation in an in vitro fertilization program. Hum Reprod 1991;6:1088-1091. [ Links ]
67. Aboulghar MA, Mansour RT, Serour GI et al. Follicular aspiration does not protect against the development of ovarian hyperstimulation syndrome. J Assist Reprod Genet 1992;9:238-243. [ Links ]
68. Amso NN, Ahuga KK, Morris N, et al. The management of predicted OHS involving gonadotrophin-realizing analogue with elective cryopreservation of all pre-embryos. Fertil Steril 1990;53:1087-1090. [ Links ]
69. Rizk B, Manners CV, Davies MC, et al. Immunohistochemical expression of endometrial proteins and pregnancy outcomes in frozen embryo replacement cycles. Hum Reprod 1992;7:413-417. [ Links ]
70. Wada I, Matson PL, Trooup SA, et al. Does elective cryopreservation of all embryos from women at risk of ovarian hyperstimulation syndrome reduce the incidence of the condition? Br J Obstet Gynecol 1993;10:265-269. [ Links ]
71. Rizk B, Smitz J. Ovarian hyperstimulation syndrome after superovulation for IVF and related procedures. Hum Reprod 1992;7:320-327. [ Links ]
72. Belaish-Allart J, Hazout A. Selective oocyte retrieval: a new approach to ovarian hyperstimulation. Fertil Steril 1988;50:654-656. [ Links ]
73. Tan SL, Balen A, Hussein E, et al. The administration of glucocorticosteroids for the prevention of the ovarian hyperstimulation syndrome in in-vitro fertilization: a prospective randomized study. Fertil Steril 1992;58:378-383. [ Links ]
74. Hombourg R, Armar NA, Eshel J, et al. Influence of serum luteinizing hormone concentrations on ovulation, conception and early pregnancy loss in polycystic ovary syndrome. Br Med J 1988;297:1024-1026. [ Links ]
75. Aboulghar MA, Mansour RT, Serour GI. Recombinant follicle stimulating hormone in the treatment of patients with history of severe ovarian hyperstimulation syndrome. Fertil Steril 1996;66:757-760. [ Links ]
76. Asch RH, Ivery G, Goldman M, Frederik JL, et al. The role of intravenous albumin in patients at high risk for severe ovarian hyperstimulation syndrome. Hum Reprod 1993;8:1015-1020. [ Links ]
77. Fischer R, Baukohl V, Naether O, Nuckel M. Human serum albumin and 10% hydroxeyethyl starch infusion as a preventive treatment of sever ovarian hyperstimulation syndrome. Hum Reprod 1994;9:123-124. [ Links ]
78. Borenstein R, Elhalah U, Lunenfeld B, Schwartz ZS. Severe ovarian hyperstimulation syndrome: a revaluated therapeutic approach. Fertil Steril 1989:791-795. [ Links ]
79. Forman RG, Frydman R, Egan D, Ross C, Barlow DH. Severe ovarian hyperstimulation syndrome using agonists of gonadatropin releasing hormone for in vitro fertilization: a European series and a proposal for prevention. Fertil Steril 1990;53:502-509. [ Links ]
80. Meldrum DR, Wisot A, Hamilton F, Gutkay AL, et al. Routine pituitary suppression with leuprolide before ovarian stimulation for oocyte retrieval. Fertil Steril 1989;51:455-459. [ Links ]
81. Padilla SL, Zamaria S, Baramki TA, García JE. Abdominal paracentesis for the ovarian hyperstimulation syndrome with severe pulmonary compromise. Fertil Steril 1990;53:365-367. [ Links ]
82. Zosmer A, Katz Z, Lancet M, Konichezky S, et al. Adult respiratory distress syndrome complicating ovarian hyperstimulation syndrome. Fertil Steril 1987;47:524-526. [ Links ]
83. Rosen GF, Lew MW. Severe ovarian hyperstimulation in a spontaneous singleton pregnancy. Am J Obstet Gynecol 1991;39:464-467. [ Links ]
84. Fakih H, Bello S Ovarian cyst aspiration: a therapeutic approach to ovarian hyperstimulation syndrome after GnRH agonist/hMG super ovulation for in vitro fertilization. Hum Reprod 1990;5:993-997. [ Links ]
85. Ferraretti AP, Gianaroli L, Diotallevi L. Dopamine treatment for severe hyperstimulation syndrome. Hum Reprod 1992;7:180-183. [ Links ]
86. Moses M, Bogowsky H, Anteby E. Thromboembolic phenomena after ovarian stimulation with human menopausal gonadotropin. Lancet 1965;2:1213-1215. [ Links ]
87. Rizk B, Aboulghar MA, Smitz J, Ron-El R. The role of vascular endothelial growth factor and interleukins in the pathogenesis of sever ovarian hyperstimulation syndrome. Hum Reprod Update 1997;3:255-266. [ Links ]
88. Ong ACM, Eisen V, Rennie DP. The pathogenesis of the ovarian hyperstimulation syndrome (OHS): a possible role of ovarian renin. Clin Endocrinol 1991;34:43-49. [ Links ]
89. Mashiach S, Bider D, Moran O, Goldenber M. Adnexal torsion of hyper stimulated ovaries in pregnancies after gonadotropin therapy. Fertil Steril 1990;53:76-80. [ Links ]














