INTRODUCCIÓN
Se estima que entre un 2 y 3 % de los embarazos en el mundo se ven afectados por anomalías estructurales fetales, que incrementan el riesgo de morbilidad y mortalidad perinatal 1. Entre estas anomalías se encuentran las malformaciones musculoesqueléticas conocidas como artrogriposis, que se caracterizan por la presencia de dos o más contracturas en las extremidades fetales en más de un área corporal 2. Esta condición es causada por la falta de movimiento fetal (acinesia fetal) que se asocia con la concentración de tejido conectivo alrededor de las articulaciones 3.
Además de las extremidades, la artrogriposis puede afectar otras áreas del cuerpo como la mandíbula, la columna vertebral y cuello fetal 2,4. Generalmente, las contracturas articulares se hacen evidentes en el segundo trimestre del embarazo, también se ha descrito la presencia de otras anomalías como translucencia nucal aumentada o higroma quístico durante el primer trimestre 5. Esta condición tiene una incidencia de 1 en 3.000 embarazos, y puede asociarse con más de 400 condiciones diferentes 2,3 lo que representa un desafío para el diagnóstico prenatal.
Dado el número de condiciones asociadas a la artrogriposis, que incluyen alteraciones neuropáticas, miopáticas, metabólicas y espacio uterino limitado, entre otras 3, es fundamental un diagnóstico preciso y una ecografía anatómica detallada para identificar la posible asociación con otras anomalías, y definir una posible causa subyacente 6,7.
La artrogriposis distal tipo 2A, o síndrome de Freeman-Sheldon, es una de estas condiciones. Este síndrome fue descrito por primera vez por el ortopedista Freeman y el pediatra Sheldon en 1938, como una displasia cráneo-carpotarsal 8. En 1996, Bamshad amplió la clasificación y propuso el síndrome de Freeman-Sheldon como una forma de artrogriposis distal con anomalía facial, sugiriendo que debería llamarse artrogriposis distal tipo 2A 9. El síndrome de Freeman-Sheldon se caracteriza por afectar principalmente la cara, las manos y los pies, con una prevalencia de 1 por cada 3.000 a 5.000 nacidos vivos.
Este síndrome está relacionado con un trastorno genético raro que puede transmitirse de forma autosómica dominante o recesiva 10,11, y se ha asociado con mutaciones en el gen MYH3 (myosin heavy chain 3), que codifica la cadena pesada de la miosina embrionaria 12,13. La miosina embrionaria es una proteína muscular que forma parte del sarcómero, el aparato contráctil subcelular de las células de los músculos esquelético y cardiaco 14,15.
Para el estudio de fetos con deformidades en las articulaciones, especialmente contracturas en vida prenatal, se recomienda la realización de pruebas de diagnóstico genético como cariotipo, hibridación fluorescente in situ (FISH) para estudio de cromosomopatías comunes, microarreglos y secuencia completa de exoma fetal, para evitar pasar por alto condiciones genéticas asociadas a las anomalías estructurales documentadas mediante ultrasonido prenatal 16,17. En el caso de la artrogriposis distal tipo 2A, es esencial utilizar la secuencia completa de exoma en vida prenatal para identificar la mutación del gen MYH3 18, a fin de facilitar un diagnóstico temprano y la evaluación de posibles diagnósticos diferenciales 9. A la fecha, en la literatura científica, en más del 90 % de los casos reportados se realiza diagnóstico posnatal.
Presentamos el caso de una paciente con diagnóstico ecográfico de artrogriposis fetal, clasificada como artrogriposis distal tipo 2A, apoyado en la identificación de una variante patogénica heterocigota en el gen MYH3. Este es de los pocos casos de diagnóstico reportado en la literatura que combina ultrasonido y pruebas genéticas prenatales.
PRESENTACIÓN DEL CASO
Se describe el caso de una mujer de 33 años, primigestante, atendida en una institución de salud de alta complejidad ubicada en Cartagena de Indias, Colombia, que atiende tanto a personas del régimen contributivo de los trabajadores y del régimen subsidiado por el Estado en el Sistema de General de Seguridad Social Colombia (SGSS). La paciente fue remitida para evaluación morfológica ultrasonográfica en segundo trimestre, a las 19 semanas y un día de gestación. La única patología relevante en su historial médico era un hipotiroidismo clínico en tratamiento, sin antecedentes familiares de importancia.
Durante la ecografía se identificaron deformidades en las extremidades del feto, consistentes en múltiples contracturas articulares distales, manifestándose como pie equino varo bilateral, y una alteración morfológica en la mano derecha con flexión de las falanges media y distal del primer y cuarto dedos, con apariencia de mano en garra. No se observaron alteraciones faciales (Figura 1). Ante estos hallazgos se sospechó un posible caso de artrogriposis congénita múltiple 2.
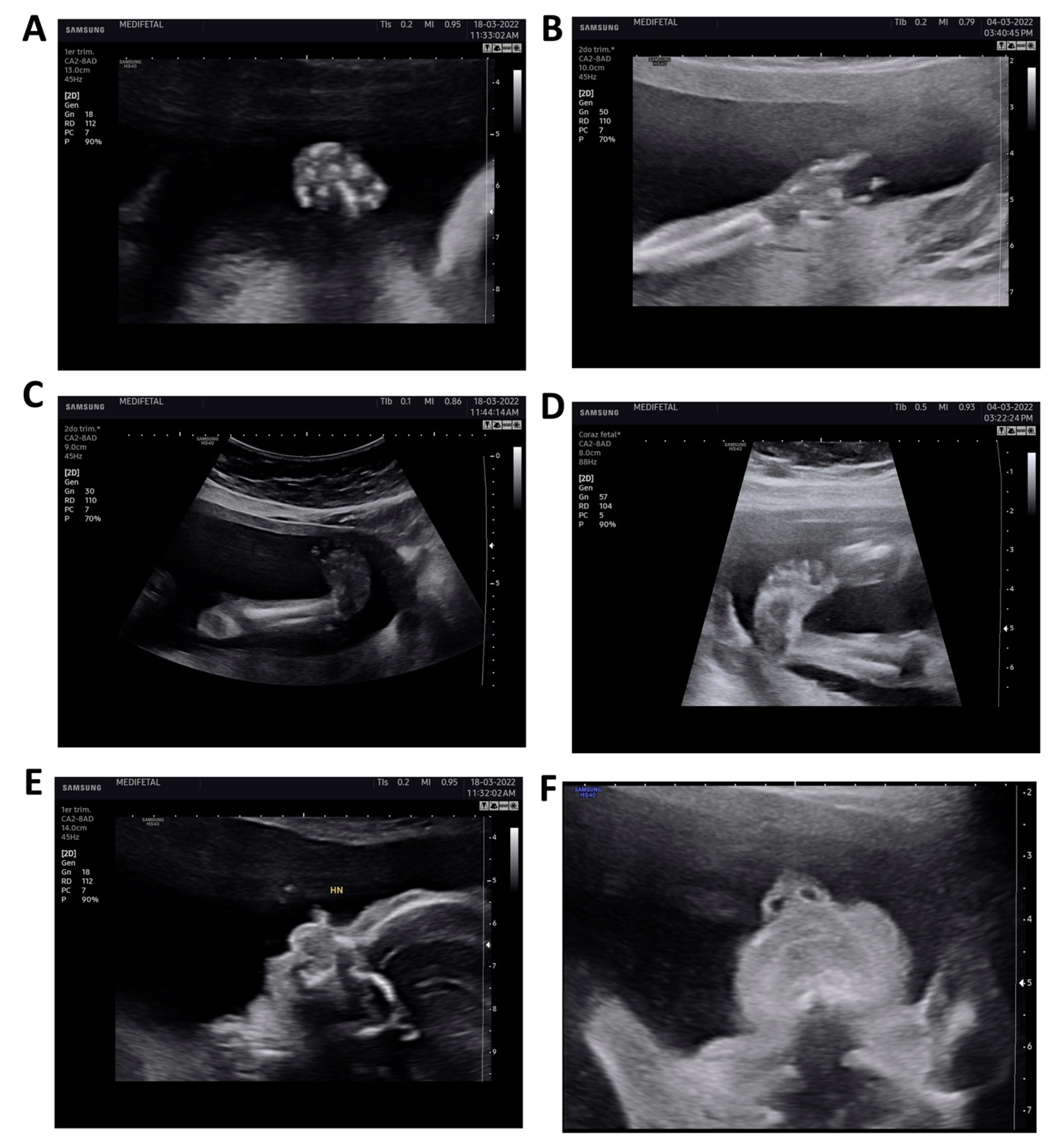
Fuente: archivo del estudio.
Figura 1 Hallazgos de alteraciones anatómicas en ecografía de detalle anatómico 1A y 1B: exploración de extremidades superiores, donde no se evidencian manos en completa extensión, con primer y cuarto dedos de la mano en flexión permanente, que sugiere mano en garra. 1C y 1D: exploración de extremidades inferiores, donde se observa desviación del eje del pie con respecto a los huesos largos de la pierna (tibia y peroné). 1E y 1F: corte medio sagital y corte nariz-boca, que se reportan dentro de límites normales.
Se informaron detalladamente a la pareja los hallazgos ecográficos, el cuadro compatible con artrogriposis fetal, las posibles etiologías y el amplio espectro de síndromes relacionados con este diagnóstico. Se les explicó el procedimiento para la obtención de muestras para estudios genéticos, a lo cual accedieron, por lo cual se procedió a realizar una amniocentesis diagnóstica a las 20 semanas y 6/7 días, para un estudio genético con aproximación de dos pasos. En el primer paso se realizó FISH para el diagnóstico rápido de aneuploidías comunes [que afecta cromosomas 13, 18, 21, X y Y]. En el segundo paso se llevó a cabo un estudio de secuenciación completa del exoma fetal mediante secuenciación de nueva generación (NGS) con plataforma Nexteq (Illumina, Inc. San Diego, CA, EE.UU.). El resultado del FISH no mostró alteración sugestiva de aneuploidías en los cromosomas evaluados. Sin embargo, el análisis de secuenciación completa del exoma fetal reveló una variante clasificada como patogénica en estado heterocigoto en el gen MYH3 (interpretación: NM_002470.3: c.1123G > A, p. Glu375Lys, het, rs121913621 patogénica), relacionada con artrogriposis distal tipo 2A (síndrome de Freeman-Sheldon). Con la identificación de la mutación en el gen MYH3 y los hallazgos ecográficos de deformidades musculoesqueléticas, se llegó al diagnóstico de feto afectado por el síndrome de Freeman-Sheldon.
Posteriormente, se realizó asesoría genética, donde se explicó a los padres que se trataba de un síndrome caracterizado por la presencia de contracturas predominantemente en las extremidades, que podría causar limitaciones motoras por la falta de movilidad de las articulaciones, pero que no era una condición incompatible con la vida. Además, se les informó que en vida prenatal no era posible determinar con certeza la existencia de compromiso en el neurodesarrollo asociado al síndrome, además que no se descartaba el riesgo de que otros órganos como el corazón se vieran afectados, aun cuando no se evidenciaba alteración estructural durante la evaluación ecográfica, debido a la participación de la miosina en la contractilidad. Con la información proporcionada, la pareja decidió solicitar una interrupción voluntaria del embarazo, acogiéndose a la Sentencia C-355 de 2006, en la causal de riesgo para la vida o la salud física, mental o social de la mujer o persona gestante con la continuación del embarazo. A las 24 semanas de gestación, se inició el proceso de maduración cervical para la inducción del parto, logrando nacimiento por vía vaginal sin complicaciones en las siguientes 24 horas. Tras el nacimiento del producto de la gestación sin signos vitales, se documentaron las alteraciones en las extremidades del recién nacido, evidenciando las alteraciones musculoesqueléticas en dos o más áreas corporales, y se confirmó posnatalmente la presencia de artrogriposis (Figura 2). No se realizó autopsia fetal, ya que los padres expresaron su disentimiento. La madre completó 24 horas de vigilancia posparto en la institución, con adecuada evolución y posterior egreso.
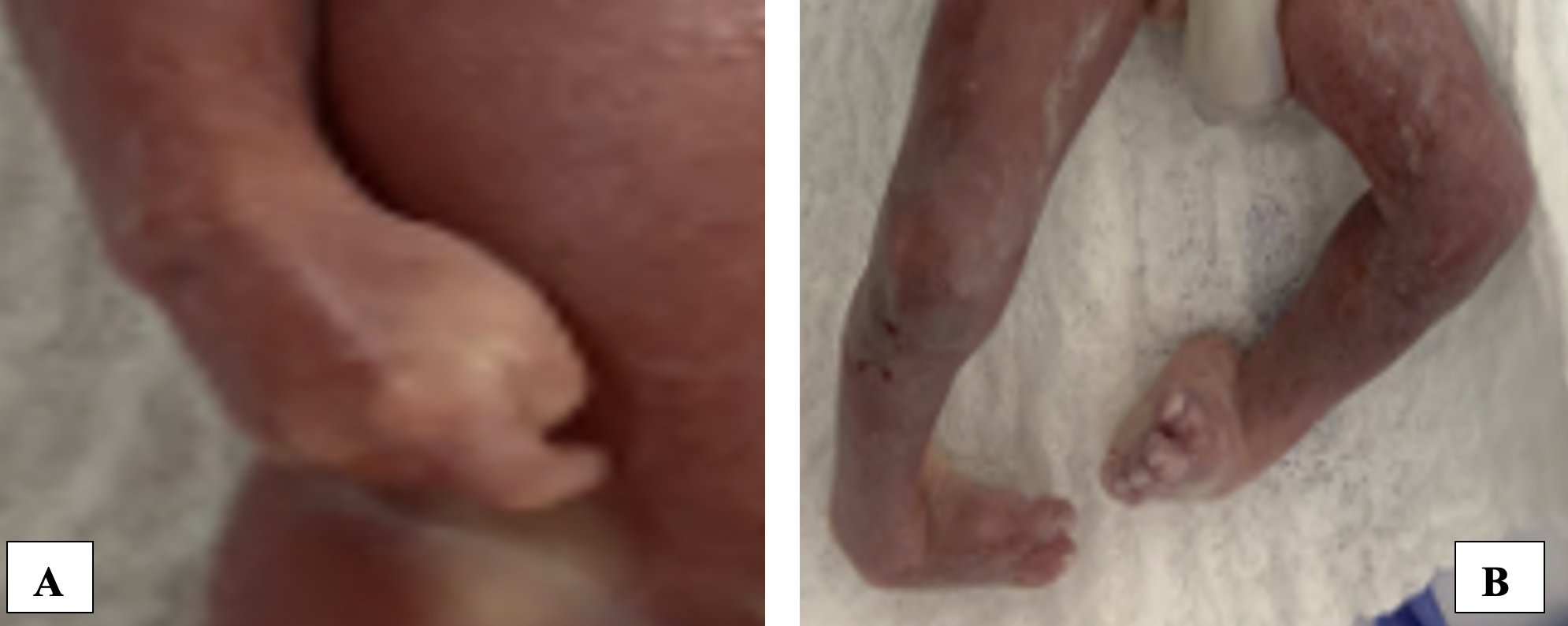
Fuente: archivo del estudio.
Figura 2 Imagen posnatal de extremidades en las que se evidencian alteraciones morfológicas en extremidades. 2A: alteración congénita de la mano derecha consistente en dedos en flexión permanente. 2B: alteración congénita de los pies consistente en pie equino varo bilateral.
Aspectos éticos. Se solicitó autorización a los padres para la publicación del reporte de caso. Se garantizó la confidencialidad de la información y la privacidad de los datos de la paciente. Se cuenta con aval del comité de ética de la institución (Dic. 22, 2023).
DISCUSIÓN
En este informe presentamos un caso de síndrome de Freeman-Sheldon diagnosticado prenatalmente. Durante la exploración ultrasonográfica se observaron deformidades en las extremidades superiores e inferiores del feto, consistentes en contracturas en más de dos áreas corporales, lo que llevó a la sospecha de artrogriposis fetal. Esto, a su vez, llevó a la recomendación de pruebas genéticas, dada la asociación de la artrogriposis con una variedad de síndromes que pueden ser diagnosticados prenatalmente mediante estudios genéticos 4,19; se utilizó la secuenciación completa de exoma fetal, donde se identificó una variante patogénica en estado heterocigoto en el gen MYH3 que codifica para la miosina embrionaria. Consideramos que la identificación de una variante patológica del gen MYH3 en vida prenatal, asociada a las alteraciones estructurales que definen la manifestación de la artrogriposis, apoya el diagnóstico prenatal de síndrome de Freeman-Sheldon realizado en la paciente.
Es relevante destacar que, a la fecha, de los reportes de casos sobre diagnóstico prenatal de síndrome de Freeman-Sheldon en la literatura, solo Antonella Vimercati et al., en 2006, describen la realización de estudios genéticos prenatales (cariotipo), con un resultado no concluyente sobre la causa genética asociada a las alteraciones articulares que documentaron por ultrasonido, aunque descartaron las cromosomopatías comunes [13, 18, 21, X, Y]. Finalmente, el diagnóstico fue confirmado en vida posnatal 10.
Las deformidades estructurales identificadas en vida prenatal, como la artrogriposis, no siempre pueden ser genéticamente diagnosticadas mediante pruebas convencionales como el cariotipo o FISH, que son parte del enfoque inicial en el diagnóstico prenatal genético 20. Hasta un 30 % de los casos de artrogriposis están asociados con alteraciones citogenéticas, incluidas duplicaciones, deleciones, variantes genéticas y alteraciones cromosómicas 7. En este caso, se descartó la asociación de las alteraciones de las articulaciones fetales con cromosomopatías comunes [13, 18, 21, X, Y], mediante el uso de FISH, siguiendo protocolo de enfoque diagnóstico genético prenatal. La secuenciación de nueva generación, y, en particular, la secuenciación completa del exoma fetal, permiten leer aproximadamente el 1 % del genoma, identificando mutaciones en genes que codifican para proteínas relacionadas con alteraciones estructurales 18, siendo útil en el diagnóstico de enfermedades monogénicas 21.
Dentro de las causas genéticas de la artrogriposis se han descrito alteraciones en genes que pueden ser identificados mediante secuenciación del exoma fetal, como es el caso del síndrome de Freeman-Sheldon 22. El diagnóstico prenatal de este síndrome mediante la identificación de mutaciones en el gen MYH3 es de gran relevancia, dada la baja prevalencia de esta patología hereditaria y la escasez de reportes de casos de diagnóstico genético prenatal en la literatura mundial. La posibilidad de identificar prenatalmente la mutación en el gen MYH3, que tiene una gran expresividad entre las semanas 6 y 24 de gestación, permite correlacionar con mayor certeza los hallazgos ecográficos con dicho síndrome 22.
A la fecha, para el diagnóstico genético prenatal puede ser razonable la utilización de diferentes pruebas, como el cariotipo, el FISH o los microarreglos cuando se sospecha su asociación con una cromosopatía común; asimismo, secuenciación de nueva generación, como la secuenciación completa de exoma fetal, en los casos en los que no se logran identificar alteraciones citogenéticas con las pruebas anteriores 2. Lo anterior permite realizar una asesoría a los padres más clara, al contar con la mayor información posible.
La fortaleza de este reporte de caso radica en la confirmación del diagnóstico prenatal ecográfico y genético de una entidad de muy baja prevalencia. Si bien los hallazgos ecográficos sugieren la posible asociación con un síndrome citogenético, la artrogriposis es una característica que se asocia a un número importante de síndromes, lo que dificulta su correlación en vida intrauterina, si no se cuenta con las pruebas genéticas adecuadas para realizar el enfoque y diagnóstico de dichas condiciones.
CONCLUSIONES
La realización de la secuenciación completa de exoma fetal es un factor clave para identificar la mutación del gen MYH3, y confirma en este caso que las deformidades evidenciadas por ultrasonido estaban relacionadas con la artrogriposis distal tipo 2A. Es importante hacer la secuenciación de exoma fetal en fetos que muestren hallazgos de malformaciones articulares en el ultrasonido prenatal.














