Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.64 no.1 Bogotá Jan./Mar. 2016
https://doi.org/10.15446/revfacmed.v64n1.50473
DOI: http://dx.doi.org/10.15446/revfacmed.v64n1.50473
ARTÍCULO DE REVISIÓN
Neurología de la anticipación y sus implicaciones en el deporte
Anticipation neurology and its implications in sports
Juan Felipe Correa-Mesa1, Paula Andrea Álvarez-Peña2
1 Universidad Nacional de Colombia - Facultad de Medicina - Departamento del Movimiento Corporal Humano – Bogotá, D.C. - Colombia.
2 Universidad Nacional de Colombia - Facultad de Medicina - Departamento de Fisioterapia – Bogotá, D.C. - Colombia.
Correspondencia: Juan Felipe Correa-Mesa. Departamento del Movimiento Corporal Humano, Facultad de Medicina, Universidad Nacional de Colombia. Carrera 30 No. 45-03, edificio 471. Teléfono: +57 1 3165000. Bogotá, D.C. Colombia. Correo electrónico: juafcorreames@unal.edu.co.
Recibido: 06/05/2015 Aceptado: 11/06/2015
Resumen
El movimiento es una acción que involucra interconexiones complejas, por lo cual se requiere profundizar en los procesos de adaptación, predicción y anticipación que permiten entender la importancia de estos aspectos desde sus bases filogenéticas y ontogenéticas hasta su implicación en movimientos complejos.
Parte de la optimización de los procesos descritos se haya en la calidad de información aferente, la cual permite la relación con el entorno —especialmente la entrada visual— que reconoce un flujo de imágenes y una proyección al contexto en el que se está inmerso. Las estructuras e interconexiones implicadas en la anticipación y predicción de movimientos son descritas de modo que se evidencia la congruencia y continuidad del flujo de información que caracteriza esta especialidad neuromecánica de movimiento.
Por otro lado, se aborda la integración de centros puntuales del sistema nervioso central y redes neuronales que permiten el entramado de procesos de aprendizaje por observación, además de proveer equilibrio y eficiencia al sistema en la recepción de estímulos y su relación con la generación de eferencias motoras que cumplan con objetivos específicos. En el ámbito deportivo estos procesos favorecen la eficiencia del gesto optimizando el movimiento.
Palabras clave: Rendimiento atlético; Tiempo de reacción; Desempeño psicomotor; Percepción de movimiento; Anticipación psicológica; Neuronas espejo (DeCS).
Correa-Mesa JF, Álvarez-Peña PA. Neurología de la anticipación y sus implicaciones en el deporte. Rev. Fac. Med. 2016;64(1):99-109. Spanish. doi: http://dx.doi.org/10.15446/revfacmed.v64n1.50473.
Summary
Movement involves complex interconnections. It is required to deeply examine the adaptation, prediction and anticipation processes to understand their importance from the phylogenetic and ontogenetic bases, until its involvement in complex movements.
Part of the optimization of these processes is found in the quality of afferent input, which allows the connection with the environment, in particular, the visual input, which recognizes an image stream and a projection to the context in which it is immersed. Those structures and interconnections involved in the anticipation and prediction of movements are described so that the consistency and the constant transfer of information that characterizes this field of neuromechanical movement speciality are evidenced.
In addition, this article addresses the integration of specific centers from the Central Nervous System and the neural networks that allow the network of learning processes by observation, and that also provide balance and efficiency to the system in receiving stimuli and their relationship with the generation of motor efferents that accomplish specific objectives. In sports, these processes favor the gesture efficience optimizing the movement.
Keywords: Mirror Neurons; Athletic Performance; Reaction Time; Psychomotor Performance; Perceptual Motor Performance; Anticipation, Psychological (MeSH).
Correa-Mesa JF, Álvarez-Peña PA. [Anticipation neurology and its implications in sport]. Rev. Fac. Med. 2016;64(1):99-109. Spanish. doi: http://dx.doi.org/10.15446/revfacmed.v64n1.50473.
Introducción
La anticipación es un factor clave para la ganancia de tiempo de reacción y ejecución de movimientos eficientes a nivel deportivo: se entrena con el fin de obtener ventaja respecto al contrincante; lo anterior lleva a la generación de patrones efectivos y un menor gasto energético, que deriva finalmente en la optimización de la praxis y el rendimiento deportivo. Por ende, esta revisión de tema resume la aplicación de la anticipación en el gesto deportivo y las estructuras neurológicas implicadas, de tal manera que se da una explicación, desde la Ciencias Básicas, de lo que ocurre en lapsos tan cortos de tiempo.
Antes de entablar una asociación entre el deporte y la anticipación, se realiza un recorrido teórico de diferentes artículos para definir la anticipación y el origen de esta. En las acciones deportivas los atletas se enfrentan continuamente a pequeños cambios durante la ejecución competitiva o de entrenamiento, lo que exige cambiar la acción motriz que ha sido planeada con anterioridad. Posterior a esto se deben reducir al máximo las variables a las que se está expuesto, acudiendo así a la selectividad de la respuesta, e iniciar la anticipación.
El movimiento animal emerge de la interrelación compleja entre el output desde el cerebro, el input sensorial desde el cuerpo y el entorno, las dinámicas musculares y las dinámicas emergentes de todo el organismo. Desde las interacciones mecánicas complejas entre el objeto y el cuerpo, los sistemas neuronales deben necesariamente contener o tomar ventaja de las propiedades estáticas y dinámicas de los sistemas mecánicos con los cuales ellos interactúan (1). La anticipación en el deporte se define como la capacidad de predecir comportamientos gracias a la percepción y sincronización de interconexiones sinápticas que dan origen a los movimientos con el fin de dar una respuesta rápida después de la realización de un filtrado para las ejecuciones correctas en el momento indicado, sacando provecho en la acción deportiva (2).
La capacidad de anticipar ha sido establecida como una de las mayores habilidades que adquieren los deportistas debido a la sensibilidad de la percepción y la capacidad de captar y procesar información en un tiempo limitado (3).
Las investigaciones realizadas con grupos experimentales y de control han revelado mejoras para el grupo que recibió entrenamiento de la percepción en comparación con los controles, dando como resultado un progreso en las pruebas de laboratorio, con respecto a la anticipación, que muestra una transferencia al trabajo de campo en algunas pero no en todas las actividades mejoradas en el entorno artificial (3). Por lo anterior, la anticipación no solo se debe entrenar en el laboratorio, también se debe hacer en el campo de trabajo con un entorno competitivo enfrentando a sus contrincantes; porque según lo dejado en consenso, los deportistas elites con buena capacidad de anticipación son selectivamente sensibles a la cinemática de los movimientos de su oponente (4). Esto se debe a que, a menudo, los deportistas pueden anticipar el resultado de las acciones sobre la base de la información visual disponible en los movimientos del cuerpo de la otra persona (4). La percepción y el rendimiento son acciones muy cercanas entrelazadas a procesos neurales, p. ej. la velocidad de iniciación de la acción puede ser facilitada por la visualización concurrente de una acción congruente, o puede ser inhibida si una acción incongruente es observada al mismo tiempo como rendimiento (5).
Farrow & Abernethy (6) trataron de fomentar el aprendizaje implícito de habilidades anticipatorias, haciendo que los participantes vieran cintas de vídeo de la acción del servicio de los jugadores de tenis he hicieran juicios acerca de la velocidad y la dirección del saque que estaban observando. Los jugadores con este entrenamiento mostraron una mejoría en la tarea, que no era evidente antes de la investigación. Por lo tanto, las publicaciones demuestran que la anticipación es entrenable, y su utilización tiene como fin compensar los retrasos; esta compensación se da por el sistema sensitivo y motor, los cuales deben ser entrenados debido a que las aferencias envían señales de futuras posiciones corticales, originando así un movimiento antes de la aparición neta del objetivo a alcanzar (7).
Estructuras neurológicas implicadas en la anticipación
Neurológicamente se tienen unas vías lentas y unas rápidas, lo que no quiere decir que las vías lentas no cumplan un papel importante en la anticipación. Los retrasos de las aferencias que dan origen a la anticipación son necesarios, de lo contrario esta no existiría; las vías lentas perfeccionan los patrones que se ejecutan por medio de las vías rápidas, p. ej. la inhibición de los movimientos que no son eficaces, acompañado de cálculos complejos, está a cargo de la corteza prefrontal (7,8). Neurofisiológicamente este fenómeno puede ser explicado debido a que, mientras la información aferente llega a su destino, dichas neuronas van realizando interconexiones más complejas que activan regiones neuronales anticipadas o rápidas para armar un esquema de ejecución motora mientras se da la respuesta (7).
Por lo anterior, se deduce que las vías lentas también compensan a la anticipación y los efectos nocivos de esta; en otras palabras, es una simbiosis que no puede ser tomada como un reflejo (9).
Neurológicamente existen varias estructuras implicadas en la anticipación, una de ellas es el núcleo anterior dorsal del tálamo, el cual tiene la capacidad de anticipar la posición de la cabeza; su mecanismo de acción se da por una integración de copias eferenciales de la señal motora, resultante de las instrucciones de mando para mover la cabeza más la retroalimentación sensorial (10). También se tiene evidencia de que se involucran los núcleos subtalámicos y sus conexiones con la corteza sensoriomotora en la fase temprana de la adaptación visomotora, más generalmente para el papel de los núcleos subtalámicos y sus conexiones en la monitorización y evaluación de errores de movimiento y sus subsecuentes ajustes motores (11). El flujo de información entre estos sitios cambia durante la adaptación.
Con la dirección de los núcleos subtalámicos a las áreas corticales sensoriomotoras se da un incremento cuando se cometen grandes errores de movimiento, estos son contextualmente relevantes en la medida en que proporcionan información que puede utilizarse para optimizar los movimientos posteriores (11). Se sugiere que las células intraparietales actúan en la anticipación visual según estudios realizados en monos (6). Las células intraparietales son activadas mediante estímulos provenientes de la corteza prefrontal lateral (8) y se sabe que esta última actúa en la inhibición del movimiento que no es necesario (7,8); por consiguiente, se puede encontrar una estrecha relación entre el córtex parietal y el córtex prefrontal en la anticipación. Estas estructuras encargadas de la anticipación buscan la compensación de las entradas visuales que por naturaleza son lentas, aun así, esta compensación se da por vías diagonales anticipatorias (12), como se explicará más adelante.
La información baja a los centros inferiores como motoneuronas una vez la anticipación esté integrada en los centros superiores —esto quiere decir que la anticipación se construye justo antes del origen del movimiento— (13). Posterior a la respuesta anticipatoria, en la tarea motriz se realiza una retroalimentación y por ultimo un aprendizaje motriz por medio de incorporación de sentidos kinestésicos o propioceptivos (14), esto con el fin de realizar monitorizaciones inmediatas de futuras predicciones para un mejor control anticipatorio.
Por lo visto, las predicciones no son solo motoras y sensitivas, también son propioceptivas; estas últimas están a cargo de la corteza motora primaria y se construyen a base de experiencias por medio del feedback debido al funcionamiento cerebral basado en modelos internos que siguen principios bayesianos (15,16). Esto quiere decir que a medida que llega la información el cerebro la va adaptando, combinándola con una previa distribución de probabilidades y niveles de incertidumbre con respecto a la retroalimentación sensorial. Por lo anterior, la corteza motora envía señales de las predicciones de las consecuencias sensoriales del movimiento (15-18). Esta información predictiva es dada por una copia eferencial hacia la corteza sensitiva o al cerebelo con el fin de realizar las predicciones. La copia eferencial se refiere a una duplicación de las órdenes motoras que realiza la predicción antes de la ejecución del movimiento (19). La respuesta de retroalimentación de error dentro del movimiento se desplaza anterior en el tiempo para producir una respuesta predictiva (20).
Por consiguiente, las anticipaciones se construyen sobre la base de los aportes sensoriales esperados, que son entradas instantáneas no reales disponibles para el sistema nervioso central (9); a la vez, el movimiento cortical codifica continuamente la velocidad de imagen para que pueda ser utilizado en la predicción de futuros patrones de entrada sensorial a lo largo del trazado de movimiento. Este aspecto estaría dado por el sistema visual humano, por lo cual los objetivos pueden ser detectados más fácilmente, fortalecido además por cambios inducidos por el movimiento en la posición espacial (21). Las entradas sensoriales son de gran importancia para la anticipación, sobre todo en la función visual que proporciona aferencias para el estímulo de la cadena de conexiones para dar inicio a la anticipación (22). Por consiguiente, se debe profundizar en la percepción visual para entender cómo se estimulan las vías de la anticipación, principalmente en el ámbito deportivo.
La percepción visual ha sido estudiada desde varios puntos de vista, pero principalmente se identifican dos: el campo constructivista y el campo ecológico; el primero sustenta que la percepción de los objetos visuales como el tamaño, la forma, la orientación, etc. se basan en una aferencia estática en donde los observadores son tratados como observadores pasivos con el fin de construir representaciones cognitivas de los objetos perceptuales y el segundo construye la percepción a través de los eventos y las acciones que utilizan la información del flujo óptico, que se genera por movimientos en la interacción entre el observador y el medio ambiente. La información del flujo óptico está contenida en el sistema de observación con el medio, la detección y el uso de la información. La interacción de los procesos de movimientos y el flujo óptico son provenientes de la corteza intraparietal y las neuronas temporales superiores (23-25).
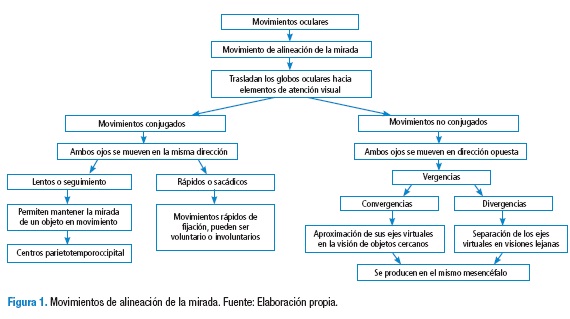
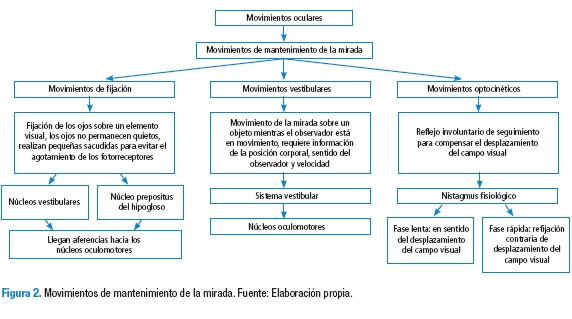
El flujo óptico se define como la información recibida de nuestro propio movimiento y sobre la estructura del medio ambiente en que nos estamos moviendo; en consecuencia, es el patrón de movimientos presentes en los objetos en una escena causada por el movimiento relativo entre un observador y la escena (23). Las aplicaciones del flujo óptico son: la detección del movimiento, la segmentación de objetos, el enfoque de cálculo de expansiones y la codificación del movimiento compensado (25). Esta información del flujo se dirige hacia la corteza temporal superior y la corteza intraparietal con el fin de enviar eferencias hacia los núcleos vestibulares para generar comandos premotores de los movimientos corporales y optocinéticos (26). El movimiento optocinético hace parte de los movimientos oculares de mantenimiento de la mirada, que junto con estructuras del SNC aportan proyecciones importantes para la anticipación (27) (Figura 1 y 2).
Las neuronas espejo y su función en la anticipación
Otras estructuras del sistema nervioso central que están involucradas en la anticipación son las neuronas espejo, estas son un conjunto de células que realizan una cartografía de las representaciones perceptuales de la acción observada a las representaciones del repertorio motor propio de la observación de la acción (28). Las neuronas espejo juegan un papel importante en el comportamiento de la imitación humana y se activan cuando una persona observa una acción realizada por otra persona, a pesar de que la primera no esté realizando la actividad. Estas neuronas envían señales de imitación que son percibidas sensorialmente por el observador, por ende este sistema identifica la complejidad de la acción de una manera inconsciente (29).
Las neuronas espejo se encuentran en la corteza parietal (30), también se han encontrado en la corteza premotora y en la circunvolución frontal inferior (31). Los estudios sugieren que, además de imitación, tienen un mecanismo de notas o mapas mentales de los diferentes comportamientos para lograr un aprendizaje motor por medio del ensayo-error (32). Lo que indica que estas células se utilizan para aprender desde los primeros pasos básicos del movimiento (33).
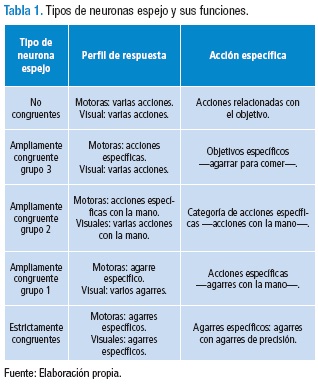
Existen diferentes tipos de neuronas espejo con funciones más específicas en diferentes situaciones como se muestra en la Tabla 1 (34).
Las neuronas espejo en un deportista, para realizar una anticipación, inician con la copia de un sistema motor del oponente, por ende cuando el deportista se pone en el lugar del contrincante ejerce una predicción de su gesto deportivo, y antes de tiempo empieza a realizar una anticipación debido a la adquisición de estímulos de información sobre lo que el contendiente va a realizar, pero lo anterior se efectúa después de tener una alta trayectoria en el deporte específico (35,36).
Las vías diagonales de la anticipación en el gesto deportivo
Los retrasos neuronales siempre están presentes en los cálculos asociados con la función del cerebro, si estas demoras no se compensan la agilidad que requiere la acción será ineficiente (12). Del mismo modo, si no se produce una compensación en las vías sensoriales, tanto de sincronización como de compensación, no existirá un patrón motriz óptimo, p. ej. la vía de la visión al transmitir estímulos de percepción dependientes del tiempo, tales como un estímulo en movimiento, arrancará significativamente detrás de la posición verdadera (22). Por lo tanto, los sistemas neuronales requieren mecanismos de compensación para los retrasos del tiempo.
Una estrategia para lograr la compensación por los sistemas neurales es el uso de la información antes de recibir un estímulo en movimiento para predecir su posición futura, de manera que la tardanza de la transmisión sea cancelada o compensada (37); debido a esto, el planteamiento de una trayectoria diagonal es probable que se adopte a la hora de la ejecución de una anticipación sobre la base de la predicción. El sistema neural selecciona dinámicamente una ruta, la cual envía la señal neural directamente a la posición futura del estímulo en movimiento codificada en la corteza; esta estrategia no podría haber sido adoptada por el sistema nervioso si los retrasos no pudieran ser compensados. De igual forma, existe una íntima relación entre los cálculos que implican demoras y los cálculos que compensan esos retrasos (7).
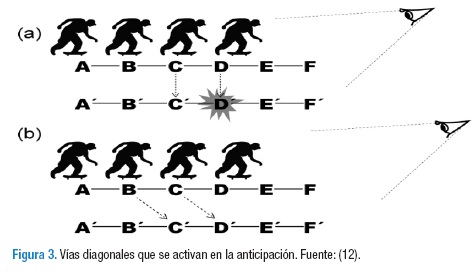
Para compensar el retraso visual, el sistema nervioso utiliza una compensación por medio de unas vías diagonales que se explican en la Figura 3: en la fila (a) aparece la comunicación entre neuronas A con A' y B con B' hasta D, mientras que en la vía diagonal (b) las neuronas tienen una comunicación horizontal o en diagonal con el fin de predecir una acción, esta sinapsis neuronal se da A con B', B con C' y predice a D' mediante la estimulación de C (12). Estas vías diagonales no solo ahorran tiempo por su tipo de conexión, también lo hacen por su comportamiento eléctrico; esto es debido a que las neuronas encargadas de la anticipación son más sensibles a los estímulos externos que otras neuronas, por consiguiente su velocidad de respuesta emula la realidad antes de que esta se procese en el encéfalo (9).
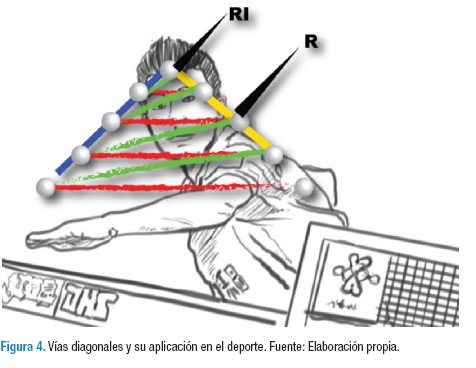
Estas vías se aplican de igual forma en el gesto deportivo: en la Figura 4 se describe a un tenimesista que observa la bola real que está señalada con la letra R; un atleta de este deporte de alto nivel logra la anticipación por medio de las vías diagonales. En realidad él no puede esperar a que la bola llegue a su punto más alto para contactarla, ya que si lo hace de esa forma la bola ya habrá iniciado su descenso en el momento del contacto, por lo tanto lo más probable es que falle o no se ejecute el golpe como se tenía planeado por el retraso visual (38); por lo anterior, el tenimesista anticipa cuál es el punto más alto en que la bola va a estar para dirigir la raqueta hacia ese lugar sin que esta haya llegado, y así se logre encontrar tanto la bola como la raqueta en el punto RI (9). Un tenimesista inexperto no anticipa, sino que utiliza las vías lentas para golpear la bola; esta vía está señalada con las líneas rojas, dando como resultado el no compacto de la bola en el punto RI. En contraposición, los deportistas de alto rendimiento logran la utilización de las vías diagonales como se explicaron en la Figura 3, y como se muestran en la Figura 4 con las líneas verdes. Por medio de estas vías diagonales se logra anticipar e impactar la bola en el punto RI, de modo que el gesto pueda surgir con un rango de error mínimo (9,38).
Vías de la anticipación
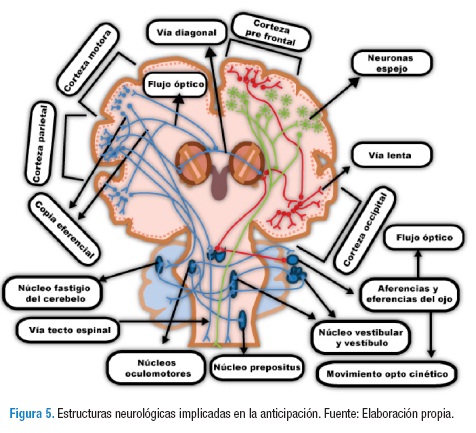
No son solo las vías diagonales las que actúan en la anticipación, también se involucran otras estructuras que funcionan durante el gesto deportivo anticipado como se explica en la Figura 4; no siempre ocurren exactamente en la dirección como se mencionará. En realidad es un contenido funcional que actúa como un todo aunque para un mejor entendimiento se explicará de una manera secuencial en la Figura 5.
Las vías de color rojo representan la vía lenta. Sin tener que realizar una anticipación, la visión entra por el nervio óptico alcanzando el colículo superior y posteriormente el geniculado lateral activando la corteza prefrontal para dar órdenes de acuerdo al entorno e ir a la corteza occipital y procesar la información posteriormente. La vía lenta perfecciona los patrones que se están ejecutando en las vías de anticipación, por ende no se puede decir que la vía lenta no tiene un papel importante en la anticipación, por el contrario minimiza los efectos nocivos de la misma (39).
Mientras la información llega a su destino, se van realizando interconexiones complejas que actúan en regiones neuronales encargadas de la anticipación con el fin de tomar un esquema como respuesta. A partir de estas interconexiones se origina la vía rápida, que por medio de las vías aferenciales de la visión, desde el núcleo geniculado lateral, activa a las neuronas en espejo y a otros núcleos talámicos encargados de la anticipación de la cabeza y el tronco (10,30-32).
La corteza parietal y temporal, mediante la estimulación del flujo óptico, envían eferencias hacia el cerebelo, propiamente al núcleo fastigial, que se comunica de manera recíproca con los núcleos vestibulares; posteriormente se comunica con los núcleos oculomonotores para finalizar con movimientos optocinéticos, con el fin de seguir el campo visual y realizar una predicción por medio de la estimulación de las neuronas diagonales, estas últimas estimulan la corteza premotora para enviar información a la corteza motora primaria con el fin de realizar una predicción propioceptiva; también realizan una copia eferencial al cerebelo y a la corteza intraparietal creando aferencias no reales para la próxima ejecución de predicción y anticipación (8,23,27,40).
Timing interno y el sistema olivo-cerebeloso en la anticipación
La amplitud de la función del cerebelo es algo sorprendente en vista de la simplicidad y homogeneidad de la corteza cerebelosa, que se compone de pocos tipos de células que están conectados de una manera ordenada. Esta estructura bastante simple se ha conservado a pesar de la evolución, aunque el propio cerebelo se ha expandido y ha adquirido nuevas funciones (41,42). Puesto que las propiedades anatómicas y fisiológicas de un circuito definen sus capacidades computacionales, los circuitos corticales básicos realizan el mismo cálculo en las distintas áreas del cerebelo, así como a través de diferentes especies. Por lo tanto, se debe buscar un tema, un denominador común para todas las funciones del cerebelo (43).
El mayor rol en el control motor está adscrito al cerebelo, especialmente durante la adquisición de habilidades motoras, y está soportado por sus proyecciones a la corteza motora primaria y la corteza pre-motora (44). Por la influencia de estas estructuras corticales motoras el cerebelo es conocido como el control de la velocidad y la regularidad del movimiento, esto es, la organización temporal de los comportamientos motores. Relacionado con esta función de temporización, se ha sostenido que se requiere el cerebelo en las situaciones que requieran alta agudeza temporal en general (44).
El concepto de timing, o de predicción de eventos relacionados con el tiempo, se puede reconocer fácilmente en casi todas las diferentes funciones que se atribuyen al cerebelo.
Numerosos modelos del cerebelo se ocupan de diferentes aspectos del timing, algunos se centran en el sistema paralelo de fibras que transmite información a las células de Purkinje a lo largo de su trayectoria a una cierta velocidad de conducción (43).
Pero, ¿cómo se logra la activación de lugares tan específicos para la predicción, y cómo estas activaciones logran las sinapsis en tan corto tiempo con un alto sincronismo? Esto se debe a que filogenéticamente la anticipación ha estado presente desde el inicio del movimiento voluntario (9); lo que sugiere que la predicción es vital para moverse eficientemente. Se debe realizar una organización pulsátil del cerebro para ejecutar sus eferencias de una manera eficaz y para lograr procesar toda la información percibida del exterior; esto con el fin de disminuir la carga aferencial y mantener el control de todos los estímulos provenientes del entorno, de modo que las cosas ocurran a intervalos discretos de tiempo y se logre así una coherencia temporal de neuronas independientes para asegurar una respuesta uniforme. Llinás (9) afirma que se trata de un marcapasos para sintonizar las actividades neuronales.
Durante las sincronizaciones de disparos se generan estímulos que logran activar sinergias —activación temporal y organizada de un grupo de colectivos musculares— en vez de músculos individuales, disminuyendo la carga computacional y aumentando la velocidad de respuesta motora (9). Gracias a que los estímulos actúan mediante sinergias, el movimiento complejo del sistema motor puede reconfigurarse dinámicamente ofreciendo una flexibilidad y estabilidad ante la ejecución de una tarea (45). Un ejemplo de sinergias fue estudiado en la simulación del pedaleo en ciclismo, de allí se han identificado seis sinergias musculares. Cuando la cadencia del pedaleo aumenta se genera una respuesta común entre los músculos evaluados en la EMG —Electromiografía— para avanzar en el tiempo, relativamente anterior, dentro de cada ciclo de pedaleo; esto se debe a que el retraso electromecánico representa una fracción cada vez mayor de la duración del ciclo en mayores tasas de pedaleo (46).
¿Pero cómo se producen estos disparos para establecer la ejecución de sinergias organizadas? Hoy en día se sabe que las neuronas disparan sus potenciales de acción de manera rítmica a cargo de la oliva inferior, recibiendo el nombre de disparos auto generativos (47-50). Este nombre es otorgado debido a que los cuerpos neuronales de la oliva inferior no necesitan de estímulos para iniciar su potencial de acción y su natural oscilación puede solo ser detectada cuando es considerada toda una población de células de Purkinje. Estas oscilaciones subumbrales sincronizadas y el complejo resultado del pico de ritmo en un ensamble de células de Purkinje pueden potencializar la entrega como un mecanismo de timing que genera patrones temporales precisos. —the olivocerebellar system as a generator of temporal patterns— (43). Por medio de la intercomunicación cerebelo-oliva inferior se da comienzo a la señal de tiempo que controla el timing interno, originando el temblor fisiológico que sincroniza los movimientos (40).
El temblor fisiológico es una señal compleja resultante de interacciones entre varios factores mecánicos y neurales. Este contiene diferentes componentes que pueden ser caracterizados por la presencia de distintas unidades de frecuencias en un espectro estimado de una señal de temblor, los cuales se pueden caracterizar en dos tipos: el primero es dado a la frecuencia resonante natural de un segmento corporal y es sensible a la carga inercial, con el aumento de la carga disminuye la frecuencia resonante, y el segundo es carga-dependiente y es también considerado por tener un origen neuronal central. Los pares de unidades motoras registrados en los músculos activos durante las contracciones voluntarias mantenidas en los seres humanos muestran una tendencia al disparo sincronizado, que está pensado para reflejar la presencia de un input común presináptico a la agrupación de motoneuronas (51).
El temblor fisiológico no es homogéneo, la existencia de un temblor fisiológico con un pico de frecuencia de 7-12Hz es determinado, por ejemplo, durante las contracciones posturales de la extensión de las manos. Un temblor de similar frecuencia ha sido identificado durante movimientos lentos de los miembros superiores y ha sido clasificado como temblor cinético (52).
Como se observa, el timing es un sistema que temporalmente es pulsátil y especialmente puede reorganizarse rápida y dinámicamente (9). Se pueden realizar las predicciones temporales gracias a estos cálculos de segmentos de tiempo bien definidos, ya que estas neuronas de la oliva dan una coherencia en el tiempo para actuar de manera coordinada (40,50).
Se debe dejar claro que a pesar de todos los mecanismos mencionados que hacen a la anticipación una excelente capacidad, esta siempre maneja un rango de error (53,54), ya que se ha formado necesariamente para la supervivencia y no para la supravivencia. Este es un sistema que está incluido en los animales para sus necesidades fisiológicas: condicionalmente, por medio de estas predicciones logran estrategias de protección, ahorran energía y mejoran la eficiencia del movimiento; es un mecanismo natural que, aunque se entrene, se logra mejorar más no perfeccionar, ya que por medio de la preparación constante no se alcanzan a cambiar años de evolución (39).
Conclusiones
Por ahora se puede concluir que la anticipación describe contribuciones esperadas que se construyen bajo entradas instantáneas no reales, pero disponibles en el sistema nervioso, y que es un sistema complejo tanto desde su definición como desde su funcionamiento y estructura. Por medio de la anticipación se logra un mejor entendimiento de la neurociencia, ya que se integran los conocimientos sobre las comunicaciones más novedosas que se tienen en los estudios del movimiento.
La importancia de conocer la acción de este sistema es la generación de investigación que permita desarrollar prototipos de entrenamientos y ejercicios que mejoren este mecanismo por medio de la realidad virtual o en campo real; además de estimularlo con tecnología o ejercicios simples en la rehabilitación de personas que sufran lesiones encefálicas que afecten estructuras implicadas en la anticipación.
Si se tiene en cuenta la anticipación como un mecanismo necesario para el ser humano desde su evolución filogenética y ontogenética, se logrará una mirada más holística del movimiento corporal humano, tanto para su recuperación como para su potencialización.
Conflicto de intereses
Ninguno declarado por los autores.
Financiación
Ninguna declarada por los autores.
Agradecimientos
Ninguno declarado por los autores.
Referencias
1. Nishikawa K, Biewener AA, Aerts P, Ahn AN, Chiel HJ, Daley MM, et al. Neuromechanics: an integrative approach for understanding motor control. Integr. Comp. Biol. 2007;47(1):16-54. http://doi.org/cnvptf. [ Links ]
2. Hernández H, Oña A, Bilbao A, Ureña A, Bolaños J. Efecto de la aplicación de un sistema automatizado de proyección de preíndices para la mejora de la capacidad de anticipación en jugadoras de voleibol. Revista de Psicología del Deporte. 2011;20(2):551-72. [ Links ]
3. Abernethy B, Schorer J, Jackson RC, Hagemann N. Perceptual training methods compared: the relative efficacy of different approaches to enhancing sport-specific anticipation. J. Exp. Psychol. Appl. 2012;18(2):143-53. http://doi.org/bb57. [ Links ]
4. Díaz GJ, Fajen BR, Phyllips F. Anticipation from biological motion: the goalkeeper problem. J. Exp. Psychol. Hum. Percept. Perform. 2012;38(4):848-64. http://doi.org/bb58. [ Links ]
5. Stanley J, Gowen E, Miall C. How instructions modify perception: An fMRI study investigating brain areas involved in attributing human agency. Neuroimage. 2010;52(1):389-400. http://doi.org/fkbrhg. [ Links ]
6. Farrow D, Abernethy B. Can anticipatory skills be learned through implicit video-based perceptual training? J. Sports Sci. 2002;20(6):471-85. http://doi.org/cgkn3f. [ Links ]
7. Nijhawan R, Wu S. Compensating time delays with neural predictions: are predictions sensory or motor? Philos. Trans. A Math. Phys. Eng. Sci. 2009;367:1063-78. http://doi.org/fk7jmp. [ Links ]
8. Krämer UM, Solbakk AK, Funderud I, Lovstad M, Endestad T, Knight RT. The role of the lateral prefrontal cortex in inhibitory motor control. Cortex. 2013;49(3):837-49. http://doi.org/bb59. [ Links ]
9. Llinás RR. El cerebro y el mito del yo: el papel de las neuronas en el pensamiento y el comportamiento humanos. Bogotá, D.C.: Grupo Editorial Norma; 2003. [ Links ]
10. Bassett JP, Zugaro MB, Muir GM, Golob EJ, Muller RU, Taube JS. Passive movements of the head do not abolish anticipatory firing properties of head direction cells. J. Neurophysiol. 2005;93(3):1304-16. http://doi.org/ck44p2. [ Links ]
11. Tan H, Zavala B, Pogosyan A, Ashkan K, Zrinzo L, Foltynie T, et al. Human subthalamic nucleus in movement error detection and its evaluation during visuomotor adaptation. J. Neurosci. 2014;34(50):16744-54. http://doi.org/bb6n. [ Links ]
12. Nijhawan R. The flash-lag phenomenon: objecto motion and eye movements. Perception. 2001;30(3):263-82. http://doi.org/b49x6s. [ Links ]
13. Desantis A, Roussel C, Waszak F. The temporal dynamics of the perceptual consequences of action-effect prediction. Cognition. 2014;132(3):243-50. http://doi.org/bb6p. [ Links ]
14. Ros T, Munneke MA, Parkinson LA, Gruzelier JH. Neurofeedback facilitation of implicit motor learning. Biol. Psychology. 2014;95:54-8. http://doi.org/bb6q. [ Links ]
15. Shi Z, Church RM, Meck WH. Bayesian optimization of time perception. Trends. Cogn. Sci. 2013;17(11):556-64. http://doi.org/bb6r. [ Links ]
16. Jiang J, Heller K, Egner T. Bayesian modeling of flexible cognitive control. Neurosci. Biobehav. Rev. 2014;46(Pt 1):30-43. http://doi.org/bb6s. [ Links ]
17. Kording KP. Bayesian statistics: relevant for the brain? Curr. Opin. Neurobiol. 2014;25:130-33. http://doi.org/bb6t. [ Links ]
18. Montagnini A, Mamassian P, Perrinet L, Castet E, Masson GS. Bayesian modeling of dynamic motion integration. J. Physiol. Paris. 2007; 101: 64-77. [ Links ]
19. Gandolla M, Ferrante S, Molteni F, Guanziroli E, Frattini T, Martegani A, et al. Re-thinking the role of motor cortex: context-sensitive motor outputs? Neuroimage. 2014;1(91):366-74. http://doi.org/bb6v. [ Links ]
20. Herzfeld D, Pastor D, Haith A, Rossetti Y, Shadmehr R, O'Shea J. Contributions of the cerebellum and the motro cortez to acquisition and retention of motor memories. Neuroimage. 2014;98:147-58. http://doi.org/bb6w. [ Links ]
21. Roach NW, McGraw PV, Johnston A. Visual Motion Induces a Forward Prediction of Spatial Pattern. Curr. Biol. 2011;21(9):740-45. http://doi.org/cv9v4w. [ Links ]
22. Wu Y, Zeng Y, Zhang L, Wang S, Wang D, Tan X, et al. The role of visual perception in action anticipation in basketball athletes. Neuroscience. 2013;237:29-41. http://doi.org/bb6x. [ Links ]
23. Page WK, Duffy CJ. Cortical Neuronal Responses to Optic Flow Are Shaped by Visual Strategies for Steering. Cereb. Cortex. 2008;18(4):727-39. http://doi.org/csbtqb. [ Links ]
24. Pan JS, Bingham N, Bingham GP. Embodied Memory: Effective and Stable Perception By Combining Optic Flow and Image Structure. J. Exp. Psychol. Hum. Percept. Perform. 2013;39(6):1638-51. http://doi.org/bb6z. [ Links ]
25. Durant S, Zanker JM. Variation in the local motion statistics of Real-life optic flow scenes. Neural. Comput. 2012;24(7):1781-805. http://doi.org/bb62. [ Links ]
26. Cullen KE. The vestibular system: multimodal integration and encoding of self-motion for motor control. Trends Neusoci. 2012;35(3):185-96. http://doi.org/fzkp4f. [ Links ]
27. Galán-Terraza A, Visa-Nasarre J. Diplopía: manual práctico con vídeos demostrativos. Barcelona: Glosa; 2005. [ Links ]
28. Nakahara K, Miyashita Y. Neuroscience. Understaning intentions: through the looking glass. Science. 2005;308(5722):644-45. http://doi.org/dts8v9. [ Links ]
29. Maeda F, Kleiner-Fisman G, Pascual-Leone A. Motor facilitation while observing hand actions: specificity of the effect and role of observer's orientation. J. Neurophysiol. 2002;87(3):1329-335. [ Links ]
30. Lacoboni M, Dapretto M. The mirror neuron system and the consequences of its dysfunction. Nat. Rev. Neurosci. 2006;7(12):942-51. http://doi.org/fm3nrn. [ Links ]
31. Michielsen ME, Smits M, Ribbers GM, Stam HJ, Van Der Geest JN, Bussmann JB, et al. The neuronal correlates of mirror therapy: an fMRI study on mirror induced visual illusions in patients with stroke. J. Neurol. Neurosurg. Psychiatry. 2011;82(4):393-8. http://doi.org/dn3t9z. [ Links ]
32. Martineau J, Andersson F, Barhélémy C, Cotier JP, Destrieux C. Atypical activation of the mirror neuron system during perception of hand motion in autism. Brain Res. 2010;1320:168-75. http://doi.org/dsdt7h. [ Links ]
33. Carvalho D, Teixeira S, Lucas M, Yuan TF, Chaves F, Peressutti C, et al. The mirror neuron system in post-stroke rehabilitation. Int. Arch. Med. 2013;6(1):41. http://doi.org/bb63. [ Links ]
34. Uithol S, van Rooij I, Bekkering H, Haselager P. What do mirror neurons mirror? Philos. Psychol. 2011;24(5):607-23. http://doi.org/dncvx5. [ Links ]
35. Lago-Rodriguez A, López-Alonso V, Fernández-del-Olmo M. Mirror neuron system and observational learning: behavioral and neurophysiological evidence. Behav. Brain Res. 2013;248:104-13. http://doi.org/bb64. [ Links ]
36. Kang H, Tsuda I. Dynamical analysis on duplicating-and-assimilating process: toward the understanding of mirror-neuron systems. J. Integr. Neurosci. 2012;11(4):363-84. http://doi.org/bb65. [ Links ]
37. Danion F, Latash M. Motor Control: Theories, Experiments, and Applications. New York: Oxford University Press; 2010. [ Links ]
38. Gross B, Schlager W. Table tennis tips from a world champion. Aachen: Meyer & Meyer Sport; 2011. [ Links ]
39. Correa J, Muñoz D. Vías de la emoción y la inhibición de la neocorteza cerebral. CES Movimiento y Salud. 2013;1(1):52:60. [ Links ]
40. Llinás RR. Cerebellar motor learning versus cerebellar motor timing: the climbing fibre story. J. Physiol. 2011; 589(Pt 14):3423-32. http://doi.org/fh7s6b. [ Links ]
41. Snell R. Neuroanatomía clínica. 7th ed. Buenos Aires: Editorial Médica Panamericana; 2007. [ Links ]
42. Bustamante B. Neuroanatomía funcional y clínica: atlas del sistema nervioso central. 4th ed. Bogotá, D.C.: Editorial Médica Celsus; 2007. [ Links ]
43. Yarom Y, Cohen D. The olivocerebellar system as a generator of temporal patterns. Ann. N.Y. Acad. Sci. 2002;978:122-34. http://doi.org/crch62. [ Links ]
44. Raab M, Johnson J, Heekeren H. Mind and motion: the bidirectional link between thought and action. Amsterdam: Elsevier; 2009. [ Links ]
45. Latash ML. Synergy. New York: Oxfort University Press; 2008. [ Links ]
46. Wakeling J, Horn T. Neuromechanics of muscle synergies during cycling. J. Neurophysiol. 2009;101(2):843-54. http://doi.org/cjnckm. [ Links ]
47. Tokuda IT, Hoang H, Scheweighofer N, Kawato M. Adaptive coupling of inferior olive neurons in cerebellar learning. Neural Netw. 2013;47:42-50. http://doi.org/bb66. [ Links ]
48. De Gruijl JR, Hoogland TM, De Zeeuw CI. Behavioral correlates of complex spike synchrony in cerebellar microzones. J. Neurosci. 2014;34(27): 8937-47. http://doi.org/bb67. [ Links ]
49. Van Der Giessen RS, Koekkoek SK, van Dorp S, De gruijl JR, Cupido A, Khosrovani S, et al. Role of olivary electrical coupling in cerebellar motor learning. Neuron. 2008;58(4):599-612. http://doi.org/fd9dd7. [ Links ]
50. Scheweighofer N, Lang EJ, Kawato M. Role of the olivo-cerebellar complex in motor learning and control. Front. Neural circuits. 2013;7:94. http://doi.org/bb68. [ Links ]
51. Halliday DM, Conway BA, Farmer SF, Roserberg JR. Load-independent contributions from motor-unit synchronization to human physiological tremor. J. Neurophysiol. 1999;82(2):664-75. [ Links ]
52. Mehta AR, Brittain JS, Brown P. The Selective Influence of Rhythmic Cortical versus Cerebellar Transcranial Stimulation on Human Physiological Tremor. J. Neurosci. 2014;34(22):7501-8. http://doi.org/bb69. [ Links ]
53. Knapen T, Kanai R, Branscamp J, van Boxtel J, van Ee R. Distance in feature space determines exclusivity in visual rivalry. Vision Res. 2007;47(26):3269-75. http://doi.org/ds84qr. [ Links ]
54. Alvis Gómez K, Pulzara Tiara A. Discriminación auditiva, exploración visual y desarrollo del esquema corporal y espacial en tenistas y no practicantes de deporte. Rev. Fac. Med. 2013;61(4):395-403. [ Links ]