Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.41 no.2 Bogotá July/Dec. 2015
Identificación de morfotipos de Empoasca spp. (Hemiptera: Cicadellidae) en agro-ecosistemas de ñame y yuca (Sucre, Colombia)
Identification of morphotypes of Empoasca spp. (Hemiptera: Cicadellidae) in yam and cassava agro-ecosystems (Sucre, Colombia)
WENDY ARROYO P.1, ANTONIO PÉREZ-H.2, JUAN DÍAZ-SOTO3 y JAVIER BELTRÁN H.4
1 Bióloga énfasis en Biotecnología. Universidad de Sucre. weyoarpe06@gmail.com.
2 Docente. M. Sc. Entomología. Universidad de Sucre. anperezh008@gmail.com.
3 Docente. M. Sc. Ciencias énfasis en Recursos Fitogenéticos Neotropicales. Laboratorio de Biotecnología, Universidad de Sucre, Carrera 28 # 5-267, Sincelejo-Colombia. juan.diaz@unisucre.edu.co. Autor para correspondencia.
4 Docente. Ph. D. Fitopatología. Universidad de Sucre. javier.beltran@unisucre.edu.co.
Resumen: El género Empoasca de amplia importancia económica, presenta dificultad en su identificación taxonómica, debido a la existencia de caracteres externos muy similares entre las especies. Con el fin de establecer diferencias en una muestra de cicadélidos colectados en cultivos de yuca y ñame (en el departamento de Sucre, Colombia), se caracterizaron morfológicamente individuos en cinco morfotipos a partir de sus estructuras reproductivas utilizando seis características de la genitalia y mediante RAPD utilizando seis cebadores. Los resultados de la caracterización molecular indican que de seis cebadores utilizados, los más polimórficos (PIC = 0,5) fueron AN10 y Z10. Por medio del AD se estableció que para la diferenciación de los morfotipos se precisa al menos de tres cebadores (AN10, OPA13, Z10) que mostraron su mayor contribución a los ejes de ordenación. Los dos primeros ejes representan el 99,2% de la variación. La función de clasificación de validación cruzada de los resultados estableció que en promedio la identificación correcta es de 80,4%. Sin embargo en razón de las restricciones impuestas en la identificación morfológica y por el marcador molecular utilizado, se sugiere la utilización de SCARs, SSRs o secuenciación de COI, de mayor poder de resolución y ampliar los muestreos a los diferentes agro-ecosistemas en Colombia, con el fin de confirmar las diferencias morfológicas y moleculares encontradas en esta investigación.
Palabras clave: RAPD. Caracterización molecular. Salta hojas.
Abstract: The genus Empoasca is of broad economic importance, but presents difficulty in its taxonomic identification due to the presence of very similar external characteristics between species. In order to establish differences in a sample of leafhoppers collected in cassava and yam crops (in Sucre departament, Colombia), individuals were characterized in five morphotypes based on their reproductive structures using six characteristics of the genitalia and six RAPD primers. Results indicate that of the six primers used for molecular characterization, the most polymorphic were AN10 and Z10 (PIC = 0.5). Through the utilization of DA, it was established that the differentiation of morphotypes is due to three primers (AN10, OPA13, and Z10), which showed the greatest contribution to the ordination axes. The first two axes represented 99.2% of the variation found. Sort function cross-validation of the results established that the correct identification average is 80.4%. However, because of the restrictions imposed by morphological identification and the molecular markers used, the use of SCARs, SSRs and COI sequencing is suggested, as well as the expansion of samplings to different agro-ecosystems in Colombia, in order to confirm the morphological differences and molecular findings of this investigation.
Key words: RAPD. Molecular characterization. Leafhopper.
Introducción
Los Cicadellidae, comúnmente llamados cicadélidos, salta hojas o chichamtas (Freytag y Sharkey 2002) se consideran de gran importancia económica debido a que son vectores de fitopatógenos y causan daños directos en las plantas al alimentarse de la savia de las células y tejidos, lo cual resulta en un debilitamiento general (Nielson 1985). Estos insectos poseen piezas bucales picadoras-chupadoras utilizadas para penetrar delicadamente las células vegetales y succionar la savia. Entre los cicadélidos, algunas especies del géneroOn-cometopia(Stal, 1869) son plagas de gran interés en cultivos de cítricos por transmitir la bacteria Xylella fastidiosa (Wells et al. 1987) agente causal de la clorosis variegada de los cítricos (Roberto et al. 1996). Para Cicadellidae, se reporta una amplia variedad de especies vegetales como fuente de alimentación, entre las cuales están: Musa spp. (L., 1753), Veta vulgaris (L., 1753), Phaseolus vulgaris (L., 1753), Apium graveolens (L., 1753), Cucumis sativus (L., 1753), Solanum melongena (L., 1753), Lactuca sativa (L., 1753), Cucumis melo (L., 1753), Carica papaya (L., 1753), Solanum tube-rosum (L., 1753), Cucurbita spp. (L., 1753), Persea americana (Mill, 1754), Pisum sativum (L., 1753), Lycopersicum esculentum (L., 1753) y Citrullus lanatus(Matsum y Nakai, 1916). Un patrón similar se registra en Colombia, en cultivos de cítricos, gramíneas, leguminosas forrajeras, hortalizas y algunas plantas ornamentales (Posada 1989).
El género Empoasca (Walsh, 1862) (Hemiptera: Cicadellidae) está distribuido alrededor del mundo (Langlitz 1964; Southern 2008) con un amplio rango de plantas hospederas. Muchas de sus especies son reconocidas como plagas de importancia económica debido a la capacidad que tienen en la transmisión de patógenos (Poos y Wheeler 1943; Nielson 1968; Maya et al. 2000); sin embargo, partes de la taxonomía, filogenia y biogeografía de este grupo son considerablemente desconocidas (Balme 2007).
En Colombia, existen reportes de 678 especies de cicadélidos, que abarcan la distribución geográfica para la región neotropical y las diferentes regiones dentro del país, en las que se identifican varias especies del género Empoasca:E. antioquinae (Davidson y De Long, 1956), E. bispinata (Davidson y De Long, 1943), E. canda (Ross y Moore, 1957), E. cavanalia (De Long, 1932), E. fabalis (De Long, 1930), E. kraemeri (Ross y Moore, 1957), E. papae (Ruppel y De Long, 1956), E. prona (Davidson y De Long, 1940), E. scinda (Ruppel y De Long, 1956) y E. zapoides (Ross, 1959) (Freytag y Sharkey 2002). Para el departamento de Sucre, el Centro Internacional de Agricultura Tropical, reporta a E. bispinata como la especie que afecta los cultivos de yuca (Manihot esculenta Crantz) (CIAT 2004).
Se ha demostrado que la identificación morfológica de las especies de este género es difícil, debido a que presentan caracteres morfológicos externos muy similares (De Long 1931, 1938; Ross 1959; Ross y Cunningham 1960; Southern 1982). Además la cuantificación de variabilidad mediante morfología presenta inconvenientes como baja variabilidad e influencia ambiental; por tal motivo las técnicas de biología molecular son usadas como herramientas útiles y complementarias para el análisis de diversidad, establecimiento de relaciones entre poblaciones, diferenciación e identificación de especies crípticas, subespecies, complejos de especies y poblaciones de insectos (Hadrys et al. 1992).
Los marcadores moleculares RAPD (Fragmentos de ADN polimórfico amplificado al azar) han sido utilizados frecuentemente en la caracterización de insectos y otros taxa similares (Skinner y Camacho 1995; Silva et al. 2004; Subodh et al. 2010), estos marcadores son técnicamente simples, de bajo costo, rápidos de implementar, discriminantes y requieren una cantidad mínima de tejido; su restricción más notable es su carácter dominante (Williams et al. 1990; Ferreira y Grattapaglia 1998), sin embargo, son invaluables cuando no hay estudios genéticos previos (Karp et al. 1997). En esta investigación, se utilizaron los RAPD para la identificación de morfotipos del género Empoasca en agro-ecosistemas de ñame (Dioscorea alata L., 1753, D. rotundata Poir) y yuca (M. esculenta ) del departamento de Sucre, Colombia.
Materiales y métodos
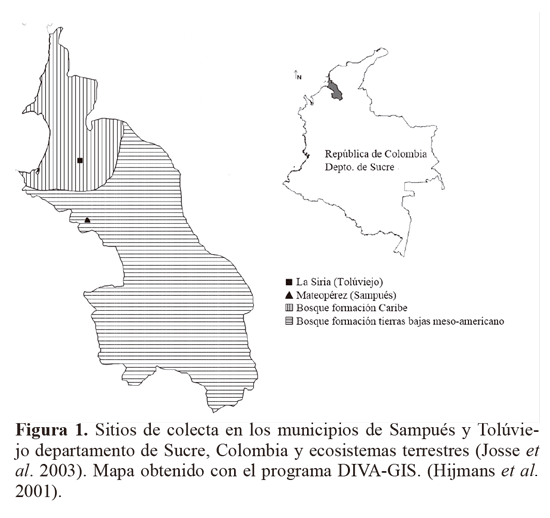
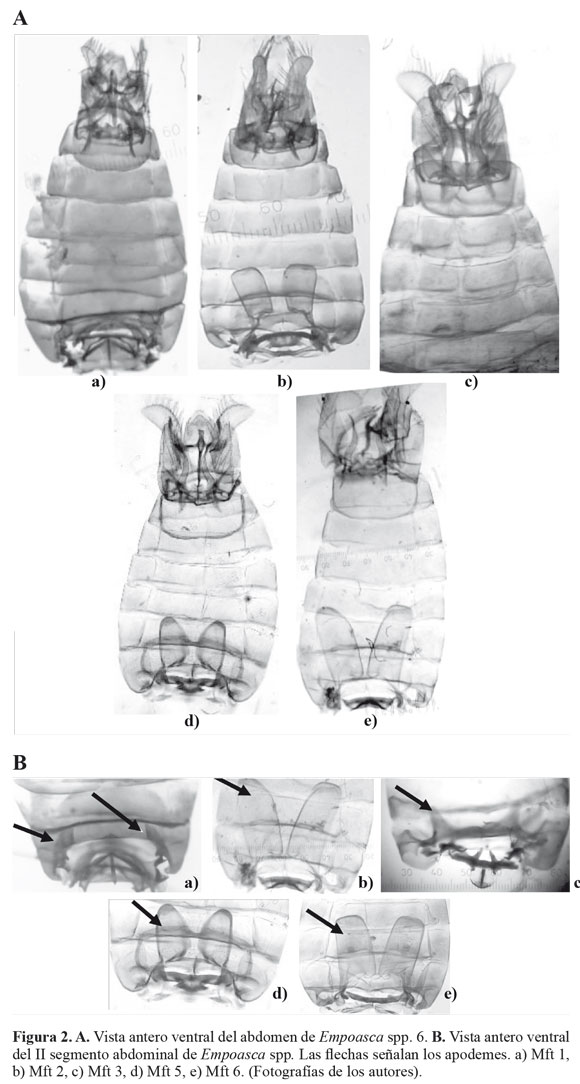
Los insectos del género Empoasca, se recolectaron con red entomológica, en agro-ecosistemas de ñame y yuca, ubicados en los municipios de Sampués (Mateopérez) y Tolúviejo (La Siria) en el departamento de Sucre, Colombia (Fig. 1). Los muestreos se realizaron en la primera localidad entre junio - septiembre de 2008 y en la segunda durante febrero - agosto de 2008. Los especímenes se preservaron en etanol 96% (Villarreal et al. 2006) y se clasificaron a nivel de morfotipos (Mft). Se separó el abdomen del resto del cuerpo, se clarificó mediante calentamiento en una solución de KOH 10%. Se determinaron estructuras abdominales y órganos genitales como los apodemes, procesos basales del pigófero, estili, aedeago, ganchos anales, I y IX segmento abdominal a partir de fotografías tomadas mediante un microscopio Olimpus (Modelo CH30) con micrómetro ocular (aumento EA-10 y EA-40) y una cámara Lumix FS-5 (Segnini y Montagne 1989; Southern 2008).
Extracción de ADN: El ADN se extrajo a partir de la cabeza y el tórax, empleando con algunas modificaciones, el método propuesto por Afanador et al. (1993): las muestras se maceraron en 50 pl de buffer de extracción (NaCl 0,5 M, Tris-HCl 0,2 M, EDTA 10 mM, SDS 1%) con proteinasa K (50 pg/ml). Se incubó en baño María 1 h a 65 °C, seguido se agregó 12,5 pl de acetato de amonio (7,5 M) con agitación a temperatura ambiente y centrifugación a 12.000 rpm. por 15 min. Se adicionó cloroformo: alcohol isoamílico (24:1) al sobrenadante, se mezcló y centrifugó. Después al sobrenadante se le agregó A volumen de isopropanol frío y se dejó precipitar. Se centrifugó y se lavó el "pelet" de ácidos nucleicos con etanol 70% frío. Finalmente, se dejó evaporar el etanol y se resuspendió en buffer TE.
Marcadores RAPD: Se evaluaron 11 cebadores y se seleccionaron los que presentaron polimorfismo y un patrón de bandas claro (Tabla 1). Las amplificaciones se realizaron siguiendo, con modificaciones, el protocolo de Williams et al. (1990). Las concentraciones finales utilizadas fueron buffer PCR 1X [Tris-HCl 20 mM (pH 8,4), KCl 50 mM], MgCk 2,5 mM, dNTPs 0,2 mM, cebador 0,6 pM, 1 U Taq DNA polimerasa, 5 pl de ADN, en un volumen final de 12,5 pl, con un perfil de temperaturas de: desnaturalización inicial a 94 °C por 5 min, seguido de 33 ciclos de desnaturalización a 94 °C por 1 min, hibridación a 38,5 °C por 1 min y elongación a 72 °C por 1 min y una extensión final de 72 °C por 7 min.
productos RAPD-PCR se analizaron mediante electroforesis en gel de agarosa 1,4% a 70 V por 2,1 horas. La tinción se realizó con "SYBR® safe". Las bandas se visualizaron a 302 nm y su tamaño se determinó mediante marcador de peso molecular 100 pb "DNA ladder" de Invitrogen®. Los procedimientos fueron realizados en un termociclador de BIORAD®, una fuente de poder BIORAD®, un tanque de electroforesis OWL® (Modelo B1) y un transiluminador VWR®.
Análisis de datos. Se cuantificaron las bandas producto de la amplificación que fueron consistentemente visibles y re-producibles. Cada locus se enumeró en orden descendente y se codificaron en una matriz binaria donde "uno" indicó presencia y "cero" ausencia (Vicente et al. 2004). La estimación con marcadores dominantes lleva a sesgos por sobreestimación hasta del 5% con muestras pequeñas, esto se corrigió mediante la estimación de Lynch y Milligan (1994), con lo cual se eliminaron los loci con frecuencia mayor a 1-(3/N), donde N es el número de individuos (Breinholt et al. 2009). Las estimaciones moleculares se determinaron a partir de los supuestos de Apóstol et al. (1996): 1. Las regiones genómicas amplificadas segregan como alelos dominantes, 2. Los loci estudiados están en equilibrio Hardy-Weinberg y 3. Los alelos dominantes son idénticos en estado. Se obtuvo una representación gráfica a partir de los resultados de un análisis discriminante (AD), mediante el programa XLSTAT demo (versión 2015.1.03.16133 Addin-soft, Inc., Brooklyn, NY, USA) y se graficaron los resultados mediante el programa NTSYSpc versión 2,11v (Rohlf 2002). Se utilizaron hojas de cálculo tipo para estimar el poder discriminatorio de los marcadores moleculares (PIC) (Warburton y Crossa 2002).
Resultados y discusión
Se coleccionaron individuos $ y S de Empoasca spp. A continuación se escogieron individuos macho para establecer su identidad taxonómica mediante morfometría. Por medio de una clave entomológica experimental se pudo determinar la presencia de diferentes Mft y se verificó la diferenciación de las especies y Mft usando los dibujos de las estructuras de la genitalia interna, tanto los de la literatura (De Long 1931; Ross y Moore, 1957; Langlitz 1964; Southern 1982, 2008) como los realizados durante este estudio. Para corroborar las observaciones, se envió un ejemplar de cada Mft al M. Sc. Juan M. Vargas Rojas (IC A-Laboratorio de Sanidad Vegetal. Bello, Antioquia - Colombia) para su identificación.
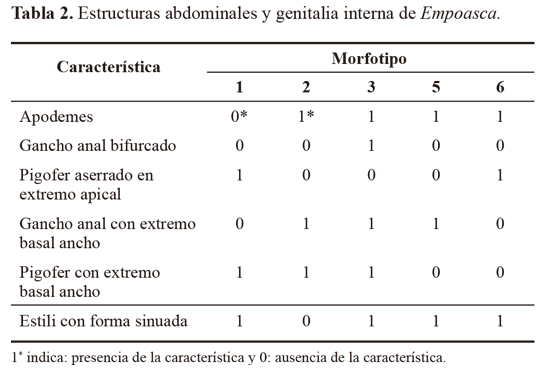
Los resultados del estudio morfológico muestran que las diferencias entre las morfotipos identificados, se fundamentan en la presencia o ausencia de uno o más caracteres diagnósticos (Tabla 2; Fig. 2). Inconvenientes en la preparación de los montajes para la identificación morfológica impidieron la caracterización de algunos individuos. Esto determinó que la localidad de Mateopérez estuviera compuesta por 21 individuos (Mft1) y La Siria por 26 (Mft1, Mft2, Mft3, Mft5 y Mft6).
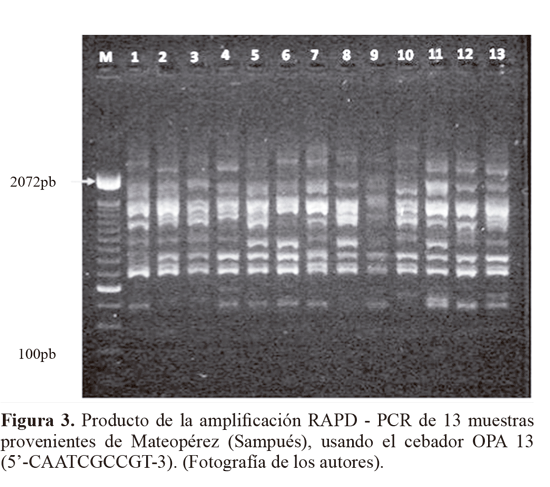
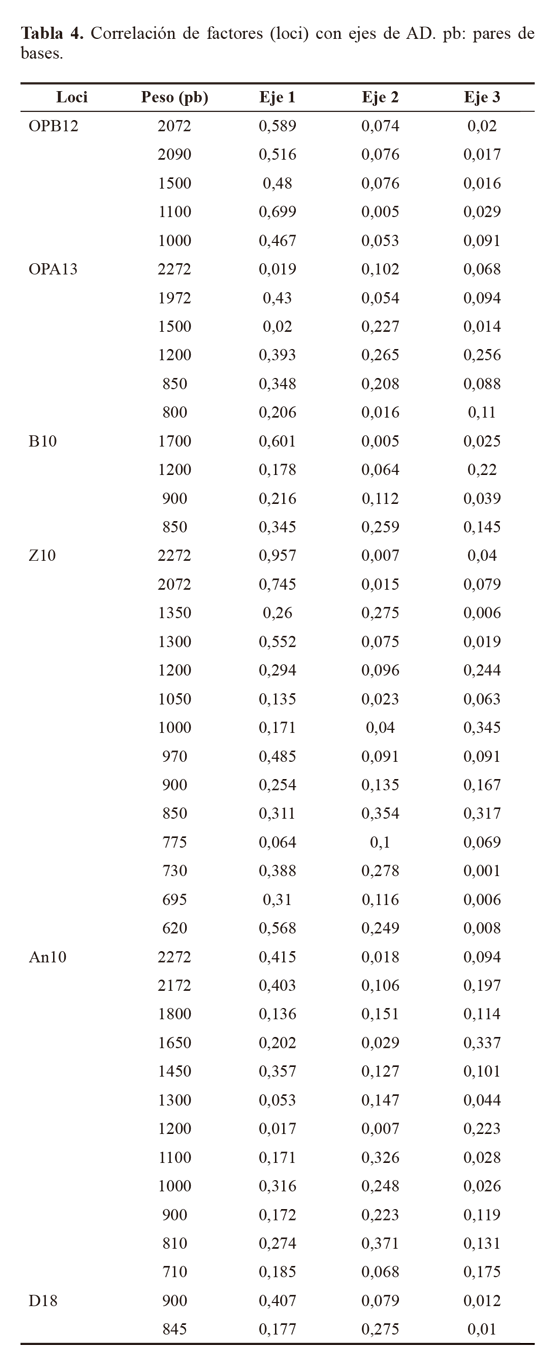
De los 11 cebadores evaluados en la caracterización molecular RAPD, seis: OPA13, Z10, OPB12, AN10, D18 y B10, (Tabla 1), fueron seleccionados (Fig. 3). Estos cebadores presentaron el mayor polimorfismo al producir 116 loci en total y un promedio de 19 loci identificados por cebador. El tamaño de los fragmentos amplificados estuvo en un rango entre 420 pb > 2072 pb.
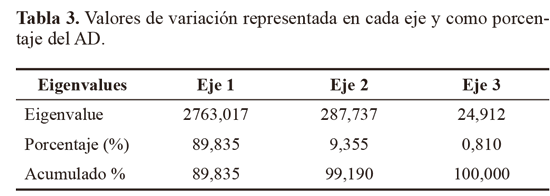
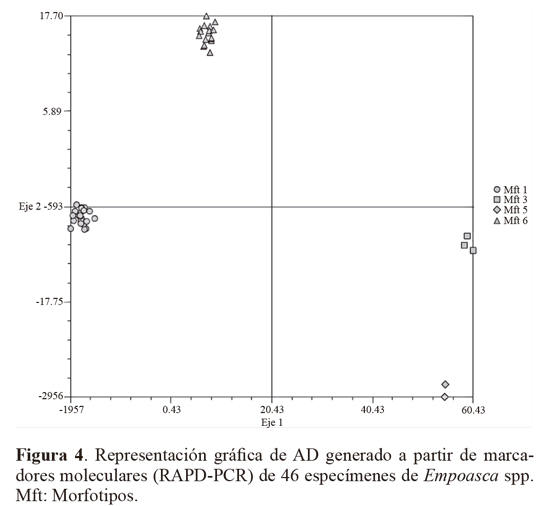
Los marcadores moleculares que contribuyeron a identificar los niveles más altos de polimorfismo (PIC = 0,5), fueron: Z10 locus 2272 pb, 1350 pb y 900 pb y AN10 2172 pb, 1800 pb, 1650 pb, 810 pb. Otros cebadores que contribuyeron en menor proporción (PIC = 0,49) fueron OPA13 (1200 pb), B10 (900 pb) y D18 (845 pb), Z10 (2072 pb y 730 pb) y AN10 (1000 pb). El alto polimorfismo revelado por el análisis RAPD, así como el número de loci totales obtenidos fue importante y constituyen un acercamiento de tipo genético para Empoasca, en el cual no se han registrado estudios genéticos en Colombia. Para el análisis AD los parámetros morfotipo, hospedero y sitio de colecta no fueron incluidos dentro de los análisis de variables, lo que le otorga a los resultados objetividad e independencia. Para el AD, solamente se tuvieron en cuenta los loci con PIC > 0,4, y por restricciones estadísticas fue descartado el Mf2, que contaba con un solo registro. El resultado mostró que el 89,84% de la variación está representado en el primer eje, el 9,36% en el segundo (Tabla 3). El eje 1 esta correlacionado a los cebadores An10, B10 y Z10, y el eje 2 con An10, Z10 y OPA13 (Tabla 4). Por su baja contribución a los ejes que explican la mayoría de variación, en futuros estudios se podrían dejar de utilizar al menos los cebadores OPB12 y D18. El análisis confirma que los morfotipos se encuentran segregados en cuatro grupos bien definidos y compactos en los ejes extraídos de las variables producto de la caracterización molecular (Fig. 4).
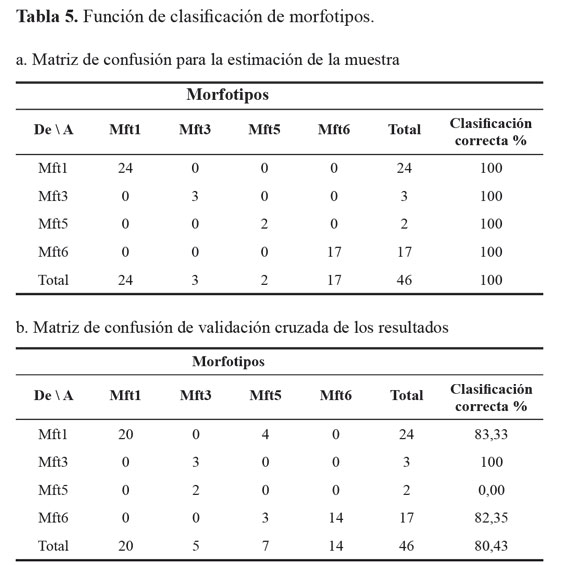
La matriz de confusión de las muestras que permite estimar la correcta identificación de los Mft producto de la discriminación molecular, permitió establecer que el 100% de los individuos fue correctamente clasificado (Tabla 5a), sin embargo el resultado de la matriz de confusión de validación cruzada de los resultados, identificó correctamente los Mft en promedio de 80,4% (Tabla 5b), indicando que los métodos de identificación morfológica deben ser más refinados e incrementar el número de caracteres diagnóstico utilizados, con el fin de clasificar adecuadamente los especímenes, en tanto que el marcador molecular utilizado, debido a su naturaleza dominante y aleatoria, predispone a falsos positivos, que pueden llevar a caracterizaciones equívocas.
Las aproximaciones tradicionales a la taxonomía del género Empoasca, han enfrentado limitaciones por la complejidad morfológica de este taxón. Generalmente este tipo de estudios apoyado en el análisis de los órganos reproductores no está exento de dificultades, en particular debido al elaborado proceso de preparación de las microdisecciones y placas fijas, además de la ausencia de taxónomos especializados. Por esto y por la alta importancia agrícola de este género, se aplicó un marcador molecular con el fin de determinar si la variabilidad morfológica cuantificada a partir de las estructuras reproductivas era reflejo de un genotipo específico. Los resultados, permitieron con relativa confiabilidad, establecer que la variabilidad de los morfotipos encontrados, genéticamente corresponden a cuatro grupos detectados en el AD.
El AD, permite concluir, que con el fin de dar paso a estudios más rápidos y eficientes, el conjunto de cebadores utilizados puede ser reducido, y aun por las mismas restricciones inherentes a estos, se sugiere el desarrollo de marcadores SCAR a partir de aquellos loci con mayor probabilidad de explicar la variabilidad. De esta forma se puedan asociar a morfotipos específicos. La realización de muestreos exhaustivos en los diferentes agro-ecosistemas del país y el desarrollo de microsatélites, permitiría de manera más confiable abordar la variabilidad y diversidad genética del taxón. Así como también, la implementation de secuenciación de genes modelo (COI: citocromo oxidasa I) u otros. Se espera que la aplicación de marcadores moleculares de mayor resolución, permita explorar el tipo de relación subyacente entre la variabilidad morfológica, de nicho y genética, para este importante grupo de alto valor económico; más aún cuando en el banco de genes NCBI, solo se encuentran reportes para E. vitis y E. fabae.
Agradecimientos
Al profesor Juan Manuel Vargas Rojas Coordinador Grupo Red de Laboratorios de Diagnóstico Fitosanitario del iCa por el envío de material bibliográfico, colaboración en la identificación y la confirmación de los especímenes; al laboratorio de Biotecnología Vegetal de la Universidad de Sucre, por otorgar los recursos para realizar esta investigación.
Literatura citada
AFANADOR, L. K.; HADLEY, S. D. ; KELLY, J. D. 1993. Adoption of a mini-prep DNA extraction method for RAPD marker analysis in common bean (Phaseolus vulgaris L). Bean Improvement Cooperative 36: 10-11. [ Links ]
APOSTOL, B. L.; BLACK IV, W. C.; REITER, P.; MILLER, B. R. 1996. Population genetics with RAPD-PCR markers: Aedes aegypti in Puerto Rico. Heredity 76: 325-334. [ Links ]
BALME, G. 2007. Phylogeny and systematics of the leafhopper subfamily Typhlocybinae (Insecta: Hemiptera: Cicadellidae). Thesis Doctor of Philosophy. North Carolina State University. EUA. 149. [ Links ]
BREINHOLT, J. W.; VAN BUREN, R.; KOPP, O. R.; STEPHEN, C. L. 2009. Population genetic structure of an endangered Utah endemic, Astragalus ampullarioides (Fabaceae). American Journal of Botany 96 (3): 661-667. [ Links ]
CIAT. 2004. Annual Report: Integrated pest and disease management in major agroecosystem. Project PE1. Centro Internacional de Agricultura Tropical. Palmira, Valle. 56 p. [ Links ]
DE LONG, D. 1931. A revision of the American species of Empoas-ca known to occur North of Mexico. Technical Bulletin United States Department of Agriculture 231: 60 p. [ Links ]
DE LONG, D. 1938. Biological studies on the leafhopper Empoas-ca fabae as a bean pest. Technical Bulletin United States Department of Agriculture 618: 62 p. [ Links ]
FERREIRA, M.; GRATTAPAGLIA, D. 1998. Introducción al uso de marcadores moleculares en el análisis genético. Embrapa-Cenargen, Brasilia, DF. 220 p. [ Links ]
FREYTAG, P. H.; SHARKEY, M. J. 2002. A preliminary list of the leafhoppers (Homoptera Cicadellidae) of Colombia. Biota Colombiana 3 (2): 235-283. [ Links ]
HADRYS, H.; BALICK, M.; SCHIERWATER, B. 1992. Applications of random amplified polymorphic DNA (RAPD) in molecular ecology. Molecular Ecology 1: 55-63. [ Links ]
HIJMANS, R. J.; GUARINO, L.; CRUZ, M.; ROJAS, E. 2001. Computer tools for spatial analysis of plant genetic resources data: 1. DIVA-GIS. Plant Genetic Resources Newsletter, 127: 15-19. [ Links ]
JOSSE, C.; NAVARRO, G.; COMER, P.; EVANS, R.; FABER-LANGENDOEN, D.; FELLOWS, M.; KITTEL, G.; MENARD, S.; PYNE, M.; REID, M.; SCHULZ, K.; SNOW, K.; TEAGUE, J. 2003. Ecological Systems of Latin America and the Caribbean: A Working Classification of Terrestrial Systems Arlington, VA: NatureServKARP, A.; KRESOVICH, S.; BHAT, K.; AYAD, W. ; HODGKIN, T. 1997. Molecular tools in plant genetic resources conservation: a guide to the technologies. International Plant Genetic Resources Institute, Rome, Italia. 47 p. [ Links ]
LANGLITZ, H. 1964. The economic species of Empoasca in the coastal and sierra regions of Peru. Revista Peruana de Entomologia 7 (1): 54-70. [ Links ]
LYNCH, M.; MILLIGAN, B. 1994. Analysis of population genetic structure with RAPD markers. Molecular Ecology 3: 91-99. [ Links ]
MAYA, V.; VERA, J. ; GARZA, R. 2000. Parametros poblacionales de Empoasca kraemeri Ross y Moore (Homoptera: Cicadelli-dae) en genotipos de frijol. Agrociencia 34 (5): 603-610. [ Links ]
NIELsOn, M. W. 1968. The leafhoppers vectors of phytopatoge-nic viruses (Homoptera, Cicadellidae). Taxonomy, biology and virus transmission. United States Department of Agriculture, Washington. 396 p. [ Links ]
NIELSON, M. W. 1985. Leafhopper systematic: 11-39. En: Nault, L. R.; Rodriguez, J. G. (Eds.). The leafhoppers and plantho-ppers. John Wiley, NewYork. 500 p. [ Links ]
POOS, F. W.; WHEELER, N. H. 1943. Studies on host plants of the leafhoppers of the genus Empoasca . Technical Bulletin United States Department of Agriculture 850: 5. [ Links ]
POSADA, L. 1989. Listado de insectos dañinos y otras plagas en Colombia. Boletín Técnico Instituto Colombiano Agropecuario 43: 662 p. [ Links ]
ROBERTO, S. R.; COUTINHO, A.; de LIMA, J. E. O.; MIRANDA, V S. ; CARLOS, E. F. 1996. Transmissao de Xylella fastidiosa pelas cigarrinhas Dilobopterus costalimai, Acrogonia terminalis e Oncometopia facialis em citros. Fitopatologia Brasileira 21 (4): 517-518. [ Links ]
ROHLF, F. 2002. NTSYS pc: Numerical taxonomy and multivariate analysis system. Exeter Publishing, Setauket, New York. 44 p. [ Links ]
ROSS, H.; MOORE, T. 1957. New species in the Empoasca fabae complex (Homoptera: Cicadellidae). Annals of the Entomological Society ofAmerica 50: 118-122. [ Links ]
ROSS, H. 1959. A survey of the Empoasca fabae complex (Hemip-tera:, Cicadellidae). Annals of the Entomological Society of America 52 (3): 304-316. [ Links ]
ROSS, H.; CUNNINGHAM, H. 1960. A key to the Empoasca solana complex with descriptions of new species. The Ohio Journal of Science 60 (5): 309-317. [ Links ]
SEGNINI, S.; MONTAGNE, A. 1989. Biología y ecología pobla-cional de Empoasca kraemeri Ross y Moore (Homoptera: Cicadellidae) en caraota (Phaseolus vulgaris L.) I.- Reconocimiento taxonómico de Empoasca kraemeri y de otras especies relacionadas. Boletín de Entomología Venezolana Nueva Serie 5 (1-4): 18-27. [ Links ]
SILVA, M.; TONET, G.; VIEIRA, I. 2004. Characterization and genetic relationships among Brazilian biotypes of Schizaphis graminum (Rondani) (Hemiptera: Aphididae) using RAPD markers. Neotropical Entomology 33: 43 - 49. [ Links ]
SKINNER, D.; CAMACHO, R. 1995. Genetic diversity within a potato leafhopper (Homoptera: Cicadellidae) population infesting alfalfa. Journal of Kansas Entomological Society 68 (1): 35-42. [ Links ]
SOUTHERN, P. 1982. Taxonomic study of the leafhopper genus Empoasca (Homoptera - Cicadellidae) in eastern Peru. The North Carolina Agricultural Research Service Technical Bulletin 272: 194 p. [ Links ]
SOUTHERN, P. 2008. New species and color forms of Empoasca (Hemiptera: Cicadellidae: Typhlocybinae: Empoascini) from South America. Zootaxa 1949: 51-62. [ Links ]
SUBODH, K. J.; BHARAT, N.; DIVYA, P.; KALPANA, J. 2010. RAPD marker system in insect study: A review. Indian Journal of Biotechnology 9: 7-12. [ Links ]
VICENTE, M. C. D.; LÓPEZ, C.; FULTON, T. (Eds.). 2004. Análisis de la diversidad genética utilizando datos de marcadores moleculares: módulo de aprendizaje. Instituto Internacional de Recursos Fitogenéticos, Roma, Italia. [ Links ]
VILLARREAL, H.; ÁLVAREZ, M.; CÓRDOBA, S.; ESCOBAR, F.; FAGUA, G.; GAST, F.; MENDOZA, H.; OSPINA, M.; UMAÑA, A. M. (Eds.). 2006. Manual de métodos para el desarrollo de inventarios de biodiversidad. Programa de Inventarios de Biodiversidad. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Bogotá, Colombia. 235 p. [ Links ]
WARBURTON, M.; CROSSA, J. 2002. Data analisys in the CI-MMYT biotechnology center for fingerprinting and genetic diversity studies. Centro Internacional Mejoramiento Maiz y Trigo, El Batán, Texcoco, México. 30 p. [ Links ]
WELLS, J. M.; RAJU, B. C.; HUNG, H.-Y; WEISBURG, W. G.; MANDELCO-PAUL, L.; BRENNER, D. J. 1987. Xylella fastidiosa gen. nov., sp. nov: Gram-negative, xylem-limited, fastidious plant bacteria related to Xanthomonas spp. International Journal of Systematic Bacteriology 37 (2): 136-143. [ Links ]
WILLIAMS, J. G. K.; KUBELIK, A. R.; LIVAK, J. K.; RAFAL-SKI, J. A.; TINGEY, S. V. 1990. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers. Nucleic Acids Research 18 (22): 6531-6535. [ Links ]
Recibido: 28-oct-2013
Aceptado: 27-sep-2015
Citación sugerida:
ARROYO P., W.; PÉREZ-H., A.; DÍAZ-SOTO, J.; BELTRÁN H., J. 2015. Identificación de morfotipos de Empoasca spp. (Hemiptera: Cicadellidae) en agro-ecosistemas de ñame y yuca (Sucre, Colombia). Revista Colombiana de Entomología 41 (2): 163-169. Julio - Diciembre 2015. ISSN 0120-0488.