Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804On-line version ISSN 2357-3791
Rev.Colomb.Quim. vol.39 no.2 Bogotá May/Aug. 2010
SÍNTESIS ESTEREOSELECTIVA DE UN NITRO DERIVADO DE FENILVINILIDENO MEDIANTE LA REACCIÓN DE HECK USANDO FOSFITOS
SYNTHESIS OF A STEREOSELECTIVE NITRO PHENYLENEVINYLENE DERIVATIVE BY THE HECK REACTION USING PHOSPHITES
SÍNTESE ESTÉREOSELECTIVA DE UM NITRO DERIVADO DE FENILVINILIDENO MEDIANTE A REACÇÃO DE HECK USANDO FOSOFITOS
Andrés Felipe Sierra1, Ricaurte Rodríguez1, César A. Sierra1,2
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia.
Recibido: 5/04/10 - Aceptado: 18/08/10
RESUMEN
En este trabajo se describen tanto la síntesis como la caracterización de E,E-1,4-dimetoxi-2,5-bis[2-(4-nitrofenil)etenil] benceno, mediante la reacción de acoplamiento cruzado de Heck usando trifenil-fosfito como ligante, lo cual -y teniendo en cuenta la literatura científica consultada- es el primer reporte de un doble acoplamiento de Heck empleando fosfitos como ligante en la formación del complejo catalítico con paladio. La caracterización del sistema fenilvinilideno obtenido muestra que el mecanismo es altamente estereoselectivo hacia la formación de enlaces trans, y su altísimo rendimiento (98%) indica que el sistema catalítico es bastante promisorio para realizar multiacoplamientos cruzados necesarios para obtener polímeros fenilvinilideno con altos pesos moleculares y altas eficiencias en las propiedades optoelectrónicas, necesarios para la tecnología de la electrónica de polímeros.
Palabras clave: electrónica de polímeros, fenilvinilideno, polímeros segmentados, reacción de Heck, fosfitos.
ABSTRACT
The synthesis and characterization of E,E-1,4-dimethoxy-2,5-bis[2-(4-nitrop-henyl)ethenyl]benzene by cross coupling Heck reaction using phosphites as ligands is described. This, to the best of our knowledge, is the first report involving a double Heck coupling using phosphites as ligand in the palladium catalyst formation. The characterization for the phenylenevinylene system obtained showed that the mechanism is highly stereoselective towards trans bond formation and its quantitative yield showed that this catalytic system is very promising for the multicoupling needed to obtain phenylenevinylene polymers with high molecular weights and high efficiency optoelectronic properties, in order to be used in polymer electronic technologies.
Key words: polymer electronics, phenylenvinylene, segmented polymers, Heck reaction, phosphites.
RESUMO
Neste trabalho descreve-se a síntese e caracterização de E,E-1,4-dimetoxi-2,5-bis [2-(4-nitrofenil)etenil]benceno, mediante a reação de acoplamentos cruzado ao Heck com trifenilfosfito como ligante. O qual, e tendo em conta a literatura científica pesquisada, é o primeiro reporte de um duplo acoplamento de Heck empregando fosfitos como ligante na formação do complexo catalítico com paladio. A caracterização do sistema fenilvinilideno obtido mostra que o mecanismo é altamente estereoselectivo para a formação de enlaces trans e que o sistema catalítico é bastante promisorio para fazer os acoplamentos cruzados necessários para obter polímeros de fenilvinilideno com alta massa molecular e altas eficiências nas propriedades optoelectronicas, necessários para a tecnologia da eletrônica de polímeros.
Palavras-chave: eletrônica de polímeros, fenilvinilideno, polímeros segmentado, Heck reação, fosfitos.
INTRODUCCIÓN
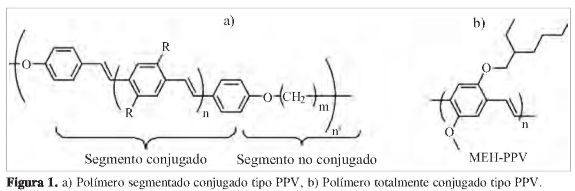
A partir del descubrimiento de la electroluminiscencia en polímeros por parte de Burroughes et al. (1), los polímeros pasaron de ser simples materiales de protección o embalaje para convertirse en el componente activo de tecnologías altamente promisorias, como los diodos orgánicos emisores de luz (Organic Ligth Emitting Diodes, OLEDs), celdas solares y baterías, entre otras, a lo cual se le denomina la electrónica de polímeros (2-4). Una de las limitantes en el desarrollo de estas tecnologías ha sido el escaso conocimiento que se tiene de los procesos fisico-químicos involucrados, por lo cual un gran número de grupos de investigación alrededor del mundo trabaja en estudios estructura-propiedad sobre sistemas oligo y poliméricos conjugados, entre los cuales se destaca el uso de sistemas fenil-vinilideno (SFV) segmentados (Figura 1a), inicialmente desarrollados por el grupo de Frank Karasz (5) en la Universidad de Massachusetts, los cuales permiten obtener polímeros altamente solubles, con control del ancho de banda espectral (band gap, Egap) y con homogeneidad en los valores de las propiedades optoelectrónicas, lo cual posibilita un mejor análisis con los resultados teóricos de los estudios estructura-propiedad antes mencionados. Cabe resaltar que esta última característica en la homogeneidad de las propiedades optoelectrónicas es muy difícil o imposible de obtener en sistemas totalmente conjugados, como el MEH-PPV (poly-methoxyethylhexyloxy-p-phenylenevinylene), polímero más estudiado y utilizado en la electrónica de polímeros (Figura 1b).
Aunque los SFV como el MEH-PPV han sido sintetizados con bastante éxito y altos pesos moleculares (hasta 1x106 Da), las metodologías utilizadas; descritas por Grimsdale y colaboradores (6) presentan dentro de sus limitantes la escasa estereo-selectividad de sus mecanismos de reacción llevando a la formación durante la polimerización de dobles enlaces en configuración cis, los cuales deben ser convertidos a configuración trans, requisito para obtener altas eficiencias optoelectrónicas, mediante reacciones pospolimerización, lo que ocasiona la presencia residual de impurezas indeseables o la pérdida de peso molecular inicial, factores que disminuyen la eficiencia de las propiedades optoelectrónicas del polímero (7). Por otra parte, la reacción de acoplamiento de Heck (Esquema 1) se presenta como una metodología bastante atractiva para obtener SFV segmentados, ya que emplea condiciones de reacción menos drásticas permitiendo el uso de un amplio espectro de funcionalidades dentro de los monómeros, y mecanísticamente favorece la formación de insaturaciones trans (evitando reacciones pospolimerización) (7). Infortunadamente, resultados de nuestro grupo y otros grupos alrededor del mundo muestran que la polimerización de SFV usando la reacción de Heck produce generalmente polímeros de cadena muy corta con valores de escasos miles de peso molecular (7, 9-10), lo cual imposibilita su aplicación en la electrónica de polímeros debido principalmente a la dificultad en la formación de películas estables a las condiciones de operación de la aplicación.
Tomando como antecedente que todos los trabajos reportados sobre PPV usando la reacción de Heck (7, 9-10) como metodología sintética utilizan fosfinas como ligante, y que el cambio en fuerza de enlace entre P-C (fosfinas) y P-O (fosfitos) podría mejorar la actividad catalítica del sistema ligante-paladio debido a una mayor estabilidad y contribuciones electrónicas, en este trabajo se reporta por primera vez un doble acoplamiento cruzado de Heck entre pnitroestireno y 1,4-diiodo-2,5-dimetoxibenceno usando trifenilfosfito como ligante, Pd(OAc)2 como fuente de paladio y carbonato de potasio como base, con excelente rendimiento (98%), lo cual se presenta como una respuesta altamente promisoria para la obtención de SFV poliméricos segmentados con alto peso molecular.
MATERIALES Y MÉTODOS
Los solventes empleados en la síntesis, tales como CHCl3, CH3OH y CH3 COOH, H2SO4, son de origen comercial y no se sometieron a ningún tratamiento previo. Por otro lado, la A,A-dimetilformamida (DMF) se secó dejándola en reflujo sobre óxido de bario por dos días bajo atmósfera de nitrógeno. El óxido de bario previamente se activó en mufla a 100 °C durante una semana. Una vez transcurrido este tiempo, la DMF se destiló y se recogió directamente en el balón de reacción usado para la síntesis.
Los puntos de fusión fueron medidos en un fusiómetro Stuart SMP10 y son reportados sin corrección. Los espectros UV-vis y FT-IR (KBr) fueron tomados en un espectrofotómetro Thermo Scientific Evolution 300 y en un Shimadzu IR prestige-21, respectivamente. Los espectros de resonancia magnética nuclear fueron tomados en un espectrómetro Bruker Advance 400 usando CDCl3 como solvente y TMS como estándar interno.
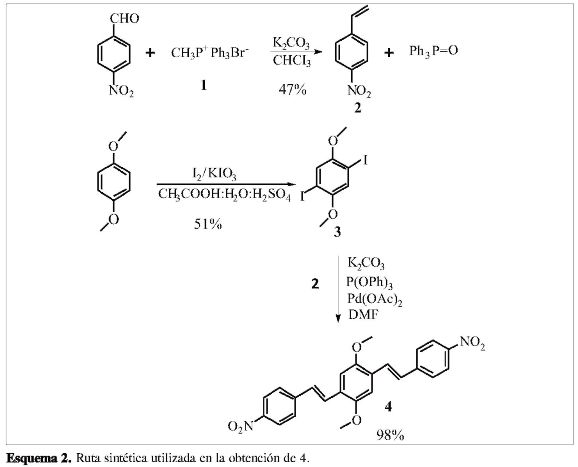
La ruta sintética seguida para la obtención del E,E-1,4-dimetoxi-2,5-bis[2-(4-nitrofenil) etenil] benceno (4) se muestra en el Esquema 2.
Bromuro de metiltrifenilfosfonío (CH3P+Ph3Br) (1)
En un baño de hielo se mezclaron 14,664 g (0,149 mol) de H2SO4 concentrado con 15,0 mL (0,370 mol) de MeOH. Después de 5 minutos de enfriamiento, esta mezcla se agregó lentamente desde un embudo de adición a 31,295 g (0,263 mol) de KBr a un balón de fondo redondo con tres bocas, el cual dirigió a través de una manguera el CH3Br formado in situ (ayudado por un calentamiento de la mezcla a 20 °C, CH3Br p.e. 4 °C) a un segundo balón que contenía 15,601 g (0,059 mol) de PPh3 solubilizado en éter etílico. Finalmente, y tras 12 h de fuerte agitación, se obtuvo un sólido blanco (8,837 g; 0,025mol, rendimiento 42%) insoluble en éter etílico con un punto de fusión de 228-230 °C (lit.(13) 230-234 °C).
p-Nitroestireno (2) (14)
En un balón de tres bocas, se adicionaron 4,768 g de K2CO3 (0,0345 mol) a 30 mL de CH2Cl2 agitando durante 15 min. Posteriormente, desde un adicionador de sólidos se agregaron lentamente 4,889 g de CH3P+Ph3Br- (0,0137 mol), manteniendo la agitación constante a temperatura ambiente por aproximadamente 20 min. Transcurrido este tiempo, se inició el calentamiento hasta 40 °C agregando 1,534 g (0,0102 mol) de p-nitrobenzaldehido desde un embudo de adición. Se mantuvo la reacción en reflujo y bajo atmosfera de N2 por 20 horas, siguiendo por cromatografía de capa fina, para finalmente separar por filtración un sólido impuro de color amarilloso. El producto se purificó mediante cromatografía en columna (sílice: n-heptano-CH2Cl2 50:50) obteniendo 0,718 g (rendimiento 47%) de un aceite café. RMN-1H (300 MHz, CDCl3) δ(ppm): 8,87(d, 2H), 7,55(d,2H), 6,70 (dd, 1H), 5,94(d, 1H), 5,52 (d, 1H). FTIR (KBr); no se observó la banda correspondiente a la vibración de estiramiento del enlace C=O (1.720 cm-1) del aldehido, la cual indica la ausencia del p-nitroben-zaldehído (reactivo de partida).
l,4-Diiodo-2,5-dimetoxibenceno (3) (9)
En un balón de fondo redondo de 500 mL se mezclaron 10,023 g de 1,4-dimetoxi-benceno (0,0725 mol), 7,781 g de KIO3 (0,0364 mol) y 21,494 g de I2 (0,0847 mol) en una solución de CH3COOH: H2O:H2S04 (200:2,5:7,5 mL). Esta mezcla se dejó reaccionar por 24 horas, tiempo en el cual se observó la formación de cristales oscuros sobre las paredes del condensador y balón, los cuales fueron filtrados y recristalizados en etanol, obteniendo un rendimiento de 51% como cristales blancos en forma de aguja (p.f. 174-176 °C, lit.(9) 174-176 °C). RMN-1H (300 MHz, CDCk) δ(ppm): 7,11(s, 2H), 3,81(s, 2H).
E,E -l,4-dimetoxi-2,5-bis[2-(4-nitrofenil)etenil] benceno (4)
En un balón de fondo redondo de 25 mL equipado con agitación magnética, condensador y bajo atmósfera de nitrógeno se mezclaron 0,162 g de p-nitroestireno (1,087 mmol), 0,187 g de 1,4-diiodo-2,5-dimetoxibenceno (0,481 mmol), 0,149 g de K2CO3 (1,082 mmol), 0,018 g de Pd (OAc)2 (0,5% mol) y 15 µL de P(OPh)3 (4,630x10-3 mmol) en 15 mL de DMF seco. Transcurridas 36 horas de agitación se agregaron 10 mL de HCL 40% a la mezcla de reacción, precipitando un sólido rojo oscuro, el cual se filtró y purificó por cromatografía en columna (n-heptano: CH2Cl210:90), obteniéndose 0,196 g (rendimiento del 98%) como un sólido morado oscuro con punto de fusión 278-280 °C, (lit. (15) 274-278 °C). RMN-1H (300 MHz, CDCl3) δ(ppm): 3,98(s, 6H), 7,18(s, 2H), 7,22(d, 2H), 7,67(d, 2H), 7,71 (d, 4H), 8,25(d, 4H).
RESULTADOS Y DISCUSIÓN
Cabe resaltar que este trabajo presenta una novedosa metodología desarrollada por nuestro grupo de investigación para sintetizar sales de trifenilfosfina como el CH3P+Ph3Br-, la cual presenta entre sus ventajas la generación in situ del bromuro de metilo, lo que simplifica y disminuye el costo económico de la síntesis, teniendo en cuenta la dificultad y el costo en la compra de compuestos alifáticos monohalogenados de bajo peso molecular, y adicionalmente, limitando las pérdidas por evaporación del reactivo (p.e. CH3 -Br: 3,56 °C). Por otra parte, durante la síntesis existe la posibilidad de generar HBr en fase gaseosa debido al uso de un exceso de H2SO4, lo que conduce a una reacción colateral con la trifenilfosfina para producir bromuro de trifenilfosfonio; sin embargo, este problema es superable con un control estequiométrico cuidadoso de la reacción.
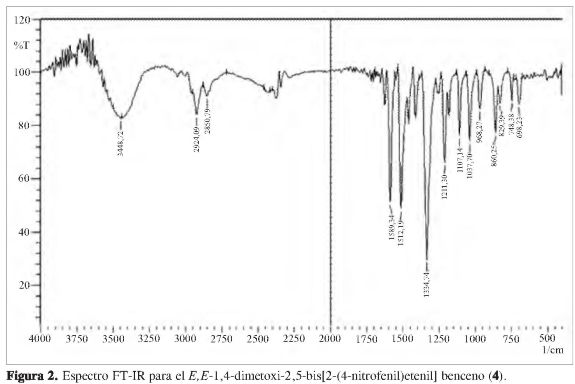
Teniendo en cuenta que el propósito de este trabajo es obtener sistemas conjugados con una alta pureza configuracional,los cuales puedan ser utilizados en la electrónica de polímeros, se eligió la reacción de Heck como metodología a seguir, aunque 4 ha sido reportado anteriormente según metodologías citadas por Nakaya y Imoto (15) y por Caruso y colaboradores (16). La diferencia entre estas tres metodologías es que sólo la reacción de Heck, debido a su mecanismo, favorece la formación de insaturaciones trans. Esta configuración es totalmente necesaria para la electrónica de polímeros ya que permite que la estructura molecular sea planar, requisito primario para obtener altas eficiencias en las propiedades optoelectrónicas de los sistemas conjugados. La configuración molecular de 4 puede ser determinada experimentalmente mediante la identificación de señales características en FT-IR (KBr) y valores de acoplamiento en RMN-1H. La Figura 2 muestra el espectro FT-IR (KBr) para 4, donde se aprecia la presencia de una banda a 968 cm-1, lo que implica la formación de vinilos trans, mientras que la banda alrededor de 690 cm-1 correspondiente al alqueno cis está ausente en el espectro (17, 18). Adicionalmente, las bandas en 1.516 y 1.346 cm-1 correspondientes a las flexiones asimétrica y simétrica del grupo nitro, respectivamente, y la banda a 1.219 cm-1 correspondiente al estiramiento C-O del grupo metoxi corroboran la presencia de estos grupos funcionales en la estructura. Esfuerzos por minimizar la intensidad de la banda a 3.448 cm-1 fueron infructuosos, lo cual sugiere una alta hidrofilicidad de 4, poco documentada para moléculas del tipo fenilvinilideno, pero atribuible a la presencia de los nitro-sustituyentes, lo cual corrobora su alta capacidad a formar puentes de hidrógeno con agua, propiedad buscada en este tipo de moléculas para generar polímeros supramoleculares mediante la formación de puentes de hidrogeno. Por su parte, el espectro de UV-vis muestra un perfil característico para sistemas conjugados tipo fenilvinilideno con un hombro a 355 nm y una máxima de absorción a 443 nm.
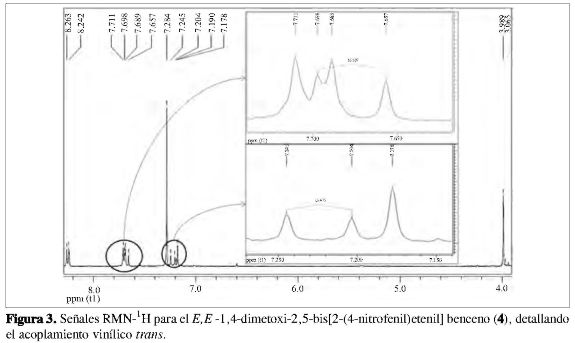
De manera complementaria y confirmando la estereoselectividad del mecanismo de Heck, el análisis del espectro de RMN-1H para 4 muestra la presencia de insaturaciones trans. La señal de los dobletes vinílicos (Figura 3), presenta una constante de acoplamiento de 16,4 Hz, característica para hidrógenos en posición trans sobre carbonos sp2 (18).
Al comparar los rendimientos para la síntesis de 4 obtenidos mediante la reacción de Heck (98%) en este trabajo contra los reportados mediante Wittig (80%) (15) y Knoevenagel (32%) (16) y trabajos nuestros anteriores (40-84%) (9, 10), es evidente que el uso de fosfitos aumenta la eficiencia del sistema catalítico de paladio. Este aumento en eficiencia puede ser debido a una mayor estabilización del catalizador al incrementar la fuerza del enlace entre el Pd-ligante, cuando se va de fosfinas (Pd-C) a fosfitos (Pd-O), lo que evita la muerte prematura del catalizador por precipitación de Pd negro (metálico). Una segunda razón basada en consideraciones electrónicas fue estudiada por nuestro grupo mediante el uso de líquidos iónicos como solvente de reacción (19), lo que mostró un mejoramiento aún mayor en eficiencia catalítica, considerando que los fosfitos aromáticos son, además de un buen donor sigma, un excelente aceptor pi, lo que permite que durante el paso de la coordinación/inserción de la olefina en el ciclo catalítico, el sistema prefiera la disociación del halógeno y la formación de una especie catiónica, la cual se ve favorecida por la presencia de líquidos iónicos como solvente de reacción. Cuando se usan fosfitos y líquidos iónicos, el estudio catalítico permitió obtener TON (por sus siglas en inglés: turn over number) de 33.000 para monoacoplamientos entre metilmetacrilato y haluros de arilo desactivados.
Finalmente, al concordar los resultados obtenidos por J. C. Cárdenas et al. (19) y los obtenidos en este trabajo sobre biacoplamiento por Heck, se puede concluir que la síntesis de sistemas poliméricos tipo fenilvinilideno de alto peso molecular (donde se requieren multiacoplamientos de Heck) con alta estereoselecti-vidad hacia vinilos trans y con altos rendimientos de reacción, es posible, y que el uso de SFV segmentados con altos valores en las propiedades optoelectrónicos para aplicaciones industriales, tales como celdas solares y OLED se puede obtener en corto tiempo.
REFERENCIAS BIBLIOGRÁFICAS
1. Burroughes, J. H.; Bradley, D. D.; Brown, A. R.; Marks, R. N.; Mackay, K.; Friend, R. H.; Burns, P. L.; Holmes, A. B. Ligth-emitting diodes based on conjugated polymers. Nature. 1990. 347: 539-541. [ Links ]
2. Garnier, F.; Hajlaoui, R.; Yassar, A.; Srivastava, P. All-Polymer Field-Effect Transistor Realized by Printing Techniques. Science. 1994. 265: 1684-1686 [ Links ]
3. Friend, R.; Gymer, R. W.; Holmes, A. B.; Burroughes, J. H.; Marks, R. N.; Taliani, C.; Bradley, D. D. C.; Dos Santos, D.; Bredas, J. L.; Loglund, M.; Salaneck, W. R. Electroluminescence in conjugated polymers. Nature. 1999 . 397: 121-128. [ Links ]
4. McGehee, M.; Heeger, A. J. Semiconducting (Conjugated) Polymer as Materials for Solid-State Lasers. Adv. Mater. 2000. 12: 1655-1668. [ Links ]
5. Yang, Z.; Karasz, F. E.; Geiset, H. J. Intrinsically soluble copolymers with well-defined alternating substituted p-phenylenevinylene and ethylene oxide blocks. Macromolecules, 1993. 26: 6570-6575. [ Links ]
6. Grimsdale, A. C.; Chan, K.; Martin, R. E.; Jokisz, P.; Holmes, A. B. Synthesis of light-emitting conjugated polymers for applications in electroluminiscent devices. Chem. Rev. 2009. 109: 897-1091. [ Links ]
7. Pasco, S. T.; Lahti, P. M.; Karasz, F. E. Synthesis of substituted poly (p-phenylenevinylene) copolymers by the Heck method for luminescence studies. Macromolecules. 1999. 32: 6933-6937. [ Links ]
8. Cabri, W.; Candiani, I. Recentdevelopments and new perspectives in the Heck reaction. Acc. Chem. Res. 1995. 28: 2-7. [ Links ]
9. Sierra, C. A.; Lahti, P. M. A photoluminescent, segmented oligo-poly-phenylene vinylene copolymer with hydrogen-bonding pendant chains. Chem. Mat. 2004. 16: 55-61. [ Links ]
10. Sierra, C. A.; Lahti, P. M. A simple multichromophore design for energy transfer in distyrylbenzenes with pyrene pendants. J.Phys.Chem.A. 2006. 110: 12081-12088. [ Links ]
11. Mikroyannidis, J. A.; Stylianakis, M. M.; Sharma, D.; Balraju, P.; Roy, M. S. A novel alternating phenylenevinylene copolymer with perylene bisimide units: synthesis, photophysical, electrochemical, and photovoltaic properties. J. Phys. Chem. C. 2009. 113: 7904-7912. [ Links ]
12. Takasu, A.; Iso, K.; Dohmae, T.; Hirabayashi, T. Synthesis of sugar-substituted poly(phenylenevinylene)s. Biomacromolecules. 2006. 7: 411-414. [ Links ]
13. Aldrich Advancing Science, Chemicals, laboratory equipment 20052006. Sigma Aldrich Corporation, p. 1687. [ Links ]
14. Roldo, M.; Barbu, E.; Brown, J. F.; Laight, D. W.; Smart, J. D.; Tsibouklis, J. Orally administered, colon-specific mucoadhesive azopolymer particles for the treatment of inflammatory bowel disease: An in vivo study. J. Biomedical Mat. Research Part A. 2006. 706-715. [ Links ]
15. Nakaya, T.; Imoto, M. Plastic oscillators. II. The synthesis of some distyrylbenzene derivatives as wavelength shifters in plastic scintillators. Bull. Chem. Soc. Jap. 1966. 39: 1547-1551. [ Links ]
16. Caruso, U.; Casalboni, M.; Fort, A.; Fusco, M.; Panunzi, B.; Quatela, A.; Roviello, A.; Sarcinelli, F. New side-chain polyurethanes with highly conjugated push-pull chromophores for second order NLO applications. Optical Materials 2005. 27: 1800-1810. [ Links ]
17. Yang, Z.; Sokolik, I.; Karasz, F. A soluble blue-light-emitting polymer. Macromolecules. 1993. 26: 11881190. [ Links ]
18. Crews, P.; Rodríguez, J.; Jaspars, M. Organic Structure Analysis (2a. ed.). New York, Oxford University Press. 2010. pp. 415, 153. [ Links ]
19. Cárdenas, J. C.; Fadini, L.; Sierra, C. A. Triphenylphosphite and ionic liquids: positive effects in the Heck cross-coupling reaction. Cat. Comm. 2010. sometido. [ Links ]