INTRODUCCIÓN
El tracto gastrointestinal de los peces es un sistema complejo de órganos, con secciones funcionales bien diferenciadas, donde cada una de ellas presenta condiciones únicas en la digestión de nutrientes (Bucking y Wood 2009), ampliamente variables según el grupo trófico, los hábitos alimentarios, el estadio de desarrollo y el tipo de dieta ingerida por las especies (Goodrich et al. 2020), especialmente en lo que se refiere a la hidrólisis y asimilación de proteínas. La optimización de la digestión proteica en peces juega un rol importante para alcanzar una alta eficiencia y rentabilidad en la piscicultura (Márquez et al. 2012). Varios factores afectan la eficiencia de la digestión proteica en peces, como: predigestión ácida en el estómago, tipo y actividad de proteasas involucradas en la hidrólisis, condiciones intestinales de pH y el tiempo total de reacción para el funcionamiento óptimo de tales proteasas (Márquez et al. 2012).
Los valores de pH en el tracto gastrointestinal difieren tanto entre especies como en individuos de la misma especie (Deguara et al. 2003; Solovyev et al. 2015; Yúfera et al. 2012). Generalmente, estos valores fisiológicos de pH no son similares a los valores de pH óptimos para la actividad enzimática gastrointestinal de las especies (Solovyev et al. 2016). Valores óptimos de pH para la máxima eficiencia de las enzimas digestivas demostradas in vitro, como el caso de la pepsina, se encuentran en el rango de 2,00 a 3,00, según lo reportado para varias especies como Clariusguriepinus, Oncorhynchus mykiss, Scophthalmus maximus, Sparus aurata (Deguara et al. 2003; Munilla-Morán y Saborido-Rey 1996; Uys y Hecht 1987). Esta situación podría causar variaciones en la acción óptima de la pepsina (por los altos valores del pH estomacal presentados en algunas especies de peces), así como en la actividad proteolítica durante el tránsito gastrointestinal. Por ejemplo, O. mykiss presenta un rango de pH gástrico entre 3,40 y 3,80, S. aurata, entre 2,50 y 5,50, y Piaractus mesopotamicus, entre 3,00 y 5,12, respectivamente (Deguara et al. 2003; Gonçalves-França et al. 2017; Sugiura et al. 2006).
El conocimiento de los valores fisiológicos del pH complementa los diversos estudios relacionados a la actividad enzimática y la capacidad digestiva de las diversas especies de peces en cultivo, y esto puede mejorar el proceso de manejo alimentario y la actividad acuícola (Hlophe et al. 2014; Solovyev et al. 2016). Sin embargo, es necesario aún disponer de información detallada sobre la variación de los valores de pH en diferentes segmentos del tracto gastrointestinal y sus efectos sobre la actividad enzimática que ayuden a entender un poco más sobre el ritmo circadiano digestivo de los peces (Solovyev et al. 2016).
Por tanto, el objetivo de este trabajo fue conocer la variación de los niveles de pH en el tracto digestivo de juveniles de "paco" (Piaractus brachypomus) y "lisa amazónica" (Schizodon fasciatus) en condiciones experimentales.
MATERIALES Y MÉTODOS
Declaración de ética
El Comité Institucional de Ética en Investigación con Animales y Biodiversidad de la Universidad Científica del Sur, con fecha 18 de septiembre de 2018, aprobó las actividades de este proyecto de investigación según Constancia N.° 14-CIEI-AB-CIENTÍFICA-2018.
Localización
El presente estudio fue desarrollado en las instalaciones del Centro Experimental Ambiental (CEA) de la Carrera de Ingeniería Ambiental de la Facultad de Ciencias Ambientales de la Universidad Científica del Sur, ubicado en el distrito de Villa El Salvador, provincia y departamento de Lima, Perú.
Condiciones experimentales
Juveniles de P. brachypomus (n=21) de 58,25 ± 0,57 g de peso húmedo total (PHT) y 14,23 ± 0,12 cm de longitud total (LT), y S. fasciatus (n=21) de 53,65 ± 4,61 g de PHT y 17,38 ± 0,94 cm de LT, provenientes de la empresa "Aquacultura Tambopata", ubicada en Puerto Maldonado (Madre de Dios, Perú), fueron trasladadas a las instalaciones del CEA de la Universidad Científica del Sur (Lima, Perú). Los peces se acondicionaron por dos semanas en tanques circulares de fibra de vidrio reforzado (250 L) a una densidad de siete individuos por tanque, separados por especie, y se verificó que no presentaran enfermedades y tuvieran un buen comportamiento alimentario.
Sistema de cultivo
Los ejemplares de P. brachypomus y S. fasciatus se mantuvieron en un sistema de recirculación conformado por seis unidades de tanques circulares de fibra de vidrio reforzado de 250 L, con caudal de 0,80 L min-1, equipado con filtros mecánicos y biológicos, calentadores con termostato (27 °C), aireación constante por una bomba de aire (0,035Mpa, 70L/ min., 80W, 220-240 V/50Hz), y se conservaron los parámetros de calidad de agua óptimos para peces amazónicos (27 °C, 5,00 mg O2 L-1, pH 7,20, y 0,025 NH3/NH4+ L-1). El experimento se manejó con un fotoperiodo de 12 horas luz y 12 horas de oscuridad. Además, los tanques se cubrieron con mallas de nylon para evitar que los peces se escaparan. Los individuos de P. brachypomus se mantuvieron en tres tanques circulares, mientras que los individuos de S. fasciatus, en los otros tres tanques.
Alimentación
Los peces se alimentaron por una semana con una dieta mixta (DM 1:1) conformada por alimento balanceado Aquatech 35 Tilapia (35,00% de proteína bruta, 5,00% de lípidos, 4,00% de fibra, 1,20% de calcio y 0,80% de fósforo) y músculo de corazón de pollo (previo retiro de cartílago y grasa, y posterior lavado con solución salina). Esta dieta mixta fue empleada para garantizar un mejor consumo del alimento por parte de los peces, dado que la inclusión del ingrediente cárnico permitió una mejor atractabilidad de las dietas. La alimentación se suministró a saciedad aparente en una frecuencia de tres veces al día.
Determinación de pH gastrointestinal
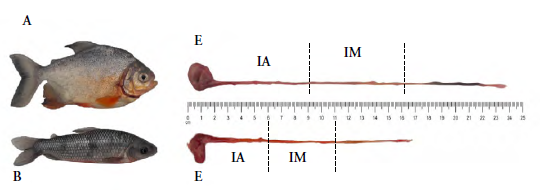
Después de tres semanas en condiciones de cultivo controlado, se procedió con la cuantificación del pH en el sistema gastrointestinal de P. brachypomus (n = 21) con 69,74 ± 7,44 g de PHT y 14,84 ± 0,85 cm de LT y S. fasciatus (n=21) con 65,32 ± 13,95 g de PHT y 18,15 ± 1,06 cm de LT, respectivamente. Los peces fueron sometidos con anterioridad a un periodo de ayuno por 24 horas, considerado suficiente para la evacuación gástrica completa (Hlophe et al. 2014). Luego se procedió a medir el pH antes de la alimentación (hora 0) y posterior de ingerir la DM (hora 1, 2, 3, 4, 6 y 8). En cada hora de evaluación se sacrificaron tres organismos por especie (un ejemplar por tanque, totalizando tres por hora de evaluación según especie), empleando una solución de benzocaína de 100 mg/L, según Neiffer y Stamper (2009) y se procedió a disectar a los organismos por la zona abdominal, con la finalidad de reconocer y extraer el estómago (E) y el intestino anterior (IA) y medio (IM) por cada individuo sacrificado. Cada porción intestinal recolectada consideró cerca de un tercio de la longitud intestinal. Finalmente, el pH gastrointestinal se midió utilizando un pHmetro EcoSense pH100A Meter (YSI, Estados Unidos), con un electrodo de pH con punta tipo lanza (PE06HD, Lutron), el cual se introdujo en cada sección del sistema digestivo (figura 1), según los tiempos establecidos.
Análisis estadístico
Los valores de pH obtenidos en las diferentes secciones del tracto gastrointestinal de ambas especies se sometieron a las pruebas estadísticas de Jarque-Bera y Barlett para verificar la distribución normal y homogeneidad de varianzas de los datos, respectivamente. Para este análisis, se consideraron los tres segmentos gastrointestinales, estómago (E), intestino anterior (IA) e intestino medio (IM) como unidades experimentales en grupos, aplicando la prueba ANOVA a dos vías (p < 0,05), para determinar diferencias significativas considerando los factores de especie y hora, posteriormente, se utilizó la prueba Tukey. Para el análisis estadístico, se utilizó el programa RStudio V 4.0.3.
RESULTADOS
Estómago
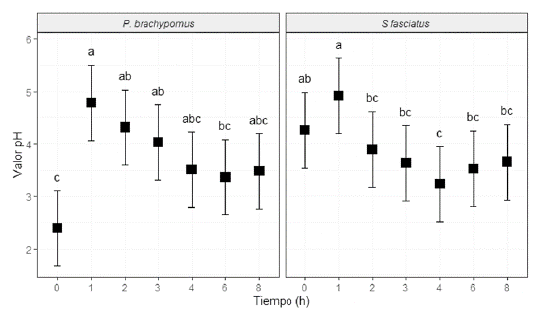
El efecto del tiempo sobre los valores de pH posprandial en el estómago mostró diferencias significativas en ambas especies (p < 0,05) frente a las demás porciones intestinales evaluadas. Previo a la alimentación, los valores de pH fueron de 2,39 ± 0,31 en P. brachypomus y de 4,47 ± 0,00 en S. fasciatus. A la primera hora posterior a que los peces consumieran la DM, se observó un incremento del pH en los estómagos de todos los organismos (figura 2). Para el caso de P. brachypomus, luego de la segunda hora en que los individuos se alimentaran, se evidenció que el pH volvió a disminuir hasta la sexta hora, con un posterior incremento al finalizar el experimento para todas las evaluaciones. En el caso de S. fasciatus, la tendencia a disminuir después de la segunda hora siguió hasta la cuarta hora, luego del cual se observó un incremento de los valores de pH más evidente hasta la octava hora posprandial, en comparación con P. brachypomus (figura 2). Estas diferencias observadas en ambas especies, de preferencias alimentarias por frutos y material vegetal, podrían estar influenciadas por el tipo de dieta utilizada y su efecto tampón.
Intestino anterior
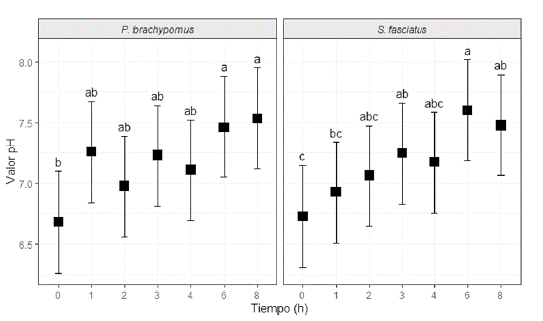
El efecto del tiempo sobre los valores de pH posprandial generó diferencias significativas en S. fasciatus (p < 0,05), lo cual parece indicar que el estado de alimentación, con DM, afecta al pH en esta sección intestinal para esta especie herbívora. Los datos de pH en el intestino anterior para S. fasciatus y P. brachypomus indican que antes de la alimentación se encuentran entre 7,04 ± 0,00 a 7,31± 0,10, lo cual hace referencia a un entorno neutro. A partir de la primera hora de alimentación con DM, se puede observar que el pH se incrementa para las dos especies, hasta la segunda hora (figura 3). Sin embargo, el pH para P. brachypomus disminuye a la tercera y cuarta hora posterior a la ingestión del alimento, y a partir de ese momento, se evidencia un incremento desde la sexta hora hasta finalizar las evaluaciones de pH (figura 3). En el caso de S. fasciatus, se determinó que el pH continúa aumentando desde la segunda hasta la octava hora, posterior al consumo de la DM. Todas las variaciones son mínimas (figura 3).
Fuente: elaboración propia.
FIGURA 3 Valores de pH del intestino anterior de P. brachypomus y S. fasciatus durante el proceso digestivo (ocho horas). Letras distintas indican diferencias significativas entre horas de digestión en el intestino anterior para cada especie (p < 0,05). Ausencia de letras indica que no existe diferencia significativa.
Intestino medio
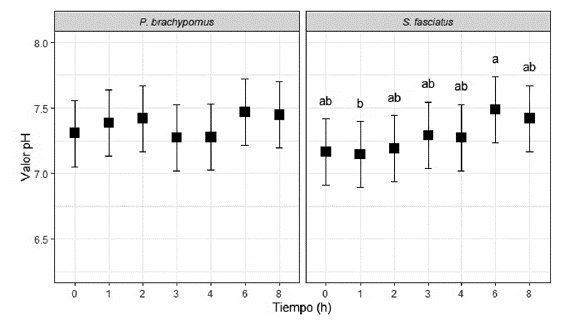
El efecto del tiempo sobre los valores de pH posprandial en este segmento gastrointestinal presentó diferencia significativa para ambas especies (p < 0,05). El pH del intestino medio para P. brachypomus y S. fasciatus es ligeramente menor, en comparación con el pH del intestino anterior en todas las evaluaciones previas a la alimentación con DM (figura 4). Al analizar las variaciones de pH durante el consumo de DM, se aprecia un aumento de este desde la primera hasta la tercera hora, y luego se observa su reducción hacia la cuarta hora de alimentación (figura 4). Finalmente, a la sexta y octava hora de consumo de la DM, ocurre un incremento del pH para todos los ejemplares (figura 4).
DISCUSIÓN
En teleósteos, se han descrito dos estrategias básicas de acidificación gástrica. Por una parte, especies que mantienen una acidificación permanente en el estómago y, por otra parte, especies que mantienen un ambiente luminal neutro entre comidas. Además, la acidificación gástrica solo se inicia al entrar el alimento en el estómago, y los valores neutros se recuperan cuando este se vacía (Solovyev et al. 2015; Yúfera et al. 2012). Especies que presentan una acidificación permanente pueden tener una subida de pH gástrico motivada por el efecto tampón del alimento ingerido (Bucking y Wood 2009).
El pH observado para P. brachypomus (pH = 2,39 ± 0,31) mostró una acidificación gástrica en ayunas, como también se ha reportado para juveniles de P. mesopotamicus (pH = 1,47) (Gonçalves-França et al. 2017). Esta situación podría sugerir la estrategia de la especie al ingerir alimentos de difícil digestión, creando un ambiente ácido en el estómago (García Gallego y Sanz Runs 2009). P. brachypomus se caracteriza por su carácter omnívoro frugívoro y preferencia por granos duros, restos de vegetales, así como por frutas de cortezas resistentes (Guimarães y Martins 2015), materiales difícilmente digeribles a pesar de su grupo trófico.
La acidificación gástrica permanente también ha sido descrita en especies de hábitos carnívoros, como O. mykiss y juveniles de Rachycentron canadum, los que presentaron un estómago permanentemente ácido, con pH gástrico luminal de 2,72 y 2,76, respectivamente (Bucking y Wood 2009; Yúfera et al. 2016).
En S. fasciatus, el valor de pH estomacal sobre valores de cuatro en situación de ayuno evidenciaría también una estrategia de acidificación permanente. No existen reportes sobre la variación de pH a nivel del tracto digestivo para S. fasciatus o de alguna especie del género Schizodon que permitan corroborar los valores encontrados en este estudio. Diversas especies de este género han sido descritas como herbívoras, teniendo como preferencia alimentaria macrófitas C4 (Forsberg et al. 1993; Jepsen y Winemiller 2007; Manetta et al. 2003), vegetales caracterizados por poseer la ruta del ácido carboxílico para la fijación de carbono, y ser una fuente alimenticia pobre para la mayoría de los herbívoros (Caswell et al. 1973).
Para el caso de S. fasciatus,Soares y Almeida (1986) mencionan que esta especie es de gremio trófico herbívoro, consumiendo macrófitas acuáticas, perifiton, algas, raíces, hojas y frutos del bosque inundable; mientras que Mérona y Rankin-de-Mérona (2004) sostienen en su estudio una preferencia exclusiva por hojas. Estudios en Tilapia rendalli y Oreochromis mossambicus, herbívoros que se alimentan de macrófitas y algas, presentaron valores de pH estomacal por encima de 4,00 (Hlophe et al. 2014), similar a lo reportado en este estudio. Sin embargo, el resultado obtenido debe tomar en cuenta las condiciones del experimento, que consideró una dieta mixta con un ingrediente cárnico húmedo para una especie herbívora.
El aumento del pH posterior a la ingesta de alimento en P. brachypomus y S. fasciatus puede relacionarse con el proceso de neutralización, debido al consumo de agua asociado a la alimentación, lo que ocasiona la dilución de las secreciones ácidas del estómago, así como la capacidad buffer del alimento (Bucking y Wood 2006; Bucking y Wood 2009; Kristiansen y Rankin 2001). Esta variación en el ritmo posprandial ha sido reportada para P. mesopotamicus (Gonçalves-França et al. 2017), así como especies de hábitos alimentarios diferentes como O. mykiss, aunque no el mismo grado, y R. canadum (Bucking y Wood 2009; Sugiura et al. 2006; Yúfera et al. 2016).
La rápida disminución del pH gástrico en P. brachypomus y S. fasciatus, luego de alcanzar el máximo ascenso en la primera hora posprandial, puede atribuirse a la expulsión y absorción de líquidos, y pareciera tener relación con la alcalinidad y dureza del agua utilizada en el experimento, y que debe ser demostraba en estudios posteriores. De acuerdo con Bucking y Wood (2009), el alto grado de disolución de Ca2+ y Mgf + en la fase fluida del quimo gástrico se correlaciona con grandes tasas de absorción del estómago y, por consiguiente, una disminución del pH gástrico. Si bien es cierto que no se hizo una medición de alcalinidad y dureza, es sabido que las aguas donde se realizó el estudio se caracterizan por su alta dureza.
Otra explicación a la disminución rápida del pH estomacal puede deberse a los procesos digestivos posprandiales. La presencia de alimento en el estómago estimula la secreción de ácido gástrico, una mezcla de ácido y enzimas digestivas, ocasionando la disminución del pH (Deguara et al. 2003, Gonçalves-França et al. 2017), lo que justificaría los cambios en los valores de pH del estómago observados en este estudio. Resultados similares fueron reportados para alevinos y juveniles de S. aurata (Márquez et al. 2012; Yúfera et al. 2004), así como una tendencia similar para juveniles de T. rendalli (Hlophe et al. 2014) en las siguientes ocho horas posprandial.
Otra razón que explica la tendencia decreciente del pH posprandial estaría relacionada con el tipo de alimento. Taylor y Grosell (2006) demostraron que los perfiles de pH de cada dieta influencian en su capacidad buffer y, por consiguiente, en los valores del pH gástrico posprandial, lo cual explica situaciones de mayor acidificación o no, independiente de los valores preprandiales. Papastamatiou y Lowe (2004) reportaron para tiburón leopardo (Triakis semifasciata) alimentado con calamar una tendencia similar a lo encontrado en nuestro estudio, con un aumento inicial del pH gástrico, seguido de una rápida disminución del pH. Esta variación posprandial puede ser afectada con la digestibilidad inherente de la presa, el contenido de lípidos y energía y la presencia de colágeno en el tejido de la presa.
Los rangos de pH gástrico medido durante la digestión en ambas especies fueron similares, 3,36 ± 0,35 - 4,78 ± 0,17 y 3,23 ± 0,33 - 4,73 ± 0,28, respectivamente. Esta situación apuntaría a una capacidad limitada de los juveniles de P. brachypomus y S. fasciatus para alcanzar las condiciones óptimas de la acción enzimática de la pepsina. Esta limitación podría deberse a las características de la dieta suministrada, en vista de que las especies estudiadas tienen una preferencia alimentaria por los frutos y material vegetal. La dieta suministrada puede cambiar o causar una modificación en la actividad enzimática (Enes et al. 2015). Además, la información sobre las características de los pepsinógenos y las pepsinas de los peces tropicales de agua dulce, sobre todo de las especies de este estudio, es limitada.
Dada la anatomía funcional del estómago y el intestino, se evidencia un cambio de niveles o valores de pH de ácido a alcalino, debido a la neutralización del quimo, a medida que ingresa al intestino anterior (Gonçalves-França et al. 2017; Grosell et al. 2005; Taylor y Grosell 2006; Wilson et al. 2002). Esta neutralización se debe a la bilis, la secreción activa de HCO3 - por parte del páncreas, y el HCO3 - suministrado por un aumento del intercambio apical Cl- / HCO3 - (Grosell et al. 2005; Taylor y Grosell 2006; Wilson et al. 2002).
En el caso de P. brachypomus, las variaciones del pH a lo largo de las horas evaluadas no mostraron cambios significativos para la sección del intestino anterior (7,27±0,10 a 7,47±0,06). Estos resultados presentan las mismas particularidades a los reportados en P. mesopotamicus, así como en juveniles de S. aurata (Gonçalves-França et al. 2017; Yúfera et al. 2004). Esto parece indicar que el estado de alimentación no afecta fuertemente al pH en esta sección intestinal. La creación de ambientes ácidos en el estómago permitiría un quimo que pueda ser hidrolizado sin inconvenientes por parte de las enzimas pancreáticas en el intestino anterior y su aprovechamiento en el intestino medio. Las condiciones alcalinas permiten mantener la integridad del epitelio intestinal y la actividad de las enzimas pancreáticas e intestinales (Bucking y Wood 2009).
Estudios realizados parecen indicar que especies con digestión estomacal más ácida son capaces de alcalinizar rápidamente el intestino anterior, tal como se ha observado en Dicentrarchus labrax L. (Nikolopoulou et al. 2011). Sin embargo, en el presente estudio, los valores del pH a nivel intestinal estuvieron en un ambiente de neutro a ligeramente alcalino, pasando de pH = 7,31 ± 0,10 (preingesta) a pH = 7,42 ± 0,18 (segunda hora posprandial). Esta situación probablemente se debería a una baja actividad del intercambiador apical Cl- / HCO3 -, el cual secreta de manera adicional HCO3 -, amortiguando el H+ secretado y liberado con el quimo gástrico, y de esta forma, incrementa el pH de la luz intestinal (Bucking y Wood 2009; Taylor y Grosell 2006; Taylor et al. 2007). Se desconoce su accionar en los procesos de digestión en los peces neotropicales.
No se observó un aumento de la alcalinidad en el intestino medio con relación al intestino anterior para P. brachypomus y S. fasciatus. Esta situación difiere de lo reportado en D. labrax L., O. mykiss, S. aurata, T. rendalli y O. mossambicus (Bucking y Wood 2009; Hlophe et al. 2014; Nikolopoulou et al. 2011; Yúfera et al. 2004). La alcalinidad tiende al aumento mientras se avanza distalmente a lo largo del intestino, pasando de un promedio de pH de 6,00 a 8,00 (intestino anterior) a una media de 7,00 a 9,00 (intestino inferior). (Deguara et al. 2004). El incremento de la alcalinidad responde a la acumulación de secreciones de HCO3 - en el quimo por parte del intercambiador Cl-/HCO3 - (Bucking y Wood 2009). Una explicación sugerida radicaría en que el intercambiador apical Cl-/HCO3 - no tendría una secreción activa de HCO3 - en peces neotropicales.
En la sección del intestino anterior y medio de S. fasciatus, las diferencias significativas encontradas permitirían establecer la influencia de la alimentación sobre los valores del pH posprandial, probablemente mediado por las condiciones digestivas de la especie según sus hábitos alimentarios. S. fasciatus ha sido descrita como una de las raras especies capaces de alimentarse de macrófitas C4 (Forsberg et al. 1993; Mortillaro et al. 2015). Estas macrófitas no son una preferencia alimentaria por la mayoría de los peces en los ecosistemas amazónicos, debido a su baja digestibilidad aún para los herbívoros, sin embargo, presenta alta cantidad de ácidos grasos esenciales y poliinsaturados (Caswell et al. 1973; Mortillaro et al. 2015).
Es probable que S. fasciatus haya desarrollado ciertas caracterizaciones de su fisiología digestiva para el aprovechamiento de material alimenticio difícilmente digeribles. Esto podría explicar las diferencias significativas encontradas a lo largo del tiempo de digestión. La longitud intestinal corta observada en nuestro estudio parecería indicar un hábito diferente a lo reportado, y no quedaría claro porque S. fasciatus presenta esta particularidad. No existen estudios al respecto que permitan entender esta configuración gastrointestinal, siendo importante realizar un estudio enfocado en esta región gastrointestinal para esta especie.
En el presente estudio, el análisis de la variación del pH gastrointestinal se centró durante las primeras ocho horas de digestión, con una dieta en particular y similar para ambas especies. No todos los peces exhiben un mismo patrón de respuesta del pH gastrointestinal al consumo de alimentos. Las variaciones pueden deberse a diferencias en la metodología del estudio, como la técnica y horas de medición, el intervalo de muestreo, el tamaño y composición del alimento, y por la naturaleza de la especie (Papastamatiou y Lowe 2004). Estos factores se deben considerar para una comprensión más precisa de la variación del pH gastrointestinal antes y durante la alimentación de peces amazónicos, P. brachypomus y S. fasciatus, donde el conocimiento generado pueda mejorar su rendimiento en actividades de cultivo.
CONCLUSIÓN
Existe variación en los ritmos del pH gástrico e intestinal en relación con la degradación y asimilación de la dieta, según las características alimenticias de cada especie. De acuerdo con las variaciones de pH estomacal, juveniles de P. brachypomus y S. fasciatus presentan una acidificación gástrica permanente como estrategia digestiva a lo largo de las primeras ocho horas de digestión. A nivel intestinal, ambas especies presentan una alcalinización ligera, sin embargo, es más marcada en S. fasciatus en función al tiempo de digestión, probablemente debido a la estrategia de digestión de sus preferencias alimentarias.