Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.39 no.1 Bogotá Jan./Mar. 2011
https://doi.org/10.5554/rca.v39i1.54
http://dx.doi.org/10.5554/rca.v39i1.54
Artículo de Revisión
Síndrome doloroso regional complejo
René F. Rodríguez*, Ana María Ángel Isaza**
* Anestesiólogo, docente Universidad Libre Cali. Clínica del Dolor y Cuidados Paliativos de la Clínica Rafael Uribe Uribe. Grupo Investigación CADPAL. Cali, Colombia.
** Universidad Libre Cali. Grupo Investigación Clínica para el Alivio del Dolor y Cuidados Paliativos CADPAL. Cali, Colombia, anaangelmd@hotmail.com.
Recibido: junio 21 de 2010. Enviado para modificaciones: agosto 4 de 2010. Aceptado: agosto 8 de 2010.
RESUMEN
Introducción. El síndrome doloroso regional complejo (SDRC) es una entidad que se presenta después de una lesión. Sus principales características son dolor, cambios en la coloración y temperatura de la piel, edema y cambios tróficos.
Objetivo. Presentar una revisión actualizada de la literatura para mejorar la comprensión de este síndrome.
Metodología. Se seleccionaron 48 artículos de revistas indexadas y 4 capítulos de libros sobre medicina del dolor.
Conclusión. El SDRC suele ser de difícil manejo, y de no ser tratado adecuadamente, la funcionalidad de la extremidad afectada puede verse comprometida. El diagnóstico temprano y el manejo oportuno reducen la severidad y duración de esta entidad.
Palabras clave: Síndromes del Dolor Regional Complejo, dolor, Causalgia, Nervios periféricos, Hiperalgesia. (Fuente: DeCS, BIREME).
INTRODUCCIÓN
El síndrome doloroso regional complejo (SDRC) es una entidad que aparece generalmente después de un trauma. Existen dos tipos de SDRC: el tipo I, llamado anteriormente distrofia simpática refleja, caracterizado porque el trauma no afecta los nervios, como sucede en esguinces, algunas fracturas, trauma quirúrgico, contusiones o distensiones; el tipo II, antes llamado causalgia, se desencadena después de una lesión que compromete un nervio periférico (1).
La primera descripción de causalgia se remonta a los tiempos de la Guerra Civil estadounidense, en la que sir Weir Mitchell, uno de los padres de la neurología moderna, observó que los soldados heridos con lesiones mayores en los nervios de las extremidades experimentaban episodios prolongados de dolor quemante; Mitchell le asignó el nombre de causalgia, del griego kausos, que significa calor, y algos, dolor (1-3). El término distroia simpática releja fue introducido en la literatura por Evans, en 1946 (4). En 1994, la Asociación Internacional para el Estudio del Dolor (IAPS) introdujo el término síndrome doloroso regional complejo para describir este desorden doloroso (5).
DEFINICIÓN
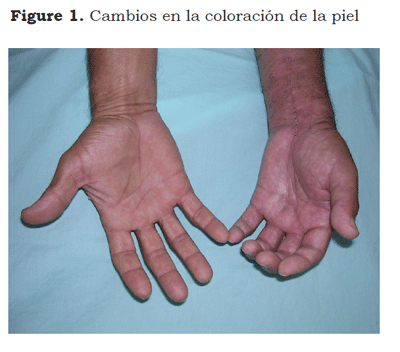
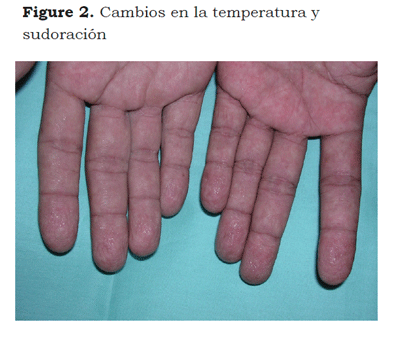
El SDRC describe una variedad de condiciones dolorosas, secundarias generalmente a una lesión; incluye dolor regional sin relación con territorios nerviosos individuales o con la localización de la lesión desencadenante; el dolor puede ser urente, espontáneo o provocado por estímulos no nociceptivos mecánicos o térmicos (alodinia), por el movimiento o la presión de las articulaciones (hiperalgesia somática profunda). El dolor se acompaña de edema, cambios de coloración en la piel (Figura 1), en la temperatura, en la sudoración (Figura 2) y pueden presentarse alteraciones funcionales y debilidad muscular. Algunos pacientes presentan temblor postural o cambios tróficos. Se diferencia de otros síndromes neuropáticos por la presencia de edema, cambios vasomotores y sudomotores (6).
DIAGNÓSTICO
El diagnóstico es clínico, por lo cual es indispensable realizar una adecuada historia clínica. Existen criterios para facilitar la identificación de SDRC; sin embargo, existe polémica acerca de cuántos de los criterios deben cumplirse. Según la IASP, las características necesarias para establecer el diagnóstico del SDRC (5) son:
1. La presencia de un evento nocivo desencadenante.
2. Dolor espontáneo o alodinia/hiperalgesia no limitado al territorio de un único nervio periférico, desproporcionado al evento desencadenante.
3. Evidencia, en algún momento, de edema, cambios en el flujo sanguíneo cutáneo o actividad sudomotora anormal en la región afectada.
4. Ausencia de otras condiciones que de alguna forma expliquen las manifestaciones clínicas. Los últimos tres criterios son necesarios para hacer el diagnóstico de SDRC tipo I.
Estudios de validación de los criterios de la IASP han demostrado que poseen una alta sensibilidad con baja especificidad, lo que lleva a que algunas enfermedades sean diagnosticadas como SDRC sin serlo.
Si bien la IASP define el dolor como desproporcionado al evento desencadenante, es frecuente que algunos pacientes presenten dolor de leve intensidad, incluso algunos presentan todos los signos y síntomas sin presentar dolor; en estos casos, existiría una "desproporción" en cuanto a la duración del síntoma en relación con el curso clínico correspondiente al trauma, pero no en relación con la intensidad.
Además de los criterios diagnósticos mencionados por la IASP, otros autores han propuesto algunas modificaciones, dentro de los que se destacan Bruehl (7) y Veldman (8). Los criterios diagnósticos de Bruehl también tienen una alta sensibilidad; éstos son:
1. Dolor continuo desproporcionado al evento desencadenante.
2. Reporte de al menos un síntoma (historia) en cada una de las siguientes categorías: sensorial (hiperestesia, hiperalgesia y/o alodinia); vasomotora (cambios en la temperatura y/o en el color de la piel); sudomoto-res/edema (sudoración asimétrica, edema); motor/trófica (arcos de movilidad articular disminuidos y/o disfunción motora, debilidad, temblor, distonía y/o cambios tróficos en vellos, uñas, piel).
3. Reporte de al menos un signo en dos o más de las siguientes categorías: sensorial: evidencia de hiperalgesia (al pinchazo) y/o alo-dinia (al tacto suave); vasomotor: evidencia de asimetría en la temperatura y/o cambio en la coloración de la piel y/o asimetría en el color de ésta; sudomotor/edema: evidencia de edema y/o cambios en la sudoración y/o sudoración asimétrica; motor/tróico: evidencia de disminución en la movilidad y/o disfunción motora (debilidad, temblor, distonía) y/o cambios tróicos (vellos, uñas, piel)
En algunos casos, los pacientes presentan un cuadro clínico acompañado de diferentes cambios vasomotores, motores y edema, sin presentar dolor; los criterios de Veldman son los únicos que permiten hacer un diagnóstico de SDRC en ausencia de dolor:
1. Cuatro o cinco de los siguientes aspectos: dolor difuso inexplicable, cambios en la coloración de la piel al comparar con la otra extremidad, edema difuso, cambios en la temperatura de la piel de una extremidad al compararla con la otra, arcos de movilidad articular disminuidos.
2. Presencia o incremento de los signos anteriores después de la actividad.
3. Presencia de los signos anteriores en un área mayor a la inicialmente afectada o inclusión del área distal a la afectada inicialmente.
DIAGNÓSTICO DIFERENCIAL
El diagnóstico diferencial debe hacerse con otras condiciones neuropáticas, como diabetes, neuropatías periféricas y por atrapamiento, trombosis venosas profundas, celulitis, insuficiencia vascular, linfedema, artritis, enfermedad de Raynaud y esclerodermia, entre otras (9).
Pruebas diagnósticas. Ningún examen de laboratorio o paraclínico sirve para confirmar el diagnóstico de SDRC, sin embargo, pueden ayudar a establecer el diagnóstico diferencial (10). Ocasionalmente, exámenes neurofisiológicos ayudan a diferenciar una radiculopatía o una lesión nerviosa periférica con el SDRC (3). No se ha comprobado que un tipo de personalidad en particular o características psicológicas predispongan a la persona para sufrir el SDRC (11).
En las radiografías se puede identificar desmineralización del hueso y disminución de la calcificación, principalmente en el área periarticular, aunque este cambio no es específico del SDRC; la desmineralización ósea se ha atribuido a la inmovilización de la extremidad (12). En algunas etapas de la enfermedad se encuentran diferentes tipos de alteraciones en la gammagrafía ósea.
Existen pruebas complementarias, como la del reflejo sudomotor, que es un índice indirecto de la actividad simpática, al medir de forma cuantitativa la producción de sudor de la extremidad afectada (13). Al igual que ésta, la termografía, la respuesta de conducción eléctrica de la piel, la evaluación del flujo sanguíneo cutáneo con Do-ppler láser, son pruebas más de uso investigativo que de utilización en la práctica clínica (3).
Las manifestaciones clínicas del SDRC no permiten determinar si el sistema nervioso simpático está involucrado en la generación y mantenimiento del dolor del SDRC. Los anestésicos locales, la guantenidina, por su efecto noradrenérgico en los axones simpáticos posganglionares y de depleción de las reservas de norepinefri-na, y la fentolamina, por su efecto antagonista α-adrenérgico, se utilizan mediante técnicas diversas, como infusión intravenosa o bloqueos regionales, para determinar si el dolor es mantenido por el simpático; esto ayuda a orientar el manejo terapéutico (14).
EPIDEMIOLOGÍA
En una reciente publicación, Mos y cols. estimaron la tasa de incidencia del SDRC, en 26,2 por 100.000 habitantes año. Este dato es cuatro veces mayor al reportado anteriormente por Sandoni, en el que se encontró una incidencia de 5,46 por 100.000 habitantes. El SDRC es tres veces más frecuente en mujeres que en hombres entre los 61-70 años (15,16). En el 65 % de los casos, la etiología está ligada con el trauma (8). No hay ninguna correlación entre la severidad de la lesión y el surgimiento del SDRC (7). El SDRC puede ser también consecuencia de un proceso distante, como una lesión cerebral, espinal o infarto del miocardio (17).
Kiralp y cols. reportan que la extremidad superior se afecta en el 61,3 % de los casos, mientras que la inferior, en el 38,7 % (18). Tanto Veldman como Kiralp confirman que el evento precipitante más común del SDRC es una fractura (8,18). En aproximadamente el 10 % de los casos no se identifica un factor desencadenante. Los factores psicológicos, como el estrés, son potenciales factores de riesgo para empeorar la severidad de los síntomas (7).
Estos datos difieren de los encontrados en el Valle del Cauca, Colombia, donde se encontró una incidencia de 1,1 por 100.000 habitantes con SDRC de los miembros superiores, con una relación hombre mujer de 1:1,1, edad promedio de 44 años, compromiso bilateral en 5 %, afección del lado derecho en 56 %, y entre los síntomas se reportaron cambios en la sudoración en 96 %, cambios en la temperatura en 92 % y cambios en la coloración en 90 % (19).
FISIOPATOLOGÍA
La fisiopatología del SDRC aún no ha sido completamente entendida. Múltiples mecanismos desempeñan un papel importante en su génesis y mantenimiento. Esto incluye inflamación neurogénica, mecanismos inmunológicos, cambios en el sistema nervioso simpático periférico y central (20,21), que se manifiestan como alteraciones sensoriales, motoras, vegetativas simpáticas e inflamatorias.
Según el estudio realizado por Schürmann y cols., las alteraciones del sistema nervioso simpático en pacientes con SDRC I son sistémicas y no limitadas al área afectada (22). Los síntomas y signos que caracterizan la hipoactividad simpática (extremidad tibia) generalmente cambian a signos y síntomas de hiperactividad simpática (extremidad fría y húmeda), debido a la sensibilidad adrenérgica. La actividad simpática agrava trastornos vasculares asociados con la inflamación. La disfunción simpática parece originarse en el sistema nervioso central en pacientes sin lesión periférica del nervio (23).
Estudios clínicos sobre el funcionamiento autonómico en pacientes con SDRC tipo I han demostrado anormalidades de los reflejos neurogénicos simpáticos y termorreguladores, como también en el mecanismo del sudor y de la temperatura de la piel y en la respuesta microcircu-latoria, tanto a reflejos periféricos como a estímulos centrales autonómicos (24).
Las neuronas espinales pueden aumentar su sensibilidad como respuesta al bombardeo nociceptivo perpetuado por los cambios autonómicos; en el espacio supraespinal puede ocurrir una reorganización de la corteza somatosensorial primaria, como en los pacientes amputados, demostrada mediante resonancia magnética funcional (4), por lo que se afirma que en la génesis del SDRC están implicados todas las escalas del procesamiento nociceptivo (periférico, medular, supramedular y cortical) (25).
Se ha planteado que los déficits hemisensoria-les observados en algunos pacientes pueden estar asociados con trastornos funcionales en el procesamiento de los estímulos nociceptivos en el núcleo ventral postalámico y, así, los déficits sensoriales generalizados podrían ser una consecuencia de la plasticidad cerebral subcortical en el dolor crónico o de origen inflamatorio central (26-28).
Dentro de los mecanismos fisiopatológicos se postulan procesos inflamatorios y neuroinmunológicos, debido al incremento de diferentes interleuquinas, factor de necrosis tumoral y el péptido relacionado con el gen de la calcitonina, presentes en la extremidad afectada (29,30). La inflamación neurogénica está involucrada en la formación de edema, vasodilatación y aumento de la sudoración.
Las alteraciones en la movilidad del miembro afectado, temblor, disminución de la fuerza motora activa y distonía, principalmente en los casos crónicos, se originan probablemente por cambios en la actividad de las neuronas motoras centrales. Se puede concluir, entonces, que en la fisiopatología del SDRC están involucrados mecanismos inflamatorios, principalmente en la fase aguda; mecanismos autonómicos, sensoriales y motores.
MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas se presentan, generalmente, después de un trauma (fracturas, luxaciones, esguinces, accidentes) que afecta la parte distal de una extremidad y se caracteriza por la presencia de dolor, cambios autonómicos, cambios tróficos y de la funcionalidad del miembro afectado.
El dolor puede ser espontáneo o inducido, de intensidad variable, punzante, quemante, tipo ardor, lancinante, que se intensifica con estímulos externos, como cambios de temperatura (alodinia térmica), tacto o presión (alodinia mecánica), o por factores emocionales, como la ansiedad y el estrés. Presenta un componente ortostático, con reducción de la intensidad cuando el miembro es elevado y aumento cuando se mantiene abajo (31).
Los signos y síntomas autonómicos se caracterizan por alteraciones vaso y sudomotoras, cambios asimétricos del color (piel pálida, roja, cianótica con manchas o aspecto moteado) y cambios dinámicos en la temperatura, que pueden ser influenciados por las condiciones ambientales. Las alteraciones en la sudoración se caracterizan por la presencia de hiperhidrosis, pero puede presentarse sequedad en la piel. Estos cambios varían de un paciente a otro y en el mismo individuo con el pasar del tiempo (32,33). Los cambios tróficos afectan a la piel, las uñas y los vellos; puede presentarse adelgazamiento de la epidermis, piel brillante, uñas delgadas y crecimiento exagerado de los vellos.
Los desórdenes motores en la extremidad afectada pueden presentarse como debilidad, temblores o estremecimientos, incoordinación muscular, disminución de la capacidad del movimiento, espasmos musculares y distonía (7), movimientos reducidos y rigidez de la articulación. La disfunción miofascial se presenta por el desuso o sobreuso de un grupo muscular, especialmente cuando se afecta el miembro superior (34,35).
Estudios retrospectivos en pacientes con SDRC, con dolor de tres años de evolución, reportan que los síntomas en su mayoría suelen permanecer estables o incluso mejorar, en vez de empeorarse progresivamente (36).
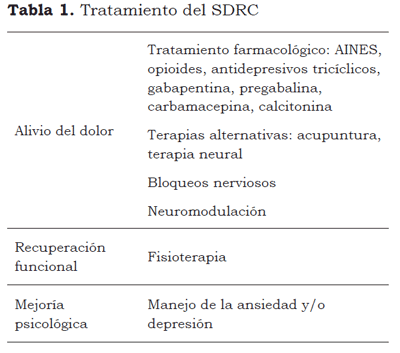
TRATAMIENTO
Diversos tratamientos se han propuesto para el manejo del SDRC, éstos incluyen terapias farmacológicas y no farmacológicas. Los objetivos del tratamiento son: el alivio del dolor, la recuperación funcional y la mejoría psicológica.
Sobre el alivio del dolor, aunque existen numerosas opciones para su tratamiento, la mayoría de ellas no han sido probadas con estudios controlados. Los antidepresivos tricíclicos, la gabapentina, la pregabalina y los opioides son tratamientos utilizados con frecuencia para el tratamiento del dolor neuropático, aunque su efecto sobre el dolor en SDRC no está completamente demostrado y su uso es anecdótico (37).
En un ensayo clínico controlado aleatorizado, cruzado y doble ciego que evaluó el efecto de la gabapentina comparado con placebo en SDRC, se reportó alivio en 43 % de los pacientes que recibieron gabapentina y 17 % de alivio en los que fueron tratados con placebo (38). No hay evidencia que sugiera que la dosis de gabapentina debe ser diferente en el SDRC, en comparación con las dosis administradas para otros tipos de dolor neuropático. Medicamentos anticonvulsivos con actividad bloqueadora de canales de sodio, como la carbamazepina, pueden ser de gran utilidad para el manejo del SDRC tipo II, porque la lesión en nervios periféricos altera la distribución y expresión de subtipos de canales de sodio en la membrana axonal (37).
Los opioides siguen siendo el tratamiento indicado para el manejo del dolor agudo, los pacientes con lesión en el sistema nervioso central pueden no experimentar alivio del dolor con su utilización. El tramadol ha resultado efectivo en estudios controlados para el dolor neuropático periférico y puede ser utilizado en pacientes con SDRC (39,40). Los bifosfonatos son inhibidores potentes de la resorción ósea; en dos estudios donde se utilizaron estos medicamentos (41,42), se reportó una mejoría en la función motora.
La clonidina, agonista α-2-adrenérgico de las neuronas presinápticas de las aferentes primarias y de las neuronas postsinápticas (43) disminuye la liberación de noradrenalina, la concentración de sustancia P en las fibras C; aumenta la actividad colinérgica en la médula espinal, y la concentración de acetilcolina en el líquido cefalorraquídeo. Ha demostrado ser efectiva en el SDRC por vía espinal.
El efecto de la calcitonina ha sido evaluado en dos estudios: en el primero se comparó con un placebo; se encontró disminución estadísticamente significativa del dolor sin que la mejoría haya sido clínicamente significativa, mientras que en el segundo estudio no se observaron diferencias estadísticas (44,45). El uso de ketamina en pacientes con SDRC fue eficaz en el control de la alodinia y la hiperalgesia. Existen reportes sobre su utilización por vía epidural con buenos resultados en pacientes con SDRC (46).
La utilización de agentes antiinflamatorios no esteroideos (AINE) o esteroides está recomendado en estadios tempranos del SDRC, con el fin de bloquear la síntesis de prostaglandinas responsables en gran medida del proceso de sensibilización de nociceptores (47). Dos estudios aleatorizados con cegamiento sencillo reportaron alivio del dolor estadística y clínicamente significativo (48,49). Deben tenerse en cuenta sus efectos colaterales a largo plazo, por lo cual su utilización en periodos prolongados no se recomienda.
En cuanto a la estimulación eléctrica medular, en un ensayo clínico controlado realizado con pacientes que no respondieron al tratamiento convencional, se comparó un grupo que recibió estimulación eléctrica medular con un grupo control tratado con terapia física; se reportó una reducción del dolor estadísticamente significativa en los pacientes con estimulación medular, aunque no se observaron beneficios sobre el estado funcional de los pacientes (50).
Sobre la recuperación funcional, existen autores que consideran que el SDRC tipo I puede resultar de una prolongada inmovilización y de la falta de uso de la extremidad comprometida después de la lesión, por lo que se considera benéfica la movilización temprana del miembro comprometido. Por tanto, se debe iniciar fisioterapia intensiva para evitar las limitaciones funcionales que se observan con frecuencia o para prevenir su desarrollo (51,52). Lamentablemente, cuando el dolor es severo no es bien tolerada por la mayoría de los pacientes, por lo que al mismo tiempo debe instaurarse un esquema analgésico eficaz. En algunos pacientes es necesaria la terapia psicológica, cuando la ansiedad o depresión afecta el curso del tratamiento (Tabla 1).
REFERENCES
1. Wilsey B, Teicheira D, Caneris OA, Fishman SM. A review of sympathetically maintained pain syndromes in the cancer pain population. Pain practice 2001;1:307-23. [ Links ]
2. Mitchell SW, Morehouse GR, Keen WW. Gunshot wounds and other injuries of nerves. Philadelphia: JB Lippincott, 1864, 100-11. (Reprinted in Clin Orthop Relat Res, 1982;163:2-7). [ Links ]
3. Schott GD. Complex? Regional? Pain? Syndrome? Pract Neurol 2007;7:145-57. [ Links ]
4. Díaz PA, Plancarte R, Tamayo AC. Síndrome doloroso regional complejo. Estado actual. Cir Ciruj 2004;72:225-38. [ Links ]
5. Merskey H, Bogduk N. Classification of chronic pain. Descriptions of chronic pain syndromes and definitions of pain terms. Second edition. Seattle, Washington: IASP Press;1994:40-2. [ Links ]
6. Cepeda S. Síndrome doloroso regional complejo tipos I-II. En: Rodríguez RF. Medicina del dolor y cuidados paliativos. Cali: Editorial Universidad Libre; 1998; 71-79. [ Links ]
7. Bruehl S, Harden RN, Galer BS, Saltz S, Bertram M, Backonja M, Gayles R, Rudin N, Bhugra MK, Stan-ton-Hicks M: External validation of IASP diagnostic criteria for complex regional pain syndrome and proposed research diagnostic criteria. Pain 1999; 81:147-54 [ Links ]
8. Veldman PH, Reynen HM, Arntz IE, Goris RJ. Signs and symptoms of reflex sympathetic dystrophy: prospective study of 829 patients. Lan-cet.1993;342:1012-6. [ Links ]
9. Raja SN, Grabow TS. Complex Regional Pain Syndrome I (Reflex Sympathetic Dystrophy). Anesthesi-ology.2002; 96:1254-60. [ Links ]
10. Ribera MV. Síndrome de dolor regional complejo tipo I y II. Dolor. 2003;18:83-84. [ Links ]
11. Neira F, Ortega J. L. El síndrome doloroso regional complejo y medicina basada en la evidencia. Rev. Soc. Esp. Dolor 2007;2:133-46. [ Links ]
12. Gler BS, Scwartz L, Allen R. Síndromes de dolor regional complejo: tipo I (distrofia simpática refleja) y tipo II (causalgia). En: Loeser JD, Butler SH, Chapman CR, et al. Bonica Terapéutica del Dolor. Vol I. 3a ed., México: McGraw-Hill Interamericana; 2003. p. 467-96. [ Links ]
13. Matoses MS. Síndrome del dolor regional complejo. Dolor neuropático periférico. Dolor. 2002;17:78-86. [ Links ]
14. Obata FC, Tsa LL. Síndrome dolorosa complexa regional: Epidemiologia, fisiopatologia, manifestações clínicas, testes diagnósticos e propostas terapêuticas. Rev Bras Anestesiol.2002;52:5:618-27 [ Links ]
15. De Mos M, de Bruijn AGJ, Huygen FJPM, Dieleman JP, Stricker BHCh, Sturkenboom MCJM. The incidence of complex regional pain syndrome: A population-based study. Pain.2007;129:12-20. [ Links ]
16. Sandroni P, Benrud-Larson LM, McClelland RL, Low PA. Complex regional pain syndrome type I: incidence and prevalence in Olmsted county, a population-based study. Pain.2003;103:199-207. [ Links ]
17. Pertoldi S, Di Benedetto P. Shoulder-hand syndrome after stroke. A complex regional pain syndrome. Eura Medicophys. 2005;41:283-92. [ Links ]
18. Kiralp ZM, Dinger Ü, Çakar E, Dursun H. Complex regional pain syndrome: epidemiologic features, treatment approaches, workday loss and return to work/disability ratios. Turk J Rheumatol 2009;24:1-5. [ Links ]
19. Rodríguez RF, Angel AM. Epidemiology and clinical characteristics of complex regional pain syndrome of upper limb in Valle-Colombia. In press [ Links ]
20. Janig W, Baron R. Complex regional pain syndrome: mystery explained? Lancet Neurol. 2003;2:687-97. [ Links ]
21. Ghai B, Dureja GP. Complex regional pain syndrome: A review. J Postgrad Med. 2004;50:300-7. [ Links ]
22. Schurmann M, Gradl G, Zaspel J, Kayser M, Lohr P, Andress HJ. Peripheral sympathetic function as a predictor of complex regional pain syndrome type I in patients with radial fracture. Auton Neuros-ci.2000;86:127-34. [ Links ]
23. Drummond DP. Involvement of the Sympathetic Nervous System in Complex Regional Pain Syndrome. Neurology. 2001;9:1296-303. [ Links ]
24. Wasner G, Heckmann K, Maier C, Baron R. Vascular abnormalities in acute reflex sympathetic dystrophy (CRPS I): complete inhibition of sympathetic nerve activity with recovery. Arch Neurol. 1999;56:613-20. [ Links ]
25. Garrido B. Complex regional pain syndrome. An approach between physiopathology and therapeutics. Rev Soc Esp Dolor. 2005;12:227-34. [ Links ]
26. Rommel O, Gehling M, Dertwinkel R, Witscher K, Zenz M, Malin JP, Janig, W. Hemisensory impairment in patients with complex regional pain syndrome. Pain 1999;80:95-101. [ Links ]
27. Rommel O, Thimineur M. Clinical evidence of central sensory disturbances in CRPS. En: Harden RN, Baron R, Janing W, editors. Complex regional pain syndrome. Vol 22.Seattle: IASP Press; 2001;193-208. [ Links ]
28. Sieweki N, Birklein F, Riedl B, Neundorfer B, Handwerker HO. Patterns of hiperalgesia in complex regional pain sindrome. Pain.1999;80:171-7. [ Links ]
29. Weber M, Birklein, B. Neundörfer, M. Schmelz. Facilitated neurogenic inflammation in complex regional pain syndrome. Pain.2001;91(3):251-7. [ Links ]
30. Üceyler N, Eberle T, Rolke R, Birklein F Sommer C. Differential expression patterns of cytokines in complex regional pain syndrome. Pain.2007;132: 195-205. [ Links ]
31. Blumberg H, Janing W. Clinical manifestation of reflex sympathetic dystrophy and sympathetically maintained pain. In: Wall PD, Melzack R (eds). Textbook of pain, 3rd ed. Edinburg: Churchill Livingstone; 1994. p. 685-98. [ Links ]
32. Birklein F, Riedl B, Neundorfer B, Handwerker HO. Sympathetic vasoconstrictor reflex pattern in patients with complex regional pain syndrome. Pain.1998;75:93-100. [ Links ]
33. Wasner G, Heckmann K, Maier C, Baron R. Vascular abnormalities in acute reflex sympathetic dystrophy (CRPS I): Complete inhibition of sympathetic nerve activity with recovery. Arch Neurol. 1999;56:613-20. [ Links ]
34. Allen G, Galer BS, Schwartz L. Epidemiology of complex regional pain syndrome: a retrospective chart review of 134 patients. Pain.1999;80:539-44. [ Links ]
35. Rashiq, S., Galer, B.S. Proximal myofascial dysfunction in complex regional pain syndrome: a retrospective prevalence study. Clin J Pain. 1999;15:151-3. [ Links ]
36. Galer BS, Henderson J, Perander J, Jensen MP. Course of symptoms and quality of life measurement in complex regional pain syndrome: a pilot survey. J Pain Symptom Manage. 2000;20:286-92. [ Links ]
37. Rowbotham MC. Pharmacological management of complex regional pain syndrome. Clin J Pain. 2006;22:425-9. [ Links ]
38. Van de Vusse AC, Stomp van den Berg SG, Kessels AH, Weber WE. Randomised controlled trial of gabapentin in Complex Regional Pain Syndrome type I. BMC Neurology.2004;4:13-22. [ Links ]
39. Sindrup SH, Andersen G, Madsen C, Smith T, Brosen K, Jensen TS. Tramadol relieves pain and allodynia in polyneuropathy: a randomised, double-blind, controlled trial. Pain.1999;83:85-90. [ Links ]
40. Harati Y, Gooch C, Swenson M, et al. Doubleblind randomized trial of tramadol for the treatment of the pain of diabetic neuropathy. Neurol-ogy.1998;50:1842-6. [ Links ]
41. Varenna M, Zucchi F, Ghiringhelli D, Binelli L, Bevi-lacgua M, Bettica P, Sinigaglia L. Intravenous clo-dronate in the treatment of reflex sympathetic dystrophy syndrome. A randomized, double blind, placebo controlled study. J Rheumatol. 2000;27:1477-83. [ Links ]
42. Adami S, Fossaluzza V, Gatti D, Fracassi, E; Braga, V. Bisphosphonate therapy of reflex sympathetic dystrophy syndrome. Ann Rheum Dis. 1997;56:201-4. [ Links ]
43. Cliffort J, Wolf, Mannion RJ. Dolor neuropático, etiología, mecanismos y manejo. Lancet. 1999;353:1959-64. [ Links ]
44. Gobelet C, Waldburger M, Meier JL. The effect of adding calcitonin to physical treatment on reflex sympathetic dystrophy. Pain.1992;48:171-5. [ Links ]
45. Bickerstaff DR, Kanis JA. The use of nasal calcitonin in the treatment of post-traumatic algodystrophy. Br J Rheumatol.1991;30:291-4. [ Links ]
46. Stanton-Hicks M. Complex regional pain syndrome (type-I, RSD; type-II, causalgia): controversies. Clin J Pain. 2000;16:33-40. [ Links ]
47. Kidd BL, Urbán LA. Mecanismos del dolor inflamatorio. British Journal of Anaesthesia.2001;87:3-11. [ Links ]
48. Braus DF, Kraus JK, Strobel J. The shoulder hand syndrome after stroke: a prospective clinical trial. Ann Neurol. 1994;36:728-33. [ Links ]
49. Christensen K, Jensen EM, Noer I. The reflex sympathetic dystrophy syndrome response to treatment with systemic corticosteroids. Acta Chir Scand. 1982;148:653-5. [ Links ]
50. Kemler MA, Barendse GA, van Kleef M, de Vet HC, Rijks CP, Furnee CA, van den Wildenberg FA. Spinal cord stimulation in patients with chronic reflex sympathetic dystrophy. N Engl J Med. 2000;343: 618-24. [ Links ]
51. Galer BS, Butler S, Jensen MP. Case reports and hypothesis: a neglect-like syndrome may be responsible for the motor disturbance in reflex sympathetic dystrophy (CRPS 1). J Pain Symptom Manage. 1995;10:385-91. [ Links ]
52. Hareau J. What makes treatment of reflex sympathetic dystrophy successful? J Hand Ther.1996;9:367-70. [ Links ]
Conflicto de intereses: ninguno declarado











 text in
text in 

