Introducción
La diarrea se define como una reducción significativa en la consistencia de las deposiciones o un aumento en el volumen de estas, >200 g/d. Generalmente, se asocia a molestias abdominales o una urgencia por defecar. De acuerdo con el tiempo de evolución, se considera diarrea crónica a aquella que tiene una duración >3 semanas, y algunos autores la describen como >4 semanas 1,2,3.
Respecto a su clasificación, se divide en tres grandes grupos: 1) diarrea acuosa, que a su vez se subdivide en osmótica -en la que ocurre una retención de agua intraluminal por sustancias no absorbidas-, secretora -en la cual la absorción de agua es reducida- y funcional, generada por hipermotilidad; 2) diarrea grasa (esteatorrea), que se subdivide en los síndromes de malabsorción -en el que ocurre un daño o la pérdida de la capacidad de absorción- y de maldigestión, ocasionado por una pérdida de la función digestiva, y 3) diarrea inflamatoria o exudativa, la cual se presenta con leucocitosis y la existencia de leucocitos en la materia fecal, e incluso con la presencia de material purulento y sangre franca 4.
La diarrea secretora, incluida dentro de la diarrea acuosa, se origina por un aumento de la secreción de electrolitos (especialmente sodio y cloro) hacia el lumen intestinal, lo cual genera un arrastre de agua, por causa de una alteración del epitelio intestinal en el transporte de agua y de electrolitos 2.
Clínicamente, la diarrea secretora se caracteriza por no estar en relación con la ingesta, por lo que con frecuencia los pacientes describen su aparición como de predominio nocturno. Por tanto, tampoco existe una respuesta al ayuno. Así, el volumen fecal no se disminuye ni se aumenta en caso de ingesta 4 y su osmolaridad es similar a la del plasma (fecal osmotic gap <50 mOsm/kg) 4. Además, la diarrea secretora es voluminosa, incluso con un gasto >1 L en 24 h, y se relaciona habitualmente con trastornos electrolíticos como hipocalemia y acidosis metabólica por la pérdida concomitante de bicarbonato 4.
Las causas de la diarrea secretora son múltiples y entre ellas se incluyen etiologías infecciosas, como las generadas por las enterotoxinas del Vibrio cholerae y de la Escherichia coli. Asimismo, se suman las causas posquirúrgicas (gastrectomía, resección intestinal, vagotomía); los secretagogos luminales (como los ácidos biliares o laxantes); los secretagogos circulantes, como algunos medicamentos (digitálicos, biguanidas, misoprostol), las hormonas (exceso de hormona tiroidea) 5,6, y las NEN funcionales, productoras de péptidos como la gastrina, el glucagón y, menos frecuentemente, el PIV, como lo es el caso clínico descrito en este reporte.
Dentro de este contexto, las NEN son neoplasias que se presentan con una frecuencia relativamente baja, de presentación clínica muy variable y que pueden pasar inicialmente desapercibidas. Sin embargo, poseen un potencial maligno y metastásico.
En efecto, el 85 % de las NEN se originan en el tracto gastrointestinal, mientras que un 10 % ocurren en el pulmón y se manifiestan como carcinoides bronquiales 7. Entre tanto, las pNEN son, en su mayoría, no funcionales. No obstante, algunas de ellas tienen la capacidad de secretar hormonas que derivan en síndromes clínicos únicos como los vipomas.
Caso clínico
Se expone el caso de un paciente de 37 años, quien consultó al servicio de urgencias por un cuadro clínico, de 6 meses de evolución, con deposiciones diarreicas, abundantes, sin moco ni sangre y una frecuencia de 4 a 6 evacuaciones por día. Estas persistieron a pesar del ayuno. El paciente negó la existencia de antecedentes de importancia.
Asimismo, el paciente consultó en varias oportunidades al servicio de urgencias, por causa de síntomas asociados a deshidratación y trastornos electrolíticos con hipocalemia severa y acidosis metabólica. Por tanto, requirió en múltiples ocasiones de hospitalización. Durante el ingreso a nuestra institución, el individuo persistió con diarrea de alto gasto, así como con deshidratación moderada y trastorno electrolítico (Tabla 1).
Tabla 1 Principales estudios realizados durante la hospitalización, previo (reporte) y posterior (control) al uso de octreotida.

mEq: miliequivalente; pO2: presión parcial de oxígeno; pCO2: presión parcial de dióxido de carbono; HCO3: bicarbonato; EB: exceso de base; 5-HIAA: ácido 5-hidroxindolacético; TSH: hormona estimulante de la tiroides (Thyroid-Stimulating Hormone); PTH: hormona paratiroidea; IgA: inmunoglobulina A
El abordaje diagnóstico inicial incluyó la búsqueda de causas infecciosas, pero tanto los coprocultivos como los hemocultivos fueron negativos. Pese a que recibió múltiples esquemas antibióticos empíricos previos, no se evidenció una mejoría. La infección por VIH también fue descartada. Fue valorado por el servicio de gastroenterología, en donde se le practicaron una endoscopia de vías digestivas altas (EVDA) y una colonoscopia avanzada a íleon con toma de biopsias. Estas pruebas descartaron la presencia de una enfermedad inflamatoria intestinal y de una enfermedad celíaca. Esta última también fue excluida por el reporte negativo para anticuerpos antiendomisio.
La diarrea se catalogó como secretora (voluminosa, no relacionada con la ingesta alimentaria) persistiendo y haciéndose más intensa aún, conduciendo a choque hipovolémico que requirió soporte vasopresor, hipocalemia severa persistente que necesitó reposición con potasio parenteral e incluso, provocó una lesión renal aguda con necesidad de iniciar terapia de reemplazo renal. En este escenario, se sospecha de una NEN funcional y se solicita el apoyo de endocrinología.
Dadas las características descritas de la diarrea, así como la existencia de la hipocalemia severa, la acidosis metabólica con depleción severa en los niveles de bicarbonato y la presencia de hipercalcemia, se decide solicitar niveles de PIV. Sin embargo, ante la no disponibilidad de realizar la medición en nuestro medio, y dada la gravedad del cuadro, se realiza una prueba terapéutica con octreotida de 0,1 µg subcutáneos, cada 8 h.
La terapia con el análogo de somatostatina condujo a la remisión total de la diarrea en las siguientes 48 a 72 h y a la resolución del choque y de la lesión renal aguda, con la suspensión, incluso, de la terapia de reemplazo renal.
Para confirmar la impresión diagnóstica de vipoma, que ganó fuerza con la respuesta positiva a la prueba terapéutica con octreotida, se realizó una resonancia magnética nuclear (RMN) de abdomen con contraste, la cual mostró una masa sólida hipervascular de 22 mm en la cola del páncreas (Figura 1), sin lesiones metastásicas. La lesión era susceptible de manejo quirúrgico, por lo que el paciente fue dirigido a una pancreatectomía distal laparoscópica más esplenectomía, por el grupo de cirugía hepatobiliar.
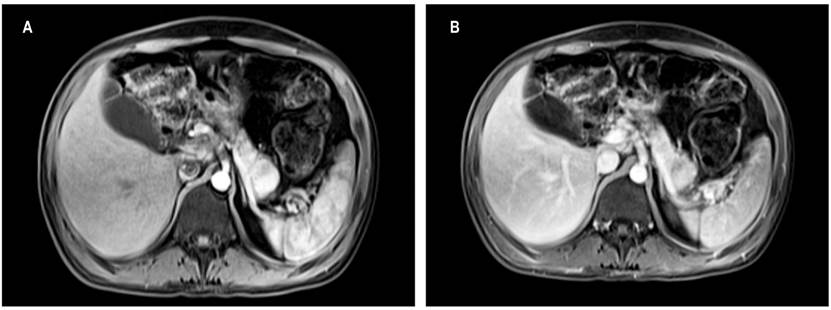
Figura 1 A. RMN abdominal contrastada. Lesión sólida de 22 mm en la cola del páncreas, con realce posterior; administración de contraste endovenoso. Páncreas de tamaño normal. B. Lesión sólida de 22 mm en la cola del páncreas, hipointensa en T1, isointensa en T2, hiperintensa en difusión, con realce posterior a la administración de contraste endovenoso.
El estudio histopatológico demostró la presencia de una NEN de páncreas grado 2 (OMS), un tamaño tumoral de 2,2 x 2 cm, un Ki67 del 5 %, con conteo mitótico de 2 mitosis por 10 campos de alto poder. No se identificó una invasión linfovascular o perineural. Durante el posoperatorio, se suspendió la octreotida, a fin de determinar el éxito del procedimiento quirúrgico, sin que sucediera la reaparición de las deposiciones diarreicas. En la actualidad, el paciente se encuentra libre de síntomas.
Discusión
Las pNEN son un grupo no muy frecuente de neoplasias que surgen de células madre multipotentes en el epitelio ductal pancreático 8. El 50 % de estas son no funcionales o secretan péptidos de bajo poder biológico, como el polipéptido pancreático (PP) o la neurotensina. El otro 50 % son funcionales y los productores de gastrina (gastrinoma) e insulina (insulinoma) son las más comunes.
Los insulinomas, caracterizados clínicamente por producir hipoglucemia con síntomas neuroglicopénicos, son benignos hasta en el 90 % de los casos 7. Entre tanto, los gastrinomas se caracterizan por la presencia de úlceras pépticas, diarreas severas y reflujo gastroesofágico secundario a una elevada producción de gastrina 7,8. Los glucagonomas se manifiestan por diabetes mellitus, trombosis, depresión y una erupción cutánea conocida como eritema necrolítico migratorio, el cual se presenta principalmente en los miembros inferiores, como una lesión eritematosa de color rojo marrón, exfoliativa y con necrólisis superficial 5,6.
De otro lado, los vipomas (o síndrome de Verner-Morrison) fueron descritos por primera vez en 1958 7,8, constituyendo una enfermedad muy rara, con una incidencia de 1 caso por cada 10 000 personas por año. Estos ocurren en los islotes B pancreáticos no productores de insulina, usualmente de gran tamaño (el 72 %, >5 cm) y malignos (64-92 %), al momento del diagnóstico 7,9. Generan diarrea profusa, hipocalemia y aclorhidria clásica por la secreción de PIV en el plasma, así como un polipéptido de 28 aminoácidos ampliamente distribuido en el tracto gastrointestinal y el cerebro, el cual ejerce una acción relajante sobre el músculo liso vascular y visceral. Todo ello conduce a la secreción de líquidos y electrolitos en el lumen intestinal 6,10,11.
La diarrea secretora, a diferencia de la diarrea osmótica, persiste durante el ayuno. Se produce por una mayor secreción de agua y electrolitos hacia la luz intestinal, que supera la capacidad de absorción 6 y es secundaria a factores externos como el PIV, que estimulan la producción de monofosfato de adenosina (Adenosine Monophosphate, AMP) cíclico 12.
Cuando el PIV se segrega en grandes cantidades en las NEN, los pacientes suelen experimentar diarrea severa, deshidratación, eritema y pérdida de peso. El PIV también promueve la glucogenólisis hepática que se traduce en hiperglucemia, dilata los vasos sanguíneos sistémicos periféricos e inhibe la secreción de ácido clorhídrico 13.
En el abordaje diagnóstico, los estudios imagenológicos desempeñan un papel importante, ya que permiten determinar la extensión de la lesión, el compromiso de los órganos vecinos, la infiltración y la relación con estructuras vasculares y nerviosas. En primera instancia, la ecografía transabdominal ofrece una sensibilidad que varía entre un 20 y un 86 % según el tamaño tumoral. Sin embargo, supone dificultades para visualizar los tumores de la superficie del páncreas y del duodeno 14. En consecuencia, este examen es útil como guía para la biopsia percutánea, en caso de estar indicada.
En contraste, la ultrasonografía endoscópica (USE) es muy útil en casos de tumores situados en la cabeza del páncreas y en la pared duodenal 14. No obstante, al considerarse el potencial de malignidad de los pNEN 15, no permite evaluar las lesiones extrapancreáticas.
Por otro lado, la tomografía computarizada (TC) permite la localización del tumor primario y de posibles lesiones secundarias, con una sensibilidad del 30 % para tumores de 1 a 3 cm, y un 95 % para los tumores >3 cm 14,16, con una notable mejoría de su rendimiento mediante el uso de técnicas multifásicas.
En el caso de lesiones pequeñas, la RMN con gadolinio cuenta con la mayor sensibilidad (91 al 94%) 14; sin embargo, tanto la TC multifásica como la RMN permiten la planeación del abordaje quirúrgico y su seguimiento posterior 14,17.
Respecto al tratamiento, en primera instancia es fundamental corregir el trastorno hidroelectrolítico potencialmente fatal y, una vez definido el compromiso por vía imagenológica, proponer al paciente la resección quirúrgica. Si el tumor no se puede eliminar por completo, la reducción quirúrgica puede tener un beneficio paliativo asociado a terapias como los análogos de somatostatina -los cuales proveen un efecto sintomático antisecretor y antiproliferativo-, a los inhibidores de la tirosina-cinasa, como el sunitinib, o a los inhibidores de mTOR, como el everolimus 11.
En síntesis, el abordaje diagnóstico del paciente descrito en este caso clínico estuvo limitado parcialmente, al no haberse podido procesar los niveles séricos de PIV. Sin embargo, se obtuvo una confirmación diagnóstica desde el punto de vista histopatológico de una pNEN.
Tras exponer el caso del paciente del Hospital Universitario Mayor Méderi y la Clínica Fundadores, se pretende socializar y demostrar nuestra experiencia con dicha patología, para lo cual partimos de un motivo de consulta relativamente frecuente: la diarrea crónica. Se presentaron dificultades para realizar un enfoque inicial, pero, finalmente, el paciente fue diagnosticado y tratado de forma correcta hasta su resolución.
Conclusiones
El vipoma es una enfermedad muy rara, con una incidencia de 1 caso por cada 10 000 personas al año. Se manifiesta a partir de una diarrea secretora profusa, como síntoma principal, el cual frecuentemente conduce a hipocalemia, pérdida de peso y aclorhidria. Esta patología puede o no ser de comportamiento maligno. Sin embargo, independiente de ello, es de vital importancia reconocer esta entidad como potencialmente fatal, dadas las alteraciones hidroelectrolíticas severas que genera.
La resección quirúrgica sigue siendo el pilar de tratamiento y se ha observado la remisión completa de la sintomatología, tal y como ocurrió en el caso clínico antes expuesto. El objetivo final de este tipo de documentos es incentivar a la publicación de casos de características similares, para así unificar métodos de abordaje de diagnóstico temprano que permitan minimizar complicaciones.











 text in
text in 


