Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev. colomb. Gastroenterol. vol.38 no.3 Bogotá July/Sept. 2023 Epub Dec 15, 2023
https://doi.org/10.22516/25007440.1014
Trabajos originales
Características endosonográficas de las lesiones subepiteliales del tracto digestivo superior: experiencia de un centro de referencia en Colombia
1General surgeon, clinical-surgical gastroenterology specialist, Fundación FOSUNAB. Bucaramanga, Colombia.
2General surgeon, clinical-surgical gastroenterology specialist. Gastroenterologist, Fundación FOSUNAB. Bucaramanga, Colombia.
3General surgeon, clinical-surgical gastroenterology specialist. Professor at the Universidad de Caldas. Unión de Cirujanos. Manizales, Colombia.
Introducción:
las lesiones subepiteliales (LSE), descritas como abultamientos o masas cubiertas por mucosa de aspecto sano, se encuentran usualmente de manera incidental durante estudios endoscópicos; suelen ser asintomáticas y se estima que se identifican en el 1% de las esofagogastroduodenoscopias realizadas.
Métodos:
se realizó un estudio descriptivo con recolección retrospectiva de la información. Se incluyeron todos los pacientes atendidos en Unión de Cirujanos, unidad de gastroenterología de referencia del Eje Cafetero ubicada en la ciudad de Manizales, entre enero de 2020 y enero de 2022, a quienes se les realizó ultrasonografía endoscópica como parte del estudio de lesiones de aspecto subepitelial localizadas en el esófago, estómago y duodeno.
Resultados:
se realizaron 152 endosonografías y se encontraron 108 lesiones subepiteliales, 66,6% de los pacientes eran mujeres y el promedio de edad fue 58 años. La mayoría de las LSE se localizaron en el estómago (78,7%) y, de estas, la localización más frecuente fue el antro; el diámetro promedio de las LSE gástricas fue de 14,6 mm y el 47% de las lesiones eran dependientes de la cuarta ecocapa; los diagnósticos presuntivos más frecuentes fueron el tumor del estroma gastrointestinal (GIST; 65,8%) y lipoma (11,7%).
Conclusiones:
las LSE del tracto gastrointestinal se originan en la muscular de la mucosa, submucosa o muscular propia, de manera más frecuente se localizan en el estómago y su caracterización suele requerir la realización de ultrasonografía endoscópica y estudio histopatológico. El tratamiento de estas lesiones sigue siendo controversial debido a su baja frecuencia, variedad histológica y bajo potencial maligno.
Palabras clave: Ultrasonografía endoscópica; lesión subepitelial; GIST; seguimiento
Introduction:
Subepithelial lesions (SELs), described as bulges or masses covered by healthy-looking mucosa, are usually found incidentally during endoscopic studies. They are typically asymptomatic and are estimated to be identified in 1% of esophagogastroduodenoscopies performed.
Materials and methods:
A descriptive study was conducted with retrospective data collection. We included all patients treated at the Unión de Cirujanos, a referral gastroenterology unit of the Coffee Region in Manizales, between January 2020 and January 2022, who underwent endoscopic ultrasonography to study subepithelial-looking lesions located in the esophagus, stomach, and duodenum.
Results:
152 endoscopic ultrasounds were performed, finding 108 SELs; 66.6% of the patients were women, and the average age was 58. Most SELs were located in the stomach (78.7%), the antrum being the most frequent location. The average diameter of the gastric SELs was 14.6 mm, and 47% of the lesions depended on the fourth echolayer; the most frequent presumptive diagnoses were gastrointestinal stromal tumor (GIST; 65.8%) and lipoma (11.7%).
Conclusions:
SELs of the GI tract originate in the muscularis mucosae, submucosa, or muscularis propria. They are most frequently located in the stomach, and their characterization usually requires endoscopic ultrasonography and histopathology. Treatment of these lesions remains controversial due to their low frequency, histological variety, and low malignant potential.
Keywords: Endoscopic ultrasonography; subepithelial lesion; GIST; follow-up
Introducción
Las lesiones subepiteliales (LSE) descritas como abultamientos o masas cubiertas por mucosa de aspecto sano se encuentran usualmente de manera incidental durante estudios endoscópicos; suelen ser asintomáticas y se estima que se identifican en el 1% de las esofagogastroduodenoscopias (EGD) realizadas1,2. Recientemente pareciera que su incidencia ha aumentado; sin embargo, este fenómeno puede corresponder a la mayor disponibilidad de los estudios endoscópicos en nuestro medio. La presente investigación se realiza con el fin de caracterizar las lesiones endosonográficas localizadas en el tracto digestivo superior en pacientes atendidos en un centro de referencia de gastroenterología en el Eje Cafetero entre enero de 2020 y enero de 2022.
Materiales y métodos
Se realizó un estudio descriptivo con recolección retrospectiva de la información. Se incluyeron a todos los pacientes atendidos en Unión de Cirujanos (centro de referencia en gastroenterología para el Eje Cafetero, ubicado en la ciudad de Manizales, Colombia) desde febrero de 2020 hasta enero de 2022 a quienes se les realizó una ultrasonografía endoscópica como parte del estudio de lesiones de aspecto subepitelial localizadas en el esófago, estómago o duodeno y que fueron encontradas de manera incidental en estudios endoscópicos previos.
Se realizó un análisis descriptivo de los datos registrados y se calculó la mediana para las variables numéricas, mientras que las variables cualitativas se describieron con frecuencias. La ultrasonografía endoscópica (UE) se realizó con un equipo de ultrasonido endoscópico de barrido radial Fujinon, procesador SU-1, de alta resolución, con frecuencias variables de 7,5, 12 y 20 MHz, por tres endosonografistas experimentados y todos los procedimientos se realizaron bajo sedación endovenosa. Se registraron de manera prospectiva para todas las lesiones las siguientes características endosonográficas: localización, diámetro máximo, patrón de crecimiento, ecocapa de origen y ecogenicidad.
Resultados
Se realizaron 152 endosonografías y en 44 casos se encontraron lesiones mucosas, 9 compresiones extrínsecas y una formación diverticular; los 108 casos restantes correspondían verdaderamente a lesiones subepiteliales (Figura 1).
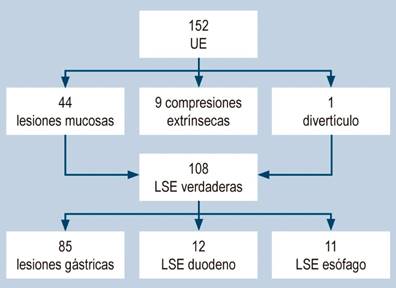
Figura 1 Estudios realizados, pacientes excluidos y cantidad de estudios por localización anatómica. LSE: lesiones subepiteliales; UE: ultrasonografía endoscópica. Imagen propiedad de los autores.
De los 108 pacientes con LSE, 72 (66,6%) eran de sexo femenino y el promedio de edad fue de 58 años. La mayoría de las LSE evaluadas estaban localizadas en el estómago (78,7%) y, de estas, la localización más frecuente fue el antro. El diagnóstico presuntivo más frecuente basado en los hallazgos endosonográficos fue el tumor del estroma gastrointestinal (GIST; 60,1%), seguido de páncreas ectópico (14,8%) y lipoma (12%).
El promedio de edad, sexo, ecocapa de origen y diagnósticos presuntivos de las lesiones según su localización se describen en las Tablas 1, 2 y 3.
Tabla 1 Características endosonográficas y diagnósticos presuntivos de las lesiones subepiteliales gástricas
| Lesiones subepiteliales gástricas | Diagnóstico presuntivo | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ecocapa | GIST | PE | LEI | LIP | TNE | Total | |||
| Promedio de edad | 59,3 | ||||||||
| Sexo | Masculino | 29 | |||||||
| Femenino | 56 | ||||||||
| Diámetro promedio | 14,6 mm | 2 | 16 | 1 | 17 | ||||
| Localización | Antro | 38 | 2 y 3 | 1 | 2 | 3 | |||
| Cuerpo | 35 | 3 | 11 | 10 | 25 | ||||
| Fundus | 11 | 4 | 39 | 1 | 4 | 40 | |||
| Cardias | 1 | Total | 56 | 14 | 1 | 10 | 4 | 85 | |
GIST: tumores del estroma gastrointestinal; LEI: leiomioma; LIP: lipoma; PE: páncreas ectópico; TNE: tumor neuroendocrino. Tabla elaborada por los autores.
Tabla 2 Características endosonográficas y diagnósticos presuntivos de las lesiones subepiteliales esofágicas
| Lesiones subepiteliales esofágicas | Diagnóstico presuntivo | ||||||
| Ecocapa | GIST | LEI | QUISTE | Total | |||
| Promedio de edad | 53,9 | ||||||
| Sexo | Masculino | 3 | 1 y 2 | 1 | 1 | ||
| Femenino | 8 | 2 | 1 | 4 | 1 | 6 | |
| Diámetro promedio | 18,1 mm | 3 | 1 | 1 | |||
| Localización | E. proximal | 0 | 3 y 4 | 1 | 1 | ||
| E. medio | 3 | 4 | 2 | 2 | |||
| E. distal | 8 | Total | 3 | 5 | 3 | 11 | |
GIST: tumores del estroma gastrointestinal; LEI: leiomioma; QUISTE: quiste de duplicación intestinal. Tabla elaborada por los autores.
Tabla 3 Características endosonográficas y diagnósticos presuntivos de las lesiones subepiteliales duodenales
| Lesiones subepiteliales duodenales | Diagnóstico presuntivo | |||||||
| Ecocapa | GIST | PE | LIP | QUISTE | Total | |||
| Promedio de edad | 56,4 | |||||||
| Sexo | Masculino | 4 | 2 | 2 | 2 | |||
| Femenino | 8 | 3 | 2 | 3 | 1 | 6 | ||
| Diámetro promedio | 13 mm | 3 y 4 | 1 | 1 | ||||
| Localización | Bulbo | 11 | 4 | 3 | 3 | |||
| D2 | 1 | Total | 6 | 2 | 3 | 1 | 12 | |
GIST: tumores del estroma gastrointestinal; LEI: leiomioma; QUISTE: quiste de duplicación intestinal; PE: páncreas ectópico. Tabla elaborada por los autores.
Discusión
La mayoría de las LSE son detectadas de manera incidental durante procedimientos solicitados por otra indicación. Se encuentran con la misma frecuencia en hombres y mujeres, generalmente después de la quinta década de la vida, datos concordantes con los encontrados en este trabajo. Se ha reportado que hasta en el 0,3% de los adultos de edad media se encuentran LSE gástricas3.
Las LSE pueden clasificarse como no neoplásicas, dentro de las que se encuentran cambios inflamatorios, quistes, tejido pancreático ectópico y várices, y neoplásicas con bajo potencial maligno como los lipomas, leiomiomas o lesiones con alto potencial maligno como GIST, tumores neuroendocrinos o linfomas4. La mayoría son asintomáticas dado que usualmente no presentan compromiso mucoso; sin embargo, en algunos casos se pueden manifestar con sangrado digestivo, anemia ferropénica, dolor abdominal o signos de obstrucción intestinal dependiendo de la localización y tamaño de la lesión, principalmente cuando se localizan en cercanía al píloro, cardias, válvula ileocecal o recto5.
El diagnóstico suele ser un reto ya que la mayoría de las veces el aspecto endoscópico no es suficiente y el rendimiento diagnóstico de las biopsias convencionales suele ser muy bajo6. La mayoría se identifican en la evaluación endoscópica como abultamientos pequeños (menores de 20 mm) recubiertos de mucosa de aspecto normal, datos concordantes con los descritos en nuestro trabajo; aunque algunas tienen características endoscópicas que pueden sugerir su etiología, como el caso de los lipomas que suelen identificarse de tonalidad amarillenta y consistencia blanda cuando se presionan con una pinza; este signo es conocido como signo de la almohada y tiene una sensibilidad reportada del 98% para este diagnóstico2,7. Por otra parte, el tejido pancreático ectópico suele identificarse como una lesión nodular con umbilicación central en el antro (Figura 2)8.
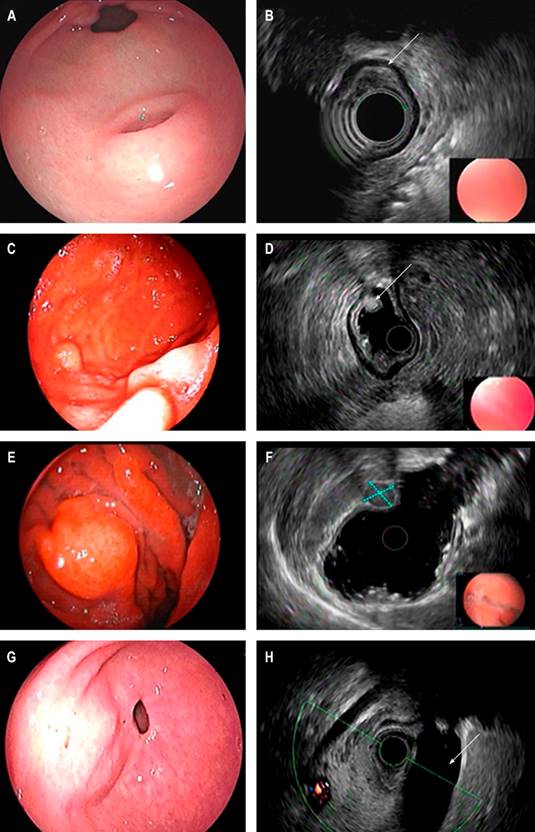
Figura 2 Visión endoscópica de LSE del antro sugestiva de páncreas ectópico. A. Apariencia endosonográfica. B. Lesión que compromete la tercera ecocapa (flecha); visión endoscópica de LSE del cuerpo gástrico distal. C. Apariencia endosonográfica. D. Lesión de la tercera ecocapa concordante con lipoma (flecha); visión endoscópica de LSE del cuerpo gástrico. E. Apariencia endosonográfica. F. Lesión de la cuarta ecocapa sugestiva de GIST (líneas punteadas); visión endoscópica de elevación de aspecto subepitelial del antro gástrico. G. Imagen endosonográfica. H. Imagen endosonográfica con compresión extrínseca de la vesícula biliar (flecha). Imagen propiedad de los autores.
En orden de frecuencia, se localizan en el estómago, esófago, duodeno y colon, datos concordantes con los resultados descritos en nuestra población2. Los leiomiomas son las lesiones subepiteliales más frecuentemente encontradas en los dos tercios distales del esófago y los GIST los más frecuentes en el estómago (Tabla 4)5.
Tabla 4 Características endoscópicas y endosonográficas de las lesiones subepiteliales más frecuentes
| Lesión subepitelial | Apariencia endoscópica | Apariencia endosonográfica | Ecocapa comprometida | Localización más frecuente |
|---|---|---|---|---|
| Lipoma | Amarillenta, signo de la almohada positivo | Hiperecogénica, homogénea | 3.a | Cualquier localización del TGI |
| Leiomioma | Sin características específicas | Hipoecoica, bordes definidos | 2.a, 3.a, 4.a | Esófago, estómago |
| Quiste de duplicación | Superficie lisa, regular, comprimibles | Anecoico, señal Doppler negativa | 3.a | Cualquier localización del TGI |
| Páncreas ectópico | Umbilicación central | Hipoecoica, heterogénea | 3.a, 4.a | Antro, cuerpo gástrico, duodeno |
| Várices | Tonalidad azulosa, tortuosas | Anecoica, señal Doppler positiva | 3.a | Cualquier localización del TGI |
| GIST de bajo riesgo | Elevación subepitelial sin ulceración mucosa o sangrado, < 30 mm | Hipoecoica, heterogénea, hipervascular | 2.a o 4.a | Esófago, estómago, intestino delgado, recto |
| GIST de alto riesgo | Áreas de ulceración o sangrado, > 30 mm | Hipoecoica, heterogénea, áreas de degeneración quística o focos hiperecogénicos | 2.a o 4.a | Esófago, estómago, intestino delgado, recto |
| Schwannoma | Sin características específicas | Hipoecoica, homogénea | 4.a | Cuerpo gástrico |
| Linfoma | Sin características específicas | Hipoecoica | 2.a, 3.a, 4.a | Estómago, intestino delgado |
| Tumores neuroendocrinos | Redondeados, tonalidad amarillenta o rojiza | Hipoecoica o hiperecoica | 2.a, 3.a | Estómago, intestino delgado, recto |
TGI: tracto gastrointestinal. Tabla elaborada por los autores.
La ultrasonografía endoscópica (UE) es el estándar de oro en la evaluación de las LSE del tracto gastrointestinal9, pues permite diferenciar compresiones extrínsecas de lesiones intramurales, establecer la ecocapa de origen, tamaño, ecogenicidad y márgenes, así como evaluar la presencia de linfadenopatías regionales y obtener muestras de tejido en caso de ser necesario10. Existen características endosonográficas patognomónicas para los lipomas y las várices; sin embargo, para otros tipos de lesión su precisión diagnóstica está reportada entre el 43% y 67%11.
Se recomienda la toma de biopsia de LSE sugestivas de GIST, aquellas con características endosonográficas de alto riesgo (bordes irregulares, degeneración quística, ulceración, focos ecogénicos, heterogeneidad) o mayores de 20 mm12.
Debido al bajo rendimiento de las biopsias convencionales, se han diseñado diferentes estrategias para su realización como la toma de biopsia sobre biopsia y el uso de pinzas jumbo o asas, también puede realizarse bajo guía endosonográfica o con una incisión mucosa que permita exponer la lesión y tomar la biopsia13; esta última técnica se recomienda principalmente para lesiones menores de 20 mm y su rendimiento diagnóstico general es del 89% dada la dificultad técnica para la toma de muestras con aguja en lesiones de este tamaño14. Al comparar el rendimiento diagnóstico de la aspiración con aguja fina (FNA) con la biopsia con aguja fina (FNB), existe evidencia a favor del uso de FNB, sin que haya evidencia que permita recomendar un tipo específico de aguja15,16. La precisión diagnóstica con FNB se ha reportado entre el 83% y 100%17.
Por un lado, las lesiones asintomáticas con características endoscópicas y endosonográficas compatibles con várices, tejido pancreático ectópico o lipomas no requieren resección o seguimiento adicional. Por otro lado, las lesiones diagnosticadas histológicamente como benignas, tales como leiomiomas, lipomas, páncreas ectópico, tumor de células granulares, schwannomas, tumor del glomo, entre otros, no requieren ningún tipo de seguimiento o tratamiento adicional pues el riesgo de malignización es muy bajo. Las lesiones con confirmación maligna requieren tratamiento individualizado5. En el caso de los tumores neuroendocrinos, los de tipo 1 menores de 10 mm podrían ser candidatos a seguimiento endoscópico anual pues el riesgo de malignización es bajo18.
El manejo de los GIST menores de 20 mm sin características endosonográficas sospechosas es controversial pues tanto el seguimiento como la resección de las lesiones son conductas aceptadas en la literatura dado que tienen bajo riesgo de malignización12,19. De optar por el seguimiento, el método de elección es la UE y aun cuando no existe consenso sobre la mejor estrategia de seguimiento, se ha recomendado la realización de USE cada 1-2 años para lesiones entre 10 y 20 mm y cada 2-3 años para lesiones menores de 10 mm. Se recomienda la resección quirúrgica de GIST diagnosticados en órganos diferentes al estómago20.
Cuando no se cuenta con un diagnóstico histológico, como sucede frecuentemente en nuestro medio, deben tenerse en cuenta los síntomas, la localización de la lesión y las características endosonográficas. Las lesiones menores de 20 mm de localización gástrica o esofágica que sean asintomáticas tienen bajo riesgo de malignización y, por tanto, podría considerarse su seguimiento como la mejor opción. Aunque el intervalo y método de seguimiento no se encuentran estandarizados, se ha sugerido la realización de esofagogastroduodenoscopia (EGD) y UE en 3-6 meses para verificar la estabilidad de la lesión y posteriormente EGD o UE cada 1-3 años21.
Dada la naturaleza retrospectiva del estudio y teniendo en cuenta que no se realizó seguimiento de las lesiones a largo plazo, no es posible establecer en la población de este trabajo la incidencia de malignización o de cambios en las mismas que permita sugerir intervalos de seguimiento.
Las lesiones subepiteliales de colon y recto requieren siempre la evaluación histológica para establecer el tratamiento adecuado, pues no hay evidencia que respalde su seguimiento como una estrategia adecuada de manejo5.
La resección endoscópica tiene como objetivo la extracción completa de las lesiones, la indicación existe para lesiones con potencial de malignización que generen síntomas o pacientes candidatos a cirugía baríatrica. El tipo de resección depende de la ecocapa comprometida y de su localización anatómica.
Para lesiones esofágicas se plantean como estrategias la resección mucosa (RM) o la disección endoscópica submucosa (DES); en la primera, el uso de bandas ha reportado un éxito técnico hasta del 100% en lesiones menores de 20 mm22, para lesiones de mayor tamaño y hasta de 40 mm podría considerarse la resección endoscópica de espesor total (REET)23.
En las LSE gástricas con indicación de resección se tienen como opciones la vía endoscópica mediante RM, DES o REET para lesiones menores de 40 mm o resección laparoscópica en cuña5.
Conclusión
Las LSE del tracto gastrointestinal se originan en la muscular de la mucosa, submucosa o muscular propia; de manera más frecuente se localizan en el estómago y su caracterización suele requerir la realización de ultrasonografía endoscópica y en algunos casos de estudio histopatológico.
Los resultados del trabajo son de gran importancia puesto que se trata del primer estudio en nuestro medio que caracteriza este tipo de lesiones; sin embargo, dado que el tratamiento descrito en la literatura sigue siendo controversial (debido a su baja frecuencia, variedad histológica y bajo potencial maligno) sería de gran utilidad realizar estudios prospectivos en los que se realice seguimiento endosonográfico a largo plazo que permita establecer la incidencia de transformación maligna en nuestra población y, de esta forma, plantear intervalos de seguimiento o la necesidad de intervenciones adicionales como toma de biopsias o resección de las lesiones.
REFERENCIAS
1. Attila T, Aydin Ö. Lesion size determines diagnostic yield of EUS-FNA with onsite cytopathologic evaluation for upper gastrointestinal subepithelial lesions. Turkish J Gastroenterol. 2018;29(4):436-41. https://doi.org/10.5152/tjg.2018.17876 [ Links ]
2. Menon L, Buscaglia JM. Endoscopic approach to subepithelial lesions. Therap Adv Gastroenterol. 2014;7(3):123-30. https://doi.org/10.1177/1756283X13513538 [ Links ]
3. Nishida T, Kawai N, Yamaguchi S, Nishida Y. Submucosal tumors: Comprehensive guide for the diagnosis and therapy of gastrointestinal submucosal tumors. Dig Endosc. 2013;25(5):479-89. https://doi.org/10.1111/den.12149 [ Links ]
4. Cho JW. Current guidelines in the management of upper gastrointestinal subepithelial tumors. Clin Endosc. 2016;49(3):235-40. https://doi.org/10.5946/ce.2015.096 [ Links ]
5. Deprez PH, Moons L, O’toole D, Gincul R, Seisean A, Pimentel-Nunes P, et al. Endoscopic management of subepithelial lesions including neuroendocrine neoplasms: European Society of Gastro- intestinal Endoscopy (ESGE) Guideline. Endoscopy. 2022;54(4):412-429. https://doi.org/10.1055/a-1751-5742 [ Links ]
6. Franco MC. Opinion: How to manage subepithelial lesions of the upper gastrointestinal tract? World J Gastrointest Endosc. 2015;7(18):1262. https://doi.org/10.4253/wjge.v7.i18.1262 [ Links ]
7. Eckardt AJ, Jenssen C. Current endoscopic ultrasound-guided approach to incidental subepithelial lesions: Optimal or optional? Ann Gastroenterol. 2015;28(2):160-72. [ Links ]
8. Arango L, Sánchez A, Bautista I, Díaz C. Endosonographic Findings of Gastroduodenal Ectopic Pancreas: Experience of A Reference Center in Colombia and Literature Review. J Gastroenterol Hepatol. 2021;21(5):1-7. https://doi.org/04.2021/1.1010 [ Links ]
9. Landi B, Palazzo L. The role of endosonography in submucosal tumours. Best Pract Res Clin Gastroenterol. 2009;23(5):679-701. https://doi.org/10.1016/j.bpg.2009.05.009 [ Links ]
10. Hu ML, Wu KL, Changchien CS, Chuah SK, Chiu YC. Endosonographic surveillance of 1-3 cm gastric submucosal tumors originating from muscularis propria. World J Gastroenterol. 2017;23(12):2194-200. https://doi.org/10.3748/wjg.v23.i12.2194 [ Links ]
11. Park EY, Kim GH. Diagnosis of gastric subepithelial tumors using endoscopic ultrasonography or abdominopelvic computed tomography: Which is better? Clin Endosc. 2019;52(6):519-20. https://doi.org/10.5946/ce.2019.188 [ Links ]
12. Hohenberger P, Raut CP, Rutkowski P. Gastrointestinal stromal tumors. Visc Med. 2018;34(5):332-3. https://doi.org/10.1159/000494077 [ Links ]
13. Sanaei O, Fernández-Esparrach G, De La Serna-Higuera C, Carrara S, Kumbhari V, El Zein MH, et al. EUS-guided 22-gauge fine needle biopsy versus single-incision with needle knife for the diagnosis of upper gastrointestinal subepithelial lesions: a randomized controlled trial. Endosc Int Open. 2020;08(03):E266-73. https://doi.org/10.1055/a-1075-1900 [ Links ]
14. Dhaliwal A, Kolli S, Dhindsa BS, Devani K, Ramai D, Sayles H, et al. Clinical efficacy and safety of mucosal incision-assisted biopsy for the diagnosis of upper gastrointestinal subepithelial tumors: A systematic review and meta-analysis. Ann Gastroenterol. 2020;33(2):155-61. https://doi.org/10.20524/aog.2020.0460 [ Links ]
15. de Moura DTH, McCarty TR, Jirapinyo P, Ribeiro IB, Flumignan VK, Najdawai F, et al. EUS-guided fine-needle biopsy sampling versus FNA in the diagnosis of subepithelial lesions: a large multicenter study. Gastrointest Endosc. 2020;92(1):108-119.e3. https://doi.org/10.1016/j.gie.2020.02.021 [ Links ]
16. Trindade AJ, Benias PC, Alshelleh M, Bazarbashi AN, Tharian B, Inamdar S, et al. Fine-needle biopsy is superior to fine-needle aspiration of suspected gastrointestinal stromal tumors: a large multicenter study. Endosc Int Open. 2019;07(07):E931-6. https://doi.org/10.1055/a-0953-1640 [ Links ]
17. Kim GH, Cho YK, Kim EY, Kim HK, Cho JW, Lee TH, et al. Comparison of 22-gauge aspiration needle with 22-gauge biopsy needle in endoscopic ultrasonography-guided subepithelial tumor sampling. Scand J Gastroenterol. 2014;49(3):347-54. https://doi.org/10.3109/00365521.2013.867361 [ Links ]
18. Oberg K, Couvelard A, Delle Fave G, Gross D, Grossman A, Jensen RT, et al. ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: Biochemical Markers. Neuroendocrinology. 2017;105(3):201-11. https://doi.org/10.1159/000472254 [ Links ]
19. Esmo T, Sarcoma E, Working N. Gastrointestinal stromal tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2014;25(Suppl 3):iii21-6. https://doi.org/10.1093/annonc/mdu255 [ Links ]
20. Landi B, Blay JY, Bonvalot S, Brasseur M, Coindre JM, Emile JF, et al. Gastrointestinal stromal tumours (GISTs): French Intergroup Clinical Practice Guidelines for diagnosis, treatments and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO). Dig Liver Dis. 2019;51(9):1223-31. https://doi.org/10.1016/j.dld.2019.07.006 [ Links ]
21. Dumonceau JM, Deprez PH, Jenssen C, Iglesias-Garcia J, Larghi A, Vanbiervliet G, et al. Indications, results, and clinical impact of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline - Updated January 2017. Endoscopy . 2017;49(7):695-714. https://doi.org/10.1055/s-0043-109021 [ Links ]
22. Kumar S, Chandrasekhara V, Kochman ML, Ahmad N, Attalla S, Ho IK, et al. Ligation-assisted endoscopic mucosal resection for esophageal granular cell tumors is safe and effective. Dis Esophagus. 2020;33(8):1-5. https://doi.org/10.1093/dote/doaa027 [ Links ]
23. Peng W, Tan S, Huang S, Ren Y, Li H, Peng Y, et al. Efficacy and safety of submucosal tunneling endoscopic resection for upper gastrointestinal submucosal tumors with more than 1-year’ follow-up: a systematic review and meta-analysis. Scand J Gastroenterol. 2019;54(4):397-406. https://doi.org/10.1080/00365521.2019.1591500 [ Links ]
Citación: Bautista-Parada IR, Rojas-Espinosa A, Arango-Molano LA, Sánchez-Gil A, Díaz-Tobar C. Características endosonográficas de las lesiones subepiteliales del tracto digestivo superior: experiencia de un centro de referencia en Colombia. Revista. colomb. Gastroenterol. 2023;38(3):264-270. https://doi.org/10.22516/25007440.1014
Recibido: 29 de Enero de 2023; Aprobado: 13 de Abril de 2023











 text in
text in 



