Introducción
Helicobacter pylori es una bacteria gramnegativa, móvil, microaerofílica y de morfología espiral, asociada con múltiples enfermedades gastroduodenales como gastritis crónica, enfermedad ulcerosa péptica, adenocarcinoma gástrico (AG) y linfoma de tejido linfoide asociado a mucosas (MALT = Mucosa- Associated Lymphoid Tissue, por sus siglas en inglés)1. Este agente tiene la capacidad de colonizar la mucosa gástrica y, en ocasiones, el epitelio mucoso esofágico o duodenal2,3.
En la mayoría de los casos, el tejido colonizado presentará un infiltrado inflamatorio de tipo linfocítico, plasmocitario y polimorfonuclear en forma de banda, ubicado sobre la superficie de la mucosa gástrica en cuellos glandulares y foveolas4. Pese a este hallazgo, no todos los individuos desarrollarán sintomatología o enfermedades asociadas; se estima que solo el 20% de ellos padecerá alguna afección gastroduodenal. Entre el 80 y 90% de los infectados permanecerán asintomáticos; siendo en estos el hallazgo histopatológico más frecuente la gastritis crónica5. Estas cifras resultan alarmantes, ya que se estima que la prevalencia mundial de esta infección se encuentra entre 44-49%, siendo mayor en los países en vía de desarrollo. Para Latinoamérica y el Caribe, se estima una prevalencia aproximada de 60-63%6.
La elevada prevalencia de la infección en lugares donde las condiciones higiénicas y de salubridad no son adecuadas, se debe a las vías de transmisión que posiblemente utiliza esta bacteria: oral-oral y oral-fecal. Esta última se divide en dos: directa, a través del contacto estrecho con una persona infectada que mantenga hábitos subóptimos de higiene personal; e indirecta, a través de agua o alimentos contaminados7. Se cree que la vía oral-oral contribuye más que la oral-fecal, a razón de que es poco probable que H. pylori sobreviva el tránsito a lo largo del tracto gastrointestinal inferior en personas sanas8. Probablemente un reservorio para esta bacteria sea el agua contaminada9.
La evidencia sugiere que esta infección se adquiere casi en la totalidad de los casos durante los primeros años de vida, tras lo cual se desarrolla una infección persistente; probablemente la relación positiva entre la edad y la prevalencia de la enfermedad es una consecuencia de esto10.
La respuesta inmunológica frente a H. pylori aún es objeto de estudio. Sin embargo, se reconoce que el paso inicial es la interacción entre las proteínas secretadas por la bacteria y las células epiteliales de la mucosa gástrica. Estas últimas actúan liberando IL-8, lo que promueve el reclutamiento de neutrófilos. Proteínas como CagA y VacA alteran la morfología y funcionalidad del epitelio gástrico, e inducen aumento de la permeabilidad celular, lo que permite que sustancias como la ureasa penetren al epitelio. Al ser estos antígenos reconocidos por los macrófagos, se induce la producción del IFN-γ, el cual se encuentra regulado de forma positiva, al igual que la IL-12. Sin embargo, la IL-10 y la IL-4 se encuentran reguladas negativamente, por lo que se favorecerá una respuesta inflamatoria de tipo Th-111.
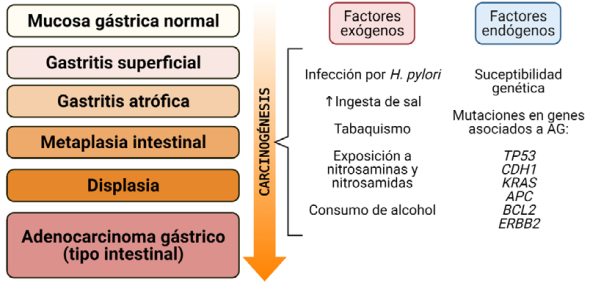
El modelo propuesto por Pelayo Correa en 1988 -conocido como cascada de Correa- brinda la explicación más aceptada sobre la patogénesis del AG12 (Figura 1). El modelo sugiere que la gastritis superficial es la lesión que precede a las demás; la aparición de esta y su evolución a AG se da por la interacción de factores endógenos y exógenos del hospedero. Los factores genéticos propios predisponen a parte de la población, mientras que factores ambientales aceleran o desaceleran la progresión de la carcinogénesis. Entre los factores exógenos se encuentra la infección por H. pylori (especialmente las cepas de genotipos cagA+, vacAs1 y babA2+)13, la alta ingesta de sal, el consumo de alcohol, la exposición a nitrosaminas y nitrosamidas, y el tabaquismo, mientras que en los endógenos están la susceptibilidad genética y mutaciones en genes asociados al desarrollo de AG, en algunos casos heredadas14.
Fuente: Elaboración propia. Creado con BioRender.com
Figura 1 Modelo propuesto por Pelayo Correa (Cascada de Correa)
Estudios epidemiológicos muestran que las poblaciones infectadas con H. pylori tienen un riesgo seis veces mayor de padecer AG en comparación con población no infectada15. La etiología del AG en la mayoría de los casos se atribuye a la infección por esta bacteria, debido a su asociación con lesiones preneoplásicas como displasia, atrofia gástrica y metaplasia intestinal16. Esta enfermedad se ha utilizado como modelo para explicar la relación entre fenómenos inflamatorios y oncogénicos.
Aproximadamente la mitad de los casos de AG son detectados en estadios avanzados, generalmente con mal pronóstico y alta tasa de mortalidad. Por lo anterior, el tamizaje y la detección temprana se convierte en herramienta fundamental para combatir esta enfermedad, puesto que la erradicación de H. pylori limitaría la progresión de lesiones preneoplásicas y reduciría el riesgo de desarrollar AG17,18. Sin embargo, en Colombia no existe ningún programa de control y prevención de AG, ni tampoco es priorizado como un problema de salud pública, pese a su elevada incidencia y moralidad19. Por el contrario, en países como Corea del Sur o Japón, se han establecido programas de tamizaje temprano, sin importar el grado individual de riesgo para desarrollar AG20.
Debido al papel oncogénico de H. pylori, actualmente se recomienda tratar a todos los pacientes con infección activa mediante esquemas de tratamiento con altas tasas de erradicación, como estrategia para la prevención de AG21. Asimismo, es necesario tener en cuenta que los esquemas terapéuticos no alcanzan tasas de erradicación aceptables sin la prescripción correcta. Estudios muestran que cerca del 20% de los pacientes requerirán un nuevo esquema si no se tienen en cuenta pautas como los patrones locales de resistencia o la educación del paciente22,23. Esto es preocupante, porque cuando el microorganismo no es erradicado, desarrolla resistencia secundaria a los antibióticos administrados24.
La resistencia antibiótica es la principal causa de falla terapéutica en H. pylori. Durante las últimas décadas, el uso generalizado de antibióticos para tratar otras infecciones (como macrólidos y fluoroquinolonas) ha generado resistencia en este agente, siendo relevante en el caso de la claritromicina. Como consecuencia, la eficacia de tratamientos considerados «estándar» disminuye progresivamente, como el caso de la terapia triple basada en este antibiótico25. En la actualidad, la eficacia de esta terapia es del 60-70%, en contraste con el 90% o más de hace dos décadas5,26.
Otra complicación es el rápido desarrollo de resistencia a levofloxacina, ampliamente utilizada como primera alternativa frente a falla terapéutica. Además, la FDA no aprueba un nuevo esquema de tratamiento para H. pylori desde 1997. Estos problemas llevaron a la investigación de nuevos tratamientos, intentando brindar alternativas a pacientes que no se curan con terapias consecutivas, porque no queda ningún tratamiento empírico al cual acudir. Por lo tanto, es necesaria la evaluación de fármacos sin registros importantes de resistencia antibiótica. Entre estas opciones se encuentra la rifabutina. Con base en lo anterior, el objetivo de esta revisión es describir los principios generales para el tratamiento de la infección por H. pylori de acuerdo con las guías de referencia vigentes y recomendaciones de autores independientes, y exponer el uso de la rifabutina como alternativa terapéutica segura y eficaz como parte del esquema de rescate.
Metodología de búsqueda
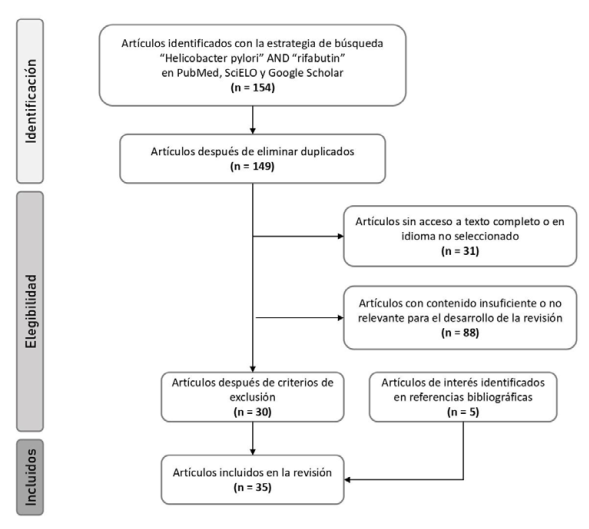
En la búsqueda bibliográfica se usaron los términos “Helicobacter pylori” AND “rifabutin”, en todos los campos de las bases de datos PubMed y SciELO. Además, se utilizó el motor de búsqueda Google Scholar®, empleando los mismos términos, pero restringido a los campos de título y resumen. El período de búsqueda se estableció como artículos publicados hasta septiembre de 2020, en idioma inglés o español. Con el fin incluir la mayor evidencia disponible, no se fijó una fecha límite para inicio de la búsqueda. Para la revisión se tomaron en cuenta artículos originales, revisiones sistemáticas, ensayos clínicos y metaanálisis. Para el caso de los ensayos clínicos, la población a tratar debían ser adultos (≥18 años). Además, se revisaron las referencias de los artículos seleccionados para identificar estudios de interés. La búsqueda se realizó entre el 10 y el 20 de septiembre de 2020. Se obtuvieron 154 artículos en la búsqueda y se revisó el resumen. Fueron excluidos artículos que no estuvieran en los idiomas seleccionados, sin acceso al texto completo, duplicados, contenido insuficiente o no relevante para desarrollar el tema. Después de aplicar estos criterios, fueron seleccionados 35 artículos para el desarrollo de esta revisión (Figura 2).
Adicionalmente se revisaron las guías de referencia para el tratamiento de H. pylori de mayor reconocimiento e impacto en la comunidad médica: American College of Gastroenterology Clinical Guideline - Treatment of Helicobacter pylori Infection27(2017), The Toronto Consensus for the Treatment of Helicobacter pylori Infection in Adults28 (2016) y The Maastricht V/Florence Consensus Report29 (2016). Las recomendaciones de las guías se contrastaron con otras recomendaciones propuestas por autores latinoamericanos, extraídas de los siguientes artículos: Helicobacter pylori: ¿cómo se trata en el 2018?5 (2018), Helicobacter pylori: ¿cómo mejorar las terapias de erradicación?30 (2018) y Guía de práctica clínica para el diagnóstico y tratamiento de la infección por Helicobacter pylori en adultos31 (2016).
Desarrollo del tema
Tratamiento
En la actualidad se encuentra una amplia variedad de esquemas terapéuticos para combatir la infección por H. pylori. Estos consisten en la combinación de varios antibióticos acompañados de inhibidores de la bomba de protones (IBP). Siempre que una prueba diagnóstica resulte positiva se recomienda administrar tratamiento. Idealmente, la selección del esquema se debe realizar bajo ciertas consideraciones (Tabla 1).
Tabla 1 Pautas generales de tratamiento para la infección por H. pylori
| Conocer los patrones locales de resistencia antibiótica si están disponibles. |
| Determinar exposición previa a antibióticos, principalmente macrólidos. |
| Consultar historia de alergia a la penicilina. |
| Educar al paciente y enfatizar la importancia de la adherencia al tratamiento, la probabilidad de efectos adversos y los impactos positivos de la erradicación de H. pylori. |
Fuente: Elaboración propia.
Terapias de primera línea
Las terapias de primera línea son los esquemas que se emplean por primera vez, preferiblemente deberían guiarse por pruebas de patrón de susceptibilidad a antibióticos, por cultivo o biología molecular, sin embargo, están sujetas a disponibilidad, por lo que con frecuencia se usan terapias empíricas27. Las guías clínicas coinciden en que lo recomendable es erradicar H. pylori al primer intento, con el fin de reducir costos, impactos negativos sobre la microbiota del tracto gastrointestinal y/o sentimientos de fracaso en el paciente. A continuación, se enlistan las opciones de primera línea recomendadas (Tabla 2).
Tabla 2 Esquemas de primera línea recomendados por las guías vigentes.
| Terapia | Dosificación | Duración | Recomendación |
| Cuádruple con bismuto | IBP 2v/día* Subsalicilato de bismuto 300 mg 4v/ día MET 400 mg 4v/día o 500 mg 3v/día Tetraciclina 500 mg 4v/día | TOR y MAA: 14 días ACG: 10-14 días | De primera línea por TOR, MAA Y ACG |
| Concomitante | IBP 2v/día* AMX 1000 mg 2v/día** MET 500 mg 2v/día CLR 500 mg 2v/día | TOR y MAA: 14 días ACG: 10-14 días | TOR y ACG: De primera línea MAA: en caso de alta resistencia a CLR o no disponibilidad del bismuto |
| Triple (estándar) | IBP 2v/día* AMX 1000 mg 2v/día** o MET 500 mg 2v/día CLR 500 mg 2v/día | TOR, MAA y ACG: 14 días | TOR: restringida a áreas con tasas de resistencia a CLR <15% o tasas de erradicación >85% MAA: solo en áreas con baja resistencia a CLR ACG: en caso de tasa de resistencia a CLR <15% y no exposición previa a macrólidos |
IBP: inhibidor de la bomba de protones. CLR: claritromicina. AMX: amoxicilina. MET: metronidazol. TOR: The Toronto Consensus for the Treatment of Helicobacter pylori. MAA: Maastricht V/Florence Consensus Report. ACG: American College of Gastroenterology Clinical Guideline - Treatment of Helicobacter pylori Infection
* Las dosis estándar de inhibidores de la bomba de protones administrados por vía oral incluyen: omeprazol 20 mg 1v/día, esomeprazol 20 mg 1v/día, pantoprazol 40 mg 1v/día, lansoprazol 30 mg 1v/día, rabeprazol 20 mg 1v/día.
**Algunos autores afirman que esta dosificación es inadecuada. Sugieren dosis de 500 mg de AMX cada 6 horas o 850 mg 3v/día, con el objetivo de mantener niveles constantes de antibiótico32.
Fuente: Tomado y modificado de Gastroenterology. 2019 Jul;157(1):44-5321
Con relación al uso de IBP, la inhibición de la secreción de ácido clorhídrico mejora la eficacia de los esquemas de erradicación. Al aumentar el pH gástrico, H. pylori presenta alta tasa de replicación y mayor vulnerabilidad a la actividad de los antibióticos5. En términos de farmacocinética y farmacodinámica, se destaca que el rabeprazol y esomeprazol no son inhibidores tan potentes del CYP2C9, a diferencia del resto33.
La terapia cuádruple con bismuto es un esquema reconocido por su alta eficacia y fácil acceso. Las guías lo recomiendan independientemente del patrón de resistencia local. Las tasas de erradicación como tratamiento de primera línea son mayores del 95%, aunque exista resistencia al metronidazol34. Las sales de bismuto tienen efecto bactericida, al acumularse sobre la pared y el espacio periplásmico, inhibiendo enzimas como la ureasa y la fosfolipasa, la síntesis de ATP y afectando la adherencia bacteriana a la mucosa gástrica35. No hay reportes de resistencia al bismuto, en contraste, se demostró que aislamientos resistentes a metronidazol (MET) y claritromicina (CLR), son erradicados al combinar la terapia con bismuto. Por lo anterior, se recomienda elegir el bismuto como parte de la terapia de primera línea especialmente en zonas geográficas con alta prevalencia de resistencia a CLR y MET35 (definidas por consenso MAA como tasa de resistencia >15% para CLR y >40% para MET). Además, este esquema es ideal en casos de alergia comprobada a la penicilina36. El principal inconveniente es el número de medicamentos tomados diariamente por el paciente (14 píldoras en total), motivo importante para que no todos finalicen el esquema y se disminuya la efectividad total. Para evitar esto, es fundamental la educación del paciente27.
En el caso de no estar disponible las sales de bismuto, se recomienda la terapia concomitante, que presenta una eficacia de ~90%, sin embargo, esta se reduciría significativamente si hay resistencia dual a MET y CLR37. Un estudio realizado en 2018 en Bogotá, Colombia, encontró cepas multirresistentes de H. pylori a cuatro antibióticos: AMX, CLR, levofloxacina (LFX) y MET25, razón suficiente para cuestionar el uso de esta terapia en el país, sobre todo en zonas con alta resistencia a MET y CLR o reportes de cepas multirresistentes38.
Otra terapia de primera línea es la triple con CLR. El uso de esta se encuentra limitada a regiones donde la resistencia local al antibiótico es menor del 15%. Por esta razón, algunos autores plantean que en Latinoamérica y el Caribe se debe evitar su uso, a no ser que se conozcan los patrones de resistencia5. En Colombia, la resistencia primaria a CLR es del 18%38.
Además, antes de iniciar la terapia es necesario determinar exposición previa a macrólidos, en este caso es factible reemplazar la CLR por LFX. Sin embargo, esto resulta controversial porque es frecuente encontrar resistencia a LFX en América39-41. La resistencia a este medicamento en Colombia se estima en 27%25. En general, las guías coinciden en que la LFX no debe ser parte de los esquemas de primera línea21.
Otras opciones de primera línea incluyen la terapia híbrida y la terapia secuencial. Sin embargo, las guías TOR y MAA recomiendan no utilizarlas debido a su complejidad en la administración, mientras que ACG las califica como aceptables, pero no ideales en la práctica médica. TOR reafirma la superioridad de la terapia concomitante sobre estos esquemas, porque es más simple y tiene mejor adherencia, sin mayor probabilidad de efectos adversos.
Por regla general, alrededor de la cuarta semana de finalizado el tratamiento de primera línea, se debe confirmar la erradicación del microorganismo idealmente por métodos no invasivos, como el test de aliento42 (sensibilidad: 88-95%, especificidad: 95-100%) o antígenos fecales43 (sensibilidad: 94%, especificidad: 97%). No se deben realizar pruebas serológicas para confirmar la erradicación, ya que los pacientes pueden seguir teniendo anticuerpos después de la erradicación. En caso de que se demuestre persistencia de la infección, se deberá proseguir con terapias de segunda línea.
Terapias de segunda línea
Aproximadamente uno de cada 4-5 pacientes requerirá un nuevo esquema de tratamiento22. En la eventualidad de fracaso del tratamiento de primera línea, para la selección de un nuevo esquema deben tenerse en cuenta otras recomendaciones (Tabla 3).
Tabla 3 Consideraciones para formular un nuevo esquema terapéutico.
| Evitar antibióticos previamente utilizados, principalmente claritromicina y levofloxacina. |
| Si no se usaron sales de bismuto, considerar una terapia que las incluya5. |
| En pacientes con exposición previa a metronidazol, es posible emplearlo nuevamente si se utiliza con bismuto por el efecto sinérgico. La resistencia a la claritromicina tiene mayor efecto en la eficacia del tratamiento comparada con la del metronidazol44. |
| Es posible reutilizar amoxicilina o tetraciclina. Los registros de resistencia son escasos (<5%). |
| El patrón de susceptibilidad antibiótica no es necesario para continuar con la terapia de segunda línea. |
| Confirmar veracidad de alergia a la penicilina |
Fuente: Elaboración propia.
Según las guías, el tratamiento de segunda línea se debe hacer con la terapia triple con LFX o la cuádruple con bismuto, dependiendo de los antibióticos usados previamente. En casos de exposición previa a CLR o LFX, se recomienda usar la terapia cuádruple con bismuto; y para MET, la triple con LFX. Adicionalmente, otras terapias alternas se pueden crear al tomar un esquema triple y añadir sales de bismuto, aumentando la eficacia terapéutica5.
La ACG, además, incluye en sus opciones de segunda línea la terapia dual a altas dosis (AMX 750 mg 4v/ día + rabeprazol 20 mg 4v/día) y la terapia triple con rifabutina (AMX 1000 mg 2v/día + rifabutina 150 mg 2v/día o 300 mg 1v/día + IBP 2v/día). Sin embargo, TOR, MAA y otros sugieren utilizar estos esquemas como de tercera o cuarta línea (o de rescate).
Terapias de tercera y cuarta línea (de rescate)
En general, la recomendación es ordenar cultivo bacteriano con antibiograma en pacientes con falla terapéutica a dos regímenes anteriores. Esto requiere la realización de una endoscopia digestiva superior; para el crecimiento de la bacteria se recomienda obtener al menos dos biopsias gástricas -antro y cuerpo-, que se deben procesar en el menor tiempo posible para su cultivo en medios sólidos suplementados los cuales serán incubados en microaerofilia a una temperatura entre 35-37°C por hasta 14 días45.
Además, el cumplimiento y adherencia al esquema debe reforzarse en el paciente. Las pautas son las mismas que las enlistadas para el tratamiento de segunda línea (Tabla 3). Entre los esquemas de rescate que resaltan las guías encontramos la terapia cuádruple con bismuto, la triple con LFX, y la dual a altas dosis. Esta última evita la resistencia a MET, CLR o LFX. Estudios demostraron resultados significativos con este esquema terapéutico, con tasas de erradicación mayores al 95% como esquema de primera línea y 89.3% como de rescate46.
Autores independientes también enlistan como esquema de recate la furazolidona. Este antibiótico es un inhibidor de la monoamino-oxidasa, altamente eficaz contra diversos microrganismos, pero poco disponible. La dosis recomendada es 100 mg 3v/día por 14 días, utilizándose en terapias cuádruples con bismuto en adición de AMX o tetraciclina y un IBP5. En Colombia se utilizó este medicamento en terapia cuádruple por 14 días y la tasa de erradicación fue de 86% con AMX y 91% con tetraciclina5.
Tiempo de tratamiento
El consenso según las guías para la mayoría de terapias es de 14 días de duración. La guía TOR concluye que hay suficiente evidencia para recomendar las terapias de 14 días sobre las de menor duración28. Por último, usar la recomendación de 14 días para todos los esquemas facilita su formulación y seguimiento.
Rifabutina
La rifabutina es un metabolito derivado de la rifamicina-S, con estructura y propiedades similares a otros antibióticos de la familia de las rifamicinas, como la rifampicina y la rifapentina. Estos antibióticos poseen farmacodinamia, espectro antimicrobiano y efectos adversos similares. Las principales diferencias se encuentran en su farmacocinética. La rifampicina tiene alta biodisponibilidad oral (90%), por lo que el nivel plasmático máximo tiende a cambiar poco durante una interacción; mientras que la rifabutina tiene baja biodisponibilidad oral (20%) con cambios grandes en las interacciones. Además, la vida media terminal de la primera es corta (3,5 horas), por el contrario, la de la rifabutina es extensa (45 horas), por lo que los niveles plasmáticos constantes sólo se alcanzan después de más de 180 horas. Otra diferencia es el metabolismo, en la rifabutina es principalmente a través de CYP3A4 y el transporte activo tiene lugar especialmente a través de OATP1B1, en cambio en la rifampicina el metabolismo no tiene lugar a través de los citocromos comunes y el transporte activo tiene lugar en OATP1B1, OATP1B3 y PGP47.
La rifampicina presenta un gran número de interacciones medicamentosas por su potente capacidad inductora del citocromo P450 (específicamente del 3A4, pero también de otros citocromos). Este antibiótico acelera el metabolismo de un amplio grupo de medicamentos, disminuyendo su efecto. Si bien la rifabutina también induce los citocromos hepáticos, no tiene efectos tan potentes como la rifampicina, razón para considerarla como alternativa ideal en pacientes polimedicados48.
La rifabutina posee propiedades farmacológicas favorables para su uso en H. pylori; entre ellas están la estabilidad química a pH ácido, altas concentraciones en la mucosa gástrica y vida media larga (28 a 62 horas). Asimismo, la sensibilidad in vitro es alta y no comparte resistencia a la CLR u otros antibióticos de primera línea. Sin embargo, las cepas resistentes a rifabutina también lo serán a las demás rifamicinas, porque comparten el mecanismo de acción48.
La rifabutina por lo general es utilizada como alternativa a la rifampicina en pacientes VIH/SIDA que reciben tratamiento antirretroviral con inhibidores de la proteasa o inhibidores no nucleósidos de la transcriptasa reversa. En ellos se utiliza para tratar la infección por el complejo Mycobacterium avium intracellulare y otras micobacterias. Además, la rifabutina tiene excelente actividad in vitro contra bacterias sensibles a la rifampicina, resultando más eficaz que la rifampicina en esas cepas, además contra otras bacterias grampositivas y gramnegativas, incluyendo H. pylori48.
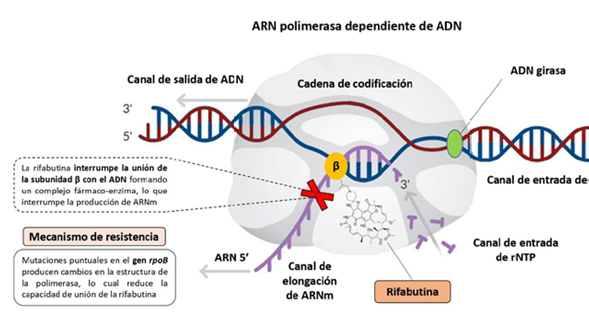
La rifabutina se une a la subunidad β de la ARN polimerasa dependiente de ADN (codificada por el gen rpoB de H. pylori), generando un complejo estable que inhibe la síntesis de ARN (Figura 3). Mutaciones puntuales en los codones 525-544 o en el codón 585 del gen rpoB otorgan resistencia a las rifamicinas por pérdida de afinidad a la subunidad. Estas regiones tienen alta homología con la región determinante de resistencia para estos antibióticos en E. coli y micobacterias. Las mutaciones L525P, H540N, I586N e I586L se asocian con resistencia de alto grado a la rifampicina y aumento de la MIC de entre 10-50 veces para la rifabutina. Sin embargo, este fenómeno es poco frecuente en cepas de H. pylori in vitro y se presenta después de múltiples aislamientos con exposición previa a antibióticos49. De igual forma, la resistencia a la rifabutina es poco frecuente en el ámbito clínico, por los usos específicos y restringidos de esta. Una revisión sistemática que incluyó 2982 pacientes, calculó una tasa global de resistencia a rifabutina de 1,3% (IC95%: 0,9 - 1,7)50. Los análisis incluyendo solamente pacientes que nunca habían recibido tratamiento para H. pylori, mostraron que la tasa disminuía a 0,6% (IC95%: 0,2 - 1,4) mientras que al incluir solo pacientes que recibieron previamente alguna terapia de erradicación, la cifra ascendía a 1,59% (IC95%: 1 - 2,1). El 96,9% de los pacientes del estudio provenían de Alemania, Italia y Reino Unido, zonas de baja prevalencia para tuberculosis; por esta razón, se plantea que en regiones endémicas las tasas de resistencia serían más altas por el uso frecuente de rifampicina y rifabutina50.
Fuente: Elaboración propia. Creado con BioRender.com
Figura 3 Mecanismo de acción y de resistencia a las rifamicinas, utilizando como modelo la rifabutina.
La rifampicina presenta excelente actividad in vitro contra H. pylori, sin embargo, actualmente su uso clínico con esta indicación está suspendido por las bajas tasas de erradicación al evaluar su uso como terapia de rescate (31,6%, calculado mediante análisis por intención de tratar)51.
Nuevos estudios
Los resultados de ERADICATE Hp2 se publicaron recientemente, este es el primer ensayo clínico aleatorizado que comparó la terapia triple basada en rifabutina (150 mg de rifabutina + 3 g de AMX + 120 mg de omeprazol por día), con un comparador activo (3 g de AMX + 120 mg de omeprazol por día), dosificado cada 8 horas durante 14 días. El ensayo incluyó 455 pacientes (228 con terapia triple frente 227 con comparador activo). De cada paciente se realizó cultivo bacteriano y se determinó el patrón de susceptibilidad antibiótica antes del proceso de aleatorización. El análisis por intención de tratar mostró tasas de erradicación más altas con la terapia triple basada en rifabutina frente al comparador activo (Tabla 4).
Tabla 4 Tasas de erradicación por grupo en el ensayo ERADICATE Hp2
| Análisis por intención de tratar | Terapia triple basada en rifabutina | Comparador activo | Diferencia en el tratamiento (%) | Valor P* |
|---|---|---|---|---|
| Tasa de erradicación, % (n/N) | 83,8 (191/228) | 57,7 (131/227) | 26,1 | <0,001 |
| Intervalo de confianza 95% | 78,4 - 88,0 | 51,2 - 64,0 | 18,0 - 34,1 |
N= Número total de pacientes en el grupo, n= Número de pacientes con erradicación confirmada
* Test de Chi-cuadrado (X2).
Fuente: Tomado y modificado de Ann Intern Med. 2020 Jun 16;172(12):795-80252.
Los efectos adversos más comunes (incidencia ≥5%) fueron diarrea (10,1% con la terapia triple frente a 7,9% con el comparador activo), cefalea (7,5% frente a 7,0%) y nauseas (4,8% frente a 5,3%). No se registraron efectos adversos graves. Estudios previos reportaron casos de mielotoxicidad asociada a la rifabutina, por esta razón, en el ensayo se realizó búsqueda activa de este efecto adverso, pero no se detectó ningún caso.
Los investigadores concluyen que la tolerabilidad de la terapia triple con en rifabutina es favorable, tiene alta adherencia y el perfil de eventos adversos es similar al grupo de comparación52. Además, resaltan que la eficacia de la terapia triple con rifabutina no se afecta por la resistencia a CLR o MET, y tampoco se evidencia resistencia a la rifabutina en los pacientes con falla terapéutica previa. Con base en lo anterior, los autores siguieren que este esquema debería considerarse de primera línea como tratamiento empírico para H. pylori. El ensayo demuestra el posible uso de la rifabutina dentro de los esquemas de tratamiento disponibles para H. pylori. Los hallazgos son similares a los reportados previamente y apoyan que se deben hacer nuevos estudios para estandarizar la duración del tratamiento, intervalos y dosis7. Finalmente, muestran que los efectos adversos graves (mielotoxicidad) tienen baja frecuencia o no se presentan con este tratamiento. En la tabla 5 se pueden observar los efectos adversos más comunes asociados al uso de rifabutina reportados en la literatura.
Tabla 5 Eventos adversos más frecuentes asociados al uso de la rifabutina según ficha técnica del fabricante
| Evento adverso reportado | Frecuencia | Definición |
|---|---|---|
| Neutropenia | 25% | Recuento absoluto de neutrófilos <750/mm3 |
| Leucopenia | 10% | Recuento absoluto de leucocitos <1.500/mm3 |
| Trombocitopenia | 5% | Recuento absoluto de plaquetas <50.000/mm3 |
| Descoloramiento de la orina | 30% | Orina de color café/anaranjado |
| Intolerancia gastrointestinal | 20% | Dolor abdominal, disgeusia, dispepsia, eructos, flatulencia, náuseas o vómitos |
| Rash cutáneo | 11% | Erupción cutánea de color rojizo |
| Mialgia | 2% | Dolor localizado en un músculo/ grupo de músculos |
| Fiebre | 2% | Temperatura >38 °C |
Fuente: Tomado y modificado de ficha técnica de Mycobutin®53. Los datos sobre seguridad provienen de ensayos clínicos aleatorizados de pacientes con SIDA que recibieron rifabutina para la prevención de la enfermedad diseminada por el complejo Mycobacterium avium.
Entre otros efectos adversos reportados en <1% de los pacientes se encuentran: síndrome pseudogripal, hepatitis, hemólisis, artralgia, miositis, uveítis, disnea y decoloración de la piel.
Las guías TOR, MAA y autores independientes consideran a la rifabutina como una opción en las terapias de rescate o salvamento5,30,50. Algunos autores proponen su uso como esquema de segunda o tercera línea, al igual que la ACG que sugiere su uso sin emitir un concepto definitivo. Es de resaltar que la rifabutina es de uso restringido, poco disponible y de alto costo. Ampliar sus indicaciones a infecciones no micobacterianas, teniendo en cuenta que existen otros esquemas de rescate, genera preocupación por el aumento de micobacterias multirresistentes. Además, existen otras consideraciones como los efectos adversos asociados a mielotoxicidad. La frecuencia de esta se estima entre 1,5 a 3% y se asocia a dosis altas por periodos prolongados (≥600 mg/ día)50. Hasta la fecha no hay registro de pacientes con infecciones u otro desenlace adverso asociados a la reducción del recuento de leucocitos, presentando recuperación celular espontánea en las primeras dos semanas, por lo cual la importancia clínica de este efecto adverso estaría sobrevalorada.
Conclusión
En pacientes con infección persistente por H. pylori, la elección de la terapia antibiótica debe guiarse por el régimen de tratamiento administrado inicialmente. Para los pacientes con un fallo terapéutico, se sugiere un régimen alternativo con una combinación diferente de medicamentos, evitando el uso de la CLR y antibióticos utilizados previamente. Si no se usaron sales de bismuto, se debe considerar una terapia que las incluya, al igual que confirmar la veracidad de la alergia a la penicilina en caso de ser relevante. Se deben realizar pruebas de susceptibilidad para guiar el tratamiento en pacientes que no han respondido a dos regímenes de tratamiento anteriores, al igual que reforzar la educación del paciente y fomentar su adherencia al tratamiento. El uso de regímenes con rifabutina se reserva para pacientes con ≥3 fracasos terapéuticos previos.
El papel de la terapia con rifabutina deberá ser definido por factores como adherencia, costo y disponibilidad. Igualmente es necesario evaluar la efectividad de la rifabutina en países donde su uso es más frecuente. En la actualidad no hay datos que permitan dimensionar los patrones de susceptibilidad a la rifabutina en otras regiones del mundo, como Latinoamérica, donde las terapias empíricas tienen mayor relevancia. Las futuras investigaciones al respecto son prometedoras; la evidencia actual sugiere que su uso como terapia de rescate es apropiado y seguro, y sería la alternativa ideal en casos de cepas multirresistentes o difícil acceso a pruebas de susceptibilidad antibiótica.