INTRODUCCIÓN
La infección del tracto urinario (ITU) es una afección bacteriana que puede comprometer el tracto urinario inferior o los riñones (1) y es frecuente en lactantes y neonatos. Datos de Estados Unidos han estimado una frecuencia de la enfermedad del 7 % en pacientes menores de 24 meses y una prevalencia de ITU neonatal del 15 % en neonatos con síndrome febril sin causa clara (2,3). Además, tanto en los casos de ITU neonatal adquirida en la comunidad como de ITU nosocomial, se ha reportado a E. coli como el agente causal más frecuente y, adicionalmente, la presentación clínica en este grupo de edad, a diferencia de otras edades pediátricas, es inespecífica, lo cual dificulta la sospecha diagnóstica (4).
Por otra parte, diferentes factores de riesgo juegan un papel fundamental para el desarrollo de la ITU neonatal. Entre estos se encuentran la no circuncisión en el sexo masculino (3), el bajo peso al nacer (1) y las malformaciones genitourinarias congénitas, especialmente el reflujo vesicoureteral (RVU); la ITU es el evento clínico más temprano que muchas veces determina su detección (5).
Adicionalmente, la ITU febril en los neonatos y lactantes menores se ha asociado con el desarrollo de cicatrices renales en un 5 a 15 % de los casos (6). Estas cicatrices pueden ocasionar complicaciones a largo plazo como la hipertensión arterial, la preeclampsia en mujeres gestantes y la enfermedad renal crónica. Por tanto, un diagnóstico oportuno y el tratamiento efectivo de las infecciones urinarias en este período son indispensables para prevenir el daño renal y las secuelas posteriores (1,6).
En Colombia, los datos epidemiológicos publicados acerca de la ITU neonatal son escasos. Solo se conoce un estudio realizado en Tuluá (Valle del Cauca), publicado por Mendoza et al. en el 2014, donde diseñaron una escala predictiva diagnóstica de ITU en neonatos febriles sin foco aparente (7).
El objetivo del presente estudio fue describir las características epidemiológicas, clínicas y microbiológicas de la ITU en los neonatos atendidos en un hospital de Medellín.
MÉTODOS
Se realizó un estudio descriptivo retrospectivo, donde se evaluaron las historias clínicas de los neonatos con ITU hospitalizados en la Clínica Universitaria Bolivariana, hospital de tercer nivel de complejidad de Medellín, entre el 1 de enero del 2013 y el 31 de diciembre del 2017. En esta institución, aproximadamente, se atienden al año 4.700 partos. De estos, 733 son prematuros y 390 requieren ingreso a la unidad de cuidados intensivos neonatal, donde son captados inicialmente los pacientes con ITU. Se ha reportado una incidencia de ITU del 3 % en neonatos (8), por esto se esperaba una población aproximada de 59 pacientes en los cinco años evaluados.
Se incluyeron todos los pacientes con edad menor o igual a 30 días, de cualquier sexo, peso y edad gestacional al nacer, a quienes se les documentó ITU al ingreso o durante su estancia hospitalaria. Los urocultivos fueron procesados en el laboratorio de microbiología de la siguiente forma: las muestras se sembraron en un medio de cultivo cromogénico CHROMID® CPS® Elite (Biomérieux, Marcy-IÉtoile, Francia). Luego se usaron tarjetas de identificación de los microorganismos y se realizaron las pruebas de susceptibilidad a los antibióticos en el equipo VITEK 2® COMPACT (Biomérieux, Marcy-Iétoile, Francia).
La ITU se definió como: 1) un urocultivo positivo por un único agente bacteriano, con un recuento igual o mayor de 50.000 UFC/ml, tomado por cateterismo vesical, con o sin la asociación de un uroanálisis sugestivo de infección (piuria o bacteriuria) en pacientes con sospecha clínica de ITU (9); 2) un urocultivo con un recuento de colonias mayor o igual a 10.000 UFC/ml, tomado por cateterismo vesical, con piuria asociada en el uroanálisis (definida por la presencia de 10 o más leucocitos por campo de alto poder en el sedimento urinario en orina no centrifugada, o cinco o más leucocitos por campo de alto poder en orina centrifugada, o la presencia de esterasas leucocitarias en la cintilla) (9,10-12); 3) cualquier cantidad de colonias en el urocultivo cuando la muestra de orina se tomó por punción supra púbica (9).
Se tuvo en cuenta la definición de pielonefritis/infección del tracto urinario superior propuesta por la NICE y la Academia Americana de Pediatría, definida como: “lactantes y niños que tienen bacteriuria y fiebre de 38º C o más”, sin incluir la elevación de reactantes de fase aguda (9,13). Los criterios de exclusión fueron pacientes con urocultivo positivo en donde se aislaron dos o más gérmenes (posible contaminación); urocultivos positivos como hallazgo incidental en pacientes que lo requirieron antes de realizar cistouretrografía miccional por diagnóstico ecográfico de otras malformaciones genitourinarias y, pacientes que fueron remitidos a otro centro durante la hospitalización o que firmaron el alta voluntaria y se retiraron del hospital sin recibir tratamiento.
Se realizó una selección de historias clínicas proporcionadas por el archivo clínico del hospital, con el código de diagnóstico de la Clasificación Internacional de Enfermedades (CIE-10) que correspondían con la infección urinaria (N390) e infección urinaria neonatal (P393), debido a que con estos dos códigos se registra en la historia clínica la infección urinaria en neonatos. El diagnóstico de pielonefritis aguda o ITU febril no aparece en el CIE-10. También, se revisaron los registros de urocultivos positivos del laboratorio de microbiología seleccionados mediante los datos que arrojó el equipo VITEK 2® COMPACT, que procesa los urocultivos en el laboratorio de la clínica, según el tiempo de seguimiento y la edad de los pacientes.
La recolección de las características epidemiológicas, clínicas, paraclínicas, microbiológicas, terapéuticas y de complicaciones de los pacientes seleccionados, se registraron en un formulario electrónico diseñado en la herramienta MAGPI™. Inicialmente, se realizó una prueba piloto con 15 pacientes, esta permitió realizar ajustes a las variables descritas en el formulario de recolección.
Las características evaluadas fueron sociodemográficas: edad gestacional al nacimiento, sexo, peso al nacer, vía de nacimiento y edad cronológica al momento del diagnóstico de infección; clínicas: temperatura (normotermia, fiebre o temperatura mayor o igual a 38ªC, hipotermia o temperatura menor a 36ªC), pielonefritis o infección urinaria con fiebre, ictericia, vómito, diarrea, distensión abdominal, taquipnea, apnea, taquicardia, hipotensión, mala perfusión distal, irritabilidad, hematuria macroscópica (evidenciada por el cuidador y confirmada en el uroanálisis por presencia de más de cinco eritrocitos por campo de alto poder en el sedimento), malformaciones genitourinarias en ecografía prenatal y posnatal; paraclínicas: recuento de leucocitos, neutrófilos y proteína C reactiva (PCR), información del uroanálisis (presencia de nitritos, esterasas leucocitarias y piuria), gram de orina, pruebas de función renal; y, microbiológicas: agente aislado en hemocultivos, en urocultivos y su número de colonias.
Finalmente, se registró el tratamiento antibiótico empírico-definitivo con su duración y las complicaciones presentadas como la urosepsis (aislamiento del mismo germen en hemocultivo y urocultivo), meningitis (aislamiento del mismo germen en cultivo de líquido cefalorraquídeo y urocultivo) y muerte. Se definió ITU nosocomial como aquella que ocurrió luego de las 48 horas de estar hospitalizado o después del alta hospitalaria (14).
Los datos fueron exportados al programa Excel y luego al software estadístico SPSS 22.0 para el análisis. Las variables cualitativas se expresaron en forma de frecuencias absolutas y relativas, las cuantitativas se presentaron como promedio y desviación estándar o mediana y rangos intercuartílicos, según si se cumplía o no el supuesto de normalidad de los datos.
El trabajo se clasificó como una investigación sin riesgo según la Resolución 8430 de 1993 del Ministerio de Salud de Colombia al realizarse de manera retrospectiva a partir de registros clínicos. Contó con la aprobación del Comité de Ética e Investigación en Salud de la Universidad Pontificia Bolivariana y el aval de la Clínica Universitaria Bolivariana.
RESULTADOS
Se identificaron en total 80 pacientes con ITU dentro del grupo de neonatos que ingresaron a las unidades neonatales del hospital en el período de cinco años. De estos, 15 fueron excluidos (5 con urocultivo con dos o más gérmenes, 5 con urocultivo positivo como hallazgo incidental, 2 remitidos a otro centro sin datos de tratamiento, 2 con urocultivos ≥ 10.000 UFC/ml sin piuria en uroanálisis, 1 alta voluntaria antes de iniciar tratamiento).
Quedaron 65 pacientes que cumplieron los criterios de elegibilidad del estudio. Estos y las características sociodemográficas se describen en la (Tabla 1).
Tabla 1 Características sociodemográficas, n = 65
| Característica | N (%) |
|---|---|
| Edad gestacional al nacimiento (semanas) | 38,4 (35,9 - 39,6)* |
| Pretérminos | 20 (30,8) |
| Sexo masculino | 46 (70,8) |
| Peso al nacer (gramos) | 2798 (±613)† |
| Vía del parto | |
| Vaginal | 51 (78,5) |
| Cesárea | 14 (21,5) |
| Edad al momento del diagnóstico (días) | 10 (5 - 17,5)* |
* Mediana y rango intercuartílico. †Media y desviación estándar. Fuente: creación propia
Las manifestaciones clínicas más frecuentes de la ITU fueron fiebre en 30 pacientes (46,2 %), ictericia en 25 (38,5 %) y apneas en 10 (15,4 %) (Tabla 2).
Tabla 2 Manifestaciones clínicas de la ITU neonatal, n = 65
| Signos | n (%) |
|---|---|
| Temperatura | |
| Normotermia | 34 (52,3) |
| Fiebre | 30 (46,2) |
| Hipotermia | 1 (1,5) |
| Ictericia | 25 (38,5) |
| Apneas | 10 (15,4) |
| Irritabilidad excesiva | 9 (13,8) |
| Hematuria macroscópica | 8 (12,3) |
| Mala perfusión distal | 7 (10,8) |
| Vómito | 6 (9,2) |
| Taquipnea | 5 (7,7) |
| Diarrea | 4 (6,2) |
| Distención abdominal | 4 (6,2) |
| Taquicardia | 3 (4,6) |
| Hipotensión | 3 (4,6) |
Fuente: creación propia
Se encontraron malformaciones genitourinarias en la ecografía renal posnatal en el 24,6 % de los pacientes, la mayoría de ellas fueron de dilatación del tracto urinario, principalmente, clasificadas como P1 según el Consenso multidisciplinario de Urología Pediátrica de dilatación del tracto urinario del 2014 (15).
En el período en que fue realizado el estudio, a todos los pacientes con ITU neonatal se les ordenó cistouretrografía miccional (CUGM), independientemente del resultado de la ecografía renal, de forma intrahospitalaria o ambulatoria, dependiendo de la autorización de la aseguradora del paciente. A 35 de ellos (53,8 %) se les realizó CUGM durante la hospitalización. En 6 se detectó RVU (17,1 %), que fue bilateral en 2 pacientes. El RVU detectado fue de grado IV en 5 unidades renales (75 %) (16). La frecuencia de RVU en pacientes con ecografía renal posnatal normal fue de 17 %, que es la misma cifra de RVU en aquellos que la tuvieron anormal (Figura 1). De los 6 niños con RVU, 4 (67 %) habían tenido un estudio ecográfico normal.
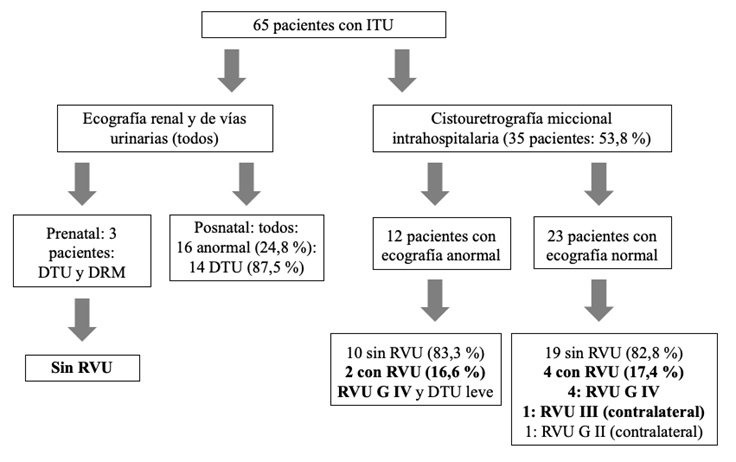
Fuente: creación propia
Figura 1 Estudios imagenológicos de las malformaciones urinarias. DTU: dilatación del tractourinario, DRM: displasia renal multiquística, RVU: reflujo vesicoureteral.
Los principales hallazgos en los paraclínicos se presentan en la Tabla 3. La mayoría de los pacientes no tuvieron elevación de reactantes de fase aguda: de 61 a quienes se les realizó PCR, solo 17 elevaron este marcador (27,9 %). De estos, 13 tuvieron PCR elevada asociada con ITU febril (21,3 %). De los resultados del uroanálisis, la presencia de esterasas leucocitarias fue el hallazgo más consistente con infección.
A todos los neonatos se les realizó urocultivo con muestra tomada por cateterismo vesical y, un 97 % de los evaluados tuvieron urocultivo con recuentos mayores o iguales a 50.000 UFC/ml. De los gérmenes aislados, 75,3% fueron bacterias gramnegativas, siendo E. coli el germen más frecuente en las infecciones adquiridas en la comunidad y nosocomiales (Figura 2).
Tabla 3 Hallazgos de laboratorio
| Paraclínico | n=64 (%) |
|---|---|
| Leucocitos (células/mm3) | 12220 (9095 - 16992)* |
| Neutrófilos (células/mm3) | 5090 (2465 - 9407)* |
| PCR (mg/dl) (n=61) | 0,3 (0,1 - 1,7)* |
| Aumentada (> 1.0 mg/dL) | 17 (27,9) |
| Uroanálisis (n=57) | |
| Esterasas leucocitarias | 37 (64,9) |
| Piuria | 25 (43,9) |
| Nitritos | 11 (19,3) |
| Gram de orina (n=56) | |
| No se observan bacterias | 24 (42,9) |
| Bacilos Gram negativos | 29 (51,8) |
| Cocos Gram positivos | 3 (5,3) |
| Creatinina (mg/dl) (n=44) | 0,42 (0,3 - 0,5)* |
| Nitrógeno ureico (mg/dl) (n=20) | 12,3 (± 8,1)† |
| Hemocultivo (n=47) | |
| Positivo | 2 (4,3) |
| Urocultivo positivo (n=65) | |
| ≥ 50.000 | 63 (97) |
| 10.000-50.000 + uroanálisis patológico | 2 (3) |
*Mediana y rango intercuartílico. †Media y desviación estándar. Fuente: creación propia
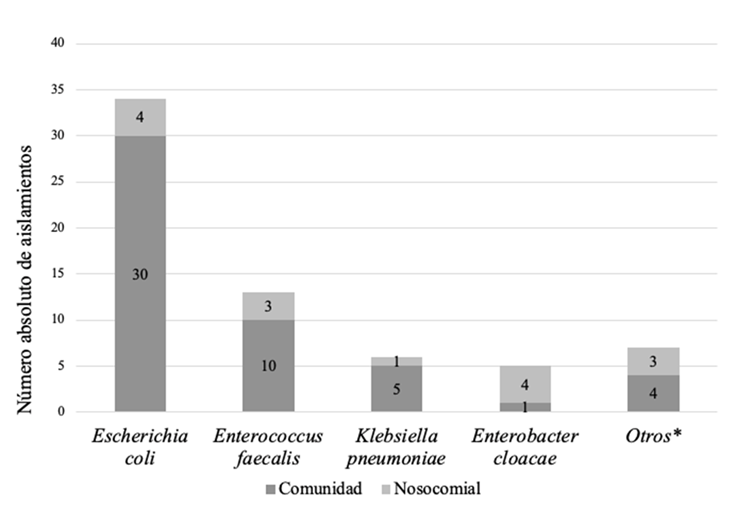
Fuente: creación propia.
Figura 2 Bacterias más frecuentes aisladas en urocultivo *Otros agentes de la comunidad: Staphylococcus aureus, Streptococcus agalactiae, Staphylococcus epidermidis, Enterobacter aerogenes. Otros agentes nosocomiales: Proteus mirabilis, Serratia marcescens.
De los 16 pacientes con malformación genitourinaria anatómica en la ecografía, 8 tuvieron infección por gérmenes diferentes a la E. coli (50 %); y, de los 6 con RVU, en 5 se aislaron gérmenes diferentes a E. coli (83,3 %).
De los 2 pacientes con recuentos de colonias bajas en urocultivo con piuria en el uroanálisis, 1 tuvo ITU febril por Streptococcus agalactiae, otro infección afebril por E. coli, en quien se encontró RVU grado de IV.
En las 50 infecciones urinarias de la comunidad el tratamiento empírico más utilizado fue el de aminoglucósido, sumado a la ampicilina en 39 casos (78 %). En las 15 ITU nosocomiales los antibióticos más utilizados fueron cefepime en 5 casos (33,3 %) y aminoglucósido en 5 (33,3 %) (Tabla 4).
Tabla 4 Características del tratamiento
| Característica | n=65 (%) |
|---|---|
| Tiempo de estancia hospitalaria (días) | 10 (7 - 15,5)* |
| Tratamiento empírico desde la sospecha de infección | 62 (95,4) |
| Tratamiento empírico (n=62) | |
| Ampicilina + aminoglicósido | 40 (64,5) |
| Cefepime | 9 (14,5) |
| Aminoglicósido solo | 7 (11,3) |
| Ampicilina + Cefotaxime | 3 (4,8) |
| Ampicilina sola | 3 (4,8) |
| Tratamiento definitivo | |
| Amikacina | 37 (56,9) |
| Ampicilina | 14 (21,5) |
| Cefepime | 5 (7,7) |
| Gentamicina | 4 (6,2) |
| Cefotaxime | 2 (3,1) |
| Aztreonam | 1 (1,5) |
| Cefalexina | 1 (1,5) |
| Ciprofloxacina | 1 (1,5) |
| Duración del tratamiento (días) | 7 (7 - 9)* |
* Mediana y rango intercuartílico. Fuente: creación propia
La pielonefritis se presentó en 30 pacientes (46,2 %). De estos, sólo 2 neonatos tuvieron hemocultivos positivos, ambos para E. coli. De los neonatos con malformación genitourinaria, 10 tuvieron pielonefritis (33,3 %) y, de los 5 con RVU, 4 la presentaron (66 %). Las complicaciones reportadas fueron meningitis por K. pneumoniae en un paciente y muerte en otro que presentó falla orgánica múltiple secundaria a la urosepsis.
DISCUSIÓN
Este es el primer estudio descriptivo realizado en la población colombiana que caracteriza la infección urinaria neonatal. En este se determinaron las manifestaciones clínicas y alteraciones de laboratorio más frecuentes en los neonatos con ITU, los agentes infecciosos causales más comunes, las malformaciones genitourinarias detectadas pre y posnatalmente, incluyendo el reflujo vesicoureteral y las complicaciones asociadas.
En los neonatos evaluados, la ITU fue predominante en los varones, hallazgo ya descrito en otros estudios, especialmente, en lactantes no circuncidados (17-23). Además, el 30,8 % de los afectados fueron prematuros, esto concuerda con otros trabajos que han identificado a esta población de mayor riesgo para ITU neonatal (17,21,23).
La clínica presentada por los pacientes fue variada e inespecífica como en otras condiciones neonatales (17). La fiebre fue la manifestación más común, cuya frecuencia concuerda con lo reportado en otros estudios (43-78,8 %) (17,21,23). La ictericia fue la segunda manifestación más frecuente, hallazgo también relevante en otros trabajos de ictericia neonatal sin etiología clara (12,2-16,7 %) (24,25).
Con relación a los hallazgos del laboratorio, como ha sido reportado en otros estudios, en menores de 60 días de vida (12,22,26), la presencia de esterasas leucocitarias fue el elemento más frecuentemente encontrado en el uroanálisis de los neonatos con ITU (64,9 %). La mayoría de los pacientes tuvieron urocultivos positivos con recuento de colonias por encima de 50.000 UFC/ml, como lo recomienda la AAP en el 2016 (9). Sin embargo, como se ha venido planteando en los últimos años, se debe estimar en lactantes un punto de corte más bajo en el recuento de colonias de urocultivos para ser considerado positivo, si se acompaña de piuria, fiebre u otros síntomas asociados (12,27); de esta manera se resalta la importancia del uroanálisis como elemento diagnóstico. En nuestro estudio, se identificaron 2 casos de ITU con recuentos bajos de colonias en urocultivo asociados con piuria, uno de ellos con RVU de alto grado.
Por otro lado, la pielonefritis ha sido considerada como la presencia de ITU febril en los niños mayores de 2 meses. Sin embargo, los neonatos tienen variabilidad térmica y, de hecho, cerca de la mitad de los pacientes del estudio no tuvieron fiebre, por ello en neonatos la fiebre no sería un requisito exclusivo para diagnosticar la pielonefritis y deberían hacerse otros biomarcadores para definirla.
Adicionalmente, los reactantes de fase aguda solo se elevaron en 21,3 % de los pacientes con ITU febril, dado que los marcadores de inflamación en neonatos se comportan de forma diferente en contraste con el resto de la población pediátrica, son insuficientes para predecir la infección bacteriana grave (28). Sin embargo, lo encontrado en este estudio, contrasta con otros hallazgos de la literatura, en donde la PCR se encontró elevada por encima del 70 % (22,29,30). Estas diferencias podrían deberse al menor tamaño poblacional de este estudio.
En cuanto a los agentes etiológicos, las enterobacterias fueron la causa más común de ITU en esta población, siendo E. coli el aislamiento más frecuente, tanto en infecciones de la comunidad como nosocomiales (52,3 %); esto es un porcentaje bajo si se lo compara con lo reportado en la literatura para este agente (70,2-88 %) (12,18,22,23,26,31). Otras bacterias frecuentes fueron E. faecalis y K. pneumoniae, hallazgo relevante para definir el cubrimiento antibiótico a nivel local. Al discriminar esta microbiología de la ITU nosocomial, un enfoque racional empírico sería optar por aminoglucósidos o cefalosporinas de cuarta generación en el manejo de estos pacientes. Además, contrario a lo reportado por otros estudios, en nuestro grupo de pacientes no hubo aislamientos en orina por hongos como Candida spp, a pesar de que, el 30,8 % de los neonatos eran prematuros, en cuyo grupo poblacional es más frecuente esta infección (21,22,32).
En relación con las malformaciones genitourinarias, la frecuencia de estas por ecografía renal posnatal fue del 24,6 % y la mayoría fueron dilataciones del tracto urinario clasificadas como leves (P1) (15); hallazgos similares a los diferentes estudios publicados en ITU neonatal (20,33,34). Aunque la guía de la AAP no hace mención sobre la recomendación de imagen en los menores de dos meses con ITU (9), la alta probabilidad de que esté acompañada de una malformación genitourinaria hace que la realización de la ecografía renal sea necesaria durante el primer episodio de ITU en neonatos, como lo recomiendan las guías británicas NICE (13) y otros grupos europeos en el primer episodio de ITU (35).
En la literatura, la frecuencia de RVU diagnosticado en ITU neonatal es diversa (10-41,7 %) (2,17,18,21,22,24,26,28,32,36). En este estudio, la frecuencia de RVU en pacientes a los que se les realizó CUGM hospitalaria fue del 17,1 %, de estos, la mayoría eran RVU de alto grado (grado III-IV) y tenían gérmenes diferentes a E. coli, cuya asociación ya ha sido reportada (37,38).
En el período del estudio, a todos los pacientes con ITU se les indicó realizar CUGM en búsqueda de RVU, pero en el 80 % de ellos no se encontró este hallazgo, lo cual sugiere replantear los criterios para la realización de la CUGM. La APP considera que la ecografía renal anormal es el único criterio para seleccionar a los pacientes que se les debe realizar CUGM (9). Sin embargo, en este estudio, la proporción de pacientes con RVU fue similar en los que tuvieron ecografía normal y en quienes tuvieron una alteración. Esto sugiere tener en cuenta otros criterios clínicos como la ITU atípica, según lo propuesto por la NICE (13) y lo evidenciado en otros estudios (33,34,39,40).
Con respecto a las complicaciones, llama la atención el bajo porcentaje de pacientes evaluados con bacteriemia por el mismo germen en la orina; esto contrasta con la frecuencia alta de bacteriemias reportadas en otros estudios (3,6-51,9 %) (12,17,20,22,24), esto puede ser explicado por el volumen de sangre insuficiente usado en ocasiones para inocular las botellas de hemocultivos que disminuye el rendimiento de esta prueba. Adicionalmente, solo un paciente con ITU presentó meningitis como complicación asociada, lo cual concuerda con lo reportado previamente donde se ha evidenciado que la diseminación al sistema nervioso central es un desenlace excepcional en la ITU neonatal (0-3,3 %) (24,26,33,41), lo que ha permitido plantear en trabajos previos la no necesidad de realizar la punción lumbar de rutina en todo neonato febril con probable ITU como etiología de la fiebre (26).
Este trabajo tiene limitaciones por su naturaleza retrospectiva que hace que algunos de los resultados de los paraclínicos no se tuvieran disponibles para todos los pacientes, incluyendo el reporte de la CUGM; adicionalmente, esto fue un obstáculo para recolectar otras variables de interés como la falla de medro o pobre alimentación. Además, aunque el tiempo de evaluación fue de un período de 5 años, el número total de pacientes evaluados fue bajo, esto subestima los datos encontrados. Como fortalezas, es el primer estudio en su clase realizado a nivel local y nacional.
CONCLUSIÓN
En conclusión, la fiebre y los reactante de fase aguda elevados fueron infrecuentes en los neonatos con ITU. El microrganismo más frecuentemente aislado fue E. coli, y la presencia de esterasas leucocitarias en el uroanálisis fue el hallazgo más común sugestivo de ITU. Los resultados sugieren que la decisión de hacer CUGM después del primer episodio de ITU no debe basarse exclusivamente en los hallazgos de la ecografía renal, sino también en otras características clínicas y paraclínicas de la ITU, como la presencia de gérmenes diferentes a E. coli.
Se requieren estudios prospectivos que permitan conocer los datos de incidencia nacional de la ITU neonatal, que determinen los factores de riesgo asociados a la presencia de RVU en neonatos y que identifiquen herramientas diagnósticas para definir la presencia de pielonefritis, diferentes a las actualmente disponibles, para así poder predecir el desarrollo de cicatrices renales a largo plazo.














