Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.14 no.2 Medellín July/Dec. 2007
PRODUCCIÓN DE COMPLEJOS ENZIMÁTICOS CELULOLÍTICOS MEDIANTE EL CULTIVO EN FASE SÓLIDA DE Trichoderma sp. SOBRE LOS RACIMOS VACÍOS DE PALMA DE ACEITE COMO SUSTRATO
PRODUCTION OF ENZYMATIC COMPLEX IN SOLID STATE FERMENTATION BY Trichoderma sp. USING PALM OIL EMPTY FRUIT BUNCH (EFB) AS SUBSTRATE
Ibeth RODRÍGUEZ G.1, Yineth PIÑEROS C.1*
1Grupo de Aprovechamiento de Recursos Agroalimentarios, Programa Ingeniería de Alimentos Universidad Jorge Tadeo Lozano.
Cra. 4 No. 22-61. Bogotá, Colombia.
RESUMEN
La explotación de palma de aceite en Colombia, quinto productor mundial, genera residuos lignocelulósicos, como los racimos vacíos (raquis o tusas), que resultan después de retirar los frutos de la palma de aceite, los cuales, teniendo en cuenta sus características, pueden ser usados como sustrato para la producción de enzimas celulasas. En este trabajo se evalúa la producción de celulasas mediante el cultivo de Trichoderma viride sobre los racimos vacíos. Los residuos se someten a pretratamientos químicos (HNO3 0,5% y 1%) y biológicos (precultivo con Pleurotus ostreatus durante 10 y 20 días), con el fin de deslignificarlos y favorecer la producción de celulasas. La evaluación de las actividades celulasa total (FPasa) y endoglucanasa (CMCasa), se realiza a los ocho días de cultivo en fermentación en fase sólida utilizando los residuos pretratados como sustrato, suplementando con dos fuentes de nitrógeno inorgánicas (NH4H2PO4 y NaNO3). Las mayores actividades celulolíticas se encuentran en cultivos realizados con pretratamiento biológico (precultivo de Pleurotus ostreatus) y NaNO3 como fuente de nitrógeno, con valores de 0,374 U/mL de FPasa y 0,776 U/mL de CMCasa; una unidad (U) de actividad es la cantidad en µmoles de azúcares reductores (glucosa) producidos por minuto.
Palabras clave: Trichoderma, lignina, celulosa, celulasas, residuos de palma de aceite
ABSTRACT
The oil palm industry in Colombia, the fifth world manufacter, generates lignocelulosic waste like the empty fruit bunch (EFB), which remains after removing the fruit of oil palm. Keeping in mind this characteristic, it can be used as substrate for cellulases production. In this study we evaluate the productivity of cellulases through native crop of Trichoderma viride T12 using EFB. The wastes are subject to chemical (HNO3 0,5% y 1%) and biological treatments (previous cultivate with Pleurotus ostreatus during 10 and 20 days), to get its deslignification and improving the production of cellulases. The evaluation of the activities of total cellulase (FPase) and endoglucanase (CMCase) was made after 8 days of cultivate by fermentation in solid state, using pretreated wastes as substrate. It was supplemented with two inorganic nitrogen sources (NH4H2PO4 y NaNO3). The major celulolitic activities were found in wastes treated with precultive of Pleurotus ostreatus and NaNO3 as nitrogen source, with values of 0,374 U/mL of FPase and 0,776 U/mL of CMCase. All activities were expressed in micromole of glucose units (U) of substrate hydrolyzed in 1 min.
Keywords: Trichoderma sp., lignine, cellulose, cellulases, palm oil wastes.
INTRODUCCIÓN
La celulosa y la hemicelulosa son los principales componentes de las paredes celulares de las plantas y los materiales biológicos más abundantes sobre la tierra. Estos compuestos polisacáridos están conformados por azúcares; estos últimos pueden ser obtenidos mediante hidrólisis enzimática. Algunos residuos urbanos, industriales, agroindustriales y otros, contienen una cantidad significativa de estos compuestos. Sin embargo, muchos de ellos son desechados o incinerados, contribuyendo a las emisiones de dióxido de carbono (1), y por lo tanto al calentamiento global.
En este contexto, los materiales ricos en celulosa son una alternativa ante la fuerte disminución de combustibles fósiles que se da hoy día en el mundo (2); por su composición pueden ser tratados fisicoquímica o biológicamente previos a la hidrólisis enzimática para la producción de azúcares fermentables, materia prima para biocombustibles. Los residuos lignoceluósicos constituyen una fuente de energía renovable y abundante, y no afectan la disponibilidad de alimentos. Además, pueden utilizarse en la producción de alimentos para animales y productos químicos (3), (4).
La explotación de la palma de aceite en Colombia genera residuos ricos en celulosa, hemicelulosa y lignina, luego del proceso de desfrutado y extracción del aceite. Teniendo en cuenta su estructura, pueden usarse como sustratos para el cultivo de hongos filamentosos capaces de producir enzimas extracelulares con actividades celulasas, con importantes aplicaciones industriales, especialmente en la manufactura de textiles y papeles (5) y en la industria de alimentos en el procesamiento de vinos (6), producción de purés de frutas, verduras y en polvos instantáneos para jugos naturales (7) además de su uso en la hidrólisis de biomasa lignocelulósica para la producción de etanol (8).
Algunos de los residuos sólidos generados en la industria de la palma de aceite, son los llamados raquis o racimos vacíos. Por cada tonelada de frutos procesados quedan de 0.2-0.25 toneladas de raquis (9). Actualmente se buscan alternativas para el aprovechamiento de estos residuos, ya que son un problema industrial y ambiental; una es la producción de complejos enzimáticos extracelulares mediante el cultivo de hongos filamentosos como el Trichoderma viride, capaz de crecer en materiales celulósicos. En base seca estos hongos están compuestos por 69% de hemicelulosa, 22% de lignina, 2.7% de pentosa y 6.6% de cenizas (10). Su composición química en base seca es aproximadamente 49.2-50.6% de C, 0,80% N, 0,22% P2O5, 2,90% K2O, 0,25% MgO, 0,29% de CaO (9). La relación N/C es baja. En Colombia se generan cerca de un millón de toneladas de estos residuos por año (11).
Es así como los residuos de palma pueden usarse como sustrato para la producción de complejos enzimáticos con actividad celulolítica mediante el cultivo de Trichoderma viride. La actividad de los complejos enzimáticos derivados de microorganismos celulolíticos puede aprovecharse en el tratamiento de residuos (12), (13). Especies del género Trichoderma son reconocidas por su producción enzimática y han sido ampliamente estudiadas (14-21)
El propósito de este estudio fue encontrar alternativas para el aprovechamiento de los racimos vacíos de palma, mediante su utilización como sustrato para la producción de enzimas celulasas por Trichoderma viride T12, aislada en el laboratorio de Biotecnología de la Universidad Jorge Tadeo Lozano. Se estudió la influencia de pretratamientos y el suplemento con fuentes de nitrógeno inorgánicas en la producción de los complejos enzimáticos.
MATERIALES Y MÉTODOS
Inóculos
La cepa de Trichoderma viride T12 fue conservada a 4º C en agar papa dextrosa (PDA). Los inóculos se realizaron en medio de cultivo Mandels (22) estéril con la siguiente composición: 1.4 g/L de (NH4)2SO4, 2 g/L de KH2PO4, 0.4 g/L de CaCl2.2H2O, 0.3 g/L de MgSO4.4H2O, 0.005 g/L de FeSO4.7H2O, 0.0016 g/L de MnSO4.4H2O, 0.0014 g/L de ZnSO4.7H2O, 0.02 g/L de CoCl2.6H2O, 0.3 g/L de urea y 0.25g/L de extracto de levadura. El medio se suplementó con 5 g/L de glucosa y 5 g/L de residuos molidos como fuentes de carbono. Se realizaron cultivos de 25 mL en frascos de 100 mL, los cuales se inocularon con un (1) mL de suspensión de esporas (1.42 x 108 esporas/mL). Posteriormente se incubaron a 28 ºC en agitación orbital a 150 rpm, durante 7 días.
Tratamientos de los residuos de palma
Los residuos de palma (racimos vacíos) fueron obtenidos de una planta extractora de aceite de palma en Cumaral, Meta; el material fue lavado, secado y cortado manualmente hasta una longitud promedio de 4 cm. Con el fin de modificar la estructura lignocelulósica de los residuos, se plantearon varios pretratamientos:
Tratamiento químico: Se prepararon soluciones ácidas al 0.5% y 1% de HNO3. Se utilizaron 250 mL de solución para cada 40 g de residuos, los cuales se sumergieron en frascos de vidrio de 500 mL. Se mantuvieron a 121º C y 15 psi durante 20 minutos. Posteriormente se aumentó el pH hasta un valor de 5 mediante la adición de NaOH 1N. Finalmente, los residuos tratados se lavaron varias veces con agua potable y se secaron a 80º C durante 2 días.
Tratamiento biológico: El tratamiento biológico consistió en cultivar el hongo Pleurotus ostreatus P1 sobre los residuos con dos tiempos diferentes de cultivo (10 y 20 días), en unidades de 40 g, humedad de 65%, 28º C y en oscuridad, logrando crecimiento micelar sobre los residuos.
Después del tratamiento biológico los residuos se lavaron retirando los restos miceliares y se secaron a 80° C durante 2 días.
Suplementación con fuentes de nitrógeno: Se realizaron soluciones de medio Mandels (22) y se enriquecieron con fosfato de amonio (NH4H2PO4) (5 g y 12 g/100 mL de medio) y nitrato de sodio (NaNO4) (6.5 g y 16 g/100 mL de medio), para adicionarlas a los residuos secos como suplemento de nitrógeno, hasta valores de relación carbono nitrógeno (C/N) de 30 y 20 g de carbono/g de nitrógeno en el sustrato sólido.
Cultivo en fase sólida de Trichoderma viride T12: Como unidades de fermentación se usaron bolsas esterilizables con tapón de algodón, cada una con 40 g de sustrato sólido (pretratado y/o suplementado con nitrógeno) con una humedad de 65%. Estas bolsas se esterilizaron, enfriaron e inocularon con 25 mL de inóculo líquido. Se homogenizó y se incubó durante 8 días a 30° C.
Procedimientos analíticos
Los extractos enzimáticos de cada cultivo se obtuvieron con buffer de citratos 0,05 M, pH 4.8, en una relación 0,5 g de sustrato/mL de buffer. Se agitaron vigorosamente y se centrifugaron a 4000 rpm durante una hora. El sobrenadante fue utilizado para medir las actividades enzimáticas.
Cuantificación de proteína
Se analizó el contenido de proteína de los extractos enzimáticos por cuantificación de proteína soluble con azul de coomassie, de acuerdo al método de Bradford (23), usando albúmina bovina como referencia.
Cuantificación de actividades enzimáticas
Los ensayos enzimáticos sobre papel filtro y CMC se realizaron según la IUPAC (24). La actividad celulasa total (FPasa, actividad sobre papel filtro) fue determinada por la medición de azúcares reductores producidos de la acción enzimática sobre papel de filtro Whatman No.1; la actividad endoglucanasa fue determinada por la medición de azúcares reductores liberados de una solución de CMC al 2%. Los ensayos fueron realizados con buffer de citrato 0.05 M a pH 4.8 e incubados a 50º C por 30 min para CMC y 60 min para papel de filtro. El contenido de azúcares reductores fue determinado usando el método de ácido 5-dinitrosalicílico (25). Una unidad de actividad FPasa y CMCasa (U) es definida como la cantidad de azúcares reductores (AR) en µmoles (equivalentes de glucosa) liberados por minuto.
Análisis estadístico
Los resultados fueron comparados por análisis de varianza (ANOVA) y evaluados por la prueba de Duncan con un nivel de significancia del 5%.
RESULTADOS Y DISCUSIÓN
Efecto de los pretratamientos
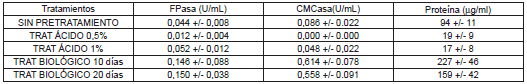
Los valores de actividades celulasas en función de los pretratamientos realizados a los residuos, se presentan en la Tabla 1. Los valores representados son el valor promedio más o menos la desviación estándar. Una unidad (U) es la cantidad de azúcares reductores en µmol producidos por minuto, U/mL, unidades por mililitro (mL) de extracto enzimático.
Tabla 1. Efecto los pretratamientos químico y biológico sobre las actividades enzimáticas.
El uso de celulosa purificada como sustrato no resulta económico para producción a gran escala de celulasas. Por está razón se quiso estudiar si los residuos de palma inducen la producción de celulasas a bajo costo. Los tratamientos químicos y biológicos disminuyen la cristalinidad de la celulosa de los materiales lignocelulósicos (26), favoreciendo el crecimiento de los hongos productores de celulasas.
Como se puede observar, el pretratamiento influye de manera importante en las actividades FPasa y CMCasa (p<0,05). Mediante la aplicación de pretratamientos biológicos se logró incrementar la actividad FPasa en 3,41 veces la obtenida sobre el residuo sin tratamiento. Se puede observar que el mayor contenido de proteína en los extractos, se encontró en cultivos realizados con pretratamiento biológico, debido probablemente a la presencia de proteína del hongo cultivado previamente (Pleurotus ostreatus). La actividad CMCasa presentó un comportamiento similar, obteniendo las mayores actividades con el pretratamiento biológico, incrementando la actividad CMCasa en 6,5 veces. Las mínimas actividades se obtuvieron en cultivos con pretratamiento químico. La actividad CMCasa fue más alta, 3,7 veces mayor que la actividad sobre papel filtro, debido a que los residuos de palma, después de ser pretratados, podrían tener regiones significativas de celulosa amorfa o fragmentada; la actividad CMCasa representa la actividad de enzima endoglucanasa, la cual es activa sobre celulosa amorfa (27).
Los pretratamientos químicos no dieron resultados favorables. El Trichoderma viride T12 utilizado para este estudio no creció de forma apropiada sobre residuos de palma pretratados químicamente, o posiblemente estuvo limitado en su crecimiento por la presencia de restos derivados del proceso químico. Con este procedimiento se pretende reducir la estructura cristalina de la celulosa, disolver los posibles complejos lignina-celulosa difícilmente atacables y aumentar la superficie de contacto de la fibra celulósica (28). Sin embargo, se conoce que la hidrólisis ácida de materiales lignocelulósicos genera sustancias inhibidoras del crecimiento de microorganismos, tales como ácido acético y furfurales entre otros (29). Estos resultados fueron similares a los de un estudio realizado utilizando papel filtro tratado químicamente para el cultivo de Trichoderma sp. (11).
Existen algunos reportes de pretratamiento químico de residuos de palma previo a la producción de enzimas por Chaetomium globosum; el método utilizado por Umikalson y su grupo (30) consistió en tratar los residuos con ácido nítrico HNO3 a temperaturas de 30º C durante 4 horas y luego esterilizarlos durante 5 minutos; debido a los grandes volúmenes de residuos generados y su manejo durante largos tiempos, en este estudio se propuso que los residuos fueran sometidos a condiciones de esterilización (121º C, 15 psi) con el ácido durante 20 minutos, teniendo en cuenta que en las plantas procesadoras de frutos de palma de aceite se dispone de autoclaves en el proceso de producción del aceite. Es probable que el nivel de hidrólisis no haya alcanzado el valor logrado por Umikalson y, por lo tanto, los resultados no sean comparables, o que el proceso realizado pueda ocasionar absorción excesiva del ácido por el hinchamiento estructural o la generación de inhibidores, lo que afectó el crecimiento del Trichoderma viride. Sin embargo, no se realizaron análisis químicos para sacar conclusiones definitivas al respecto.
En otros trabajos, los tratamientos químicos seguidos de autoclavado ocasionan una disrupción física de la estructura externa de la celulosa, permitiendo una gran accesibilidad fúngica para que las moléculas sean fermentadas (31), (32).
También la pérdida de actividad puede deberse a la absorción de las enzimas por la celulosa y la lignina (33-34), o ser consecuencia de la inhibición por presencia de azúcares luego de la hidrólisis ácida de la celulosa. Algunas investigaciones han mostrado que la glucosa y la celobiosa inhiben la actividad enzimática, ya que son los productos de la actividad celulasa (35).
Por otro lado, considerando que el trabajo se desarrolló con residuos de palma de 4 cm de tamaño, el acceso del microorganismo al sustrato se limita, ya que si el tamaño fuera menor existiría una mayor área superficial y por lo tanto mayor actividad enzimática (36). Este aspecto se puede discutir, teniendo en cuenta estudios previos realizados sobre racimos vacíos de palma, que obtuvieron altas actividades (30) realizando pretratamientos químicos y una reducción de tamaño hasta una longitud de 2 mm y 10 mm; no obstante, esta reducción de tamaño a nivel industrial sería costosa y de difícil manejo, razón por la cual este trabajo se desarrolló con tamaños de partícula superiores.
En resumen, las características físico-químicas del sustrato, así como su mayor o menor complejidad, son la causa fundamental de que el pretratamiento
afecte en mayor o menor medida el comportamiento de las actividades enzimáticas del complejo celulolítico de Trichoderma viride T12.
Estudios previos han demostrado mayores actividades de las enzimas celulolíticas producidas por Trichoderma reesei Rut C-30, utilizando como sustrato residuos pretratados con vapor y celulosa cristalina (37). La composición del complejo enzimático depende de la lignocelulosa utilizada como sustrato, el microorganismo y las condiciones de cultivo (27).
Efecto de la fuente de nitrógeno
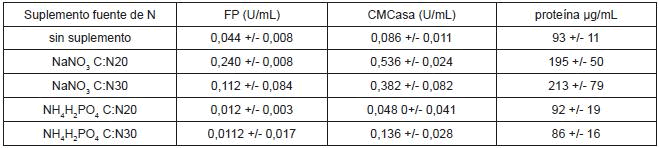
Los resultados de las actividades enzimáticas en función de la fuente de nitrógeno para los cultivos sin pretratamiento se presentan en la tabla 2. Los valores representados son el valor promedio más o menos la desviación estándar. Una unidad (U) es la cantidad de azúcares reductores en µmol producidos por minuto, U/mL, unidades por mililitro (mL) de extracto enzimático.
El hongo Trichoderma sp. tuvo crecimiento utilizando los residuos con y sin fuente de nitrógeno adicional. Sin embargo, se observó una diferencia en las características del crecimiento entre las dos fuentes de nitrógeno; los cultivos suplementados con fosfato de amonio no crecieron abundantemente, como sí lo hicieron los cultivos suplementados con nitrato de sodio (NaNO3). Los resultados obtenidos con nitrato de sodio (NaNO3) confirman lo encontrado por Gutiérrez y sus colaboradores (38), quienes compararon la producción de enzimas con actividad celulolítica con fuentes de nitrógeno orgánicas e inorgánicas, obteniendo mejores resultados con fuentes inorgánicas.
Tabla 2. Efecto de la fuente de nitrógeno sobre las actividades enzimáticas.
La actividad sobre papel filtro como sustrato se incrementó 5.5 veces, comparada con la actividad obtenida con los residuos sin fuente de nitrógeno, con un valor de 0.240 U/mL +- 0.008. La actividad CMCasa se incrementó 6.2 veces, comparada con la actividad obtenida con los residuos sin fuente de nitrógeno, con un valor de 0.536 U/mL +- 0.024.
No se observa incremento en la actividad usando como suplemento fosfato de amonio (NH4H2PO4); las actividades encontradas para estos cultivos, en su mayoría son menores a las alcanzadas en cultivos sin fuente de nitrógeno. Es importante hacer notar que, con suplemento de nitrato de sodio (NaNO3), las concentraciones de proteína en los extractos son mayores. El empleo de nitrato es justificado, ya que la mayor parte de hongos filamentosos utilizan nitratos vía reducción a amonio y utilizan el amonio como fuente de nitrógeno, siendo esta asimilación secuencial, pues la nitrato reductasa se inhibe por amonio (39).
Efecto de la interacción de los tratamientos y las fuentes de nitrógeno
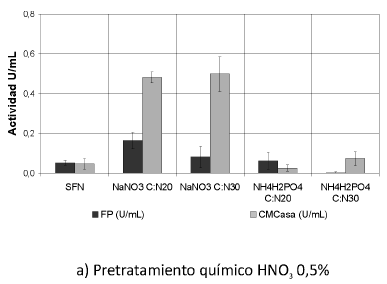
Se muestran las actividades enzimáticas obtenidas de la interacción de los pretratamientos y las fuentes de nitrógeno trabajadas (Ver Figura 1). Se puede observar que las actividades enzimáticas PFasa y CMCasa se incrementaron con la interacción de los pretratamientos y las fuentes de nitrógeno, principalmente con el tratamiento biológico y la fuente nitrato de sodio (NaNO3) (p< 0.05).
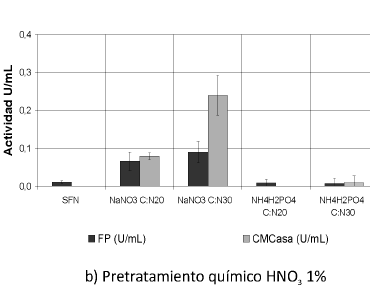

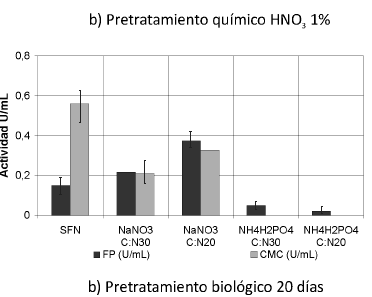
Figura 1. Interacción entre los pretratamientos y las fuentes de nitrógeno. Una unidad (U) de actividad FPasa y de actividad CMCasa es la cantidad de µmoles de azúcares reductores producidos por minuto. SFN (Sin suplemento de fuente de nitrógeno).
Actividad celulasa total (PFasa)
Según el análisis estadístico, existe homogeneidad entre los tratamientos biológicos para esta actividad; la actividad FPasa se incrementó 2,5 veces sobre los residuos tratados biológicamente cultivados sin fuente de nitrógeno, alcanzando un valor máximo de 0.374 U/mL +-0,046, obtenido con tratamiento biológico por 20 días y NaNO3 como suplemento de nitrógeno en una relación C/N de 30.
Se han reportado valores de FPasa de 9.88 IU/mL y 8.38 IU/mL (IU: µmoles de azúcares por min) de dos mutantes de T. reesei QMY-1 y MCG 80, cultivados en fase sólida sobre paja de trigo pretratada con NaOH y explosión por vapor (40). Los bajos valores de actividad FPasa revelan la capacidad limitada que tiene el complejo enzimático en la actividad sinérgica de las tres enzimas (exoglucanasa, endoglucanasa y ß-glucosidasa) (41); sin embargo, debe tenerse en cuenta que el microorganismo utilizado era modificado genéticamente para producir celulasas y los tratamientos fueron diferentes.
Según el análisis estadístico, teniendo en cuenta la homogeneidad de los datos (Prueba de Duncan) del suplemento fosfato de amonio (NH4H2PO4), no existe un efecto significativo sobre la actividad FPasa en U/mL.
Según los datos obtenidos sobre cultivos suplementados con nitrato de sodio (NaNO3), en éstos sí se presenta un efecto significativo sobre el incremento de la actividad FPasa en U/ml y son diferentes significativamente con respecto a todos los cultivos.
Los resultados obtenidos con los tratamientos químicos muestran la misma tendencia; sin embargo, son muy bajos en comparación con los que se consiguen con los tratamientos biológicos, posiblemente debido a las razones antes dichas.
Actividad endoglucanasa (CMCasa)
La actividad CMCasa de los cultivos con nitrato de sodio (NaNO3) como suplemento y pretratamiento biológico, incrementó en 1.15 veces respecto a los residuos tratados biológicamente, cultivados sin fuente de nitrógeno, con un valor de 0.776 U/mL +- 0.096 (0.030 µmol AR/µg proteína). Según el análisis estadístico, el tratamiento biológico realizado con P. ostreatus durante 10 días, obtuvo resultados significativamente diferentes a los de todos los demás cultivos en esta actividad. Se han reportado valores de actividad CMCasa de 0.048 µmoles/µg de proteína a partir del cultivo de T. reesei (mejorado genéticamente) sobre avicel. Esta actividad fue usada como pretratamiento para el cultivo de una bacteria sobre este sustrato (19). Debe tenerse en cuenta que el microorganismo utilizado en este trabajo es de tipo silvestre y la actividad obtenida es 0,625, la obtenida por T. reesei. Además es importante anotar que la carboximetilcelulosa (CMC), que se ha utilizado tradicionalmente como sustrato de endoglucanasas, presenta inconvenientes, ya que se trata de una mezcla heterogénea de polímeros de distinta longitud, con varias poblaciones de enlaces glucosídicos en cuanto a su grado de accesibilidad a las enzimas (42).
CONCLUSIONES
Fue posible cultivar el hongo Trichoderma viride T12 (aislado en el laboratorio de Biotecnología de la Universidad Jorge Tadeo Lozano), sobre residuos de palma de aceite, detectándose actividades endoglucanasa total (CMCasa) y celulasa total (FPasa) en el complejo enzimático. La actividades enzimáticas de las endoglucanasas y exoglucanasas producidas por el hongo aislado son bajas, comparadas con las obtenidas en otros estudios, en los cuales se han trabajado cultivos mixtos e inductores de actividad. Los resultados revelan que la actividad enzimática depende de las condiciones del material lignocelulósico en cuanto a su composición y acceso enzimático, que simultáneamente dependen del pretratamiento realizado a los sustratos. Los mayores valores de actividades enzimáticas se obtuvieron con los cultivos tratados biológicamente con Pleurotus ostreatus y suplementados con nitrato de sodio (NaNO3), con un valor de 0,374 U/mL de FPasa y 0,776 U/mL de CMCasa.
Los tratamientos químicos no tuvieron un efecto positivo sobre la producción enzimática. Requieren un proceso mejor controlado, ya que las condiciones afectan significativamente el material, y por lo tanto la producción enzimática. Se debe estudiar la presencia de compuestos químicos inhibidores luego de procesos de hidrólisis química, con el fin de controlar sus efectos sobre la producción de las enzimas.
La suplementación con fosfato de amonio no favoreció la actividad de las celulasas; es probable que haya causado inhibición, mientras que la suplementación con nitrato de sodio favorece el contenido de proteína, el crecimiento del hongo y la producción de enzimas.
Se observó una clara superioridad en la producción de celulasas sobre sustratos pretratados biológicamente para las actividades evaluadas en este estudio. Por lo tanto, la deslignificación biológica usando P. ostreatus es una alternativa ambientalmente amigable, con la que se pueden generar productos adicionales, como hongos comestibles y complejos enzimáticos con actividades ligninasas. Así pues, con este estudio se presentan alternativas de uso de los residuos de palma, ricos en lignina y celulasa, dando opciones de valorización a estos materiales. Este proceso conduce no solamente a la producción de las enzimas celulasas, sino también a la hidrólisis enzimática de los mismos residuos, con el fin de producir azúcares fermentables, materia prima para la producción de etanol, y productos importantes para otras industrias como la farmacéutica de alimentos y química, generados por fermentación de los mismos. Para este propósito es necesario estudiar otros métodos de delignificación, tanto físicoquímicos como biológicos, con el fin de disminuir la barrera biológica de la lignina, que afecta tanto la producción de las enzimas como la hidrólisis enzimática.
También es necesario estudiar de manera más profunda el complejo enzimático del hongo aislado, analizando posibles inductores de actividad como iones, cultivos mixtos, surfactantes, suplementos y fuentes de nitrógeno diferentes.
AGRADECIMIENTOS
Este trabajo fue financiado por la Dirección de Investigaciones de la Universidad Jorge Tadeo Lozano de Bogotá, proyecto 002IA, bajo el grupo de investigación Aprovecha.
REFERENCIAS BIBLIOGRÁFICAS
1. Vega JM, Castillo FY, Cárdenas F. La bioconversión de la energía. Madrid: Pirámide; 1983. [ Links ]
2. Kuhad RC, Singh A, Eriksson KE. Microorganisms enzymes involved in the degradation of plant fiber cell walls. Adv Biochem Eng Biotechnol. 1997; 57: 45-125. [ Links ]
3. Detroy RW, Julian G. Biomass conversion: Fermentation chemicals and fuels. CRC. crit. Rev Microbiol. 1982; 10:203-228. [ Links ]
4. Bhat MK. Cellulases and related enzymes in biotechnology. Biotech Adv. 2000; 18(5):355-383. [ Links ]
5. Pandey A.Recent process developments in solid-state fermentation.Process Biochem. 1992; 27(2): 109-117. [ Links ]
6. Roldán A, Palacios V, Peñate X, Benítez T, Pérez L. Use of Trichoderma enzymatic extracts on vinification of Palomino no grapes in the Sherry region. J Food Eng. 75: 375-38. [ Links ]
7. Beg Q, Kappor M, Mahajan L, Hoondal G. Microbial xylanase and their industrial application: a review. Appl Microbiology. Biotechnology. 2001; 56: 326-338. [ Links ]
8. Chen M, Liming X, Peijan X. Enzymatic hydrolysis of corncob and ethanol production from cellulosic hydrolysate. International Biodeterioration & Biodegradation. 2006; 59 (2): 85-89. [ Links ]
9. Saletes S, Caliman J, Raham D. Study of mineral nutrient losses from oil palm empty fruit bunches during temporary storage. J Oil Palm Research 2004; 16(1): 11-21. [ Links ]
10. Siregar FA, Saletes S, Caliman JP, Liwgang T. Empty fruit bunch compost: processing and utilities. En: International Oil Palm Conference. Bali, Indonesia : IOPRI; 2002: 27-57. [ Links ]
11. Fedepalma.Estadísticas.(sitio en Internet).Disponible en: http://www.fedepalma.org/estadisticas.htm. Consultado: 13 de abril de 2007. [ Links ]
12. Novotny C, Svobodava K, Erbanova P, Cajtham I, Kasinath A, Lang E, et al. Ligninolytic fungi in bioremediation: Extracellular enzyme production and degradation rate. Soil Biology and Biochemistry 2004; 36(10):1545-1551. [ Links ]
13. Oksanen T, Pere J, Paavilainen L, Buchert J, Viikar IL. Treatment of recycled kraft pulps with Trichoderma reesei hemicellulases and cellulases. J Biotechnol 2000; 78(1):39-48. [ Links ]
14. Marquina DD. Producción de biomasa de hongos celulolíticos para la degradación de residuos celulósicos. (Tesis doctoral). Universidad Complutense de Madrid ;1991. [ Links ]
15. Macarrón LR. Purificación y caracterización de endoglucanasa III de Trichoderma reesei QM9414. (Tesis doctoral). Universidad Complutense de Madrid;1992. [ Links ]
16. Miettinen O, Paloheimo M, Lantto R, Suominen P. Enhanced production of cellobiohydrolases in Trichoderma reesei and evaluation of the new preparations in biofinishing of cotton. J Biotechnol. 2005; 116(3):305-317. [ Links ]
17. Prabavathy VR, Mathivanan N, Sagadevan E, Murugesan K, Lalithakumari D. Intra-strain protoplast fusion enhances carboxymethyl cellulase activity in Trichoderma reesei. Enzyme and Microbial Technology. 2005; 38(5):719-723. [ Links ]
18. Riaan DH, Shaunita HR, Lee RL, Willem VZ. Hydrolysis and fermentation of amorphous cellulose by recombinant Saccharomyces cerevisiae. Metabol Eng. 2007; 9(1): 87-94. [ Links ]
19. Abdul AN, Philip JW. Role of fragmentation activity in cellulose hydrolysis. International Biodeterioration & Biodegradation 2006; 58(3-4):180-185. [ Links ]
20. Nan C, Jun-Bao F, Jin X, Jie C, Yi L. Enzymatic hydrolisis of microcrystalline cellulose in reverse micelles. Biochimica et Biophysica Acta Proteins & Proteomics. 2006; 1764(6): 1029-1035. [ Links ]
21. Tomimura YK, Khoo C, Putri FA. Enzymatic hydrolysis of some Malaysian woods. JTFS1. 1989; (3):255-262. [ Links ]
22. Mandels M, Weber J. The production of cellulases. Adv Chem Ser. 1969; 95:394-414. [ Links ]
23. Bradford M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 1976; 72: 248-254. [ Links ]
24. Ghose TK. Measurement of cellulase activities. Biochemical Engineering Research centre. Indian Institute of Technology. Pure Appl Chem. 1987; 59(2):257-268. [ Links ]
25. Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal Chem. 1959; 31:426-428. [ Links ]
26. Olsson L, Chistensen T, Hansen K, Palmavist E. Influence of the carbon source on production of cellulases, hemicellulases and pectinases by Trichoderma reesei Rut C-30. Enzyme and Microbial Technology 2003; 33(5): 612-619. [ Links ]
27. Uhlig H. Industrial enzymes and their applications. 2 ed. New York: Wiley-interscience; 1998. [ Links ]
28. Han YW, Catalano EA, Ciegler A. Wood and Agricultural Residues. New York: Academic Press; 1983. [ Links ]
29. Galbe M, Zacchi G. A review of the production of ethanol from sofwood. Appl Microbiol Biotechnol. 2002. 59: 618-628. [ Links ]
30. Umikalsom MS, Ariff AB, Zulkifli HS, Tong CC, Hassan MA, Karim MIA. The Treatment of oil palm Empty Fruit Bunch fibre for subsequent use as substrate for cellulase production by Chaetomium globosum. Bioresource Technology. 1997; 62 (1-2):1-9. [ Links ]
31. Rowell RM, Schultz TP, Narayan R, editors. Emerging Technologies for Materials and Chemicals from Biomass. U.S:ACS Symposium Series 476;1992. [ Links ]
32. Parajo JC, Alonso JL, Santos V. Delignification and swelling of Eucalpytus wood ahead of enzymatic hydrolysis of the cellulosic fraction. Process Biochemist. 1995; 30(6):537-545. [ Links ]
33. Sutcliffe R, Saddler JN. The role of lignin in the adsorption of cellulases during enzymatic treatment of lignocellulosic material. Biotechnol. Bioengng Syrup. 1986; 17: 749-762. [ Links ]
34. Chernoglazov VM, Ernolova OV, Klyosov A. Adsorption of high purity endo l,4-ß-glucanases from Trichoderma reesei on components of lignocellulosic materials: cellulose, lignin and xylan. Enzyme Microbial Technol. 1988; 10(8): 503-507. [ Links ]
35. Holtzapple M, Cognata M, Shu Y, Hendricson C. Inhibition of T. reesei cellulase by sugars and solvents. Biotechnol Bioeng. 1990; 36: 275-287. [ Links ]
36. Himmel M, Tucker M, Baker J, Rivard C, Oh K, Grohmann K. Comminution of biomass: hammer and knife mills. Biotechnology and Bioengineering Symposium. 1985; 15: 39-58. [ Links ]
37. Szengyel Z, Zacchi G, Varga A, Reczey K. Cellulase production of Trichoderma reesei Rut C-30 using steam pre treated spruce. Hydrolytic potential on different substrates. Appl. Biochem. Biotechnol. 2000; 84-86: 679-691. [ Links ]
38. Gutiérrez CM, Portal L, Moreno P, Robert P. Tengerdy mixed culture solid substrate fermentation of Trichoderma reesei with Aspergillus niger on sugar cane bagasse, Bioresource Technol. 1999; 68(2):173-178. [ Links ]
39. Schoemer RH, Garrett RH. Nitrate transport system in Neurospora crassa. U. Bacteriol 1974; 118: 259-269. [ Links ]
40. Awafo VA, Chahal DS, Simpson BK. Evaluation of combination treatments of sodium hydroxide and steam explosion for the production of cellulase-systems by two T. reesei mutants under solid-state fermentation conditions. Bioresource Technol. 2000; 73(3):235-245. [ Links ]
41. Zhang YH, Lynd LR. Toward an aggregated understanding of enzymatic hydrolysis of cellulose: noncomplexed cellulase systems. Biotechnol Bioeng 2004; 88: 797-824. [ Links ]
42. Sharrock KA, Cellulase assay methods: a review. J Biochem Biophys Meth. 1988; 17:81-106. [ Links ]
Recibido: Junio 26 de 2007 Aceptado: Septiembre 13 de 2007
*Autor a quien se debe dirigir la correspondencia: yineth.pineros@utadeo.edu.co