Introducción
El virus Zika (ZIKV) es un flavivirus miembro de la familia Flaviviridae y es transmitido por m os-quitos especialmente del género Aedes1. Es el causante de la fiebre del Zika, caracterizada por ser una enfermedad exantemática acompañada comúnmente de rash, fiebre, artralgia y conjuntivitis 2. Su transmisión es vectorial; sin embargo la transmisión vertical o útero-placentaria 3 y sexual 4-7 se confirmó durante la epidemia de 2015-2017. Durante este período se reportaron en el país más de 100.000 casos, siendo el país con mayor incidencia solo después de Brasil 8. Con cerca de 19.963 mujeres embarazadas reportadas 8, y 248 casos confirmados de niños nacidos con microcefalia 9, Colombia afrontó un período difícil para la salud pública. Oficialmente la epidemia fue declarada finalizada en 2016 por el Ministerio de Salud colombiano, luego de comprobar el fin de transmisión autóctona 10. Durante el 2017 se realizaron las últimas pesquisas epidemiológicas, dando como resultado que la tasa de mortalidad en nuestro país por ZIKAV fue del 0,0 %; con respecto a la población gestante las empresas aseguradoras de planes de beneficio en salud (EAPBS) solo realizaron un seguimiento de las gestantes con fiebre del Zika en el 49 % de los casos en el país y con respecto a nuestro departamento, Tolima, en tan solo el 32,3 % 11.
El síndrome congénito por ZIKV (SCZ) es una de las presentaciones que más ha acaparado la atención mundial por las repercusiones que tiene en el desarrollo de los fetos durante la gestación. Inicialmente se presentó en Brasil, cuando un estudio llevado a cabo en Rio de Janeiro mostró anomalías ecográficas fetales en doce de 42 mujeres (29 %) con infección por ZIKV durante el embarazo; siete de los 42 fetos (17 %) que se estudiaron tuvieron microcefalia, atrofia cerebral o calcificaciones cerebrales 11; esta sería la primera señal del efecto nocivo del virus en el sistema nervioso central de los fetos. Respecto a la microcefalia, uno de los hallazgos más comunes y llamativos, es definida por el Centro para el control y la prevención de enfermedades (CDC) como una circunferencia occipitofrontal por debajo del tercer percentil (< 3 SD) para la edad gestacional y el sexo 13. En Colombia, por su parte, otra investigación llevada a cabo en Barranquilla e Ibagué mostró hallazgos imagenológicos similares; se concluyó que deben transcurrir quince semanas entre la presentación de los síntomas en la gestante y el hallazgo temprano de signos imagenológicos en el feto 14 además de presentar estos síntomas durante el primer trimestre de gestación; con ello se corroboró el efecto teratogénicos del virus 15-20. Moore et al.21 caracterizaron los patrones hallados en el SCZ y los individualizaron respecto a los de otras neuroinfecciones congénitas del TORCH; encontraron entonces como únicos del Zika la microcefalia severa con colapso parcial del cráneo, cortezas cerebrales delgadas con calcificaciones subcorticales, cicatrización macular y manchas pigmentarias retinianas focales, contracturas congénitas y marcada hipertonía temprana con síntomas de afectación extrapiramidal.
Caso clínico
Paciente masculino de cuatro meses y veinte días de edad procedente del área rural de Ibagué que es llevado a consulta al servicio de Plan Canguro de la Unidad Materno Infantil del Tolima (UMIT) el 18 de enero de 2017 para primer control posnatal acompañado de un diagnóstico previo de microcefalia asociado a neuroinfección por Zika con prueba confirmatoria de la madre (RT-PCR) por parte del Instituto Nacional de Salud (INS).
Antecedentes
Prenatales: retardo en el crecimiento intrauterino (RCIU), infección congénita por Zika (confirmado), madre presenta RASH y fiebre durante la semana diez de gestación. Perinatales: Parto vaginal (29/09/2016) a la edad gestacional de 37 semanas, con un peso de 2.000 gramos, perímetro cefálico de 28 centímetros (< -3 SD). Apgar: ocho puntos al minuto, nueve puntos a los cinco minutos, diez puntos a los diez minutos. Al examen físico general se encuentra hallazgo de retinopatía. Posnatales: requerimiento de Unidad de Cuidados Intensivos Neonatal sin asistencia ventilatoria por bajo peso al nacer (30/09/2016). Ultrasonografía Transfontanelar que reporta signos de microcefalia con dilatación ventricular y presencia de microcalcificaciones por neuroinfección a nivel ganliobasal y periventriculares. Así mismo, se encuentran hallazgos compatibles con lisencefalia.
Desde su nacimiento hasta su último control se realizan tres controles con Neuropediatría, con la presencia de los siguientes hallazgos:
(18/01/2017). Examen físico muestra talla en -3 SD y peso < -3 SD. A la exploración topográfica se identifica en cráneo y cara fontanela cerrada con frente estrecha y cuero cabelludo redundante, mirada sostenida hacia la derecha (Figura 1). Examen neurológico: hipertonía con hiperre-flexia y tendencia al opistótono. Concepto clínico que menciona un riesgo neurológico alto y con diagnósticos activos de microcefalia severa por Zika. Se solicita TAC cerebral simple, electroencefalograma (EEG), radiografía de cráneo y VOD.
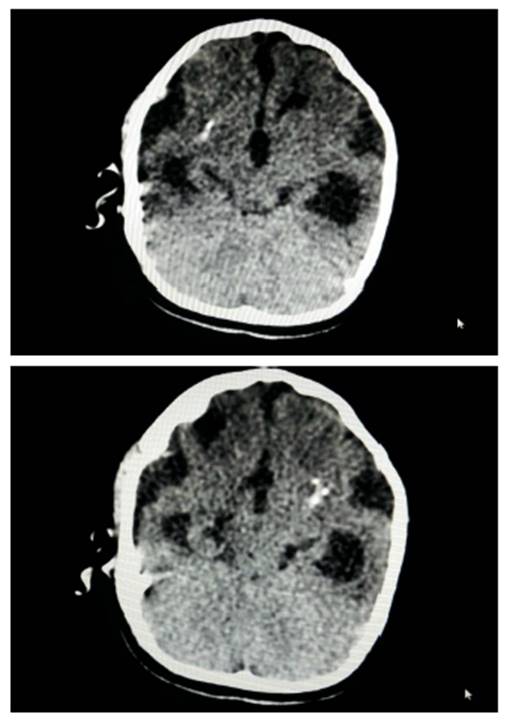
(5/04/2017). Examen físico: muestra talla < -3 SD, peso < -3 SD y perímetro cefálico < -3 SD. Cráneo con fontanela cerrada. Examen neurológico: se encuentra en el campo motor hipertonía con hiperreflexia, DPM correspondiente para un mes de edad. El TAC cerebral simple (Figura 2) reporta dilatación simétrica de los ventrículos laterales, imágenes hiperdensas focales hacia los lóbulos parietales, normalidad de las cisternas perime-sencefálicas, tallo y fosa posterior. El EEG enseña un trazado en sueño NREM uno y dos normal. Concepto clínico es de retraso en el desarrollo psicomotor (RDPM) y microcefalia por Zika.
(10/07/2017). Examen físico: muestra talla y peso < -3 SD, perímetro cefálico que persiste en < -3 SD. Examen neurológico: sin cambios con respecto al control anterior. Persiste hipertonía e hiperreflexia. Edad neurológica de 3 meses.
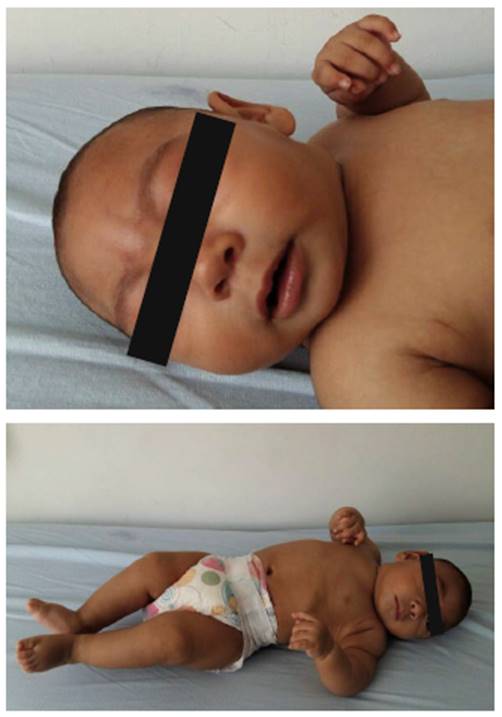
Fuente: Sandra Patricia Mansilla, 18 de enero de 2017, UMIT.
Figura 1 Paciente con A. microcefalia severa y B. hipertonía e hiperreflexia con tendencia al opistótono.
Discusión
El actual caso se presenta como uno de los pocos confirmados de que se tiene registro hasta la fecha en Tolima. Junto a este, veintiún casos más que aguardan por la confirmación por parte del Instituto Nacional de Salud (INS) a la Secretaría de Salud del Tolima. Pero estos presentan las características típicas del CSZ (microcefalia severa, atrofia cortical, calcificaciones, ventriculomegalia, retinopatía, entre otras) 3,12,14,15,17,18,21-25 y corresponden a niños nacidos vivos de madres a las que se les realizó el muestreo serológico (RT-PCR) para ZIKV.
La microcefalia es severa, persistiendo por debajo de las -3 SD con un P50 al nacimiento que corresponde al de un feto a las 28 semanas. Pese a que progresa, tiende a estancarse a medida que se avanza en los controles y se aleja cada vez más del límite inferior de -3 SD (Figura 3). El trastorno del tono es marcado y persistente, su hiperreflexia con actitud en opistótono es un factor de pronóstico para Parálisis Cerebral Espástica alcanzados sus dos años de edad. El EEG es de morfología normal; se descarta cualquier posibilidad de epilepsia pese a los múltiples hallazgos que la literatura en los casos de CSZ 23-26. En cuanto a los hallazgos oftalmológicos del caso, es importante mencionar que la retinopatía por Zika hace parte del cuadro clínico típico 21; con ella se concluye la existencia de un daño a nivel retiniano y del nervio óptico que comprometerá la visión de los recién nacidos de forma permanente, alcanzando en algunos casos a la ceguera por la gravedad de las lesiones 27-29.
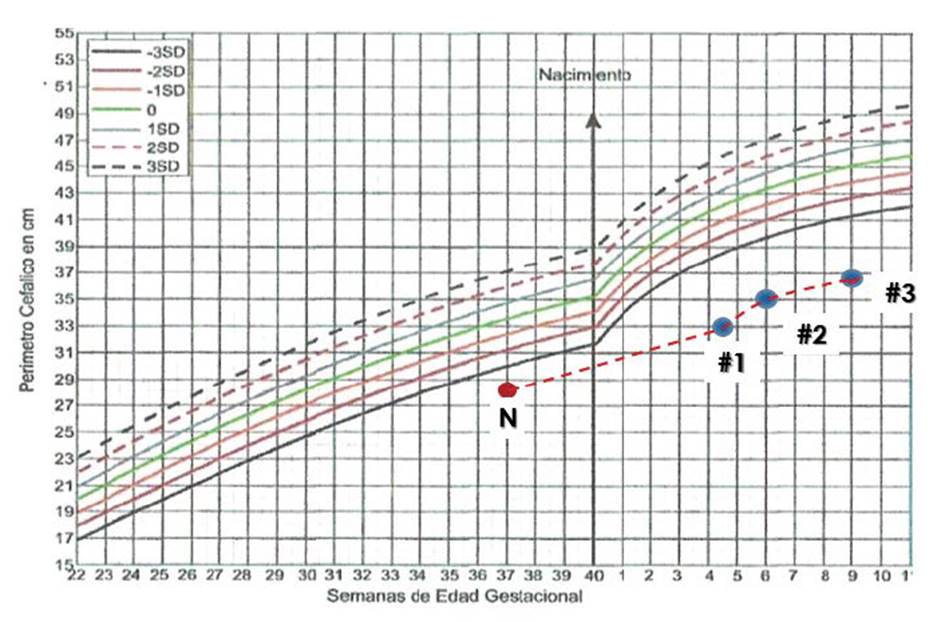
Fuente: elaboración a partir de información tabulada de registros de historia clínica del paciente.
Figura 3 Progresión del perímetro cefálico desde el nacimiento hasta el último control.
Se menciona como importante la caracterización de todos estos casos y su detección para poder entablar un seguimiento neurológico que se justifica por el alto riesgo de compromiso motor, cognitivo y sensorial. Establecer las diferencias con las secuelas neurológicas que se observan en las microcefalias del Síndrome TORCH e incluir también las secuelas de los síndromes de origen cromosómico. En Colombia y en Tolima el rezago de la vigilancia al seguimiento de estos casos es más que evidente 11; sin embargo organizaciones como la Red Colombiana de Colaboración en Zika (Recolzica) menciona como importante poder llevar un seguimiento a los nacidos con microcefalia para obligar a explorar otros tipos de secuelas en esta población, hoy infantil 30.