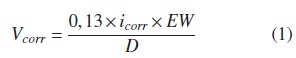Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ciencia en Desarrollo
Print version ISSN 0121-7488
Ciencia en Desarrollo vol.6 no.1 Tunja Jan./June 2015
Evaluación de la degradación de superficies de fluorapatita mediante técnicas electroquímicas
Degradation Assessment of Fluorapatite Surfaces Using Electrochemical Techniques
L. J. Reyes Jaimesa,*
H. A. González Romeroa
A. Sandoval Amadora
D. Y. Peña Ballesterosa
H. A. Estupiñán Duránb
aGrupo de Investigaciones en Corrosión, Escuela de Ingeniería Metalúrgica y Ciencia de Materiales, Universidad Industrial de Santander, Bucaramanga, Colombia.
*Autor de correspondencia: johereyes@hotmail.com
bGrupo de Ciencia y Tecnología de Materiales, Facultad de Minas. Universidad Nacional de Colombia, sede Medellín, Colombia.
Resumen
Se evaluó el efecto del pH de fluido corporal simulado en la formación de apatitas y en la degradación de superficies de la aleación Ti6Al4V recubiertas con Fosfato de Calcio mediante la técnica de electrodeposición catódica. Como variables de estudio se tomaron el pH del fluido corporal simulado y el tiempo de inmersión de los recubrimientos. Mediante microscopia electrónica de barrido, espectroscopia de energía dispersiva, difracción de rayos X y absorción atómica se pudo corroborar la formación de apatitas, y la degradación de los recubrimientos se evaluó mediante Espectroscopia de impedancia electroquímica y curvas de polarización potenciodinámicas.
Los resultados obtenidos muestran que los recubrimientos tenían altas concentraciones de Fluorapatita (Ca5(PO4)3F) y que su formación se ve favorecida a medida que el pH del fluido corporal simulado y el tiempo de inmersión aumenta. Por otra parte, se obtuvo que las muestras evaluadas a pH de 7,2 son menos estables termodinámicamente; sin embargo, las evaluadas a 7,6 presentan una superficie más activa, por lo que se obtiene una mayor velocidad de degradación.
Palabras clave: Degradación de superficies, Electrodeposición catódica, Fluorapatita, SBF, Ti6Al4V.
Abstract
The pH effect of a Simulated Body Fluid in the apatite formation and the degradation of the Ti6Al4V alloy surfaces, coated by calcium phosphate obtained through cathodic electrodeposition was evaluated. The simulated body fluid pH and the coating immersion time were taken as variables. The formation of apatite was corroborated by Scanning Electron Microscopy, Energy Dispersive Spectroscopy, X Ray Diffraction and Atomic Absorption Techniques. The coating degradation was assessed by the Electrochemical Impedance Spectroscopy and the Potential Dynamic Polarization Curves. The results have shown that the coatings had high concentrations of fluorapatite (Ca5(PO4)3F) and its formation was favored as the simulated body fluid pH and the immersion time increases. Moreover, it was found that the coatings samples evaluated at pH 7.2 were less thermodynamically steady; however, the evaluated coating at pH 7.6 exhibited a more active surface, so that a higher rate of degradation is obtained.
Key words: Degradation, Cathodic Electrodeposition, Fluorapatite, pH, SBF, Ti6Al4V.
1. Introducción
Los biomateriales metálicos han mostrado buenas cualidades para ser empleados en implantes dentales y ortopédicos, gracias a su resistencia a la corrosión y a sus propiedades mecánicas [1, 2]; sin embargo, suelen darse complicaciones en la salud del paciente, debido a la liberación de iones [2, 3]; por lo tanto, para su buen desempeño es necesario someterlos a modificaciones superficiales tales como recubrimientos cerámicos o poliméricos sobre el metal, medianécnicas como inmersión, electrodeposición, plasma spray o sol-gel, entre otras; actualmente, la técnica más empleada es la de electrodeposición catódica, que permite crear recubrimientos cerámicos ricos en calcio y fósforo sobre el metal [2, 4].
Por otra parte, todos los procesos fisiológicos que se llevan a cabo dentro del cuerpo humano están profundamente influenciados por el pH de este [5]; por esta razón, el pH en la sangre del cuerpo humano debe estar entre 7,35 y 7,45 [6], mientras que en la boca debe estar entre 7,2 y 7,8 [7]; si el pH no se conserva en estos rangos se presentan complicaciones en la salud del paciente [8, 9, 10]. En cuanto a los implantes, si el pH disminuye se constituye un estado de acidosis que indica un aumento en la concentración de iones de hidrógeno, lo cual puede promover los procesos de degradación de estos; de forma contraria, si el pH aumenta se constituye un estado de alcalosis que podría llevar a la formación de apatitas Cam(PO4)n (F,Cl,OH) [11].
En los últimos años se han realizado estudios en el ambiente bucal que muestran que si el pH disminuye, se incrementa la solubilidad de la fase apatítica, pero se satura el fluido bucal de calcio, fosfato, carbonato y fluoruro, lo cual implica la desmineralización del diente, con el tiempo [12, 13, 14]. De forma contraria, a pH de 7,8 se han observado nódulos calcificados bien formados [7, 14].
Algunos investigadores han estudiado el comportamiento de la aleación Ti6Al4V al sumergirse en Fluidos Corporales Simulados (SBF) [3, 15] durante diferentes tiempos, observando que la aleación presenta baja velocidad de corrosión y que a medida que pasa el tiempo se forma una doble película pasiva con segregaciones de los productos de apatita formados por la interacción de la película de óxido de titanio con la solución SBF; sin embargo, esta película de productos formados es inestable, y para tiempos de exposición prolongados puede llegar a disolverse [15].
El objetivo de este trabajo es evaluar el efecto del pH del SBF en la capacidad de formación de apatitas y en la degradación de recubrimientos de fosfato de calcio obtenidos mediante electrodeposición catódica.
2. Materiales y métodos
Muestras de Ti6Al4V de 3 mm de espesor y 14 mm de diámetro fueron desbastadas con papel de carburo de silicio N.° 120 hasta 600, seguido por un pulido mecánico con alúmina de 3 µm y 0,05 µm, y fueron sometidas a limpieza ultrasónica con acetona durante 15 minutos; este procedimiento se basó en la norma ASTM E407. Posteriormente, las muestras fueron sumergidas en una solución de ácidos (H2SO4 95-97%, HCl 37% y agua desionizada -relación de volumen 1:1:1-) a 60 °C, durante 25 minutos, para incrementar su rugosidad superficial y mejorar la adherencia del recubrimiento. Finalmente, se realizó de nuevo limpieza ultrasónica en acetona durante 15 minutos para limpiar la superficie de los sustratos.
La obtención de superficies recubiertas se llevó a cabo mediante electrodeposición catódica, siguiendo la metodología planteada en [4, 16, 17]. Posteriormente, los sustratos recubiertos se sometieron a un tratamiento térmico de cristalización, llevando las muestras a 800 °C durante una hora, con una velocidad de calentamiento de 33 °C/min, y enfriamiento dentro del horno.
Para conocer su morfología y composición, los recubrimientos fueron analizados mediante microscopia electrónica de barrido y espectroscopia de energía dispersiva, en un microscopio QUANTA FEG 650; difracción de rayos X, en un equipo X BRUKER D8 ADVANCE, y espectroscopia infrarroja por transformada de Fourier, en un espectrómetro FT-IR Tensor 27.
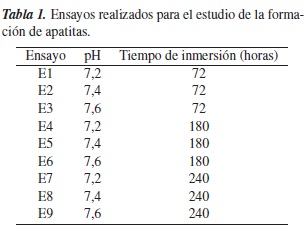
Tras el tratamiento térmico, las muestras de Ti6Al4V recubiertas se sumergieron en SBF (Kokubo) bajo diferentes condiciones de pH (7,2, 7,4 y 7,6) y tiempo (72, 180 y 240 horas), con el fin de inducir la formación de apatitas.
Por último, se realizó el estudio mediante espectroscopia de impedancia electroquímica, haciendo un barrido de frecuencias desde 10 mHz hasta 100 KHz, y curvas de polarización potenciodinámica, barriendo potenciales desde -500 mV hasta 2000 mV vs. el potencial de circuito abierto. Estas pruebas se realizaron en un potenciostato/galvanostato GAMRY 600. El SBF se empleó bajo los 3 diferentes pH de estudio, trabajando a 37 °C en una celda de tres electrodos, empleando Ag/AgCl como electrodo de referencia, grafito como contraelectrodo y el sustrato de Ti6Al4V recubierto como electrodo de trabajo.
3. Resultados y discusión
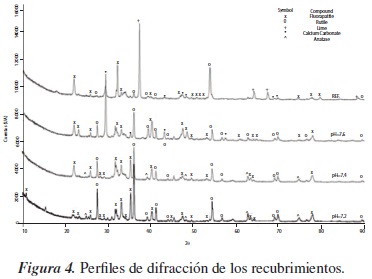
En la figura 1 se presenta la morfología de las superficies de Ti6Al4V recubiertas por electrodeposición catódica. Como se observa, los recubrimientos presentaron aglomerados irregulares, con una superficie rugosa, alto nivel de porosidad y morfología basada en partículas bastas; sin embargo, es importante destacar que su forma tenía una tendencia a granos relativamente equiaxiales [18]. Adicionalmente, al comparar las figuras 1a y 1b es posible observar que el tratamiento térmico realizado a 800 °C sobre los recubrimientos permitió obtener mayor cristalinidad dándole una morfología más ordenada y unos aglomerados un poco más equiaxiales; esto se puede corroborar en la figura 4, donde se hace evidente el incremento de la cristalinidad al producirse un aumento en la intensidad de los picos de los compuestos cristalinos en las muestras expuestas a diferentes pH.
En la figura 2 se muestran las micrografías de los recubrimientos después de la inmersión en SBF bajo las condiciones de trabajo que se muestran en la tabla 1.
Las micrografías de la figura 2 muestran que a medida que el tiempo de inmersión y el pH aumentan, el recubrimiento va perdiendo su forma cristalina y va adquiriendo una morfología con apariencia de esponja.
Sin embargo, es importante notar que para las muestras inmersas en SBF con pH de 7,2 se perciben todo el tiempo los granos equiaxiales, debido a que este pH tiende a promover la degradación del recubrimiento y no favorece demasiado su calcificación. Caso contrario ocurre con las muestras inmersas en SBF con pH de 7,6, debido a que, en estas, a medida que avanza el tiempo desaparecen por completo los granos equiaxiales, y al finalizar la inmersión solo se percibe una morfología de aglomerados irregulares altamente porosos.
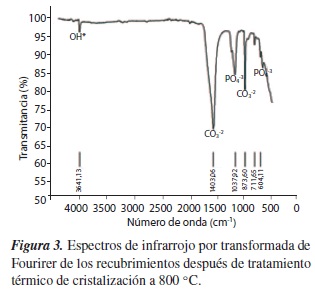
En la figura 3 se observa el espectro FT-IR, donde se puede ver la región de absorción entre 3700 y 3100 cm−1 y la banda de 1638 cm−1, que son asignadas al estiramiento y doblamiento del enlace O-H; sin embargo, la intensidad del pico indica que no hay gran cantidad de estos enlaces. Otra banda, que va desde 1200 hasta 960 cm−1, corresponde al modo asimétrico de estiramiento del grupo PO4−3, y una banda simple va del rango de 670 a 500 cm−1, indicando un modo de doblamiento de los enlaces O-P-O del fosfato, muy similares a los espectros encontrados en las apatitas [19].
La banda más intensa del espectro se localizó desde los 1600 hasta los 1400cm−1, contando también con un pequeño pico a 874 cm−1, lo cual es atribuido a la banda característica del grupo CO3 −2 en una apatita carbonatada [19]. Por último, se observa un pico muy débil a 711 cm−1, el cual puede ser atribuido a la sustitución de los iones OH−por F−[20].
La figura 4 muestra el difractograma de una de las muestras sin inmersión (REF) y de 3 muestras inmersas en SBF durante 180 horas bajo pH de 7,2, 7,4 y 7,6; es posible observar en esta que existen picos representativos de Fluorapatita (Ca5(PO4)3F), y se encuentra principalmente en el esmalte de los dientes [19]. La Fluorapatita se considera un biomaterial prometedor para implantes óseos y dentales, debido a sus similitudes con la hidroxiapatita; además, cuenta con el beneficio adicional de liberar flúor, el cual puede contrarrestar la desmineralización de los huesos [19].
También en la figura 4 es posible observar la presencia de rutilo, que es la única fase termodinámicamente estable de óxido de titanio y que se forma a altas temperaturas [21]. Antes de realizar la inmersión no se observa la presencia de anatasa, debido a que esta fase de TiO2 es metaestable, y a temperatura de entre 400 y 1000 °C se transforma irreversiblemente en rutilo [21]; mientras que en las muestras estudiadas a pH de 7,2 y 7,4 sí se observa su presencia, debido a que el metal alcanzó a estar en contacto con el medio, que le causó una protección mediante la formación de esta película espontánea. Adicional-mente, en la muestra sin inmersión se puede observar la presencia de lima (CaO) y de carbonato de calcio (CaCO3), formados a partir del proceso de electrodeposición; el CaCO3 también se presenta en la muestra estudiada a pH de 7,6, debido a las características del SBF con el que estuvo en contacto.
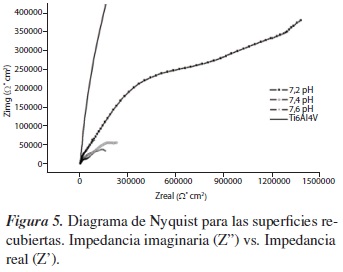
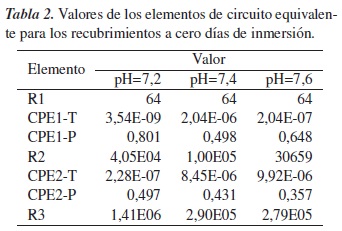
La figura 5 muestra los diagramas de Nyquist de los sustratos recubiertos, tratados térmicamente a 800 °C y a cero días de inmersión; en esta es posible observar que tanto la muestra desnuda como la muestra evaluada a pH de 7,2 presentan los mayores valores de resistencia a la transferencia de carga e impedancia, en comparación con las muestras evaluadas a pH de 7,4 y 7,6, y que el valor de dicha resistencia aumenta a medida que disminuye el pH, debido a que se disminuye la cantidad de zonas activas, dificultando la interacción entre el medio y el sustrato recubierto. A partir de esto, el pH de 7,6 sugiere una mayor velocidad de degradación, debido a que su superficie es más activa.
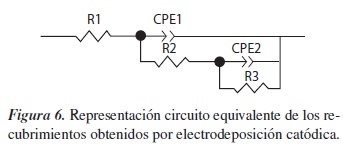
En la figura 6 se muestra el circuito que mejor se ajusta al sistema estudiado, el cual está compuesto por:
- R1: que representa la resistencia de la solución (Rs), la cual fue ajustada a un valor de 64 a partir de la revisión bibliográfica para recubrimientos de Fosfato de Calcio obtenidos mediante electrodeposición catódica [16]. Este ajuste fue necesario debido a que el circuito planteado se ajustaba muy bien a los datos obtenidos, pero se obtenían valores negativos de resistencia de la solución, lo cual no es correcto.
- CPE1 y R2: elementos asociados a la interfase electrolito-recubrimiento.
- CPE2 y R3: elementos asociados a la interfase recubrimiento-sustrato.
En la tabla 2 se muestran los datos obtenidos mediante la simulación del circuito equivalente; es posible observar el valor de la resistencia a la transferencia de carga, el cual disminuye a medida que aumenta el pH.
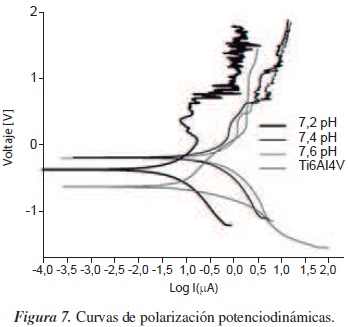
En la figura 7 se muestran las curvas de polarización potenciodinámicas obtenidas para los recubrimientos estudiados a cero días de inmersión en SBF con pH de 7,2, 7,4 y 7,6. A potenciales menores a −0,5 V se encuentra el dominio catódico donde prevalecen las reacciones de reducción del agua, principalmente. Además, a pH de 7,4 y de 7,6 el valor del potencial de corrosión (Ecorr) es mayor, indicando que tienen menor tendencia a degradarse; sin embargo, son las que mayor velocidad de degradación presentan, debido a que la superficie del recubrimiento se torna más activa con dicha solución. De forma contraria, la muestra estudiada a pH de 7,2 muestra menor potencial de corrosión, lo que indica que bajo esta solución el recubrimiento es menos estable termodinámicamente; además, esta curva muestra en la parte anódica una pequeña disminución en la densidad de corriente, debida a la inestabilidad del recubrimiento, que causa la exposición del metal y da lugar a su pasivación. Esta zona de pasivación no es posible observarla a pH de 7,4 y 7,6, dado que en estos el recubrimiento tiene la posibilidad de resistir un poco más, debido a la formación de fluorapatita.
La velocidad de degradación se puede calcular a partir de las pendientes anódicas y catódicas de la figura 8 mediante la ecuación (1):
donde:
icorr es la densidad de corriente de corrosión
EWes el peso equivalente de la aleación (10,88 g)
Des la densidad de la aleación (4,42 g/cm3)
Vcorr es la velocidad de degradación de la muestra
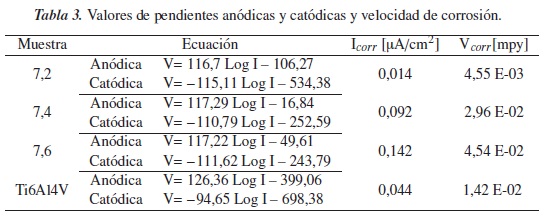
En la tabla 3 se muestran los valores de las pendientes anódicas y catódicas, así como la velocidad de degradación de los recubrimientos para los diferentes pH de estudio; en esta es posible observar que la mayor velocidad de degradación se presenta en la muestra estudiada a pH de 7,6, debido a que la superficie se comporta de forma activa al estar en contacto con este ambiente.
4. Conclusiones
Mediante la técnica de electrodeposición catódica fue posible obtener recubrimientos ricos en fluorapatita, los cuales, al aumentar el pH del SBF y el tiempo de inmersión de las muestras, producen un incremento en la cantidad de fluorapatita formada; además, mediante EIS se determinó que las muestras analizadas a pH de 7,2 presentan la mayor resistencia a la transferencia de carga, mientras que a pH de 7,6 se obtuvo la menor resistencia, lo cual indica que estas tenían una superficie más activa que les permitía reaccionar con el medio.
Por otra parte, a partir de las curvas potenciodinámicas fue posible obtener la velocidad de degradación para las muestras en estudio, obteniendo mayor velocidad para la muestra inmersa en SBF con pH de 7,6 (4,54 e-02 mpy) y una menor velocidad para la muestra inmersa a un pH de 7,2 (4,55e-03 mpy), lo cual confirma que el medio más básico proporciona una superficie más activa.
Con base en los resultados obtenidos se puede confirmar que es posible que estos recubrimientos sean empleados como biomateriales para aplicaciones ortopédicas y dentales, debido a que no se degradarán una vez estén en contacto con el cuerpo, por el contrario, tenderán a formar apatitas que le permitirán al implante unirse al hueso, favoreciendo la osteointegración.
Agradecimientos
A Colciencias, por la financiación de este proyecto, bajo el contrato N.°>780-2011, a Quirúrgicos Especializados S.A. y al Grupo de Investigaciones en Corrosión (GIC) de la Universidad Industrial de Santander, por su constante apoyo y colaboración.
Referencias
[1] K. C. Dee, D. A. Puleo, R. Bizios. "Biomaterials", An introduction to tissue-biomaterial interactions. Wiley-Liss, New Jersey, 2002, pp. 2-6. [ Links ]
[2] S. E. Rodil, "Modificación superficial de biomateriales metálicos", Rev. LatinAm. Metal. Mat vol. 2, no. 9, pp. 67-83, 2009. [ Links ]
[3] H. R. Asgari Bidhendi, and M. Pouranvari, "Corrosion study of metallic biomaterials in simulated body fluid", Metalurgija-MJoM, vol. 17, no. 1, pp. 13-22, 2011. [ Links ]
[4] E. Millán Castro, H. A. Estupiñán, y D. Y. Peña Ballesteros, "Obtención de recubrimientos de fosfatos de calcio sobre Ti6Al4V ELI mediante electrodeposición catódica", Scientia et Technica, vol. 13, no. 36, pp. 209-213, 2007. [ Links ]
[5] S. Wray, "Smooth muscle intracelular pH: measurement, regulation, and function", Am. J. Physiol, vol. 254, pp. C213-c225, Feb. 1988. [ Links ]
[6] The University of Arizona: Department of Biochemistry and Molecular Biophysics. Clinical Correlates of pH Levels [En línea]. Enero de 1999. Disponible en: http://www.biology.arizona.edu/biochemistry/problem_sets/medph/05t.html. [ Links ]
[7] T. Okabe, M. Sakamoto, H. Takeuchi, and K. Matsushima, "Effects of pH on mineralization ability of human dental pulp cells", JOE, vol. 32, no. 3, pp 1898-201, Mar. 2006. [ Links ]
[8] ¿Cómo afecta el pH de la sangre a nuestra salud? [En línea]. Septiembre 30 de 2011. Disponible en: http://prefierolonatural.wordpress.com/2011/09/30/como-afecta-el-ph-de-la-sangre-anuestra-salud/. [ Links ]
[9] M. J. Bueno Cortés, "El pH y la enfermedad", [En línea], 2015. Disponible en: http://www.biosalud.org/archivos/noticias/4ph%20y%20enfermedad.pdf. [ Links ]
[10] Prevención de la salud: la importancia del equilibrio de pH [En línea], 2014. Disponible en: http://www.alimentacionsana.org/PortalNuevo/actualizaciones/equilibrioph.htm. [ Links ]
[11] The University of Arizona: Department of Biochemistry and Molecular Biophysics. Clinical Correlates of pH Levels [En línea], 2004, Disponible en: http://www.biology.arizona.edu/biochemistry/problem_sets/medph/05t.html. [ Links ]
[12] A. Larée, "Bioquímica de las caries" [En línea], 2015. Disponible en: http://www.odontochile.cl/archivos/tercero/cariologia/bioquimicadelascaries.doc. [ Links ]
[13] X. Moreno Ruíz, C. G. Narváez Carrasco, y V. Bittner Schmidt, "Efecto in vitro de las bebidas refrescantes sobre la mineralización de la superficie del esmalte dentario de piezas permanentes extraídas," Int. J. Odontostomat, vol. 5, no. 2, pp. 157-163, agosto 2011. [ Links ]
[14] D. P. Núñez y L. García Bacallao, "Bioquímica de la caries dental", Rev Haban Cienc Méd. Vol. 9, no. 2, pp 156-166, Junio 2010. [ Links ]
[15] I. D. Talavera Jaume, "Estudio de la corrosión de una aleación Ti6Al4V utilizada como biomaterial", Trabajo de grado, Escuela de Ingeniería Metalúrgica y Ciencia de los Materiales, Facultad de Ingeniería, Universidad Central de Venezuela, Caracas, junio de 2007. [ Links ]
[16] L. J. Sánchez y S. A. Forero, "Evaluación de la formación de apatita sobre una superficie biocerámica patronada obtenida por electrodeposición catódica y litografía láser", Trabajo de grado, Escuela de Ingeniería Metalúrgica y Ciencia de Materiales, Facultad de Ingenierías Fisicoquímicas, Universidad Industrial de Santander, Bucaramanga, 2013. [ Links ]
[17] M. Saremi and F. Haghighat Sabet, "Nano hydroxyapatite coating on stainless steel 304 by electrochemical method", Int J. Mod. Phys. B. Vol. 22, 2008. [ Links ]
[18] A.B. Martínez-Valencia, H.E. Esparza-Ponce y colaboradores, "Caracterización estructural y morfológica de hidroxiapatita nanoestructurada: estudio comparativo de diferentes métodos de síntesis", Superficies y vacío, vol. 21, no. 4, pp. 18-21, diciembre 2008. [ Links ]
[19] X. Y. Liu, H. Ye and H. P. Hong, "Cladding of titanium/fluorapatite composites onto Ti6Al4V substrate and the in vitro behavior in the simulated body fluid", El Sevier, 2009. pp. 8126-8134. [ Links ]
[20] R.A. Berner, P. Regnier y A.C. Lasaga, "Mechanism of CO32-substitution in carbonatefluorapatite: Evidence from FTIR spectroscopy, CNMR and quantum mechanical calculations", American Mineralogist, Vol. 79, pp. 809-818, 1994. [ Links ]
[21] R. Mariarosa, F. Matteucci, G. Cruciani, M. Dondi and G. Guarini, "Mecanismos colorantes en pigmentos cerámicos a base de rutilo", Qualicer, Castellón (España). pp. 271-282, 2004. [ Links ]