Introducción
El síndrome antifosfolípido (SAF) es una enfermedad auto-inmune no inflamatoria que se relaciona con la producción persistente de anticuerpos antifosfolípidos (aPL) tales como: anticuerpos anticardiolipina (aCL), o anticuerpos anti-β2 glucoproteína-I (aβ2GPI), con evidencia de actividad funcional determinada por la presencia de anticoagulante lúpico (AL). Esta entidad puede causar trombosis venosa o arterial (SAF trombótico), o morbilidad obstétrica (preeclampsia, parto pretérmino, restricción del crecimiento intrauterino o pérdida fetal)1,2.
Como síndrome tiende a clasificarse como una sola enfermedad, pero los mecanismos fisiopatológicos de las manifestaciones trombóticas y obstétricas difieren, pues mientras en el SAF trombótico aplica la teoría del doble «hit», donde los aPL generan el «primer hit» al causar un estado protrombótico, pero es necesario un segundo «hit» para inducir la formación de trombos (embarazo, inmovilización prolongada, cirugía o suspensión de la anticoagulación), en el SAF obstétrico los aPL generan directamente un proceso inflamatorio y la activación del complemento, ocasionando los desenlaces clínicos gestacionales característicos2-6.
La prevalencia en población general de los aPL oscila entre 1-5%, mientras que la prevalencia de SAF oscila entre 40-50 casos por 100.000 personas, siendo más frecuente en mujeres5,7; sin embargo, su presencia en ciertas poblaciones específicas es mayor, como en pacientes con eventos trombóticos o pérdidas fetales recurrentes, donde la frecuencia de estos anticuerpos puede alcanzar hasta un 40%1. El SAF puede presentarse en pacientes sin evidencia clínica o de laboratorio de alguna otra condición (SAF primario) o puede estar asociado a otras enfermedades, principalmente lupus eritematoso sistémico (LES), tumores malignos, infecciones o algunas sustancias5,7.
Se ha reportado que hasta el 40% de las pacientes con LES pueden tener aPL pero menos de este porcentaje pueden desarrollar manifestaciones clínicas de SAF trombótico. Adicionalmente, ambas enfermedades pueden producir manifestaciones clínicas durante el embarazo, haciendo que el curso de éste varíe en presencia de SAF, LES o la combinación de ambas8-10.
A escala mundial, el estudio más representativo, hasta ahora publicado, que evalúa el SAF obstétrico corresponde a una cohorte de 247 mujeres europeas predominantemente de raza blanca denominado EUROAPS, en quienes las manifestaciones obstétricas más frecuentes fueron aborto recurrente y pérdida fetal. Además, la trombosis y la progresión a LES en pacientes con SAF obstétrico fue menos común que en SAF clásico, sugiriendo mecanismos fisiopatológicos diferentes1. Otros estudios internacionales han dirigido su investigación a establecer vínculos causales entre el tipo de anticuerpos y los desenlaces obstétricos11,12.
En nuestro contexto se han realizado 2 estudios que han descrito las características de pacientes con SAF, y entre éstos, el subgrupo de SAF obstétrico, siendo la pérdida fetal la manifestación obstétrica más frecuente13,14. Estos estudios han proporcionado datos relevantes sobre el SAF, pero falta mayor profundización sobre las características y desenlaces maternos y perinatales. Por este motivo se realizó el presente estudio, cuyo objetivo fue evaluar las características epidemiológicas, clínicas y terapéuticas, así como la morbilidad obstétrica, trombótica y durante el posparto, en pacientes gestantes con diagnóstico de SAF obstétrico en una institución de alta complejidad.
Materiales y métodos
Diseño y población. Se realizó un estudio descriptivo retrospectivo, cuya población estuvo conformada por pacientes de cualquier edad con SAF obstétrico atendidas entre 2010 y 2016, en el servicio de medicina maternofetal y reumatología de una institución de alta complejidad. Se incluyeron pacientes por criterios de Sidney de 201615 durante el período de estudio. Se excluyeron aquellas pacientes con otras trombofilias hereditarias, incompetencia cervical o con antecedente de hepatitis B, hepatitis C y virus de inmunodeficiencia humana.
Para la recolección de la información se diseñó un formulario electrónico mediante la herramienta MAGPITM, en donde se utilizaron campos con restricción de ingreso de datos para disminuir errores en la digitación. Una vez que se obtuvo el aval ético, se solicitó a la institución participante un listado de las historias clínicas generadas en los servicios de consulta externa, hospitalización y urgencias, que estuvieran identificadas con los códigos de la Clasificación International de Enfermedades (CIE-10) relacionados con SAF: defecto de la coagulación en el posparto (O733), tromboflebitis superficial en el embarazo (O222), flebotrombosis profunda en el embarazo (O223), trombosis venosa cerebral en el embarazo (O225), otras complicaciones venosas en el embarazo (O228), complicación venosa no especificada en el embarazo (O229), tromboflebitis superficial en el puerperio (0870), flebotrombosis profunda en el puerperio (O871), trombosis venosa cerebral en el puerperio (O873), otras complicaciones venosas en el puerperio (O878), complicación venosa en el puerperio no especificada (O879), otras complicaciones venosas consecutivas al aborto, al embarazo ectópico (O087), aborto recurrente (O262), otros tipos de trombofilia (D686), otras alteraciones especificadas de la coagulación (D688) y defecto de coagulación no especificado (D689).
Posteriormente, se revisaron las historias clínicas de las pacientes que cumplieron los criterios de elegibilidad del estudio y se recolectaron los datos sociodemográficos, clínicos y terapéuticos desde el ingreso a la institución hasta la culminación del embarazo.
Variables: sociodemográficas, clínicas: enfermedades crónicas concomitantes; antecedentes de LES y compromiso orgánico visceral, índice de actividad SLEDAI; antecedentes obstétricos: número de gestaciones, edad gestacional al momento del parto, mortinato, presencia y número de pérdidas antes o después de las 10 semanas de gestación, hijos vivos, parto pretérmino (antes de las 34 semanas), preeclampsia y eclampsia, insuficiencia placentaria, rompimiento prematuro de membranas, restricción en el crecimiento intrauterino, edad gestacional al nacimiento y complicaciones intra y posparto.
Variables relacionadas con SAF: edad de diagnóstico, marcadores serológicos, tratamiento farmacológico, antecedente o desarrollo de trombosis y tipo de trombosis; complicaciones no obstétricas (infección, trombocitopenia, falla renal) y obstétricas
Análisis estadístico. Las variables cualitativas se expresaron mediante frecuencias absolutas y relativas, y las cuantitativas utilizando la media y desviación estándar (DE) o la mediana y el rango intercuartílico (RIC), según la distribución de los datos. Todos los análisis se llevaron a cabo en el programa IBM SPSS® versión 22.
Aspectos éticos. Según la legislación nacional vigente, la presente investigación se clasificó como una investigación sin riesgo, dado su diseño retrospectivo, que requirió para su ejecución la revisión de historias clínicas. Se contó con el aval del Comité de Investigación en Salud y la autorización de la institución participante.
Resultados
Se revisaron 700 historias clínicas de pacientes con diagnósticos CIE-10 relacionados con SAF, de las cuales 16 gestantes (17 embarazos) cumplieron los criterios de elegibilidad. El promedio de edad de las gestantes fue 30,5 años (DE: 3,9); 12 (75%) mujeres procedían del área urbana y 15 (94%) pertenecían al régimen contributivo. Con respecto a la escolaridad, 5 (31%) tenían estudios universitarios.
El promedio de edad al momento del diagnóstico de SAF fue 28 años (DE: 5,7) y el promedio de edad gestacional fue 20,2 semanas (DE: 11,2; rango: 4 - 37,2). Dos pacientes (12,5%) cumplieron criterios de SAF trombótico (una paciente con LES asociado con antecedente de trombosis arterial y una paciente con antecedente de trombosis venosa) y 14 (87,5%) pacientes se clasificaron como SAF obstétrico sin complicaciones trombóticas.
De las 16 pacientes, 9 (56,3%) tenían antecedente de LES asociado; de éstas, 6 (66,7%) ingresaron al estudio con antecedente de compromiso orgánico, principalmente hematológico; sin embargo, la mediana del SLEDAI al ingreso fue 0 puntos (tabla 1). Adicional al LES, se encontraron otros antecedentes, tales como: anemia de células falciformes (n = 1), cirrosis biliar primaria (n = 1), obesidad (n = 1), hepatitis autoinmune (n = 1) y púrpura trombocitopénica idiopática (n = 1).
Tabla 1 Características clínicas de gestantes con síndrome antifosfolípido obstétrico en una institución, Medellín, 2010-2016
| Características clínicas | n/N (%) |
| Tipo de SAF | |
| SAF con LES asociado | 9/16 (56,3) |
| SAF primario | 7/16 (43,8) |
| Edad al diagnóstico de SAF (años) | |
| Media (SD) | 28 (5,7) |
| LES | 9/16 (56,3) |
| Antecedente orgánico | 6/9 (66,7) |
| Hematológico | 5/6 (83,3) |
| Articular | 3/6 (50,0) |
| Piel | 3/6 (50,0) |
| Respiratorio | 1/6 (16,7) |
| Sistema nervioso central | 1/6 (16,7) |
| Cardíaco | 1/6 (16,7) |
| Nefritis | 1/6 (16,7) |
| SLEDAI, Mediana (RIC), n = 9 | 0 (0-1) |
En lo relacionado con los antecedentes ginecoobstétricos, la mayoría de las pacientes eran multigestantes (62,5%). Siete pacientes (43,8%) tenían antecedente de aborto, 5 de ellas (71,4%) habían tenido 3 abortos y todas las pérdidas ocurrieron después de la semana 10; mientras que ninguna cumplió el criterio de pérdida fetal recurrente como criterio de SAF obstétrico.
El antecedente de mortinato estuvo presente en 3 pacientes (18,8%) y estos ocurrieron entre las semanas 24 a 28. Seis (37,5%) pacientes tenían hijos nacidos vivos; de estos, solo uno (16,7%) había nacido antes de la semana 37. Una paciente tuvo antecedente de insuficiencia placentaria y otra de preeclampsia; ninguna tuvo antecedente de eclampsia.
De los aPL (positivos en las 16 pacientes), el principal marcador fue el AL (prueba confirmatoria por veneno de víbora de Russell) (75%), seguido de los aCL en 8 (50%) gestantes (fig. 1). Dos (12,5%) pacientes tenían triple positividad y 6 (37,5%) doble positividad que incluyó el AL, 2 en presencia de anticuerpos anti-β2glucoproteína I (aβ2GPI) y los 4 restantes tenían anticuerpos aCL.
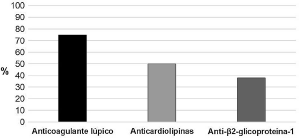
Figura 1 Presencia de anticuerpos antifosfolípido en pacientes con síndrome antifosfolípido obstétrico, en una institución de Medellín, 2010-2016.
De los 17 embarazos, en 6 (35,3%) se presentaron complicaciones (2 casos de colestasis intrahepática gestacional, 2 trombocitopenias graves (recuentos plaquetarios menores a 20.000/mm3), una paciente con artritis reumatoide y otra con enfermedad indiferenciada del tejido conectivo). Cinco de estas pacientes complicadas, tenían AL, de las cuales 2 tenían triple positividad de aPL y presentaron recaída lúpica que requirió hospitalización debido a trombocitopenia grave en una paciente y por el desarrollo de serositis y artritis reumatoide en la otra.
Por otra parte, las complicaciones obstétricas fueron más frecuentes en las pacientes con LES y SAF asociado (tabla 2). La insuficiencia placentaria evidenciada por ecografía, independiente del diagnóstico de RCIU y preeclampsia, ocurrió en 2 gestantes con LES y AL positivo; de ellas, una tenía doble positividad en presencia con aCL. De igual manera, los 4 casos de rompimiento prematuro de membranas en pacientes con LES ocurrieron en 3 gestantes con AL (un caso de doble positividad con aCL y otro de triple positividad).
Tabla 2 Complicaciones y desenlaces obstétricos en pacientes con síndrome antifosfolípido obstétrico en una institución, Medellín, 2010-2016
| Complicaciones y desenlaces | Total, n: 17 n (%) | LES + SAF, n: 9 n (%) | SAF n: 8 n (%) |
| Insuficiencia placentaria | 2 (11,8) | 2 (22,2) | 0 (0,0) |
| Rompimiento prematuro de membranas | 4 (23,5) | 4 (44,4) | 0 (0,0) |
| Preeclampsia | 2 (11,8) | 2 (22,2) | 0 (0,0) |
| Restricción de crecimiento intrauterino | 1 (5,9) | 1 (11,1) | 0 (0,0) |
| Parto pretérmino | 5 (29,4) | 4 (44,4) | 1 (12,5) |
| Complicaciones intraparto | 1 (5,9) | 1 (11,1) | 0 (0,0) |
| Complicaciones posparto | 2 (11,8) | 2 (22,2) | 0 (0,0) |
| Trombosis venosa | 1 (5,9) | 1 (11,1) | 0 (0,0) |
Los 2 casos de preeclampsia en pacientes con SAF y LES asociado ocurrieron también en pacientes con AL, uno en presencia de doble positividad con aCL; el único caso de RCIU se presentó en una de las pacientes con doble positividad (AL + aCL), la cual tuvo también insuficiencia placentaria y parto pretérmino. Además, 3 pacientes exhibieron trombocitopenia a lo largo de la gestación, una tenía triple positividad de aPL y una tenía doble positividad de aPL (AL + aβ2GPI); de estas, una tuvo parto pretérmino y la otra rompimiento prematuro de membranas y parto pretérmino.
Solo se presentó una complicación durante el parto (hemorragia por atonía uterina) en una paciente con doble positividad para aCLs (AL + aCL). En el posparto, hubo 2 complicaciones dentro del contexto de infecciones: una paciente con endometritis y otra con infección del sitio operatorio; ambas complicaciones se evidenciaron en pacientes con SAF y LES asociado (tabla 2).
En lo relacionado a otros desenlaces obstétricos, ninguna paciente debutó con diabetes gestacional, eclampsia, trombosis arterial ni óbito fetal; asimismo, no hubo ninguna muerte materna.
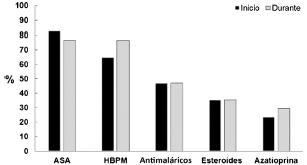
En la figura 2 se muestra el manejo terapéutico dado a estas pacientes, quienes recibieron ácido acetilsalicílico (ASA) en 14/17 embarazos (82,4%) y heparinas de bajo peso molecular (HBPM) a dosis profilácticas en 11/17 casos (64,7%) (indicado por las manifestaciones obstétricas de SAF), manejo que permaneció constante en la mayoría de pacientes durante todo el embarazo. Sólo una paciente durante el embarazo no recibió ASA ni HBPM, aunque sí recibió manejo inmunosupresor; esta paciente desarrolló trombosis venosa, recaída lúpica con trombocitopenia que requirió pulsos de esteroides y presentó, como complicación obstétrica, parto pretérmino.
Discusión
Este estudio evaluó las características principales de gestantes con SAF primario o asociado a LES, así como los desenlaces maternos y perinatales en una institución de alta complejidad. Los principales hallazgos fueron: 1) Las pacientes con SAF obstétrico asociado a LES fueron más que en aquellas con SAF primario; 2) el principal criterio clínico para SAF obstétrico fue la pérdida gestacional por encima de las 10 semanas; 3) la triple positividad de aPL se observó en gestantes con LES, quienes presentaron desenlaces adversos tanto clínicos como obstétricos; y 4) las complicaciones y desenlaces obstétricos relacionadas con la presencia de aPL se observaron más en las pacientes que tenían SAF y LES asociado.
Los resultados obtenidos muestran algunas diferencias en relación con otras series publicadas; entre ellas, la edad promedio de las pacientes de esta cohorte, que fue 10 años menor1,11-14,16, lo que pudiera ser explicado por la edad más temprana de concepción en las mujeres colombianas comparadas con mujeres europeas17,18, así como por el carácter de las cohortes colombianas en las que se evaluaron manifestaciones trombóticas que tienden a tener un debut un poco más tardío19,20.
La mayoría de las pacientes tenían SAF asociado a LES, a diferencia de estudios previos donde las pacientes tenían con mayor frecuencia SAF primario1,21,22. Este hecho pudiera atribuirse al tipo de institución de la población estudiada, donde habría una mayor probabilidad de captar pacientes con comorbilidades graves dado su alto nivel de complejidad.
Por otra parte, la edad gestacional de ingreso al estudio fue, en promedio, 20,2 semanas, la cual es tardía si se tiene en cuenta que las principales manifestaciones del SAF ocurren en el primer trimestre del embarazo23,24. El principal criterio clínico para SAF obstétrico fue la pérdida gestacional por encima de las 10 semanas, a diferencia de otras cohortes donde han sido las pérdidas fetales recurrentes11. Esto podría reflejar dificultades administrativas para acceder al servicio médico de alto nivel de complejidad (reumatología o medicina materno-fetal) o bien podría estar relacionado con el desconocimiento de la patología entre la comunidad médica, por lo que los casos de pérdida fetal recurrente pudieran pasar desapercibidos.
Con respecto al perfil serológico, la triple positividad de aPL se presentó en 2 gestantes con SAF obstétrico asociado a LES, quienes presentaron desenlaces adversos tanto clínicos como obstétricos, similar a lo reportado por Latino et al. y Pons Estel et al. 21,25, lo que refleja un perfil de mayor riesgo obstétrico asociado a este subgrupo serológico. Desenlaces como insuficiencia placentaria, restricción del crecimiento intrauterino y parto pretérmino sólo fueron observados en pacientes con AL o con doble positividad que lo incluían; esto es importante, pues el AL es una prueba funcional que se asocia a peores desenlaces obstétricos1,26.
Además, las complicaciones y desenlaces obstétricos fueron más frecuentes en pacientes con LES asociado, lo que podría indicar un comportamiento más agresivo de la enfermedad en presencia de aPL. Varios estudios han reportado una frecuencia aumentada de morbilidad obstétrica en pacientes con LES con aPL positivos (hasta en un 47%)27. En el presente estudio, las pacientes con LES que presentaron desenlaces obstétricos desfavorables tenían aPL, principalmente AL o aCL y, aunque por el diseño descriptivo de esta investigación no se puede establecer ningún tipo de relación, los hallazgos obtenidos, de alguna manera evidencian la participación de los aPL en los desenlaces obstétricos en gestantes con LES y concuerdan con lo publicado28.
Con respecto al manejo farmacológico, la totalidad de las pacientes que ingresaron al estudio tenían algún tipo de manejo para SAF o LES; esto podría explicarse porque eran pacientes que llegaban a un centro de referencia y también por la edad gestacional avanzada al momento del ingreso. La mayoría de las pacientes recibían terapia antiplaquetaria o antitrombótica claramente indicada en el SAF, tratamiento que, en la mayoría de los casos, se mantuvo a lo largo del embarazo. La única paciente que no recibió ASA ni HBPM presentó trombosis venosa, trombocitopenia y parto pretérmino, lo que puso en evidencia la importancia del manejo antitrombótico y antiplaquetario en esta patología8. Adicionalmente, ninguna paciente tuvo pérdida gestacional, a diferencia de otras cohortes con SAF obstétrico donde se reportaron hasta en un 16,9% de los casos25, lo cual posiblemente se explica por el bajo número de pacientes incluidas en el presente estudio y por diferencias étnicas, ya que el tratamiento de la cohorte argentina de Latino et al. 25 fue el mismo que utilizaron las pacientes en la presente cohorte.
Entre las debilidades de este estudio se encuentra el número pequeño de gestantes evaluadas, además de su carácter retrospectivo, lo que tal vez conlleve un subregistro de pacientes potencialmente elegibles. Sin embargo, este número de pacientes resultó de una captación en un período de 6 años y se revisaron exhaustivamente por 2 investigadores todos los posibles códigos CIE-10 para esta enfermedad, así como las bases de datos de ambos servicios (Reumatología y Medicina Maternofetal) con el fin de disminuir los posibles sesgos de selección de la población, al tiempo que se procuró encontrar casos no detectados por los códigos diagnósticos.
Otro sesgo en el que se pudo incurrir fue el hospitalario. Al tratarse de pacientes atendidas en un centro de alta complejidad, estas quizá no reflejen las condiciones de las gestantes atendidas en otros niveles de atención, lo que pudiera limitar la aplicabilidad de los resultados. No obstante, las pacientes evaluadas en este estudio reflejan la población que tiene la oportunidad de ser atendida por un servicio de reumatología que se enfrenta, con frecuencia, a pacientes con SAF obstétrico y LES asociado.
Se considera que la principal fortaleza de esta investigación radica en ser la primera en nuestro país, hasta donde se sabe, que evalúa con detalle las características del SAF obstétrico, su coexistencia con LES, el perfil inmunológico y sus desenlaces clínicos. Finalmente, si bien por el diseño descriptivo del estudio no es posible determinar ningún tipo de asociación, sus resultados permiten formular hipótesis para nuevos estudios y expandir el conocimiento en esta área en particular.
Conclusiones
En esta serie de pacientes gestantes con SAF se observaron características basales homogéneas, con un promedio de edad 10 años menor que otras cohortes, y en las cuales hubo peores desenlaces obstétricos y no obstétricos en pacientes con LES asociado. Además, aquellas pacientes con triple positividad de anticuerpos antifosfolípido o con doble positividad incluyendo al AL exhibieron complicaciones obstétricas más agresivas.