Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Universitas Scientiarum
Print version ISSN 0122-7483
Univ. Sci. vol.19 no.3 Bogotá Sept./Dec. 2014
https://doi.org/10.11144/Javeriana.SC19-3.asrh
Aspergillus sclerotiorum: riesgo para la herencia cultural y la salud
Aspergillus sclerotiorum: a risk to cultural heritage and health Abstract
Aspergillus sclerotiorum: risco para a herança cultural e para a saúde
Daymí-I Carrazana-García1, Dayana González-Ávarez1, Edgardo Díaz-Álvarez1, Leyanis Mesa-Garriga1, Alexander Banguela-Castillo1, Annarella Chea-González1, Rene Cupull-Santana1
Edited by Alberto Acosta
1Universidad Central "Marta Abreu" de Las Villas, Santa Clara, Villa Clara, Cuba.
Funding: N/A
Electronic supplementary material: N/A
Received: 01-03-2014 Accepted: 21-05-2014 Published on line: 10-07-2014
Para citar este artículo / To cite this article
Carrazana-García DI, González-Álvarez D, Díaz-Álvarez E, Mesa-Garriga L, Banguela-Castillo A, Chea-González A, Cupull-Santana R (2014) Aspergillus sclerotiorum: riesgo para la herencia cultural y la salud. Universitas Scientiarum 19(3): 323-332 doi: 10.11144/Javeriana.SC19-3.asrh
Resumen
A partir de una mancha de enmohecido de un libro del Archivo "Coronado" con valor patrimonial, se obtuvo una cepa fúngica mediante aislamiento en medio de cultivo micológico. La cepa fué Aspergillus sclerotiorum y se identificó por secuenciación de ADN ribosomal. Se evaluó y confirmó su capacidad deteriorante sobre el papel, al determinar cualitativamente las actividades enzimáticas celulolítica, proteolítica y amilolítica, así como la producción de pigmentos y ácidos. Se evaluaron cuantitativamente sus actividades enzimáticas celulasa total sobre papel de filtro (FPasa) y &beta-endoglucanasa, FPasa y &beta-endoglucanasa; confirmando actividades bajas. Aunque su capacidad deteriorante es discreta, resulta ser amenza para la conservación del documento y potencialmente peligroso para la salud de las personas que consultan y archivan.
Palabras clave: Aspergillus sclerotiorum;, celulolítica; proteolítica; amilolítica; ácidos; patrimonio documental.
Abstract
By performing a mycological culture, we isolated a fungal strain from a mold patch in a book of great heritage value from the "Coronado" archives. Ribosomal DNA sequencing identified the strain as Aspergillus sclerotiorum. By qualitatively determining its cellulolytic, proteolytic and amylolytic and enzymatic activities, as well as the production of pigments and acids, we confirmed its paper deteriorating abilities. Quantitatively, we evaluated its total cellulase enzyme activities on filter paper (FPase) and &beta-endoglucanase, and FPase and &beta-endoglucanase; confirming low activities. Although its deteriorating abilities are weak, it poses a threat to the preservation of the document and is a potential health hazard to the people who refer to and archive these books.
Keywords: Aspergillus sclerotiorum; cellulolytic; proteolytic; amylolytic; acids; FPase; beta-endoglucanase; documentary heritage.
Resumo
A partir de uma mancha de bolor de um livro do Arquivo "Coronado" com valor patrimonial, obteve-se uma cepa fúngica mediante isolamento em meio de cultura micologica. A cepa foi Aspergillus sclerotiorum e identificou-se por sequenciação de ADN ribossomal. Avaliou-se e confirmou-se a sua capacidade deteriorantesobre o papel, ao determinar qualitativamente as atividades enzimáticas celulósica, proteolitica e amiolitica, assim como a produção de epigmentos e ácidos. Avaliaram-se quantitativamente as suas atividades enzimáticas celulase toral sobre o papel de filtro (FPasa) e &beta-endoglucanasa, FPasa e &beta-endoglucanasa; confirmando atividades baixas. Apesar da sua capacidade deteriorante ser discreta, resulta ser ameaçante para a conservação do documento e potencialmente perigoso para a saúde das pessoas que consultam e arquivam.
Palavras-chave: Aspergillus sclerotiorum, celulolítica; proteolítica; amilolítica; ácidos; património documental.
Introducción
En el papel, los microorganismos cuentan con diferentes compuestos que utilizan como nutrientes a partir de su degradación. Tal disponibilidad depende de sus características, origen y antigüedad. En los papeles más antiguos el polímero predominante es la celulosa. Además el almidón y la gelatina son constituyentes de este soporte. Estas sustancias son sustratos de sistemas enzimáticos de celulasas, amilasas y proteasas fúngicos (Cappitelli & Sorlini 2005, Cappitelli & Sorlrm 2010).
Las celulasas son un complejo enzimático formado por tres enzimas que combinando su acción realizan una degradación eficiente de la celulosa: las &beta-endoglucanasas (también conocidas como carboximetilcelulasas), las &beta-glucosidasas (conocidas como celobiasas) y la &beta-exoglucanasa. El almidón es degradado por enzimas llamadas amilasas (a-amilasas y &beta-amilasas). La licuefacción de las proteínas se lleva a cabo por proteasas (Capitelli & Sorlini 2010).
Estas enzimas y otras producidas por las especies fúngicas que han sido aisladas de documentos (glucanasas, lacasas, fenolasas, queratinasas, mono-oxigenasas etc.), así como los ácidos excretados por los hongos filamentosos (oxálico, fumárico, succínico, acético etc.) y compuestos orgánicos volátiles; pueden ocasionar alteraciones del soporte. Entre estas las más frecuentes son: manchas de diferentes colores y tonalidades, decoloración, acidificación y degradación física. Además los hongos pueden producir pigmentos que también modifican las características químicas y físicas del papel (Cappitelli et al. 2010, Sterflinger 2010).
Por otro lado, la presencia de hongos que se mantienen viables en los documentos archivados, constituye un riesgo para la salud de las personas que estén en contacto directo con estos o con sus propágulos en forma de bioaerosoles aéreos (Pasanen 2001, Górny 2004).
La exposición a hongos puede provocar inflamación no específica de las vías aéreas superiores e inferiores e infección profunda por hongos que crecen en el tracto respiratorio (Verhoeff & Burge 1997, Bardana 2001, Huttunen et al. 2003), incrementar la incidencia de infecciones en la piel (Rylander & Etzel 1999), causar alergia (Terr 2004) y reacciones tóxicas a micotoxinas (Requena et al. 2005, Duarte-Vogel & Villamil-Jiménez 2006).
Actualmente existen varias técnicas para investigar el biodeterioro fúngico sobre materiales orgánicos e inorgánicos, pero el aislamiento en medios de cultivo micológico y la identificación de las especies mediante características morfológicas, continúa siendo la forma más convencional al alcance de los conservadores e investigadores. Este procedimiento, permite además constatar la viabilidad del microorganismo. No obstante, posee limitantes, como la dificultad para aislar especies xerófilas que frecuentemente causan daño al papel y que requieren medios de cultivo con una baja actividad de agua (aw) para la germinación de las esporas y producción de cuerpos fructíferos (Pinzari et al. 2010).
Entre las técnicas moleculares, la detección de regiones ITS (de las siglas en inglés Internal Transcribed Spacers) es de gran utilidad en la identificación de las especies de hongos filamentosos, debido a su elevada especificidad taxonómica (Sterflinger 2010).
De modo que si en un documento archivado existe un hongo filamentoso viable, y este se consulta ocasionalmente y se manipula sistemáticamente para su limpieza, hay mayor o menor riesgo tanto para la conservación del documento como para la salud de las personas en contacto con este según la especie de la cual se trate.
Por otro lado, en caso de desastre en el archivo, el documento contaminado es fuente de inóculos para la propagación del hongo en diferentes soportes (Borrego et al. 2009).
El archivo "Coronado" se ubica en el Centro de Documentación e Información Científico-Técnica de la Universidad Central "Marta Abreu" de Las Villas (UCLV), Cuba. En este, se almacenan documentos de elevado valor cultural e histórico, muchos pertenecientes al fondo patrimonial de la nación, y es visitado por clientes que consultan las obras en el mismo sitio.
El material bibliográfico de partida y mayoritario en este archivo es la colección de Francisco de Paula Coronado (1870-1926), quien fuera Director de la Biblioteca Nacional de Cuba "José Martí" y un prominente bibliófilo cubano. Su colección privada fue puesta en venta después de su muerte y los libros hacinados inadecuadamente. Luego fue trasladada al Palacio de Aldama en La Habana, donde algunos ejemplares fueron restaurados, hasta que fue adquirida por la UCLV en 1960 (Castillo & Vega 2005). Actualmente se encuentra en un local que hasta su reciente reparación e impermeabilización presentaba daños constructivos, tales como grietas, fisuras y filtraciones en parte del techo de la edificación.
"Viaje al estrecho de Magallanes de Pedro Sarmiento de Gamboa", editado en 1768 en la Imprenta Real de la Gazeta de Madrid, pertenece a la Colección de Libros Raros con Valor Patrimonial del archivo "Coronado". En la portada de este documento se observa debajo del pie de imprenta un área con enmohecido, que se caracteriza por presentar múltiples colonias color ocre de pequeño tamaño sobre un área cuya coloración es más oscura a la del resto del soporte. En los cuadernillos siguientes se observa lo mismo, pero con mayor grado de enmohecido.
En la investigación, se trazaron como objetivos el aislamiento y la identificación del hongo presente en el documento y la evaluación de su capacidad enzimática celulolítica, proteolítica y amilolítica, así como la producción de ácidos y pigmentación del papel. Lo anterior se hizo para determinar su capacidad deteriorante sobre el papel. Además, teniendo en cuenta que este soporte se compone fundamentalmente de celulosa, se cuantificó la actividad celulasa total sobre papel de filtro (FPasa) y en particular la &beta-endoglucanasa.
Materiales y métodos
Aislamiento e identificación del hongo filamentoso: Se tomó una muestra del enmohecido antes referido (Figura 1) con hisopo estéril seco, realizando el aislamiento por diseminación en una placa de Petri conteniendo agar extracto de malta suplementado con antibiótico. Este medio de cultivo posee un alto contenido de peptona, extracto de malta y glucosa, con lo que se favorece el crecimiento de los hongos sobre las bacterias. Se le pueden agregar otros agentes selectivos de crecimiento, habiéndosele incorporado en este caso cloranfenicol (0,0001 g mL-1). La incubación fue a 30±1 °C por siete días, debido a que en este rango está la temperatura promedio dentro del archivo donde se encuentra el documento a partir del cual se hizo el aislamiento fúngico (resultado sin publicar).

A la cepa obtenida se le realizó una preparación con lactofenol para la observación de la morfología en microscopio óptico de campo claro. Para su identificación hasta nivel de género se emplearon claves (Barnett & Barry 1998). De acuerdo a su clasificación se cultivó en agar Czapek a 28±1 °C durante siete días para su caracterización cultural y microscópica. El aislado se conservó en este medio de cultivo para las evaluaciones siguientes.
Los medios de cultivo referidos son de uso común para el aislamiento y conservación de hongos filamentosos a partir de documentos con soporte de papel (Cappitelli et al. 2010).
Para identificar la cepa fúngica obtenida hasta nivel de especie, conociendo ya su género, esta se cultivó en medio agar Czapek por siete días a 28± 1°C en placas Petri de 9 cm de diámetro. Posteriormente, se removió el micelio de la superficie del agar, se pesó y se purificó el ADN fúngico utilizando el DNeasy Plant Kit (Qiagen) de acuerdo a los requerimientos del fabricante.
Las regiones del ADN ribosomal ITS1-5.8S-ITS2 se amplificaron mediante la reacción en cadena de la polimerasa (PCR) utilizando los cebadores ITS1: TCCGTAGGTGAACCTGCGGG e ITS4: TCCTCCGCTTATTGATATGC (White et al. 1990). El procedimiento se realizó en un volumen de reacción de 25 ul en el que estaban contenidos 50 ng del ADN, 1 umol L-1 de ambos cebadores, 1,5 mmol L-1 de MgCl2, 1 mol L-1 de cada nucleótido y 1,5 unidades de GoTaq Flexi (Promega, USA). La amplificación se realizó en un termociclador MiniCycler (MJ Research, PTC-150) y se utilizó el programa: 95 °C por 3 min seguido de 35 ciclos de 95 °C por 45 seg 55 °C por 45 seg y 72 °C por 1 min y finalmente 10 min de extensión a 72 °C. El amplicón de aproximadamente 600 bp se purificó a partir de PCR utilizando el PCR Clean Up Kit (Qiagen). El producto purificado se secuenció directamente. Para la determinación precisa de la secuencia del amplicón, ambas cadenas se secuenciaron (Macrogen, Korea) utilizando los cebadores ITS1 e ITS4. La secuencia obtenida se comparó con las contenidas en la base de datos GenBank utilizando el software BLAST del NCBI (http://wwwincbi.nlm.nih.gov/BLAST) y las secuencias con mayor identidad se alinearon mediante el uso del software ClustalX (Thompson et al. 1994). La secuencia de 574 pb obtenida se introdujo en el GenBank (http://www.ncbi.nlm.nih.gov).
Determinación de la capacidad deteriorante de la cepa fúngica: Para la determinación de la capacidad celulolítica y la producción de pigmentos se utilizó el procedimiento descrito por Rautela & Cowling (1966). Para esto se procedió a inocular el aislado en un medio de cultivo (MCbase) cuya composición salina para 1 L fue: nitrato de sodio (2,0 g); fosfato de dipotasio (1,0 g); sulfato de magnesio (0,5 g); cloruro de potasio (0,5 g); sulfato ferroso (0,01 g); agar (20,0 g); agua destilada c.s.p. 1 L; pH = 5,5.
En esta prueba se preparan tres alternativas de fuente de carbono: una tira de papel de filtro, celulosa cristalina y glucosa como control. Los cultivos se incubaron a 28±1 °C durante 21 días. La producción de pigmentos se evaluó por observación visual del papel de filtro y se señaló como negativa o positiva, en cuyo caso se determinó el color.
La capacidad proteolítica se determinó usando dos ensayos de hidrólisis de gelatina. Para el primero, el hongo fue inoculado en MCbase, al que se le adicionó gelatina. Después de siete días de incubación a 28±1 °C, se añade reactivo de Frazier sobre cada placa. Un precipitado blanco indica la presencia de gelatina no hidrolizada y la ausencia de este, hidrólisis de la gelatina. El ensayo en los tubos fue realizado para confirmar el ensayo positivo en las placas de Petri. En este caso, la cepa se inoculó por punción en el medio de cultivo distribuido en un tubo de ensayo. La composición del medio era idéntica al del ensayo en placa de Petri, pero sin agar. Los tubos inoculados se incubaron durante siete días a 28± 1 °C. Luego se refrigeraron a 4 °C por 30 minutos, y la reacción de hidrólisis de la gelatina se puso de manifiesto por la licuefacción del medio cuando los tubos fueron agitados (Iwatzu 1984).
Para la determinación de la capacidad amilolítica, la cepa se sembró en una placa de Petri en MCbase que contenía almidón como fuente de carbono. Después de siete días de incubación a 28±1°C se añadió reactivo de lugol sobre cada placa de cultivo y la presencia de una zona de color azul alrededor del crecimiento micelial fue tomada como indicador de hidrólisis positiva (Galiotou-Panayotou et al. 1997).
Los aislados fúngicos fueron inoculados en MCbase sin agar distribuido en tubos de ensayo, con glucosa al 1% a pH = 7,0. Estos fueron incubados a la temperatura antes referida durante tres días, pasados los cuales se determinó el pH del medio de cultivo con el empleo de un pHmetro (Borrego et al. 2010).
Todas las pruebas se hicieron por quintuplicado, dándose como positiva cuando la respuesta fue coincidente en todas las réplicas y calculándose el valor medio en el caso de la determinación del pH.
Determinación de las actividades enzimáticas celulasa total sobre papel de filtro (FPasa) y &beta-endoglucanasa: Para la obtención del inóculo fúngico con vista a determinar la actividad celulasa total sobre papel de filtro (FPasa) y &beta-endoglucanasa, la cepa fúngica fue inoculada en MCbase sin agar, usando como fuente de carbono glucosa al 1% a pH = 5,5. El frasco de cultivo fue puesto en una incubadora-agitadora Termostatizada (Sartorius) a 28±1 °C a velocidad de agitación de 150 rpm por siete días. La biomasa fue separada por filtración en condiciones asépticas. Del mismo modo se pesaron 0,05 g del inóculo, añadiéndolo en un erlenmeyer que contenía 100 mL de MCbase sin agar, agregando como fuente de carbono celulosa cristalina al 1%. El cultivo se realizó bajo las mismas condiciones de temperatura y agitación durante 21 días. El experimento fue llevado a cabo por triplicado.
Las actividades enzimáticas se evaluaron a los 7, 10, 14, 17 y 21 días. Los azúcares reductores totales fueron determinados colorimétricamente usando el método del ácido dinitro salicílico (DNS) (Miller 1959). La actividad FPasa fue determinada según lo descrito por Ghose (1987). Una tira de 1x6 cm (50mg) de papel de filtro Whatman No.1 fue añadido a un volumen total del sobrenadante del cultivo de 1,5 mL y 0,05 M de buffer citrato (pH = 4,8). Las muestras fueron incubadas a 50 °C por 1 h. La reacción fue terminada por la adición de 3 mL de solución de DNS, seguido por ebullición durante 5 minutos. Después de enfriar, 5 mL de agua destilada fue añadida y se midió la absorbancia a 540 nm. El contenido de azúcares reductores en el medio de fermentación fue estimado indirectamente a partir de los blancos de enzimas de las medidas de FPA. Las unidades de actividad enzimática fueron calculadas según la recomendación de Ghose (1987).
La determinación de la actividad &beta-endoglucanasa se realizó siguiendo el procedimiento antes referido, usando carboximetilcelulosa al 1% en lugar de papel de filtro (Mandels 1975).
Los procedimientos referidos son los establecidos por la IUPAC (por las siglas en inglés de International Union of Pure and Applied Chemistry; Ghose 1987).
Resultados
Aislamiento e identificación del hongo filamentoso: El hongo filamentoso aislado fue identificado preliminarmente como Aspergillus sp. En Agar Czapek a 28±1 °C la colonia creció lenta y discretamente. El haz presentó micelio blanco y esporulación amarillo ocre con textura vellosa y el envés color crema. Formó un borde amarillo claro estrecho. Pigmentó el sustrato muy ligeramente de color amarillo claro. Se formaron abundantes esclerocios. En la preparación microscópica se observaron cabezuelas conidiales radiales y en ocasiones erectas con pocas columnas y de color amarillo ocre, columnas lisas, vesículas globosas, cabezuelas biseriadas y conidios globosos lisos.
A través de las técnicas moleculares empleadas, la cepa fue identificada como Aspergillus sclerotiorum (Hubber, 1933). La secuencia y otros datos de interés se encuentran disponibles en el GenBank (accesión KF924396). Posee un 98% de similitud con la referida para Aspergillus sclerotiorum cepa ATCC 16892.
Determinación de la capacidad deteriorante de la cepa fúngica: La evaluación de los resultados de la capacidad celulolítica y la producción de pigmentos se realizó mediante inspección visual y se indicó siguiendo criterio dado por Borrego y colaboradores (2010): crecimiento abundante (750/o del área o más); crecimiento moderado (50% del área); crecimiento pobre (25% del área); crecimiento muy pobre (menos del 25% del área).
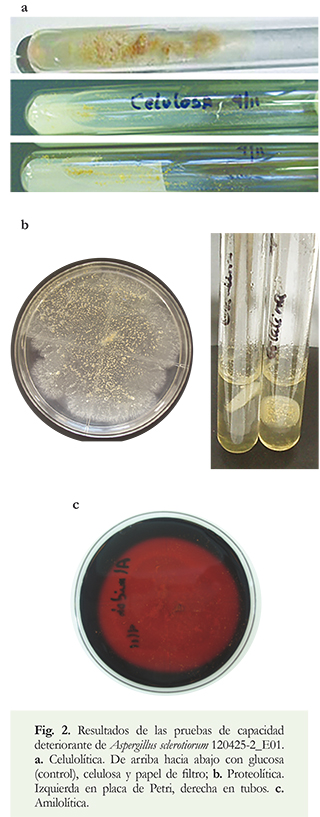
El crecimiento con glucosa como fuente de carbono fue abundante y pobre con celulosa cristalina y papel de filtro (Figura 2a). Se visualizaron pigmentos sobre el papel de filtro de color amarillo claro.
La capacidad proteolítica fue positiva (Figura 2b) al igual que la amilolítica (Figura 2c). En el primer caso se observan en la evaluación en tubos, discos de biomasa que crecieron superficialmente que se sumergen en el medio de cultivo cuando son agitados luego de enfriados, demostrando la licuefacción de la gelatina.
Cabe señalar que de todos los empleados fue el medio de cultivo MCbase con almidón (como fuente de carbono) donde se observó mayor abundancia de crecimiento fúngico, sin embargo, este presentaba una coloración que tendía más al color ocre que al amarillo, más parecida a la de las colonias fúngicas a partir de las que se aisló en el documento (Figura 3).

En cuatro de las réplicas el pH del medio de cultivo descendió de 7,0 a 6,6 y en uno a 6,7, para un valor medio de 6,62.
Determinación de las actividades enzimáticas celulasa total sobre papel de filtro (FPasa) y β-endoglucanasa: La ecuación que describe a la curva estándar de glucosa utilizada en el ensayo de determinación de las actividades enzimáticas es: y = 5,687x - 0,42547 y el coeficiente de correlación es: R2 = 0,9904. Todos los valores de concentración de glucosa determinados se encontraron dentro del rango de la curva estándar de glucosa.
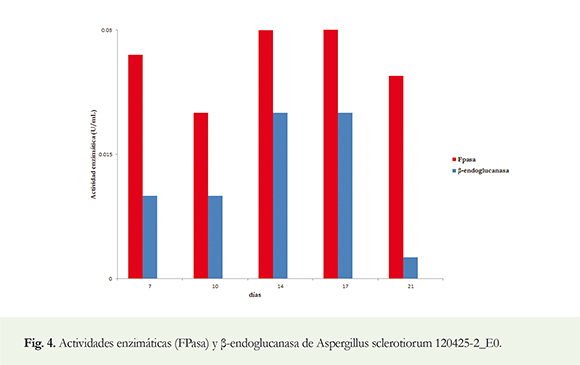
Se muestran las actividades enzimáticas obtenidas durante el período de estudio (Figura 4).
Aspergillus sclerotiorum fue descrito por Hubber en 1933. Los datos de distribución muestran que esta especie aparece preferentemente en zonas subtropicales y tropicales (Domsch et al. 2007). Solamente se encontró una referencia a la determinación de
Discusión
Aislamiento e identificación del hongo filamentoso: El hecho que haya cambio de coloración del soporte y se extienda a áreas alejadas de las colonias fúngicas y se repita el patrón en los cuadernillos siguientes de forma muy similar; hace pensar que no está asociado al crecimiento fúngico. Aparentemente esta zona del documento estuvo en contacto con agua, provocando el cambio de color del papel y favoreciendo el desarrollo del hongo (Figura 1).
El medio de cultivo empleado en la caracterización cultural es el recomendado por la APHA (por las siglas en inglés American Public Health Association) para el cultivo de Aspergillus spp. (Eaton et al. 1998). Tanto las características culturales como las microscópicas corresponden con lo planteado por Raper & Fenell (1965) para esta especie.
A sclerotiorum en foxing presente en un documento en soporte de papel empleando la técnica FTIR (por las siglas en inglés de Fourier Transform Infrared Spectroscopy) y fluorescencia bajo luz UV (Zotti et al. 2011).
Esta especie se ha encontrado causando onicomicosis y otomicosis (Singh & Barde 1983, García-Martos et al. 2001, Harima et al. 2004). Produce ocratoxina A en animales de laboratorio y domésticos. Esta micotoxina es nefrotóxica, carcinogénica, teratogénica, imunotóxica, y hepatotóxica. Además es un posible agente causal de nefropatías y tumores a nivel urotelial en humanos (Cuciureanu 2008). También es capaz de producir otras micotoxinas, tales como ácidos penicílicos y xanthomegninas (Frisvad et al. 2004). Teniendo en cuenta el peligro potencial para la salud humana de la cepa fúngica presente en el documento referido, es peligrosa la manipulación de este por parte del archivista y los clientes del archivo.
Determinación de la capacidad deteriorante de la cepa fúngica: A. sclerotiorum fue capaz de crecer, aunque pobremente, a expensas de la celulosa cristalina (de difícil asimilación) y del papel de filtro como única fuente de carbono (celulosa amorfa, de más fácil asimilación), lo que indica que presentó capacidad celulolítica discreta. Si bien, sobre agar Czapek y en el papel de filtro usado en la evaluación cualitativa de la capacidad celulolítica se observó la producción de pigmentos de color amarillo claro, en el documento no se produjeron o no se pueden percibir por observación visual, dado el oscurecimiento del papel.
Domsch (2007) plantea que A sclerotiorum crece mejor a partir de almidón, dextrina, glucógeno o fructosa que de glucosa como fuente de carbono. Esto explica el elevado crecimiento fúngico en las placas con almidón como única fuente de carbono. No obstante el crecimiento con glucosa fue también abundante. Sin embargo con sacarosa (agar Czapek) fue discreto. Por otro lado, el aislado produjo ácidos pero en poca medida.
La producción de celulasas, amilasas, proteasas, oxidasas y ácidos cítrico, láctico y fumárico por aislados del género Aspergillus, provocan manchas miceliares de diferentes colores, degradación y acidificación del soporte (Capitelli & Sorlini 2010). Las celulasas degradan el sustrato más eficientemente en condiciones ácidas, dando a los microorganismos un nivel de especialización en la degradación de complejos celulósicos (Villalba et al. 2004).
Los resultados antes obtenidos demuestran que la cepa fúngica que se estudia tiene capacidad para deteriorar el papel. Se debieran hacer estudios que demuestren la actividad deteriorante de esta sobre el papel.
Determinación de las actividades enzimáticas celulasa total sobre papel de filtro (FPasa) y &beta-endoglucanasa: Teniendo en cuenta la capacidad celulolítica obtenida y la lenta formación de biomasa durante la preparación del inóculo para la fermentación se decidió realizarla por 21 días. La actividad enzimática celulasa total en papel de filtro (FPasa) y &beta-endoglucanasa aumentaron de modo general desde las mediciones del séptimo día de incubación al 17. Luego en la del día 21, se observó un descenso en ambas actividades, fundamentalmente en la segunda. La mayor actividad FPasa fue de 0,031 U mL-1 a los 17 días de incubación. La actividad &beta-endoglucanasa máxima medida de 0,02 U mL-1 se obtuvo a los 14 días y se mantuvo a los 17 días, seguido de una reducción. Ambas actividades enzimáticas pudieron haber alcanzado valores superiores, aunque pensamos que no demasiado, entre los días 14 y 17 de incubación, por lo que pudiera repetirse este estudio tomando muestras en este intervalo.
Gomes (2007) evaluó la actividad celulasa de A. sclerotiorum obtenido del sedimento de un manglar. La determinación se hizo por el mismo método empleado en la presente investigación, luego de una fermentación en agitación por 72 horas a 30 °C, y resultó ser nula. Este resultado no contradice los obtenidos por nuestro grupo de trabajo, pues a los siete días de incubación en que se realizó la primera determinación los valores fueron bajos.
Está descrito en la literatura científica que A. sclerotiorum produce un sistema enzimático completo de celulasas capaces de degradar parcial o totalmente la celulosa en celobiosa y glucosa (Chacón & Waliszewski 2005).
En la literatura científica consultada sobre capacidad biodeteriorante de cepas fúngicas en soportes de valor patrimonial no apareció la evaluación cuantitativa de la actividad celulasa. Estas determinaciones son frecuentes en estudios sobre la utilización de hongos para la degradación de residuos lignocelulósicos con fines industriales; en las que se estudia comúnmente el efecto de la adición de inductores. Entre estos, se encuentran los realizados por Villena et al. (2001), quienes compararon la actividad FPasa en cultivos superficiales y sumergidos, obteniendo mayores valores en el primer tipo. Lo anterior pudiera explicarse por la menor disponibilidad de oxígeno y crecimiento de biomasa bajo la segunda condición, que correspondió con el sistema de fermentación empleado en la presente investigación, ya que el incremento de la actividad metabólica está relacionado con la densidad celular. Se ha comprobado que la producción de celulasas cuando el hongo se encuentra creciendo sobre un soporte es mayor que cuando se encuentran en un cultivo libre. La adsorción de los microorganismos a superficies genera una respuesta fisiológica distinta reflejada en el aumento de la producción de celulasas (Villena et al. 2001). Sería recomendable investigar las actividades enzimáticas evaluadas en un sistema superficial de fermentación.
Por otro lado, el aislado de A sclerotiorum evaluado en la investigación que se presenta se obtuvo a partir de un discreto crecimiento micelial sobre papel, lo cual se corresponde con los bajos valores de actividad enzimática obtenida y su expresión relativamente tardía. Además, ya se refirió la preferencia por otras fuente de carbono de esta especie, por lo que pudiera ser que tome tiempo activar la síntesis y expresión de las enzimas celulolíticas.
Conclusión
Aspergillus sclerotiorum fue aislado a partir de un área de enmohecido en un libro antiguo. Aunque su capacidad deteriorante es discreta, resulta arriesgado para la conservación del documento y potencialmente peligroso para la salud de las personas que lo consulten y el archivista.
Agradecimientos
A Julia Ross Rojas, archivista de la Colección "Coronado".
Conflictos de intereses
Los autores declaran no tener conflicto de intereses.
Referencias
Bardana EJ (2001) Indoor pollution and its impact on respiratory health. Annals of Allergy, Asthma & lmmunology 87(6)33-40 doi:10.1016/S1081-1206(10)62338-1. [ Links ]
Barnett HL, Barry BH (1998) Illustrated genera of imperfect fungi. 4th Edition, APS Press, Pennsylvania, USA. [ Links ]
Borrego S, Dorta M, Pérez A, Mirabal M (2009) Gestión de riesgos para la prevención y mitigación de desastres en el patrimonio documental. Archivo General de la Nación, Volumen LXXXIV, Santo Domingo, Distrito Nacional, República Dominicana. [ Links ]
Borrego S, Guiamet P, Saravia S, Batistini P, Garcia M, et al. (2010) The quality of air at archives and the biodeterioration of photographs. International Biodeterioration & Biodegradation 64:139-145 doi:10.1016/j. ibiod.2009.12.005. [ Links ]
Cappitelli F, Pasquariello G, Tarsitani G, Sorlini C (2010) Scripta manent? Assessing microbial risk to paper heritage. Trends in Microbiology 18(12):538-542 doi:10.1016/j.tim.2010.09.004. [ Links ]
Cappitelli F, Sorlini C (2005) From papyrus to compact disc: the microbial deterioration of documentary heritage. Critical Review Microbiology 31:1-10 doi:10.1080/10408410490884766. [ Links ]
Cappitelli F, Sorlini C (2010) Paper and Manuscripts. In: Cultural Heritage Microbiology: Fundamental Studies in Conservation Science. Mitchell R, McNamara CJ (ed). ASM Press, Washington, USA, pp 45-59. [ Links ]
Castillo B, Vega O (2005) Bibliotecología. ENPES, La Habana, Cuba. [ Links ]
Chacón SL, Waliszewski KN (2005) Preparativos de celulasas comerciales y aplicaciones en procesos extractivos. Universidad y Ciencia 21:113-122. [ Links ]
Cuciureanu R (2008) Ocratoxina A- implicatii în patologia umanä §i animalä. Fungi & Mycotoxins 2(1):120-133. [ Links ]
Domsch KH, Gams W Anderson TH (2007) Compendium of soil fungi. Ed. 2 IHW-Verlag, Eching, Germany. [ Links ]
Duarte-Vogel S, Villamil-Jiménez LC (2006) Micotoxinas en la Salud Pública Revista de Salud Pública 8(1):129-135 doi:/10.1590/S0124-00642006000400011. [ Links ]
Eaton AD, Clesceri LS, Greenberg AE (eds.) (1998) Standard Methods for the Examination of Water and Waste water, 20th Ed., American Public Health Association. Washington, DC, USA. [ Links ]
Frisvad JC, Frank JM, Houbraken JAMP, Kuijpers AFA, Samson RA (2004) New ochratoxin A producing species of Aspergillus section Circumdati Studies in Mycology 50:23-43. [ Links ]
Galioto-Panayotou M, Kapantai M, Kalantzi O (1997) Growth conditions of Aspergillus sp. ANTHEM-3488 for polygalacturonase production. Applied Microbiology and Biotechnology 47:425-429. [ Links ]
García-Martos P, Guarro J, Gene J, Mira J, Linares M et al.(2001) Onychomycosis caused by Aspergillus sclerotiorum. Journal de mycology médicale 11(4) :222-224. [ Links ]
Ghose TK (1987) Measurement of cellulase activities. Pure Applied Chemistry 59:257-268 doi:10.1351/pac198759020257. [ Links ]
Gomes D (2007) Diversidade e potencial biotecnológico de fungos filamentosos isolados do manguezal Barra das Jangadas, Jaboatão dos Guararapes, Pernambuco. Tese Doutorado Biología de Fungos. Universidade Federal de Pernambuco, Brasil http//:wwwrpassavante.pro.br/teses/tese_daniela.pdf Consultado Enero 10 2013.
Górny RL (2004) Filamentous microorganisms and their fragments in indoor air-A review. Annals Agricultural Environmental Medicine 11:185-197. [ Links ]
Harima N, Inoue T, Kubota T, Okada O, Ansai S, et al. (2004) A case of otomycosis caused by Aspergillus sclerotiorum. The Journal of Dermatology 31(11):949-950. [ Links ]
Huber, G.A. 1933. Aspergillus sclerotiorum, n. sp., and its relation to decay of apples. Phytopathology. 23:306-308. [ Links ].
Huttunen K, Hyvärinen A, Nevalainen A, Komulainen H, Hirvonen MR (2003) Production of proinflammatory mediators by indoor air bacteria and fungal spores in mouse and human cell lines. Environmental Health Perspectives 111:85-92. [ Links ]
Iwatzu T (1984) A new species of Cladosporium from Japan. Mycotaxon XX 521-533. [ Links ]
Mandels M, Sternberg D, Andreotti RE (1975) Growth and cellulose production by Trichoderma. In: Bailey M, Enari TM, Linko M (ed). Proceedings of Symposium on Enzymatic Hydrolysis of Cellulose. SITRA. Helsinki, Finlandia. [ Links ]
Miller GL (1959) Use of DNS A regent for determination of reducing sugars. Analytical Chemistry 32:426-428. [ Links ]
Pasanen AL (2001) A Review: Fungal Exposure Assessment in Indoor Environments. IndoorAir 11(2):87-98 doi:10.1034/j.1600-0668.2001.110203.x. [ Links ]
Pinzari F, Montanari M, Michaelsen A, Piñar G (2010) Analytical protocols for the assessment of biological damage in historical documents. Coalition 19:6-12. [ Links ]
Raper KB, Fennell DI (1965) The Genus Aspergillus. Williams & Wilkins Company Ed, Baltimore, USA. [ Links ]
Rautela GS, Cowling EB (1966) Simple culture test for relative cellulolytic activity of fungi. Applied Microbiology 14(6):892-898. [ Links ]
Requena F, Saume E, León A (2005) Micotoxinas: Riesgos y prevención Zootecnia Tropical 23(4):393-410. [ Links ]
Rylander R, Etzel R (1999) Introduction and summary: workshop on children's health and indoor mold exposure. Environmental Health Perspectives 107(3):465-468. [ Links ]
Singh SM, Barde K (1983) A Case of Onychomycosis Caused by Aspergillus sclerotiorum. Indian Journal of Dermatology, Venerology and Leprology 49:22-25. [ Links ]
Sterflinger K (2010) Fungi: Their role in deterioration of cultural heritage. Fungal Biology Reviews 24:47-55 doi:10.1016/j.fbr.2010.03.003. [ Links ]
Terr AI (2004) Are indoor molds causing a new disease? Journal of Allergy and Clinical Immunology 113(2):221-226 doi:10.1016/j.jaci.2003.11.014. [ Links ]
Thompson JD, Gibson TJ, Plewniak F, Jeanmougin F, Higgins DG (1994) The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research 25(24):4876-4882. [ Links ]
Verhoeff AP, Burge HA (1997) Health risk assessment of fungi in home environments. Annals of Allergy, Asthma & Immunology 78:544-554 doi:10.1016/S1081-1206(10)63214-0. [ Links ]
Villalba LS, Mikán, JF, Sánchez J (2004) Actividades hidrolíticas y caracterización isoenzimática de poblaciones microbianas aisladas del patrimonio documental del Archivo General de Colombia. Nova-Publicacion Cientifica 2:50-58. [ Links ]
Villena G, Moreno P, Gutierrez-Correa M (2001) Cellulase production by fungal biofilms on polyester cloth. Agro-food-Industry Hi-Tech 12(1):32-35. [ Links ]
White TJ, Bruns T, Lee S, Taylor JW (1990) Amplification and direct sequencing of fungal genes for phylogenetics. In: PCR Protocols: a Guide to Methods and Applications. Innis M, Gelfand DH, Sninsky JJ, White TJ. Academic Press, San Diego, CA, pp 315-322. [ Links ]
Zotti M, Ferroni A, Calvini P (2011) Mycological and FTIR analysis of biotic foxing on paper substrates. International Biodeterioration & Biodegradation 65:569-578. [ Links ]













