Introducción
La crianza de Cavia porcellus es el sustento socioeconómico de los pobladores altoandinos de Perú, por su alta demanda en el mercado nacional e internacional y gracias a su carcaza de alto valor proteico y terapéutico (Huamán et al., 2020), sin embargo, las patologías infecciosas como lesiones subcutáneas vienen repercutiendo negativamente en la producción, ocasionando altas mortalidades y exuberantes pérdidas económicas a los productores de Cavia porcellus (Cambier et al., 2017).
Las lesiones subcutáneas en cuyes son originadas por dermatomicosis (Microsporum spp. y Trichophyton spp.) que ocasionan lesiones necróticas a nivel del tejido epitelial (Thomson et al., 2015), acompañadas de inflamación tisular, exudado, eritema y prurito, con cuadros clínicos de estrés, disminución del consumo de alimento, pérdida de peso, retardo del crecimiento y baja respuesta inmunológica del animal (Cambier et al., 2017; Huamán et al. 2020), resultando el tratamiento complejo y con poca efectividad con el uso de fármacos veterinarios convencionales (Thomson et al., 2015).
Existen diversos productos veterinarios como: griseofulvina, terbinafina, itraconazol, ketoconazol, fluconazol y sulfato de cobre al 5 % (vía tópica) y cristal violeta para el tratamiento de lesiones subcutáneas y dérmicas, sin embargo, la mayoría de estos fármacos son tóxicos, teratogénicos y su uso indiscriminado ha generado resistencia antifúngica (Huamán et al., 2020), requiriendo mayor tiempo de acción terapéutica (Kraemer et al., 2012), lo que incrementa los costos de producción (Bezada et al., 2016).
Piper angustifolium, Allium sativum y Aloe vera, entre otras plantas, poseen componentes bioactivos como ácido artánico, resinas, taninos, alcaloides, saponinas, flavonoides y triterpenoides (Burčová et al., 2018; Melgar et al., 2018; Javeda et al., 2023), los cuales pueden integrarse como elementos terapéuticos naturales para controlar patologías causadas por Microsporum spp. y Trichophyton spp., responsables de heridas subcutáneas en animales domésticos (Bezada et al., 2016; Tekin et al., 2019). No obstante, es necesario investigar la concentración óptima, el método de obtención, el solvente de arrastre de los metabolitos y la toxicidad de los extractos vegetales. Bajo este contexto, el objetivo del estudio se orientó a evaluar la actividad cicatrizante del extracto etanólico liofilizado de Piper angustifolium en cuyes con lesiones subcutáneas y dérmicas en diversas concentraciones, así como su valoración del costo.
Materiales y métodos
Ámbito de estudio
La investigación fue realizada en Perú, provincia de Huancavelica, y en los ambientes del Laboratorio Central de Investigación, Área de Salud Animal de la carrera profesional de Zootecnia y en el minibioterio del Centro de Investigación Científica Multidisciplinario (CicmiUNH) de la Universidad Nacional de Huancavelica, ubicado a 3860 metros sobre el nivel del mar (m s.n.m.) a temperaturas que oscilan entre 8,5 º C y 16 º C (Senamhi, 2021).
Adquisición del material vegetal
Se seleccionaron y recolectaron 10 kilogramos (kg) de hojas frescas de Piper angustifolium de la localidad de Acoria, Perú, en sobres manilas (rotulados) y empacados en cajas poliestireno expandido a temperaturas de 10-12 °C, siguiendo la metodología indicada por Castañeda et al. (2021), y se trasladaron al Laboratorio de Salud Animal de la Universidad Nacional de Huancavelica, en Perú.
El material vegetal fue deshidratado a temperatura ambiente en espacios ventilados bajo sombra durante 18 días hasta que las hojas se quebraban con facilidad al tacto, según Cebada Reyes et al. (2020). Posterior a ello, las hojas se pulverizaron utilizando un molino marca Corona, modelo SKU:25113001, para luego llevar a un tamaño de partícula de 450 μm mediante tamizador analítico (As 400 Control, Retsch, Alemania) y, finalmente, se conservó el pulverizado vegetal acorde con lo señalado por Rivas-Morales et al. (2016), en frascos ámbar a temperatura ambiente y en un lugar oscuro.
Preparación de los extractos liofilizados
Las hojas pulverizadas de Piper angustifolium (matico) fueron sometidas a maceración inicial por 25 días en solución hidroalcohólica (etanol de 96 °) a dilución de 2:1:0,8 sometidos a agitación en Orbitral Shaker (Labnique; 52150000, Estados Unidos) durante una hora a 180 rpm en un recipiente de vidrio ámbar; el macerado, posteriormente, fue colocado en solvente de etanol de 70 °, macerándose por 10 días en agitación y la mezcla fue separada mediante el método de filtro (Whatman n.º 1). Previamente, se determinó el punto de saturación y de densidad aparente del matico mediante las fórmulas: grado de alcohol en disolución: a × b = c × d (donde a: solución de alcohol, b: grados de alcohol, c: disolución y d: nuevo de grados de alcohol) y densidad de muestra: P = m/v, con el de fin optimizar las cantidades de concentraciones a utilizar del soluto y los solventes, considerándose las recomendaciones establecidas por Bakhytkyzy et al. (2018) y Benítez-Benítez et al. (2020).
La eliminación del solvente del extracto se realizó mediante el método ebullición-refrigeración, el cual consistió en someter los extractos a baño maría a 45 ºC durante 8 horas bajo ventilación dirigida y en refrigeración a 10 °C por 24 horas en frascos ámbar estabilizados a temperatura ambiente durante 12 horas (Bakhytkyzy et al., 2018) y rectificados mediante un evaporador rotativo automatizado (Büchi Rotavapor®, R-300, Alemania), sometiendo el extracto por 4 horas a 80 °C a 100 milímetros de mercurio (mmHg) de presión al vacío y, para la eliminación total del solvente, se liofilizó, utilizando un liofilizador Labconco Freezone 12-7754040 con cámara de bandejas (Labconco Corporation, Kansas City, Estados Unidos), de acuerdo con Luque De Castro y Priego-Capote (2010).
Por último, el extracto se diluyó en dimetilsulfóxido (DMSO) a 40 % y 70 % (Alemania, Darmstadt, Merck; número de catálogo: D9170), con el fin de obtener una concentración final de 0,5 mg/μl, se envasó herméticamente en frascos ámbar, conservándose a 10 °C por 90 días máximo, buscando no alterar sus componentes bioactivos (Benítez-Benítez et al., 2020).
Manejo de las unidades experimentales
Se consideraron para el estudio 92 cuyes hembras, raza Perú, de seis meses de edad, con peso vivo promedio de 1020 ± 10 g y que presentaran lesiones subcutáneas por dermatomicosis no tratadas (dos meses de anterioridad al estudio), aplicándose un muestreo no probabilístico y por conveniencia. Antes de ser seleccionados, los animales fueron sometidos a un chequeo clínico para el diagnóstico de la patología, basado ello en la presencia de prurito, alopecia, eritema, pápulas, costras, pústulas, erosiones y ulceraciones (figuras A1, A2 y A3).
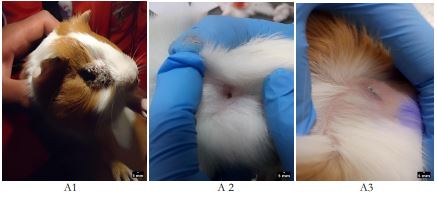
Fuente: Elaboración propia
Figuras 1 Heridas subcutáneas dérmicas en cuyes: A1) costras- y prurito, A2) erosiones y ulceraciones y A3) eritema y alopecia
Para confirmar la etiología de las lesiones subcutáneas dérmicas en los animales, se realizaron exámenes directos mediante la prueba de KOH, descrita por Del Boz et al. (2016) y que consiste en recolectar muestras de zonas activas de lesiones húmedas y secas (borde de lesión) mediante hisopos y hojas de bisturí. Las muestras fueron colocadas en portaobjetos y coloreadas con solución de Swartz-Lamkins (tinta Parker® potasa al 20 %) y visualizadas con un microscopio digital (LCD.13.203P, Honyu, Zhejiang, China) a 20× y 40× e interpretadas según el protocolo propuesto por Bonifaz et al. (2013).
Los animales fueron instalados en jaulas metálicas (Metal Kya; modelo industrial, Lima, Perú) en el minibioterio del Cicmi-UNH, acondicionados a temperatura constante entre 15 °C y 18 °C, con ciclo de luz/oscuridad de 12 por 12 horas (Huamán et al., 2020) y alimentados con raciones balanceadas paletizadas “La Molina” para reproductoras (75 g/d) y forraje asociado de trébol blanco (Trifolium repens) y ray-grass inglés (Lolium perenne) de 240 g por día (Sarria Bardales et al., 2019).
Aplicación de los tratamientos
Los 92 cuyes seleccionados fueron distribuidos en cuatro grupos de estudio: grupo 1: matico 40 % (G1- M 40 %: n = 25), grupo 2: matico 70 % (G2- M 70 %: n = 25), grupo 3: control positivo (G3- CP: n = 22) y grupo 4: control negativo (G4- CN: n = 20). Se aplicaron extractos de matico a dosis de 1 mL/vía tópica a cuyes del grupo G1 y G2 a concentraciones de 40 y 70 %, respectivamente; al grupo G3-CP se le aplicó tintura de violeta de genciana al 1 % (cloruro de metilrosanilina) a dosis 1 mL, todos ellos en horarios nocturnos (7:00 p. m. - 10:00 p. m.) de manera progresiva (dos días continuos) y al G4-CN no se le aplicó ningún tratamiento, respetando las normas de bioseguridad. Previamente, todos los animales fueron evaluados según el grado de las heridas subcutáneas (inspección macroscópica) y se determinó el diámetro de estas mediante el uso de un calibrador digital Vernier (Unit Electtronic, BEF-Y001, México).
Cicatrización de las heridas
La cicatrización fue evaluada considerando las fases: desaparición del exudado, desprendimiento del tejido necrótico y aparición del tejido de granulación, categorizándose en: leve, moderada o severa y, para ello, se utilizó la fórmula matemática: proceso de cicatrización (%) = [(A-B)/(AC)] × 100; donde A = mediana del daño en el control positivo; B = mediana de daño en el grupo de tratamiento (matico a concentraciones de 40-70 % + CP); C = la mediana del daño en el control negativo, de acuerdo con los señalado por Herrera-Calderón et al. (2019). La reducción del tamaño (diámetro) de heridas en función al tiempo se midió mediante el uso del calibrador digital Vernier (Unit Electtronic, BEF-Y001, México), realizándose la actividad en horarios diurnos (6:00 a. m.) durante 15 días y registrándose los resultados en fichas validadas; asimismo, se realizó la prueba de KOH (método directo) a todos los grupos de estudio para la confirmación del diagnóstico negativo al germen micótico, como forma de validar del proceso de recuperación de los animales.
Al finalizar el estudio, los animales fueron sacrificados mediante la insensibilización por desnucamiento (Mota Rojas et al., 2012) y los cadáveres de los animales y los residuos biológicos fueron enterrados. La investigación fue supervisada por un comité de ética reconocido bajo resolución n.° 0348-2019-CU-UNH.
Costos de tratamiento
La evaluación de los costos de tratamiento se realizó a través del cálculo de los materiales directos (costos de insumos y materiales) y del costo de materiales indirectos que se consideraron en la elaboración del extracto etanólico liofilizado del matico, donde se usó la fórmula: CTT = (NAA)(TDT) = TDU (CDAT), donde: CTT = costo total de tratamiento, NAA = número de animales aplicados, TDT = total días de tratamiento, TDU = total dosis utilizados y CDAT = costo de dosis por animal tratado.
Análisis estadístico
Se determinó la distribución de la frecuencia para el proceso de cicatrización de heridas y análisis de Anova para el tiempo de cicatrización de heridas, a través de un diseño completamente al azar (DCA) y prueba de Tukey, para determinar diferencias significativas entre grupos con margen de error p < 0,05. Los datos fueron procesados en el software SPSS v. 25.
Resultados
En la tabla 1 se observa que el extracto etanólico liofilizado de matico al 70 % de concentración (G2- M 70 %) demostró ser eficaz para la cicatrización de heridas subcutáneas en cuyes, mostrando tendencias altas de desaparición del exudado (96 %), desprendimiento del tejido necrótico (96 %), aparición del tejido de granulación (100 %) y con ausencia del germen micótico a la prueba de KOH a los 10 días de tratamiento, sin embargo, los tratamientos del grupo G1- M 40 % y G3-TP mostraron su eficacia como cicatrizantes a tiempos más prolongados (15 días de tratamiento). Asimismo, se evidenció en G4-TN una masiva proliferación de heridas subcutáneas, apreciándose una escasa desaparición del exudado y el desprendimiento del tejido necrótico y de granulación.
El tiempo y el diámetro de cicatrización de heridas subcutáneas y dérmicas mostraron diferencias significativas (p < 0,05) con el extracto liofilizado de hojas de matico del tratamiento G2-M 70 % (0,04 ± 0,1c), evidenciando su efectividad en 10 días, en comparación con los tratamientos G3TP (0,80 ± 0,1a) y G1- M 40 % (0,36 ± 0,4c), los cuales no mostraron su potencial de efectividad (tabla 2 y figuras 2A, 2B y 2C).
Tabla 1 Cicatrización de heridas subcutáneas dérmicas en cuyes según tratamiento (N = 92)
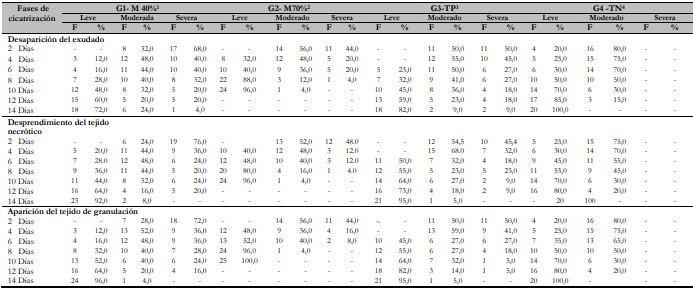
Notas aclaratoriasG1- M 1: grupo 1 de extracto etanólico de matico-40 % (25 animales), G2- M2: grupo 2 de extracto etanólico de matico-70 % (25 animales), G3-TP3: control positivo (22 animales), G4-TN4: control negativo (20 animales), F: frecuecia y %: porcentaje.
Fuente: Elaboración propia
Tabla 2 Tiempo de cicatrización de heridas subcutáneas dérmicas en cuyes (n = 92)
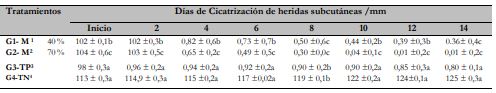
Notas aclaratoriaslas medias entre filas con letras distintas difieren estadísticamente (p < 0,05); G1- M1: extracto etanólico de matico-40 % (25 animales), G1- M2: extracto etanólico de matico-70 % (25 animales), G3-TP3: control positivo (22 animales) y G4-TN4: control negativo (20); a≠ b, b ≠ c a la prueba de Tukey (p < 0,05).
Fuente: Elaboración propia
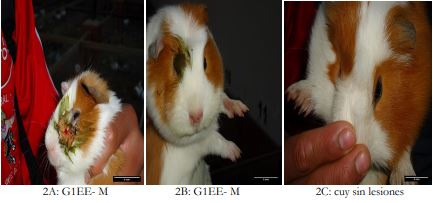
Fuente: Elaboración propia
Figuras 2 Proceso de cicatrización de heridas subcutáneas dérmicas en cuyes: 2A) cicatrización con G1- M 40 %, 2B) cicatrización con G2- M 70 % y 2C) animal cicatrizado a los ocho días de tratamiento
Por otro lado, los costos/tratamiento para G2- M 70 % ($1,80) fueron inferiores en comparación a G1($2,50) y G3 ($3,20) (tabla 3).
Tabla 3 Estimación del costo del tratamiento según grupo de estudio (dólar estadounidense)
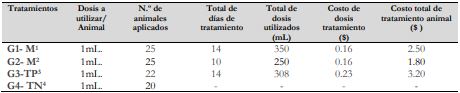
Notas aclaratoriasG1- M1: extracto etanólico de matico-40 % (25 animales), G2- M2: extracto etanólico de matico-70 % (25 animales), G3-CP3: control positivo (22 animales) y G4-CN4: control negativo (20 animales).
Fuente: Elaboración propia
Discusión
Los resultados evidenciaron una eficaz actividad cicatrizal con predominancia para la desaparición del exudado, con rápido desprendimiento del tejido necrótico y aparición de tejido de granulación, apreciándose una recuperación total de las lesiones de piel a los 10 días postratamiento con G2- M 70 %, mientras que los animales del G1- M 40 % y G3-CP mostraron un proceso de cicatrización de lesiones subcutáneas y dérmicas a tiempos prolongados. A partir del sexto día, el grupo G2- M 70 % presentó re-epitelización de las lesiones en comparación con los otros tres grupos en los que no hubo ningún efecto pronunciado, mientras que el grupo G4CN presentó nuevas lesiones a partir del tercer día, repitiéndose esto de manera progresiva durante el estudio.
La eficiente actividad farmacológica cicatrizante demostrada por el matico podría estar relacionada con la disponibilidad bioactiva de piperina, ácido piperico, piperlonguminina, pelitorina, piperoleína B, piperamida, piperetina, polisacáridos mucilaginosos (Arroyo-Acevedo et al., 2019) y kusunoquinina (Takooree et al., 2019; De Oliveira et al., 2022) en las hojas, lo que posibilita la rápida proliferación de melanocitos y la colagenización de fibroblastos, favoreciendo la regeneración de superficie epitelial lesionada con una acelerada desaparición de prurito, alopecia, eritema, pápulas, costras, pústulas, erosiones y ulceraciones (Bui et al., 2017; Assefa et al., 2018).
Asimismo, podría atribuirse a que el matico contiene alicina y ajoeno con principios antifungistáticos (Dworecka-Kaszak et al., 2020; Tahir et al., 2022), polisacáridos y compuestos fenólicos con actividad antiinflamatoria que favorecieron la rápida cicatrización y angiogénesis en los animales con lesiones subcutáneas y dérmicas (Arroyo-Acevedo et al., 2019; Tahir et al., 2022).
Algunos estudios han mostrado que los compuestos bioactivos del Piper angustifolium, sometidos a procesos de maceración-liofilización, incrementan su potencial de saponinas, taninos, quinonas, flavonoides y alcaloides (Mgbeahuruike et al., 2017; Tahir et al., 2022), contribuyendo de manera favorable como antiinflamatorio, analgésico, antiséptico y cicatrizante (Assefa et al., 2018; Wolff et al., 2019), así como antimicótico y bactericida (Silva et al., 2019; Long et al., 2020), lo que explicaría los resultados encontrados como eficaz cicatrizante de heridas dérmicas y subcutáneas en cuyes, siendo importante la validación científica en modelos animales para ser promovidos en medicina etnoveterinaria (Teka et al., 2020).
Un estudio realizado en Indonesia por Hartati et al. (2019) indica que se lograron cicatrizar heridas en ratas mediante el uso tópico de extracto de Piper nigrum L al 10 % de concentración. Asimismo, Fallah Huseini et al. (2020) encontraron actividad cicatrizante y renegación de tejidos en ratas diabéticas con extracto de Teucrium polium al 10 %, entre tanto, Gangwar et al. (2015) mostraron efectividad en cicatrizar heridas y disminuir el daño tisular mediante extracto de Mallotus philippinensis en ratas y Ahangarpour et al. (2018) reportaron que extractos de Portulaca oleracea L al 10 % aceleraron el proceso de cicatrización de heridas en ratones, debido a que actuó como citoprotector, antioxidante, inmunomodulador, antiproliferativo y antifúngico (Herrera-Calderón et al., 2019).
Por su parte, Bezada et al. (2016) encontraron que tenía acción cicatrizante y fungicida contra Trichophyton mentagrophytes en pomada del extracto hidroalcohólico de Tropaeolum majus al 1,5 % en cuyes con dermatomicosis; Melgar et al. (2018) demostraron eficacia de Allium sativum y Aloe vera en cuyes con lesiones cutáneas provocadas por dermatofitos (Trichophyton mentagrophytes) en 21 días y, por último, Alberto Trujillo et al. (2018) lograron reducir el tamaño de una lesión cutánea a los 18 días en animales de experimentación mediante el uso de crema de extracto hidroalcohólico de matico a 25 % y 40 %.
Los hallazgos mostrados por antecesores son similares a los resultados encontrados en el presente estudio, sin embargo, reportan una mayor variabilidad de tiempos prolongados de efectividad farmacológica de especies vegetales en procesos de cicatrización de heridas cutáneas micóticas en modelos animales, de ahí que resulta novedoso nuestro estudio por haber encontrado la eficacia del matico en un tiempo reducido con metodología sofisticada, lo cual apoya para dilucidar el uso del extracto etanólico liofilizado de P. angustifolium como cicatrizante ecológico.
Por otro lado, el extracto liofilizado de hojas de Piper angustifolium (G2 -Matico 70 %) demostró una disminución significativa en el cierre de las heridas, logrando un cierre total y una restauración tisular de heridas subcutáneas en los cuyes a los 10 días, mientras que, en los grupos G1- M 40 % y G3-CP se prolongó la disminución del diámetro de heridas, apreciándose el cierre progresivo a partir de los 14 días, sin embargo, en el grupo G4-CN aparecieron nuevas roturas de tejidos epiteliales con presencia masiva de eritema, prurito, erosiones y ulceraciones, por la prolongada respuesta inflamatoria e inmunosupresión.
El efectivo cierre del diámetro de heridas dérmicas y subcutáneas alcanzadas por el matico estaría estrechamente relacionado al estímulo mecánico, físico, químico o biológico sobre la membrana celular, originado por el Piper angustifolium (Kovalik et al., 2014; Wolff et al., 2019), contribuyendo a la reducción del estrés oxidativo tisular e induciendo al aumento de actividad de fosfolipasa A2, la liberación de histamina del mastocito y la activación de cascada del ácido araquidónico (Bahramsoltani et al., 2017; Eming, 2019).
La literatura científica argumenta que diferentes especies vegetales con contenidos altos de mucílago muestran efectos antiinflamatorios y cicatrizantes, por lo tanto, justifica la efectividad como cicatrizante mostrada por el Piper angustifolium (Tamri et al., 2014), sin evidenciarse ninguna reacción adversa al usar el producto natural, lo cual muestra su seguridad de uso terapéutico en animales con patologías dérmicas (Melgar et al., 2018).
Alberto Trujillo et al. (2018) lograron la cicatrización total de lesiones a los 18 días con crema de matico al 25 % y al 40 %, estos reportes difieren a los resultados encontrados en este artículo, por lo que se requieren más estudios en modelos animales con metodologías adecuadas para su validación y aplicación en la etnoveterinaria; además, los productos ecológicos son recomendados debido a que no afectan estéticamente la piel y el pelaje, no resultan ser tóxicos para los animales, no implican una mayor mano de obra en el tratamiento y contrarrestan la proliferación epidemiológica al resto de los animales, garantizando carne ecológica y de calidad al consumidor.
En cuanto a los costos, el tratamiento G2-M-70 % evidenció un costo económico accesible para el tratamiento eficaz de cuyes con heridas subcutáneas y dérmicas, considerándose como la fórmula recomendada para la aplicación en la etnoveterinaria, siendo eficaz a bajo costo; el costo accesible reportado en el estudio se puede atribuir a la efectividad del extracto liofilizado de matico mostrado en cicatrizar la herida en un tiempo reducido, lo que resultó determinante en la reducción de dosis, sumándose a ello la elaboración con insumos propios de la zona y de fácil acceso. Por lo tanto, el extracto liofilizado de matico, en un futuro, puede sustituir a los fármacos sintéticos veterinarios por sus fuentes fitoquímicas y por ser un prometedor potencial terapéutico, dado por su eficacia como cicatrizante y antimicótico ecológico, por ello es necesaria la conservación de sus principios activos mediante la micro y la nanocapsulación.
Conclusiones
El extracto etanólico liofilizado de matico al 70 % de concentración demostró una eficaz actividad cicatrizal con predominio de desaparición de exudado, con rápido desprendimiento del tejido necrótico, aparición de tejido de granulación y un acelerado cierre de heridas en cuyes con lesiones subcutáneas y dérmicas.
Económicamente, el extracto etanólico liofilizado de matico al 70 % de concentración resultó ser económico y accesible para el tratamiento de heridas subcutáneas y dérmicas, recomendando como la fórmula para la aplicación en la etnoveterinaria como un tratamiento eficaz a bajo costo.
Contribución de los autores
Victor Carhuapoma-Delacruz: diseño, ejecución de metodologías, construcción de las bases de datos, análisis de la información, elaboración del manuscrito y revisión crítica de la corrección del manuscrito; Brian Huaman Cusi: registro de información en campo; Janeth Vanessa Maldonado Chilquillo y Luis Mariano Soldevilla Choque: recopilación y tabulación de los datos; Maricruz Quispe Gaspar: recolección del material bilógico (plantas y animales); Nicasio Valencia Maman: supervisión de actividades y análisis de la información; Melanio Jurado Escobar: supervisión, coordinación de metodología de la elaboración de los extractos etanólicos y revisión crítica del manuscrito, Mario Esparza: supervisión de actividades, análisis de la información y aplicación de las técnicas estadísticas.
Implicaciones éticas
El manuscrito cuenta con la supervisión por el comité de ética reconocido bajo resolución N.° 0348-2019-CU-UNH, avalado con carta N.° 023-CEFCI-UNH-2021 de la Universidad Nacional de Huancavelica, Perú, con fecha del 18 de mayo del 2021, así mismo se obtuvo el consentimiento de los dueños de los animales y de las plantas utilizadas en la investigación.















