Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.50 no.2 Santa Marta July/Dec. 2021 Epub Dec 03, 2021
https://doi.org/10.25268/bimc.invemar.2021.50.2.1062
Artículos de Investigación
Distribución, composición y abundancia del ictioplancton en tres áreas marinas protegidas del Pacífico colombiano
1Investigadora Independiente, Carrera 47 # 2A -75 Apto 102 G. Cali, Colombia E-mail: bbeltranleon@yahoo.com
2Investigadora Independiente, Carrera 22A -6-05 Oeste. Cali, Colombia E-mail: ymoralesosorio@gmail.com
With the purpose of characterizing ichthyoplankton in three marine protected areas (Sanquianga National Natural Park, Gorgona National Natural Park and Malpelo Fauna and Flora Sanctuary) in the Colombian Pacific during November 2009, scientific expeditions were carried out to obtain 56 samples by trawling with bongo nets. 3,155 / 10 m2 fish larvae were captured distributed in 1,553 larvae / 10 m2 (49.22 %) for the PNN Sanquianga; 1,411 larvae / 10m2 (44.72 %) for the Gorgona PNN and 191 larvae / 10m2 (6.05 %) for the Malpelo SFF. The main families were Engraulidae (PNN Sanquianga), Bregmacerotidae (PNN Gorgona) and Phosichthyidae (SFF Malpelo). The NMS community analysis shows that the location of the PNN Sanquianga (coastal), PNN Gorgona (intermediate) and SFF Malpelo (oceanic) areas, marks a clear difference in the composition, distribution and abundance of the larvae. Eggs of Engraulidae were found for the first time in the Malpelo area, an unusual area in its distribution, coinciding with what was reported by the Climate Alert Bulletin (BAC, 2009) of July 2009, which reports the development of an El Niño event, which lasted until the first quarter of 2010.
KEY WORDS: marine protected areas; ichthyoplankton; Colombian Pacific; fish larvae.
Con el propósito de caracterizar el ictioplancton en tres áreas marinas protegidas (Parque Nacional Natural Sanquianga, Parque Nacional Natural Gorgona y Santuario de Fauna y Flora Malpelo) en el Pacífico colombiano durante noviembre de 2009, se realizaron expediciones científicas para obtener 56 muestras mediante el arrastre con redes bongo. Se capturaron 3155/10 m2 larvas de peces distribuidas en 1553 larvas/10 m2 (49,22 %) para el PNN Sanquianga; 1411 larvas/10 m2 (44,72 %) para el PNN Gorgona y 191 larvas/10 m2 (6,05 %) para el SFF Malpelo. Las principales familias fueron Engraulidae (PNN Sanquianga), Bregmacerotidae (PNN Gorgona) y Phosichthyidae (SFF Malpelo). El análisis de comunidades evidencia que la ubicación de las áreas, PNN Sanquianga (costera), PNN Gorgona (intermedia) y SFF Malpelo (oceánica), marca una clara diferencia en la composición, distribución y abundancia de las larvas. Se encontraron por primera vez huevos de la familia Engraulidae en el área de Malpelo, no habitual en su distribución, coincidiendo con lo registrado por el Boletín de Alerta Climática (BAC, 2009) de julio de 2009, que plantea el desarrollo de un evento El Niño, que se extendió hasta el primer trimestre de 2010.
PALABRAS CLAVES: Áreas marinas protegidas; ictioplancton; Pacífico colombiano; larvas de peces.
INTRODUCCIÓN
El ictioplancton es un componente importante del zooplancton marino y los factores que tienen influencia sobre la distribución y abundancia de este, son los mismos que para otros pláncteres: la necesidad de alimento (alimento adecuado en el momento preciso y en cantidad suficiente), la incidencia de depredadores, incluyendo los mecanismos que eviten la depredación, la influencia de la temperatura, la salinidad, las corrientes y otros factores físicos y químicos (Giraldo et al., 2014). Ecológicamente su importancia radica en que como componente estructural y funcional de los ecosistemas acuáticos muestra a través de la variabilidad de su composición y abundancia, la calidad o el deterioro del medio que ocupa (Beltrán-León y Ríos, 2000). Las áreas marinas protegidas: Parque Nacional Natural (PNN) Gorgona, PNN Sanquianga y Santuario de Fauna y Flora (SFF) Malpelo, juegan un papel muy importante en la dispersión y reclutamiento de larvas claves para el mantenimiento y repoblación de los recursos pesqueros en las aguas circundantes, como ha sido registrado en otras islas alrededor del mundo (Swearer et al., 1999). El auge de la explotación de recursos pesqueros en aguas costeras y oceánicas del Pacífico colombiano, ha generado un aumento en la presión de uso de las áreas de pesca, incrementando el interés hacia las zonas protegidas. Por lo tanto, para enfrentar este reto de uso, se requiere modificar el estilo de desarrollo, tomando y llevando a cabo decisiones que integren la conservación, el uso sostenible y la participación equitativa de los beneficios, sin afectar las condiciones fundamentales para la vida y su desarrollo (Beltrán-León y Ríos, 2000). En este contexto, el estudio del ictioplancton se convierte en un medio relevante para evaluar el estado del stock íctico de una localidad, ya que permite establecer información sobre la composición, diversidad y potencial productivo de una región, y simultáneamente identificar las áreas y periodos críticos para el desarrollo del recurso (Beltrán-León y Ríos, 2000). La Dirección Territorial Suroccidente (DTSO) ahora Dirección Territorial Pacífico (DTPA) del Sistema de Parques Nacionales Naturales, con apoyo de la Fundación Malpelo y parciales de WWF Colombia y Conservación Internacional a través de proyectos de cooperación, desarrollaron durante noviembre de 2009, diferentes expediciones científicas a los PNN Sanquianga y Gorgona y el SFF Malpelo, con el objetivo de caracterizar el plancton presente en las tres áreas protegidas y poder brindar información sobre los huevos y larvas de peces, determinar áreas de desove y cría y la relación e influencia del medio ambiente sobre el desarrollo de vida temprana. Además de obtener un inventario de la biodiversidad de especies que a futuro y mediante muestreos periódicos (monitoreos) coadyuve a la toma de decisiones que integran la conservación y el uso sostenible de los recursos.
ÁREA DE ESTUDIO
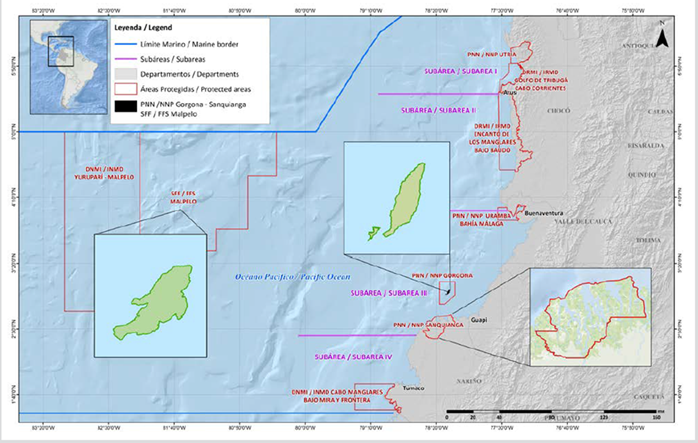
Las áreas protegidas PNN Gorgona (02° 58′ 17″ N - 78° 11′ 04″ W), PNN Sanquianga (2° 38′ 59″ - 78° 17′ 09″ W) y SFF Malpelo (Punto 1: 4° 26’ 00″ N - 82° 00’ 00″ W, Punto 2: 4° 26’ 00″ N - 81° 08’ 00″ W, Punto3: 3° 32’ 00″ N- 82’ 00’ 00″ W, Punto 4: 3° 32’ 00″ N - 81° 08’ 00″ W), hacen parte de las 59 áreas protegidas del Sistema Nacional de Parques y están ubicadas en la zona costera y oceánica del Pacífico colombiano (Figura 1).
MATERIALES Y MÉTODOS
Se siguió un plan de muestreo de 24 estaciones en la zona marina frente al PNN Sanquianga, grilla establecida por el Proyecto Pequeños Pelágicos de WWF Colombia - Min Agricultura 2008 (Zapata et al., 2011); 24 estaciones alrededor del PNN Gorgona, grilla establecida por el proyecto Univalle - Colciencias 2006 (Escarria et al., 2007) y 12 estaciones alrededor del SFF Malpelo, grilla establecida por el Proyecto INPA - DIMAR 1993 (Beltrán-León, 2007), durante noviembre de 2009 para las tres áreas (Figura 2).
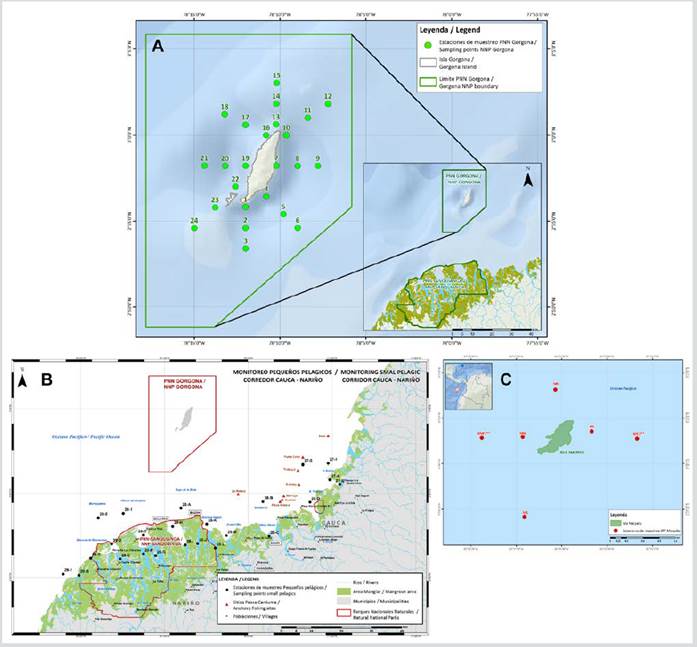
Figura 2 Ubicación de las estaciones de muestreo A. PNN Gorgona, B. PNN Sanquianga y C. SFF Malpelo, Pacífico colombiano.
Se realizaron arrastres superficiales de zooplancton para el PNN Sanquianga (24 estaciones) y el SFF Malpelo (12 estaciones) y por logística y diseño de muestreo para el PNN Gorgona (24 estaciones) oblicuos hasta una profundidad máxima de 50 m, de acuerdo con la metodología establecida por Smith y Richardson (1979), utilizando redes bongo de 300 y 500 µm, provistas de copos colectores blandos y contadores de flujo análogos Hydrobios. Las muestras fueron preservadas con formalina buferizada al 10 % en agua de mar. Todos los arrastres se realizaron a una velocidad de 3,7 km/h. Simultáneamente, en cada estación se registró la temperatura y la salinidad superficial, utilizando un sistema portátil para medición de conductividad, salinidad y temperatura YSI, mientras la transparencia en la columna de agua se midió con un disco Secchi. Una vez trasladadas las muestras desde las áreas al laboratorio en la ciudad de Cali, se midió la biomasa zooplanctónica por el método volumétrico y se separó el total de huevos y larvas de peces (ictioplancton) del resto del zooplancton (invertebrados planctónicos), colectado en la malla de 300 µm.
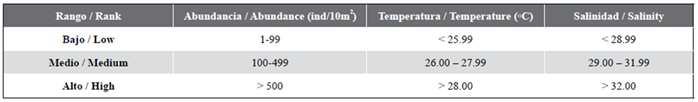
Las larvas de peces fueron identificadas con base en los caracteres merísticos, morfométricos y de pigmentación, hasta el menor nivel taxonómico posible (familia, género y/o especie), siguiendo las claves de identificación de Moser (1996) y Beltrán-León y Ríos (2000). Para todos los casos el número de organismos se estandarizó a ind/10 m². Para los análisis se tomaron como referencia los rangos de salinidad, temperatura y abundancia registrados por Rueda-Montenegro y Beltrán-León (1992) y modificados por Beltrán-León et al. (1994) (Tabla 1). Para todos los análisis se trabajó con un nivel de significancia de 5 %. Las correlaciones entre las dos variables físicoquímicas (temperatura y salinidad) y las cinco variables biológicas (biovolumen zooplanctónico, huevos de peces, larvas de peces, huevos de Engraulidae y larvas de Engraulidae) se evaluaron con la prueba para correlación de Pearson. Para la comparación entre las tres áreas protegidas, de acuerdo con cada una de las siete variables (las dos variables fisicoquímicas y las cinco variables biológicas), se siguió la siguiente ruta:
Evaluación de normalidad en cada uno de los tres subconjuntos de datos, con la prueba de Lilliefors (Kolmogorov-Smirnov).
Evaluación de homocedasticidad entre los tres subconjuntos de datos, con la prueba Fligner-Killeen.
Evaluación de igualdad de medias (o medianas, según sea el caso): i. Si hay normalidad y homocedasticidad, con una ANOVA estándar. ii. Si hay normalidad y heterocedasticidad, con una ANOVA de Welch. iii. Si no hay normalidad, las distribuciones son semejantes, y hay homocedasticidad, con una ANOVA no paramétrica de Kruskal-Wallis. iv. Si no hay normalidad, las distribuciones son semejantes, y hay heterocedasticidad, con la técnica no paramétrica de bootstrap (Hesterberg, 2015).
Se evaluó el grado de asociación entre abundancia de larvas de peces y parámetros fisicoquímicos, mediante correlación no-paramétrica de un análisis NMS y la matriz ambiental. Toda la información obtenida del muestreo y los análisis en el laboratorio se estandarizaron a individuos/10 m2 con el fin de hacer los datos comparables.
RESULTADOS
Condiciones oceanográficas
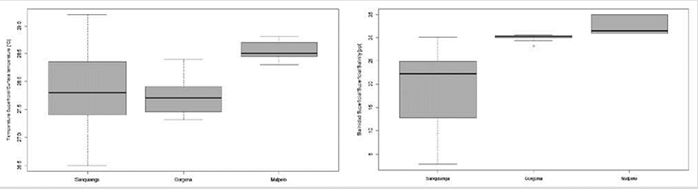
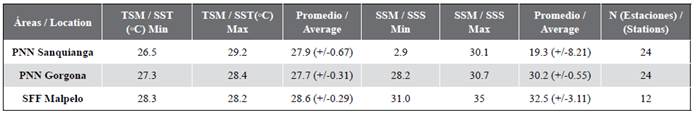
La temperatura superficial del mar -TSM, durante noviembre de 2009 osciló entre 26,5 y 29,2 °C, el valor promedio más bajo se encontró en Gorgona, aumentando en 0,2 °C para Sanquianga y en 0,9 °C para Malpelo. Los datos de TSM para Sanquianga y Malpelo pueden ser considerados con distribución normal (p = 0,596 y 0,138), pero no para Gorgona (p = 0,015), siendo estadísticamente diferentes entre las tres áreas (p < 0,001), Malpelo es de mayor temperatura que Sanquianga y Gorgona (p < 0,001), pero Sanquianga y Gorgona no son diferentes entre sí (p = 0,691) (Figura 3, Tabla 2).
La salinidad superficial del mar -SSM, osciló entre 2,9 y 35; con el valor promedio de salinidad más bajo en Sanquianga, aumentando en 10,9 para Gorgona y 13,2 para Malpelo. Los datos de salinidad para Sanquianga y Gorgona pueden ser considerados con distribución normal (p = 0,073 y 0,056), pero no para Malpelo (p = 0,007). Las salinidades superficiales son estadísticamente diferentes entre las tres áreas (p < 0,001), siendo mayor en Malpelo, seguida de Gorgona y menor en Sanquianga (p < 0,003). (Figura 3, Tabla 2).
Tabla 2 Temperatura superficial del mar (TSM °C) y salinidad superficial del mar (SSM) en el PNN Sanquianga, PNN Gorgona y SFF Malpelo, Pacífico colombiano, durante noviembre de 2009.
Biomasa zooplanctónica
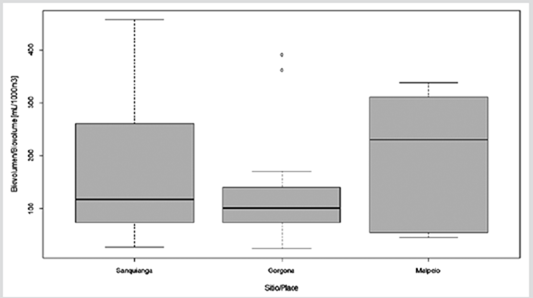
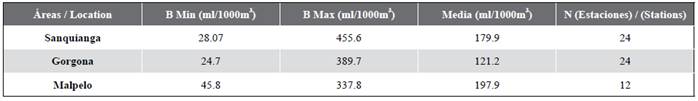
El biovolumen zooplanctónico osciló entre 24,7 y 455,6 ml/1000 m3. Los datos de biovolumen para Malpelo pueden ser considerados con distribución normal (p = 0,115), no para Sanquianga y Gorgona (p = 0,006 y 0,009). Los biovolumenes no fueron estadísticamente diferentes entre las tres áreas (p = 0,089) y estuvieron en el rango de biomasa media para las tres (Figura 4, Tabla 3).
Tabla 3 Biovolumen del zooplancton en el PNN Sanquianga, PNN Gorgona y SFF Malpelo, Pacífico colombiano, durante noviembre de 2009.
Huevos de peces
Se recolectaron en total 17 341 huevos/10 m2, de los cuales 6603 huevos/10 m2 pertenecen al PNN Sanquianga, 10 256 huevos/10 m2 al PNN Gorgona y 482 huevos/10 m2 al SFF Malpelo. Los huevos de peces no presentaron una distribución normal en ninguna de las tres áreas protegidas (p < 0,009), no se rechaza el supuesto de homocedasticidad (p = 0,063). No presentaron diferencias significativas (p = 0,73); entre las tres áreas. Se apreciaron valores más altos en Gorgona, seguidos de Sanquianga y Malpelo (Figura 5, Tabla 4). 62,50 % de las estaciones en Sanquianga, 70,83 % en Gorgona y 85,00 % en Malpelo presentaron abundancias bajas de huevos.
La abundancia total de huevos de la familia Engraulidae fue de 9 312 huevos/10 m2, de los cuales la mayor abundancia (8 586 huevos/10 m2) se presentó en la estación 17 noroeste del PNN Gorgona. Estos huevos no presentaron una distribución normal en ninguna de las tres áreas y se rechaza el supuesto de homocedasticidad (p < 0,001). Las diferencias en el conteo de huevos de Engraulidae entre las tres áreas fueron significativas (P = 0,001), siendo mayor la abundancia en Gorgona, seguido de Sanquianga y menor en Malpelo.
Tabla 4 Abundancia de huevos (H) y larvas de peces (L) en el PNN Sanquianga, PNN Gorgona y SFF Malpelo, Pacífico colombiano, durante noviembre de 2009.
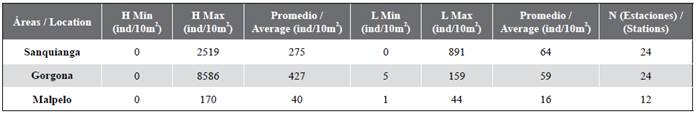
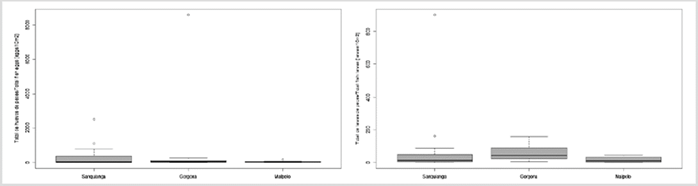
Figura 5 Abundancia de huevos de peces (izquierda) y abundancia de larvas de peces (derecha) (ind/10m2) en el PNN Sanquianga, PNN Gorgona y SFF Malpelo, Pacífico colombiano, durante noviembre de 2009.
Larvas de peces
Se recolectaron en total 3155 larvas/10 m2, de las que 1553 larvas/10 m2 (49,22 %) pertenecen al PNN Sanquianga, 1411 larvas/10 m2 (44,72 %) al PNN Gorgona y 191 larvas/10 m2 (6,05 %) al SFF Malpelo. Las larvas de peces para Gorgona y Malpelo pueden ser consideradas con distribución normal (p = 0,045 y 0,093), pero para Sanquianga no (p < 0,001). Con la homocedasticidad encontrada se hallaron diferencias significativas entre las tres áreas (p = 0,001). Fueron más abundantes en Gorgona que en Sanquianga y Malpelo (p = 0,008 y 0,003), pero entre Sanquianga y Malpelo no hay diferencias significativas (p = 0,512) (Figura 5, Tabla 4). 91,67 % de las estaciones en Sanquianga, 79 % en Gorgona, y 95 % en Malpelo presentaron abundancias bajas de larvas de peces.
Larvas de la familia Engraulidae no se encontraron en Malpelo. Ni Gorgona ni Sanquianga muestran distribución normal en la cantidad de larvas, de acuerdo con el gráfico QQ-plot, y el test de Shapiro-Wilk (p < 0,001). Se encontraron diferencias significativas en la cantidad de larvas de engráulidos entre Sanquianga y Gorgona (p = 0,022). En promedio es mayor la cantidad de larvas en Sanquianga que en Gorgona.
Composición de las capturas
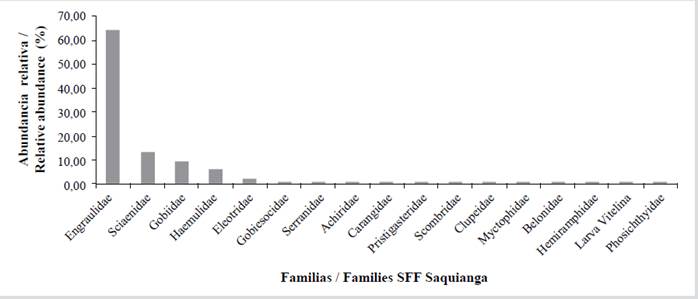
Durante noviembre de 2009 se identificaron para las tres áreas protegidas 42 familias, 65 géneros y 90 especies, de las cuales 16 familias (38,10 %), 21 géneros (32,31 %) y 32 especies (35,56 %) fueron de Sanquianga; 29 familias (69,05 %), 38 géneros (58,46 %) y 52 especies (57,78 %) fueron de Gorgona; y 12 familias (28,57 %), 19 géneros (29,23 %) y 21 especies (23,33 %), de Malpelo. (Tabla 5). Las mayores abundancias en el PNN Sanquianga las presentaron las familias Engraulidae (anchoas) (64,39 %), Sciaenidae (peladas) (13,39), Gobiidae (sapitos) (9,53 %), Haemulidae (pargos blancos) (6,12 %) y 12 familias más que componen 6,37 % restante; 0,19 % corresponde a larvas vitelinas sin clasificar (Tabla 5, Figura 6).
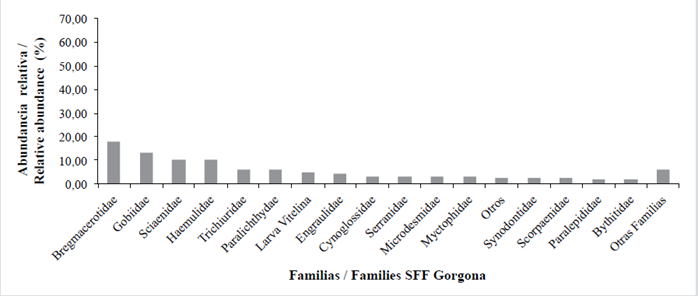
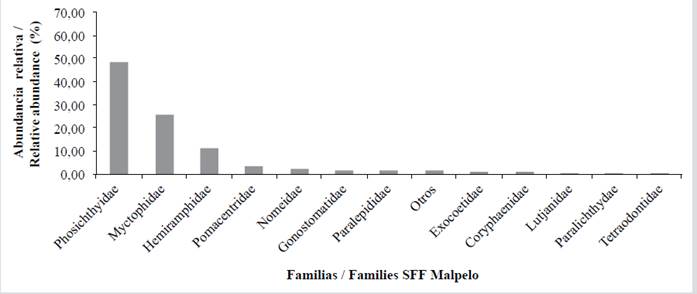
Tabla 5 Composición y abundancia relativa (%) de las larvas de peces presentes en el PNN Sanquianga, PNN Gorgona y SFF Malpelo, Pacífico colombiano, durante noviembre de 2009
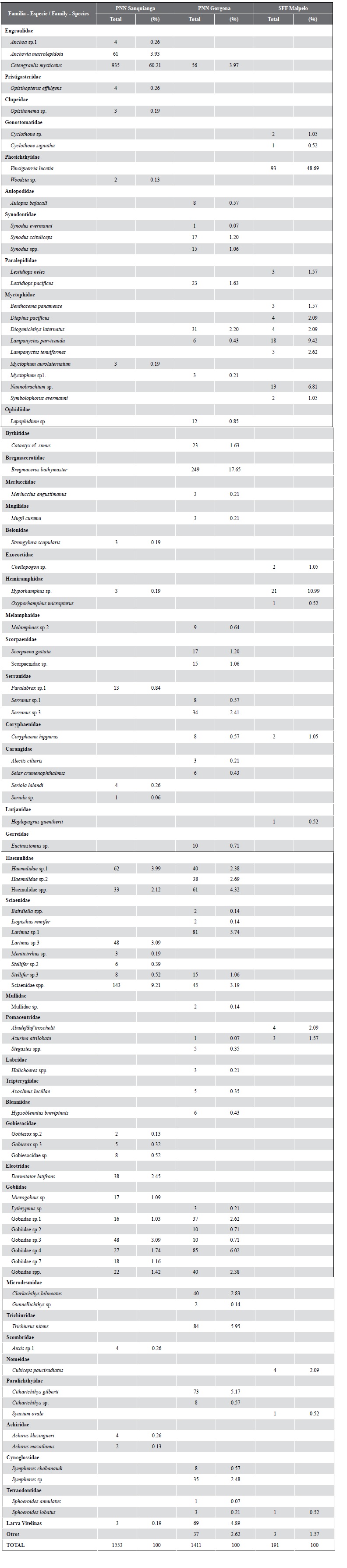
Para el PNN Gorgona las familias Bregmacerotidae (merlucitas) (17,65 %), Gobiidae (sapitos) (13,11 %), Sciaenidae (peladas) (10,28 %), Haemulidae (pargos blancos) (9,85 %), Trichiuridae (peces cinta) (5,95 %), Paralichthyidae (lenguados) (5,74 %), Engraulidae (anchoas) (3,97 %), Cynoglossidae (peces lengüeta) (3,05 %), Serranidae (chernas) (2,98 %) y 20 familias más que componen el 19,92 % restante; el 4,89 % corresponde a larvas vitelinas y 2.62 % a otros (Tabla 5, Figura7). Para el SFF Malpelo las familias Phosichthyidae (peces linterna) (48,69 %), Gobiidae (sapitos) (13,11 %), Myctophidae (peces linterna) (25,65 %), Hemiramphidae (mediopicos) (11,52 %), Pomacentridae (repeladores) (3,66 %) y ocho familias más que componen 8,90 %; 1,57 % corresponde a otros (Tabla 5, Figura 8).
De las 42 familias identificadas 14,29 % (Engraulidae, Serranidae, Carangidae, Haemulidae, Sciaenidae y Gobiidae) están presentes tanto en Sanquianga como en Gorgona, 11,90 % (Paralepididae, Coryphaenidae, Pomacentridae, Paralichthyidae y Tetraodontidae) presentes en Gorgona y Malpelo, el 4,76 % (Phosichthyidae y Hemiramphidae) presentes en Sanquianga y Malpelo y el 2,38 % (Myctophidae) están presentes en las tres áreas protegidas. Mientras 16,67 %, compuesto por las familias Pristigasteridae, Clupeidae, Belonidae, Gobiesocidae, Eleotridae, Scombridae y Achiridae fueron exclusivas para el PNN Sanquianga; 40,48 %, familias Aulopidae, Synodontidae, Ophidiidae, Bythitidae, Bregmacerotidae, Merlucciidae, Mugilidae, Melamphaidae, Scorpaenidae, Gerreidae, Mullidae, Labridae, Tripterygiidae, Blenniidae, Microdesmidae, Trichiuridae y Cynoglossidae, fueron exclusivas del PNN Gorgona; 9,52 %, familias Gonostomatidae, Exocoetidae, Lutjanidae y Nomeidae fueron exclusivas para el SFF Malpelo (Tabla 5).
El análisis de ordenación fue muy consistente, se observan diferencias (evidenciada por la distancia de los puntos) de la riqueza y composición de especies separando las áreas en tres grupos: PNN Sanquianga ubicada en la zona costera (asociada al eje 1, separada de Malpelo por salinidad y temperatura y de Gorgona por salinidad), Gorgona en la zona intermedia (asociada también al eje 1, separada de Malpelo por temperatura y de Sanquianga por salinidad) y Malpelo en la zona oceánica (asociada al eje 2, separada de Sanquianga por salinidad y temperatura y de Gorgona por temperatura). Resulta evidente la clara separación en la distribución de los puntos en los sitios por área, lo que respalda la ubicación de las áreas en las zonas costera, intermedia y oceánica (Figura 9).
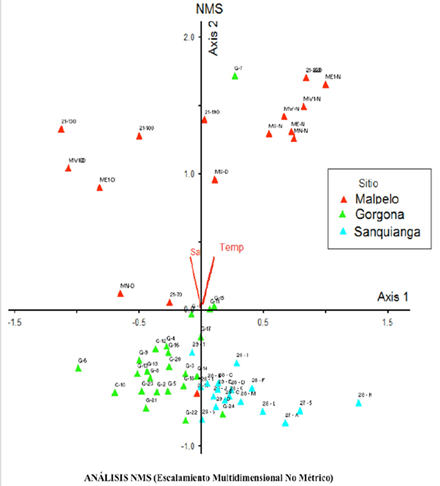
Figura 9 Análisis NMS sitio 1 rojo (SFF Malpelo), sitio 2 verde (PNN Gorgona) y sitio 3 azul (PNN Sanquianga), noviembre 2009.
El área protegida del PNN Sanquianga, ubicada en la zona costera, presentó la mayor abundancia dominada por la especie Cetengraulis mysticetus con 935 larvas/10 m2 (60,21 %). El PNN Gorgona presentó una abundancia menor, dominada por la especie Bregmaceros bathymaster con 249 larvas/10 m2 (17,65 %). El SFF Malpelo ubicado en la zona oceánica, mostró una abundancia muy baja de larvas de peces en comparación con las otras áreas, dominada por la especie Vinciguerria lucetia 93 larvas/10 m2 (48,69 %). Para noviembre de 2009 se encontraron huevos de la familia Engraulidae en el PNN Gorgona, lo cual puede ser normal; sin embargo, no lo es con un valor de muy alta abundancia. De igual manera, resulta sorpresivo haber encontrado huevos de esta familia en los alrededores de Malpelo, de noche al occidente y en el día al sur.
DISCUSIÓN
Considerando las condiciones de temperatura superficial registradas durante noviembre/09 para las tres áreas muestreadas se puede determinar que la media para el PNN Gorgona y el PNN Sanquianga se encuentra en el rango de temperaturas medias. Estos valores son característicos de aguas cálidas. Mientras que los valores de salinidad son variables, la media encontrada para el área del PNN Sanquianga se encuentra en el rango de salinidades bajas, lo que es normal pues su posición en la zona nerítica y que hace que se encuentre influenciada por el gran aporte de los ríos Patía y Sanquianga.
Por su parte las áreas del PNN Gorgona y el SFF Malpelo presentaron salinidades en el rango de medias a altas, lo que también es normal para sus zonas y el mes de muestreo, dado que las dos áreas protegidas se encuentran más alejadas de costa y por lo tanto con menor aporte fluvial. Esto corresponde a las condiciones normales para el área y época que va de mayo a diciembre con bajos valores de salinidad superficial y una termoclina profunda (40 a 50 m) (Stevenson et al. 1970; Giraldo, 2008; Giraldo et al., 2008a). Mientras la temperatura para el SFF Malpelo se encontró en el rango de altas, lo que coincide con lo registrado para 2009 acerca de la presencia de un posible evento El Niño (BAC, 2009). Estos eventos generan importantes impactos climáticos, oceanográficos, biológicos y económicos en todo el planeta (Chávez, 1987; Mann y Lazier, 1996; Levinton, 2001; Franco-Gordo et al., 2004), produciendo un descenso en la tasa de producción primaria y una disminución en la composición y biomasa zooplanctónica, que afecta la sobrevivencia, reproducción y distribución de los organismos de niveles tróficos superiores como peces, aves y mamíferos (Chávez, 1996; Martínez-Aguilar et al., 2010).
Los valores de biomasa fueron relativamente estables en el rango de medias durante noviembre de 2009 para las tres áreas muestreadas, lo que evidenció un aporte de producción secundaria importante que aparentemente no se vio afectada por los valores altos de temperatura que se presentaron en el mes muestreado. Noviembre de 2009 no fue un mes importante para el desove y alevinaje de muchas especies de peces, pues entre 60 % y 95 % de las estaciones presentaron abundancias bajas de huevos y larvas para Sanquianga, Gorgona y Malpelo; esto también puede deberse a que el evento El Niño también incide en el reclutamiento de larvas y la tasa de mortalidad natural del ictioplancton (Connoly y Roughgarden, 1999; Hopcroft et al., 2002; Lavaniegos et al., 2002). Durante noviembre de 2009, el PNN Sanquianga presentó la mayor abundancia relativa, seguido por el PNN Gorgona y SFF Malpelo. Mientras la mayor riqueza de especies se encontró en el PNN Gorgona, seguido del PNN Sanquianga y el SFF Malpelo.
El área protegida del PNN Sanquianga, ubicada en la zona costera presentó la mayor abundancia, dominada por Cetengraulis mysticetus, la cual se constituye en una de las principales especies desde el punto de vista ecológico y económico para la zona costera, ya que soporta la base de la cadena trófica y en su momento era la materia prima de la industria de harina y aceite de pescado (Beltrán-León, 1992; Beltrán-León et al., 1994; Zapata et al., 2013). El PNN Gorgona presentó la mayor diversidad y riqueza de las tres áreas, lo que puede ser normal como zona intermedia, dado que en ella pueden confluir especies tanto de la zona costera como de la oceánica, pero con abundancia más baja, dominada por Bregmaceros bathymaster de importancia ecológica. El SFF Malpelo ubicado en la zona oceánica presentó menos abundancia de larvas que Gorgona y Sanquianga, lo que es normal para sistemas oligotróficos oceánicos tropicales que presentan menores abundancias, dominada por la especie Vinciguerria lucetia de importancia ecológica.
La disminución drástica en la abundancia de huevos y larvas de peces para noviembre en Malpelo estuvo probablemente acentuada como una respuesta de los organismos a las altas temperaturas que se presentaron durante noviembre de 2009 en esta zona (> 28,5 °C), coincidiendo con lo registrado por el Boletín de Alerta Climática (BAC, 2009) de julio de 2009 que reporta el desarrollo de un evento El Niño, que se extendió hasta el primer trimestre de 2010. En dicho boletín, el Centro de Control Contaminación del Pacífico (CCCP) manifiesta que durante el monitoreo de julio de 2009, se presentó una anomalía positiva a nivel superficial de 0,72 °C respecto a la media histórica.
El empobrecimiento de los hábitats pelágicos durante la fase cálida ENOS es uno de los efectos más descritos en la literatura (Martínez-Aguilar et al., 2010). Para 2009, se encontraron huevos de la familia Engraulidae en abundancia muy alta en Gorgona y muy baja en los alrededores de Malpelo, en el occidente de noche y en el sur de día; cabe resaltar que es la primera vez que esta familia compuesta por pequeños pelágicos costeros, es recolectada en Malpelo, que por su característica oceánica no es el lugar típico de una especie considerada pelágica costera de aguas tropicales y subtropicales distribuida entre los 8 y 12 km mar afuera, y a profundidades hasta de 25 m (Chirichigno, 1998). Lo anterior probablemente como un resultado de posibles alteraciones en el sistema de corrientes en el Pacífico colombiano, donde esta familia pudo desplazarse a zonas no habituales en su distribución. Esto es consistente con lo indicado por López-Peralta (1984), quien plantea que debido a que los huevos de peces son derivadores pasivos, es de esperar alta frecuencia de los mismos en la parte oceánica influenciados por el patrón de circulación superficial, el cual se ve afectado por la corriente de Colombia, que en noviembre es más intensa (vientos alisios del sur hacia el noroccidente), durante la época de lluvias (mayo-noviembre) el jet de Panamá se debilita, y la circulación en el Pacífico colombiano está dominada por la formación de un giro anticiclónico en la zona central (Rodríguez-Rubio et al., 2003; Devis-Morales et al., 2008). En términos generales se ha identificado a la oscilación estacional de los vientos alisios como el principal forzante atmosférico, que modula el patrón de circulación de mesoescala y productividad regional (Rodríguez-Rubio y Giraldo, 2011). Esto implica necesariamente el transporte de huevos fuera de la costa, aumentando su densidad en la parte oceánica. De igual manera se nota una posible respuesta de la familia Engraulidae a los cambios medioambientales anómalos (altas temperaturas) que se presentaron (Beltrán-León, 2002).
El análisis de comunidad NMS fue muy consistente ya que permite observar la agrupación de las estaciones y las especies por área, lo que respalda la ubicación espacial de las áreas así: en la zona costera el PNN Sanquianga con la mayor abundancia representada por Cetengraulis mysticetus, en la zona intermedia el PNN Gorgona representada por Bregmaceros bathymaster y en la zona oceánica el SFF Malpelo representada por Vinciguerrria lucetia, evidenciando diferencias en los parámetros ambientales que inciden en la distribución de las larvas, mostrando también familias exclusivas para cada área.
CONCLUSIONES
Noviembre de 2009 no fue un mes importante para el desove y alevinaje de muchas especies de peces, ya que se presentaron abundancias bajas en las áreas protegidas. El PNN Sanquianga, ubicado en la zona costera, presentó las mayores abundancias de larvas de la familia Engraulidae (carduma), mientras el PNN Gorgona presentó las mayores abundancias de larvas de peces y el SFF Malpelo presentó las menores abundancias de huevos y larvas de peces, probablemente como una respuesta de los organismos a las altas temperaturas que se presentaron durante noviembre de 2009.
Las principales familias capturadas y representativas de cada área fueron Engraulidae con Cetengraulis mysticetus (PNN Sanquianga), Bregmacerotidae con Bregmaceros bathymaster (PNN Gorgona) y Phosichthyidae con Vinciguerria lucetia (SFF Malpelo). El análisis de comunidad NMS fue muy consistente evidenciando la separación de las áreas en costera para el PNN Sanquianga, intermedia con el PNN Gorgona y oceánica con el SFF Malpelo, mostrando diferencias en los parámetros ambientales que inciden en la distribución y exclusividad en las familias de larvas. Los promedios de temperatura encontrados en el SFF Malpelo sugieren la presencia de una anomalía térmica positiva, evidenciando su influencia sobre el patrón de distribución y disminución de la abundancia de ictioplancton, donde también se encontraron huevos de Engraulidae de distribución pelágica costera, probablemente como un resultado de posibles alteraciones en el sistema de corrientes en el Pacífico colombiano, donde esta familia pudo desplazarse a zonas no habituales en su distribución.
AGRADECIMIENTOS
A los funcionarios de las áreas protegidas Sanquianga, Gorgona y Malpelo por el apoyo brindado durante las salidas de campo. A los administradores de las áreas por el apoyo logístico durante las expediciones científicas. A Parques Nacionales, Fundación Malpelo, WWF Colombia y Conservación Internacional por el apoyo brindado a través de los diferentes proyectos de cooperación. A las otras entidades participantes de los proyectos y sus respectivos investigadores, por el apoyo brindado. A Julio Herrera y Francisco Álvarez por el apoyo en el análisis estadístico. A Luis Zapata (WWF-Colombia) por la revisión del manuscrito. A Leydi Cuadros (WWF-Colombia) por la elaboración de los mapas.
REFERENCIAS
Beltrán-León, B.S. 1992. Identificación y descripción de los tipos de huevos, larvas y post-larvas de Engraulidos y Clupeidos (Pisces, Clupeiformes) en el Pacífico colombiano febrero-marzo de 1991. Tesis Biol. Énfasis Mar. Univ. Valle, Cali. 134 p. [ Links ]
Beltrán-León, B. S. 2002. Changes in the distribution, abundance, and spawning season of the anchovy Cetengraulis mysticetus, in the Pacific Ocean off Colombia during the Events of El Niño and La Niña. Invest. Mar., 30(1): 106-107. [ Links ]
Beltrán-León, B. S. 2007. Caracterización del ictioplancton en el transecto Buenaventura-Malpelo. En: DIMAR-CCCP y Uaespnn-DTSO (Eds). Santuario de Fauna y Flora Malpelo: descubrimiento en marcha. Serie Publ. Esp. DIMAR, 5: 73-96. [ Links ]
Beltrán-León, B. S. y R. Ríos. 2000. Estadios tempranos de peces del Pacífico colombiano. Instituto Nacional de Pesca y Acuicultura INPA, Buenaventura. 727 p. [ Links ]
Beltrán-León, B. S ., G. E. Ramos, J. C. Escobar y J. A. Tovar, 1994. Distribución y abundancia de huevos y larvas de Opisthonema spp. (Gill 1961) y Cetengraulis mysticetus (Günther 1866) (Pisces: Clupeiformes) en el Pacífico colombiano, durante enero de 1993. Bol. Cient. INPA, 2: 181-199. [ Links ]
BAC.2009. Comisión Permanente del Pacífico Sur (CPPS), Boletín de alerta climático. http://www.inocar.mil.ec/boletin/BAC/bac226.pdf. [ Links ]
Chávez, F.P. 1987. El Niño y la Oscilación del Sur. Invest. Cienc., 128: 46-55. [ Links ]
Chávez, F.P. 1996. Forcing and biological impact of onset of the 1992 El Niño in central California. Geophys. Res. Lett., 23: 265-268. [ Links ]
Chirichigno, N. 1998. Clave para identificar los peces marinos del Perú. 2a ed. IMARPE Pub. Especial. El Callao. 496 p. [ Links ]
Connoly, S.R. and J. Roughgarden. 1999. Increased recruitment of northeast Pacific barnacles during the 1997 El Niño. Limnol. Oceanogr., 44: 466-469. [ Links ]
Devis-Morales, A., W. Schneider, R.A. Montoya-Sánchez and E. Rodríguez-Rubio. 2008. Monsoon-like winds reverse oceanic circulation in the Panama Bight. Geophys. Res. Lett., 35: L20607. DOI: 10.1029/2008GL035172. [ Links ]
Escarria, E., B. Beltrán-León and A. Giraldo. 2007. Ichthyoplankton in the Nacional Natural Park Isla Gorgona (Pacific Ocean of Colombia) during September 2005. Invest. Mar., 35(2): 127-133. [ Links ]
Franco-Gordo, C., E. Godínez-Domínguez, A.E. Filonov, I.E. Tereshchenko and J. Freire. 2004. Plankton biomass and larval fish abundance prior to and during El Niño period of 1997-1998 along the central Pacific coast of México. Progr. Oceanogr., 63: 99-123. [ Links ]
Giraldo, A. 2008. Variabilidad espacial de temperatura, salinidad y transparencia en el ambiente pelágico del PNN Gorgona durante septiembre 2007 y marzo 2008. Bol. Cient. CIOH, , 26: 157-163. [ Links ]
Giraldo, A., E. Rodríguez-Rubio y F. Zapata. 2008. Condiciones oceanográficas en isla Gorgona, Pacífico oriental tropical de Colombia. Lat. Am. J. Aquat. Res., 36(1), 121-128. [ Links ]
Giraldo, A ., B. Valencia, J.D. Acevedo y M. Rivera. 2014. Fitoplancton y zooplancton en el área marina protegida de isla Gorgona, Colombia, y su relación con variables oceanográficas en estaciones lluviosa y seca. Rev. Biol. Trop vol. 62 suppl.1 [ Links ]
Hesterberg, T. C. 2015. What teachers should know about the bootstrap: resampling in the undergraduate statistics curriculum. Am. Stat., 69 (4): 371-386. https://doi.org/10.1080/00031305.2015.1089789. [ Links ]
Hopcroft, R.R., C. Clarke and F.P. Chávez. 2002. Copepod communities in Monterey Bay during the 1997-1999 El Niño and La Niña. Progr. Oceanogr., 54: 251-264. [ Links ]
Lavaniegos, B.E., L.C. Jiménez-Pérez and G. Gaxiola-Castro. 2002. Plankton response to El Niño 1997-1998 and La Niña 1999 in the southern region of the California Current. Progr. Oceanogr., 54: 33-58. [ Links ]
Levinton, J.S. Marine biology: function, biodiversity ecology. Oxford University Press, New York. 515p. [ Links ]
López-Peralta, R.H. 1984. Descripción y abundancia del ictioplancton entre 0 y 10 m de profundidad para el Pacífico colombiano (nov. 1982). Tesis Biología Marina. Univ. Jorge Tadeo Lozano., Bogotá. 218 p. [ Links ]
Mann, K.H. and J.R. Lazier. 1996. Dynamics of marine ecosystems: biological-physical interactions in the oceans. Blackwell Science, Boston. 394p. [ Links ]
Martínez-Aguilar, T. I., A. Giraldo y E. Rodríguez-Rubio. 2010. Ictioplancton en la zona costera del Pacífico colombiano durante la fase terminal de El Nino 2006 2007. Lat. Am. J. Aq. Res., 38(1):151-166 DOI: 10.3856/vol38-issue1-fulltext-14 [ Links ]
Moser, G. (Ed.) 1996 The early stages of fishes in the California Current Region. CalCOFI, Atlas No. 33. 1505 p. [ Links ]
Rodríguez-Rubio, E. y A. Giraldo. 2011. Características oceanográficas en la isla Malpelo y su relación con la cuenca oceánica del Pacífico colombiano. Bol. Invest. Mar. Cost. 40 (Supl. Esp.): 19-32. [ Links ]
Rodríguez-Rubio, E ., W. Schneider and R. Abarca del Río. 2003. On the seasonal circulation within Panama Bight derived from satellite observations of winds, altimetry and sea surface temperature. Geophys. Res. Lett., 30: 1410-1413. [ Links ]
Rueda-Montenegro, C. y B. Beltrán-León. 1992. Ictioplancton de las familias Clupeidae y Engraulidae en el litoral pacífico colombiano. Mem. VIII Sem. Nal. Cienc. Tecnol. Mar Congr. Centroam. Car. Cienc. Mar, Santa Marta. 785-743 p. [ Links ]
Smith, L. y S. Richardson. 1979. Técnicas estándar para prospecciones de huevos y larvas de peces pelágicos. FAO. Doc. Tec. Pesca, 175, 107 p. [ Links ]
Stevenson, N., O. Guillén and J. Santoro. 1970. Marine atlas of the Pacific coastal waters of South America. Univ. Calif. Press. 23 p. [ Links ]
Swearer, S. E., J. E., Caselle, D. W. Lea and R. R. Warner. 1999. Larval retention and recruitment in an island population of coral-reef fish. Nature, 402: 799-802. [ Links ]
Welch, B.L. 1951. On the comparison of several mean values: An alternative approach. Biometrika, 38: 330-336. [ Links ]
Zapata, L., J. Herrera, B. Beltrán-León, P. Jiménez, L. Prieto, C. Guevara-Flecher y E. Zambrano. 2011. Estado actual de la pesquería de pequeños pelágicos en el Pacífico colombiano; 157-173. En: Díaz, J.M., C. Vieira y G. Melo (eds.), Diagnóstico de las principales pesquerías del Pacífico colombiano. Fundación Marviva - Colombia, Bogotá. [ Links ]
Zapata, L . A., B. S, Beltrán-León, J. C. Herrera, P. Jiménez-Tello, L. M. Prieto, R. A. Baos, C. E. Guevara and E. Zambrano. 2013. Evaluation of the current state of small pelagic fisheries in the Colombian Pacific: ensuring the sustainability of the resource and evaluating its response to climate events. Adv. Goesci., 33: 63-68. [ Links ]
Recibido: 25 de Julio de 2020; Aprobado: 05 de Mayo de 2021











 text in
text in