INTRODUCCIÓN
El constante crecimiento poblacional de la humanidad permite el desarrollo de nuevos mercados, en diferentes sectores económicos (Puerto Becerra, 2010). Es el caso del sector frutícola, donde se reflejó un incremento de la producción de 3,8 %, entre 2017 y 2018, siendo Asia, América Latina y África, las tres regiones principales productoras del mundo, lo cual, obedece al aumento del área cosechada (Molina, 2016; FAO, 2020). Se estima que para el periodo comprendido entre el 2019 y el 2028, se tendrá un crecimiento mesurado, aproximadamente, del 2,8 % en promedio, encabezando la lista las frutas tropicales, como el mango, la piña, la papaya, el aguacate, las pasifloras y los cítricos (Orrego et al. 2020; FAO, 2020).
En Latinoamérica, Colombia es el segundo país productor de frutas tropicales, debido a su ubicación geográfica y a la variedad de frutas disponibles, que exhiben excelentes cualidades sensoriales, nutricionales o nutracéuticas (Molina-Hernández et al. 2019). Entre las frutas tropicales con gran importancia comercial, se encuentra el maracuyá (Passiflora edulis fo. flavicarpa, Degener 1932), que pertenece a la familia Passifloraceae (Cañizares Chacín & Jaramillo Aguilar, 2015; Molina-Hernández et al. 2019). Esta familia posee entre 17 a 25 géneros, dentro de los cuales, Passiflora resulta ser el más numeroso e importante en la economía, ya que agrupa, aproximadamente, 575 especies (Ocampo et al. 2010).
Los principales productores de maracuyá, a nivel mundial, son Brasil, Ecuador, Colombia y Perú con, aproximadamente, 805.000 t/año (Passionfruit, 2021). En Colombia, esta fruta fue introducida a inicio de los 60´s y en 2019, la superficie dedicada a este cultivo fue de 8.164 hectáreas, con una producción de 137.622 toneladas y un rendimiento promedio de 16.86 ton/ha, de las cuales, el 70 % son destinados a la industria como jugo concentrado para exportación, debido a sus características nutritivas, coloración amarillo-naranja, sabor ácido y aroma exótico (Talcott et al. 2003; Molina-Hernández et al. 2019; Agronet, 2021).
A pesar de la gran demanda que genera esta fruta tropical, uno de los factores limitantes para su desarrollo corresponde al ataque de varios insectos plagas (Menacé Almea et al. 2019). Se reportan en Colombia, las especies, Langsdorfia sp., Diabrotica sp., Hexaleurodicus sp., Trigona sp., Drosophila sp., Agraulis sp., Leptoglossus sp., Tetranychus urticae., Tetranychus mexicanus, Neohydatothrips sp., Dasiops inedulis, Corythucha gossypii, Aphis gossipii, Myzus persicae, Thrips tabaci Lindeman, Frankliniella auripes Hood, Frankliniella occidentalis, Perg., Neohydatothrips signifer Priesner, Ceroplastes cirripediformis, Dione juno juno Cramer, Eveides isabella Huebneri , Polyphagotarsonemus latus, Anastrepha pallidipennis, Drosophila sp., Diactor bilineatus, Agrotis ípsilon, Feltia sp. (Kondo, 2009; Hernández M. et al. 2011; Romero-Ramírez et al. 2018).
Dentro de este complejo de plagas, Ceroplastes cirripediformis Comstock, 1881 (Hemiptera: Coccidae), comúnmente conocida como escama de percebe o tortuguita, es la única especie del género Ceroplastes, reportada en el maracuyá (Kondo, 2009; García et al. 2019); sin embargo, se referencia como una plaga altamente polífaga, capaz de alimentarse de plantas hospedadoras de 119 géneros en 63 familias, en más de 32 países (García et al. 2019), razón por la que, en el 2017, el centro internacional para la agricultura y biociencia (CABI), la designó como una escama invasiva, que causa daños severos a las plantas hospedantes, generando pérdidas económicas sustanciales (Wang et al. 2020). Como la mayoría de los insectos escama, esta especie se caracteriza por su hábito chupador, que inserta su estilete en el floema y otros tejidos de la planta, donde destruye al hospedante, succionando jugo directamente de él y excretando melaza para inducir manchas de carbón. El primer y segundo instar ninfal infestan las hojas de las plantas hospedantes y migran a los tejidos leñosos durante el tercer instar, donde culminan su ciclo de vida (Wang et al. 2020).
Para planificar las estrategias de control, incluidas dentro del manejo integrado de plagas (MIP), es importante conocer cómo se dispersan las poblaciones del insecto plaga en tiempo y espacio (Paz & Arrieche, 2017). Asimismo, resulta esencial tener conocimiento de los atributos que le son inherentes a los sistemas de vida, como son la disposición que presentan en el espacio, las fluctuaciones poblacionales en el tiempo y su relación con las variables meteorológicas (Sánchez-Castro et al. 2016).
En cuanto a la disposición espacial de las poblaciones de insectos es fundamental tener en cuenta la interacción entre la dinámica de la población y los factores bióticos o abióticos (Sciarretta & Trematerra, 2014), debido a que estas interacciones permiten exhibir patrones de distribución en el espacio, ya sea de forma homogénea, aleatoria o agrupada (Fortin et al. 2006). Cada tipo de distribución espacial podría ser el resultado de restricciones medioambientales, como la disponibilidad de recursos, el clima, el tipo de suelo, la entrada de sustancias químicas y la manipulación física en los cultivos, lo que da como resultado, cambios en el paisaje (Hahn et al. 2017). Comprender estos cambios permite analizar cómo las plagas agrícolas se distribuyen espacialmente y qué decisiones de manejo son las más adecuadas (Hahn et al. 2017). Además, se logra optimizar qué medidas de control se pueden dirigir hacia las zonas específicas de infestación, reduciendo el uso de insecticidas, retrasando el desarrollo de resistencia y promoviendo la conservación de enemigos naturales (Pérez-Álvarez et al. 2010).
En relación con lo anterior, se planteó reconocer los diferentes grados de infestación de C. cirripediformis, su distribución espacial y la relación de la distribución espacial con la temperatura y la precipitación, en el agroecosistema maracuyá.
MATERIALES Y MÉTODOS
La investigación, se realizó en un cultivo de maracuyá, establecido en el municipio de Ciénaga de Oro, Córdoba, Colombia (Figura 1), ubicado a 8°49’25,3’’ LN 75°36’12.4’’ LO, con una temperatura promedio de 30,5 °C y humedad relativa de 77 %, lo que permite clasificarlo, de acuerdo con Holdridge (1982), como una zona de bosque seco tropical (Gobernación de Córdoba, 2012).
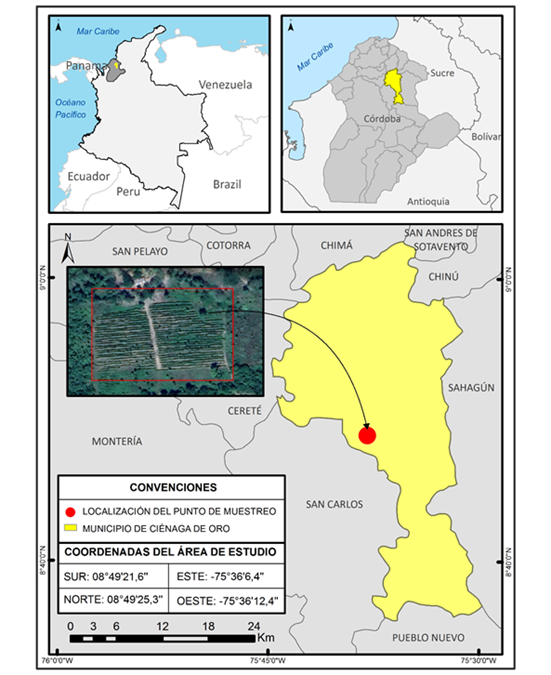
Figura 1 Ubicación geográfica de la zona de estudio (Municipio de Ciénaga de Oro, Córdoba, Colombia).
Escala de daño para C. cirripediformis. Se muestrearon al azar 50 tallos de maracuyá con incidencia de C. cirripediformis. Con el uso de una cinta métrica, se calculó el rango en que fluctúan las poblaciones del cóccido en cada tallo, determinando el intervalo promedio en que oscila C. cirripediformis en tallos. Posteriormente, se contabilizó el número de escamas presentes por cada segmento de tallo, independientemente, del estado de desarrollo del cóccido y se registraron los daños causados por la escama sobre cada una de las estructuras vegetales. En este parámetro, todas las plantas oscilaban con una edad de 18 a 20 meses (etapa reproductiva) y al muestrear no se discriminó el lugar de fijación del insecto en las diferentes secciones del tallo, debido a la ubicación que presenta C. cirripediformis, según el estado de desarrollo.
Con la información obtenida, se construyó una tabla de niveles de severidad, teniendo en cuenta tres criterios: número de individuos presentes por cada grado, longitud de la sección del tallo afectado y caracterización de los daños expresados por cada grado de infestación, lo que permitió evaluar el grado de severidad, por cada punto de muestreo.
Tipo de muestreo. Se procedió a realizar un muestreo sistemático, donde se establecieron puntos específicos, teniendo en cuenta el área del cultivo y la densidad de plantas. Para esto, se utilizó una grilla espacial, donde se seleccionaron seis calles del cultivo y, en cada una, seis puntos de muestreo, a una distancia de 30 m de largo x 18 m de ancho, para un total de 36 puntos. Estos puntos fueron marcados dentro del lote y georreferenciados con un GPS, permitiendo, de esta forma, la ubicación exacta de cada punto dentro del predio. Teniendo en cuenta la escala de daño y el tipo de muestreo establecido, se llevaron a cabo muestreos mensuales donde se registró el grado de severidad de la escama.
Variables evaluadas. Se instaló un termómetro de máximos y mínimos en el cultivo y durante un periodo de 6 meses, se realizó el registro diario de los valores de temperatura, en tres espacios del día (mañana, medio día y tarde). Asimismo, con el uso de un pluviómetro, se hizo registro de cada uno de los valores correspondientes a las precipitaciones ocurridas, durante el desarrollo de la investigación.
Distribución espacial. Con la información recopilada, se realizó una base de datos, donde se registró, mensualmente, el grado de severidad y la abundancia de C. cirripedifomis. Los valores de abundancia obtenidos fueron utilizados para determinar los índices de dispersión, varianza/media, índice de Morisita y exponente K de la binomial negativa, con los cuales, se estimó el tipo de distribución que presentan las poblaciones de la escama.
Para determinar el índice de varianza/media (S2 / x̄), se utilizó la ecuación 1.
Donde, I es el índice de dispersión, s2 la varianza y x̄ es la media. Si los valores de la relación se aproximan a 1, se puede decir que la distribución de la población es completamente aleatorizada; valores de 0 o cercanos a este indican una distribución espacial uniforme y valores mayores de 1 señalan una distribución agregada (Fernandes et al. 2003; Vivas C. & Notz, 2011; Silva et al. 2016).
Para estimar el índice de Morisita (Iδ), se utilizó la ecuación 2.
Donde, Iδ es el índice de agregación, ni es el número de individuos en cada una de las muestras, n el total de individuos en el total de las muestras, N corresponde al número de muestras. Así, cuando Iδ = 1, la distribución es aleatoria; cuando Iδ > 1 la distribución es del tipo contagioso y cuando Iδ < 1 indica una distribución regular (Fernandes et al. 2003; Vivas C. & Notz, 2011; Silva et al. 2016).
Con relación al exponente K de la distribución binomial negativa, se utilizó la ecuación 3.
Donde, K1 es el índice de agregación, x̄ es la media y s2 la varianza. Este parámetro es una medida inversa del grado de agregación, en este caso, los valores negativos indican una distribución regular o uniforme, los valores positivos, cercanos a cero, indican disposición agregada y los valores más altos que ocho indican una disposición al azar (Fernandes et al. 2003; Vivas & Notz, 2011; Silva et al. 2016).
Con el uso de gráficos, se compararon los grados de severidad de C. cirripediformis con las variables de temperatura y precipitaciones. De igual manera, se realizó un análisis de correlación (r de Pearson) en el programa estadístico R versión 4.1.2 (R core team, 2021), entre los factores abióticos y los índices de dispersión evaluados, permitiendo estimar el efecto que pueden tener estas variables sobre los grados de infestación del cóccido, en el transcurso del tiempo.
También, se llevó a cabo la estimación de los datos de abundancia en cada mes por medio del método de interpolación IDW (Distancia Inversa Ponderada), ejecutado en el software ArcGIS 10.1 (Spatial Analyst Tools/Interpolation/IDW) (ESRI, 2012). Realizado este proceso, se elaboraron los respectivos mapas, teniendo en cuenta la reclasificación de la escala de daño de C. cirripediformis por el IDW (< 0 corresponde a ausencia de plantas; valores entre 0 y 0,5, equivalen a grado 0; entre 0,5 y 1,5, equivalen a grado 1; entre 1,5 y 2,5, corresponde a grado 2 y los valores superiores a 2,5, equivalen a grado 3).
RESULTADOS Y DISCUSIÓN
Caracterización de daños y grados de severidad de la escama. La presencia de C. cirripediformis en el cultivo permitió determinar una escala de daño para evaluar la presencia del cóccido en los diferentes muestreos. Se obtuvo que las altas poblaciones del cóccido se agruparon en longitudes, que variaron de 20 a 63 cm, con un promedio de 33,4 ± 9,7 cm y más de 80 individuos, independientemente, del estado en desarrollo del insecto; sin embargo, existían poblaciones con menor cantidad de individuos con relación a la longitud del tallo.
Con base a estas observaciones se establecieron 4 grados de severidad:
Donde el grado 0 se caracterizó por la ausencia del cóccido, presentar tallos sanos y vigorosos de color verde, con haces vasculares en buen estado fisiológico y hojas fotosintéticamente activas sin daños mecánicos.
El grado 1 presentó de 1 a 40 individuos en instar ninfal N3, N4. Los tallos, se caracterizaban por su coloración verde y aún vigorosa. Ante la presencia de la escama, se producen excreciones de miel de rocío, que resultan de gran atracción para agentes fúngicos oportunistas, que producen fumagina sobre la superficie del tallo.
En el grado 2, el número de individuos varía de 41 a 80, notándose la presencia de instares ninfales N3, N4 y adultos. Los tallos mantienen su coloración, aunque las paredes de los tejidos internos son más secas en comparación con el grado 1.
En el grado 3, la población sobrepasa los 81 individuos, con presencia de ninfas N3, N4 y adultos, siendo, este último, de mayor abundancia. La planta presenta exceso de fumagina, tanto en tallos como hojas e, incluso, sobre las mismas escamas, lo que influye en la reducción de la fotosíntesis, daños cosméticos al fruto y otros órganos de la planta. Con el paso del tiempo y la severidad del cóccido, los tallos cambian de coloración, pasando a un color marrón claro, las hojas se vuelven cloróticas y se desprenden, la planta se descompensa, a nivel fisiológico y morfológico, presenta marchitez descendente y posterior muerte (Figura 2).

Figura 2 Presencia de poblaciones de Ceroplastes cirripediformis en tallos de maracuyá Passiflora edulis fo. Flavicarpa.
La descripción de los anteriores grados de severidad coincide con los reportes de Kondo (2009), quién evaluó la severidad de C. cirripediformis en tallo en diferentes lotes de maracuyá, en Palmira, Valle del Cauca, concluyendo que, a un nivel bajo, el control de la escama se puede combatir con podas directas, aplicación de extractos naturales (Aceite de Neem), aspersiones adecuadas de productos químicos y monitoreo constante.
Al comparar los grados de severidad con los factores de temperatura y de precipitación, se obtuvo que la precipitación es un factor de regulación de la escama en el maracuyá, dado que las abundancias de éstas, registradas hasta el mes 4, fueron disminuyendo en los meses 5 y 6, donde se presentaron lluvias hasta el punto de no registrar individuos, en 10 puntos de muestreo (Figura 3).
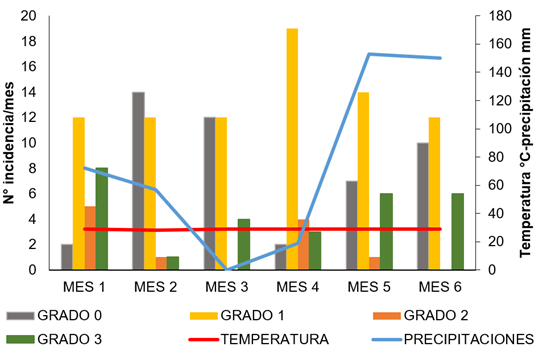
Figura 3 Influencia de los factores abióticos sobre los grados de severidad de Ceroplastes cirripediformis en tallos de maracuyá Passiflora edulis fo. flavicarpa. (Mes 1: diciembre, Mes 2: enero; Mes 3: febrero, Mes 4: marzo, Mes 5: abril, Mes 6: mayo).
Al correlacionar este factor abiótico con los índices de dispersión evaluados, se determinó que el índice de dispersión (0,32) y el índice de Morisita (0,09), se asociaron positivamente presentando una correlación directamente proporcional, es decir, a medida que aumentan las precipitaciones el estado de agregación se mantiene en las poblaciones de C. cirripediformis; no obstante, el índice de la binomial negativa (-0,19), se asoció negativamente en relación con la precipitación, por lo que, a medida que aumenta este factor, los valores de este índice se acercan a cero, manteniendo una distribución en agregado; sin embargo, si los valores pasan de cero a valores negativos, se vería reflejada una distribución regular en las poblaciones del cóccido, incidiendo, notablemente, esta variable sobre el número de individuos o el ciclo de vida de la especie (Tabla 1).
Tabla 1 Matriz de correlación de las condiciones ambientales evaluadas de temperatura y de precipitación y los índices de dispersión, Morisita y binomial negativa.
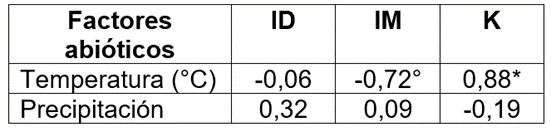
*: Diferencias al 5 %; °: Diferencias al 10 %.
Lo anteriormente descrito, coincide con los resultados reportados por Urías-Lopez et al. (2010), quienes indicaron que poblaciones de Aulacaspis tubercularis Newstead en huertos comerciales de mango, disminuyó en julio y agosto, donde el factor precipitación osciló de 316 a 459 mm, lo que produjo un descenso drástico de las poblaciones del insecto.
Por otro lado, las temperaturas reflejadas durante los meses evaluados se comportaron de manera constante. De acuerdo con la correlación de Pearson entre la temperatura y los índices de dispersión evaluados, este factor se asoció negativamente con el índice de dispersión (-0.06) y Morisita (-0.72), lo que indica que son inversamente proporcionales. Por tanto, si aumenta la temperatura disminuye el estado de agregación de C. cirripediformis, pudiendo pasar a una distribución aleatoria o uniforme, debido al efecto que esta variable ejerce sobre las poblaciones del cóccido. Por el contrario, la temperatura se asoció positivamente con el índice de distribución binomial negativa, comportándose directamente proporcional a esta variable, lo que demuestra que, al aumentar o disminuir la temperatura y los valores del índice de la binomial negativa, las poblaciones se alejan de un estado de agregación, reflejando una distribución, de acuerdo con las condiciones de temperatura presente y el número poblacional de la especie.
Por tanto, la temperatura es un factor que puede influir en la distribución de C. cirripediformis al igual que en su tasa reproductiva, ya que, a temperaturas cálidas, tiende a disminuir la duración del ciclo de vida y, a su vez, aumenta la tasa reproductiva de la escama, tal como lo demuestran Marín-Loayza & Cisneros-Vera (1995), al comparar la duración del ciclo de vida de C. cirripediformisk, en época de verano e invierno. Asimismo, Abd-Rabou et al. (2009) y Robayo Camacho & Chong (2015) reportaron que, a una mayor temperatura, Saissetia coffeae (Walker) alcanzó una menor duración del ciclo de vida, resultados que coinciden con los obtenidos en esta investigación, para los meses 3 y 4 (Figura 3).
Distribución espacial. La escama del maracuyá, bajo las condiciones del municipio de Ciénaga de Oro, Córdoba, registró una distribución en agregado, corroborado con los diferentes índices de dispersión evaluados (Tabla 2). Dicha distribución se confirma, puesto que los valores obtenidos para los índices de varianza/media y Morisita son superiores a uno, como fue descrito por Silva et al. (2016). De la misma forma, con la X2 y F, se corrobora que el índice varianza/media y Morisita, respectivamente, reflejaron una distribución en agregado en las poblaciones de C. cirripediformis, durante los meses evaluados. Con relación al avance de las fechas de muestreo el valor de K fue más cercano a cero, lo que evidencia un mayor grado de agregación, como lo referencian Vivas C. & Notz (2011), Silva et al. (2013) y Silva et al. (2016) (Tabla 2).
Tabla 2 Medias (m), varianzas (S2), índices de dispersión (I, razón varianza/media), índice de Morisita (Iδ) y exponente K de la distribución binomial negativa de la abundancia del insecto plaga Ceroplastes cirripediformis en un cultivo de maracuyá Passiflora edulis fo. flavicarpa en el municipio de Ciénaga de Oro, Córdoba, Colombia.
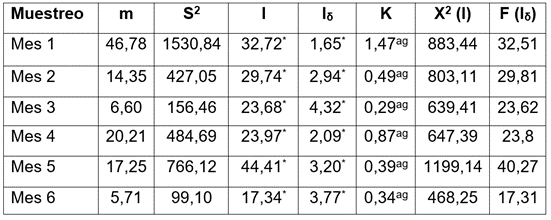
*: Significativo al 5 %; ag: Agregado.
La distribución descrita para esta especie puede estar atribuida a los factores abióticos estudiados. Autores, como Badii et al. (2011) y Silva et al. (2016), consideran que esta distribución puede obedecer a diferentes factores bióticos o abióticos, como microclimas (temperatura, humedad o viento), el desarrollo de huevos en masas debajo de la capa cerosa de la madre, preferencia por ciertos tejidos de la planta por parte de ninfas y adultos, respuestas a feromonas o parasitismo diferencial.
Por otro lado, es importante resaltar que la presencia de altas poblaciones del cóccido en ciertos puntos del agroecosistema genera competencia intraespecífica, lo que provoca que las poblaciones del insecto se dispersen hacia los alrededores, generando una distribución escalonada de los grados de severidad dentro del cultivo que, en el tiempo, se manifiesta en una infestación generalizada. En razón a lo anterior, se sugiere realizar un monitoreo constante, la ubicación de los primeros focos de mayor incidencia de la escama y el manejo oportuno, a través de podas de remoción, destrucción de tejido vegetal removido, eliminación de arvenses hospederas, uso de productos selectivos, entre otros. Esquivel Higuera & Jasso García (2014) y Silva et al. (2016) registraron distribución espacial en agregado del gusano soldado Mythimna unipuncta y de Vatiga spp., en cultivo de maíz y e yuca, respectivamente, para lo cual, sugirieron basar la reducción poblacional de estos insectos, mediante la focalización de estrategias de manejo hacia puntos específicos o focos de infestación.


















