INTRODUCCIÓN
La familia Cucurbitaceae, se caracteriza por su alta diversidad botánica, con alrededor de 825 especies y 118 géneros, de los cuales, Citrulus, Cucumis, Sechium, Lagenaria, Luffa y Cucurbita son los más relevantes y Cucurbita, el más importante. En este género se destacan las especies domesticadas: Cucurbita argyrosperma Huber, C. ficifolia Bouché, C. maxima Duchesne, C. pepo L. y C. moschata (Duchesne ex lam) Duchesne ex Por, donde C. moschata es la más extendida en América tropical, desde México hasta el Perú (Rodríguez R. et al. 2018).
C. moschata se conoce como zapallo o ahuyama, una hortaliza que presenta frutos carnosos tipo baya (baciforme), su pulpa es anaranjada, con altos contenidos de vitamina A, en forma de carotenos totales α y β (535 μg/g), contenido alto de proteína cruda (14,5 %) y minerales, como calcio, hierro y fósforo, características atractivas en términos nutricionales, tanto para consumo humano como fruto fresco y como fruto procesado en el diseño de raciones para animales (Ortiz Grisales et al. 2013). Este fruto presenta un alto número de semillas, que varía entre 300 a 700 semillas (Ortiz Grisales et al. 2015), las cuales, se pueden considerar como oleaginosas, ya que alcanzan un 43 % de grasa bruta (Ortiz Grisales et al. 2009), mostrando contenidos de aceite, que van desde el 30 al 50 %, según la especie (Singh & Kumar, 2021; Valdés Restrepo et al. 2014). Son fuente de proteína y grasa poliinsaturada, que estimulan el metabolismo de las grasas acumuladas (Achilonu et al. 2018). Se suelen emplear como diurético, vermífugo, tónico estomacal, antihelmíntico, para curar asma bronquial y algunas enfermedades de la piel (Ortiz Grisales et al. 2015).
El color del mesocarpio en las cucurbitáceas es un rasgo agronómico importante para determinar el contenido de carotenoides (Luo et al. 2021), los cuales, se presentan en una alta concentración en estas plantas, especialmente, el α y β caroteno. Los carotenos son importantes en la dieta humana, debido a que se ha demostrado que bajos contenidos de carotenoides, en especial, α-caroteno aumenta el riesgo de asma en niños (Khalil et al. 2021).
Según el anuario estadístico de la Faostat para el 2020, a nivel mundial, se produjo un total de 28 millones de toneladas de cucurbitáceas, incluyendo, zapallos, calabazas y calabacines, donde el 60 % de la producción mundial se registró en Asia, con una participación 7.433.743 t, 5.113.692 t y 1.268.270 t, proveniente de China, India y Ucrania, respectivamente, seguido de Europa con un 17,5 % y América con 11,9 % donde Colombia participa con 147.684 t, aproximadamente (FAOSTAT, 2020).
En Colombia, la mejor producción de zapallo se encuentra en Santander, con 15.089,50 t, seguido de Cesar, con 10.256 t, Valle del Cauca, con 8.551,85 t, Huila, con 7.368,50 t y Bolívar, con 5.698 t, alcanzándose rendimientos de 17 t/ha (Agronet, 2018), cuyo valor estimado en el mercado por tonelada en 2016 fue de 345 USD (FAOSTAT, 2020).
En el Valle del Cauca, cerca del 80 % de los cultivos de zapallo son establecidos con variedades mejoradas, como el cultivar “Unapal-Bolo Verde”, ampliamente conocido por agricultores y comercializadores; los frutos de esta variedad, en el momento de la cosecha, alcanzan un peso entre 2,5-4,0 kg, con un rendimiento de 30 t/ha (Estrada S. et al. 2004); n obstante, investigaciones del programa de hortalizas de la Universidad Nacional de Colombia generaron otras cuatro variedadesn con características agronómicas sobresalientes, “Unapal-Llanogrande”, con rendimientos experimentales de 18,9±6 kg/planta (Estrada Salazar et al. 2010), “Unapal-Dorado”, de rendimiento 15 kg/planta, contenido de materia seca mayor al 16 % (Vallejo C. et al. 2010), “Unapal-Mandarino”, con rendimiento de 4 kg/planta y “Unapal Abanico 75”, cuya producción por planta oscila en 29 a 32 kg/planta, peso promedio del fruto entre 5-6 kg, materia seca 24-26 % (Baena García et al. 2010).
Algunas especies, como C. moschata, C. máxima y C. pepo, presentan tonalidades de colores que van del amarillo intenso al naranja, lo que ha revelado altos niveles de carotenoides, principalmente, α y β-caroteno, β-criptoxantina, luteína y zeaxantina (Rodríguez-Amaya et al. 2008; Jaeger de Carvalho et al. 2012). Su importancia va más allá de alimentación humana; los residuos de zapallo o ahuyama son empleados para alimentación animal por su contenido nutricional, antioxidantes y pigmentos, que podrían mejorar la calidad de la carne, la leche y los huevos, que contribuyen a la nutrición (Valdez-Arjona & Ramírez-Mella, 2019), debido a que los animales no pueden sintetizar carotenoides y deben obtenerlos de los alimentos (Cho et al. 2018).
Por la anterior, esta revisión estudia la ruta carotenogénica y los pigmentos predominantes en la pulpa de zapallo, por ser esta una de las hortalizas con mayor contenido de carotenoides.
MATERIALES Y MÉTODOS
Se realizó una revisión documental que permitió reunir lo más reciente sobre el estudio de carotenogénesis y pigmentos en cucurbitáceas; una temática que causa interés debido a su importancia en la ruta metabólica de varios procesos de síntesis. Se consultaron libros y artículos científicos en áreas de estudio, como ciencia, tecnología e ingeniería, en una franja comprendida entre el 2004 y 2022, que abarca literatura sobre la historia de las cucurbitáceas, cultivares en Colombia, importancia de los carotenoides, especialmente, de α y β caroteno, así como la acumulación y la regulación de la biosíntesis de carotenoides; la información se ordenó, de acuerdo con los aspectos más relevantes para la temática siguiente, un patrón lógico de trazabilidad. Se consultaron base de datos, como Scopus, Google académico, ScienceDirect y SciELO, las cuales, fueron seleccionadas de acuerdo con los apartados, palabras clave y relevancia en la temática; en la relevancia de los textos se tuvo en cuenta la argumentación e información científica.
RESULTADOS Y DISCUSIÓN
Importancia de los carotenoides. El color del fruto u hortaliza es un indicador sensorial fundamental, como estándar de calidad para consumo en fresco, tanto para su comercialización como para el consumidor (Lado et al. 2018; Abbas et al. 2020); el color de los frutos está determinado, principalmente, por la composición de los carotenoides, presentes en los tejidos fotosintéticos de las plantas y contribuyen a las funciones de fotorrecepción de luz, mediante la absorción, en el rango de 450-570 nm (Ruiz-Sola & Rodríguez Concepción, 2012) y fotoprotección contra el exceso de luz; sirven para mejorar la eficiencia de las reacciones de luz fotosintética, que absorben fotones en la región azul-verde del espectro solar y transfieren la energía absorbida a la clorofila (Hashimoto et al. 2016). Además, los carotenoides actúan como precursores de moléculas de señalización y forman fitohormonas, como el ácido abscísico y estrigolactonas, que regulan el desarrollo y la interacción de las plantas con su entorno (Giuliano, 2014). A su vez, los carotenoides son precursores de moléculas, como los apocarotenoides, importantes en las interacciones entre planta y ambiente, contribuyen al sabor, aroma de las flores y frutos, características que pueden cambiar dependiendo del cultivar y de la especie (Ortiz Grisales et al. 2020), participan en la atracción de polinizadores, agentes de dispersión de semillas y en la defensa contra patógenos y herbívoros, siendo el licopeno, el β-caroteno y la zeaxantina los principales precursores de la apocarotenoides (Moreno Beltran & Stange, 2016).
En los tejidos animales también están presentes, donde actúan como antioxidantes y ayudan a reducir enfermedades crónicas, cardiovasculares, oculares y cáncer (Fiedor & Burda, 2014). Además, son precursores para la biosíntesis de vitamina A; según Thorne-Lyman & Fawzi (2012), la deficiencia de esta vitamina aumenta el riesgo de contraer enfermedades infecciosas, como el sarampión, la malaria y la diarrea, siendo más común en niños y puede causar ceguera (Jang et al. 2016). Por esta razón, los carotenoides se emplean como colorantes en la industria alimentaria, aditivos para raciones de animales (dietas para salmónidos y camarones) y nutraceúticos de uso animal y humano (Zhang et al. 2016).
Fisiología de la ruta fotosintética hasta α- y β-carotenos. En las plantas, la luz destinada para el proceso fotosintético es absorbida por dos tipos de pigmentos: clorofilas y carotenoides, el espectro de absorción de este último oscila entre 400 y 500 nm. (Azcón-Bieto & Talón, 2008). Los carotenoides están compuestos por cuarenta átomos de carbono (C40), son una clase de isoprenoides, en su mayoría terpenoides, son moléculas lipofílicas que proporcionan a los frutos y vegetales el color rojo, naranja y amarillo (Yuan et al. 2015; Sun et al. 2022), se sintetizan mediante una ruta lineal, desde fitoeno a licopeno y se bifurca en α- y β-carotenos ciclados (Alagoz et al. 2018), pueden estar asociados a ácidos grasos, proteínas, azúcares y otros compuestos, que hace que influyan en sus funciones biológicas (Rodríguez-Concepción et al. 2018). La biosíntesis y almacenamiento de los carotenoides ocurre en los plastidios y existen varios tipos de plastidios, como los proplastidos, etioplastos, cloroplastos, amiloplastos y cromoplastos, todos tienen la capacidad de producir carotenoides, excepto los proplastidos (Li et al. 2016; Feder et al. 2019).
En los carotenoides cuando se presenta un grupo oxigenado, se denominan xantofilas, mientras que, en los hidrocarburos sin oxígeno, carotenos. Los principales carotenoides presentes en el cloroplasto son el α-caroteno, el β-caroteno y cinco xantofilas: luteína, violaxantina, anteraxantina, zeaxantina y neoxantina (Azcón-Bieto & Talon, 2008). La biosíntesis de los carotenoides empieza en la ruta del metileritritol difosfato (MEP), en donde la fitoeno sintasa (PSY) es una importante enzima limitante de la velocidad en la ruta biosintética de carotenoides, siendo la primera enzima comprometida en la carotenogénesis (Cao et al. 2019). Posteriormente, las desaturaciones e isomerizaciones de la SPY producen licopeno de color rojo, que se cicla y forma β y α carotenos, que se metabolizan a xantofilas (Moise et al. 2014).
Regulación de la biosíntesis de los carotenoides. La biosíntesis de los carotenoides ocurre en los plastidios de las plantas, involucrados en su estabilidad, actividad carotenogénica y diversidad de pigmentos (Sun et al. 2017). Se sintetizan por dos vías independientes: la vía del ácido mevalónico (MVA) y la vía plastidios o metileritritol difosfato (MEP). En la vía MEP (Figura 1), mediante enlaces carbono, se produce el isopentenil difosfato (IPP) y su isómero dimetil-alil difosfato (DMAPP), como molécula iniciadora y la enzima geranilgeranil difosfato sintetasa (GGPS); la sintetasa condensa tres moléculas de IPP y forma, como producto, geranilgeranil difosfato (GGPP), siendo el punto de inicio de la ruta de biosíntesis de los carotenoides (Camagna et al. 2019). A partir de ahí la enzima fitoeno sintetasa (PSY) cataliza la condensación de dos moléculas de GGPP, que produce 15-cis-fitoeno, siendo un caroteno lineal incoloro (primer caroteno C40); posteriormente, suceden una serie de reacciones de desaturación e isomerización (cuatro en total), catalizadas por la enzima fitoeno desaturasa (PDS); a través de la desaturación, se produce 9, 15,9’ tri-cis-ζ-caroteno. Posteriormente, se presenta una isomerización causada por ζ-caroteno isomerasa (Z-ISO), a la forma trans, que genera 9,9’ di-cis-ζ-caroteno, de nuevo actúa otra enzima ζ -Caroteno desaturasa (ZDS) introduce dobles enlaces en forma cis en los carbonos 7 y 7’ que va a formar prolicopeno (7,9,7’,9’-tetracis-licopeno) y, por último, la enzima caroteno isomerasa CRTISO convierte la configuración cis a la configuración trans. que generará la molécula de licopeno, propiamente trans-licopeno de color rojo (Giuliano, 2014).
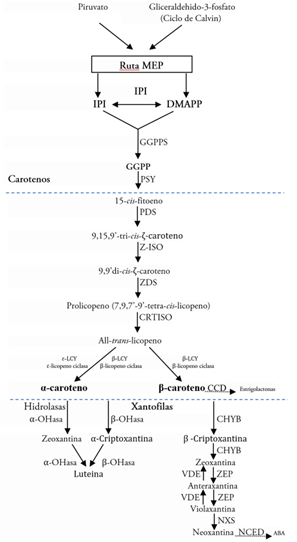
Figura 1 Esquema de la vía metabólica del carotenoide. Adaptado a partir de Yuan et al. (2015) y Sun et al. (2017).
La ciclación del licopeno por la enzima ɛ-licopeno ciclasa (LcyE) y la β-licopeno ciclasa (LcyB) produce las ramas de α-caroteno y β-caroteno de color naranja, carotenoides precursores de vitamina A, abundantes en frutas y en hortalizas, como zanahoria, batata, zapallo, melón y naranja (Yuan et al. 2015); posteriormente, se presenta una hidroxilación en cada rama de α-caroteno y β-caroteno, por dos hidroxilasas diferentes: las hidroxilasas de tipo CHYB (BCH), que hidroxila el anillo β de los carotenos cíclicos y el tipo citocromo P450. De este último, se desprenden las hidroxilasas ε-OHasa y β-OHasa, que hidroxilan los anillos β y ε, respectivamente, lo que genera xantofilas amarillas (Neuman et al. 2014). En la rama de α-caroteno de color naranja es catalizado por hidroxilasas de tipo α-OHasa para producir luteína de color amarillo, abundante en las flores amarillas, como la caléndula (Calendula spp.) y el narciso (Narcissus spp.) y en vegetales de hoja verde oscuro; en la rama de β-caroteno de color naranja es hidrolizado por CHYB, para producir zeaxantina amarilla; esta es epoxidizada por la enzima zeaxantina epoxidasa (ZEP), para producir antheraxantina y luego violaxantina y, finalmente, a través de la enzima neoxantina sintetasa (NXS), en neoxantina (Yuan et al. 2015). La violaxantina se puede convertir de nuevo en zeaxantina, por medio de la violaxantina despoxidasa (VDE) (Neuman et al. 2014; Sun et al. 2017). La vioxantina es utilizada para sintetizar el ácido abscísico, a través de la escisión oxidativa catalizada por 9- cisepoxicarotenoide dioxigenasa (NCED) (Tuan et al. 2019).
Acumulación de carotenoides en cucurbitáceas. La acumulación de carotenoides es un proceso dinámico, a nivel transcripcional de las proteínas estructurales, vías biosintéticas y de degradación, influenciados por la expresión génica y condiciones ambientales (Lu et al. 2017). Una de sus funciones en la planta es intervenir en la recepción de luz, como también elementos de señalización, sus interacciones y la acumulación de carotenoides en diferentes órganos de las plantas (Llorente et al. 2016); a su vez, una de las principales funciones biológicas de los carotenoides está asociada con la protección contra el daño oxidativo (Widomska et al. 2019). Los déficits hídricos al igual que otro tipo de estrés ambiental, tienden a desviar el potencial redox celular a un estado más oxidativo y aumentar la concentración de radicales libres o especies reactivas del oxígeno (ROS) (Radical superóxido, Radical oxidrilo y el peróxido de hidrógeno); la toxicidad de ROS, se debe a sus reacciones con numerosos componentes celulares, que causan una cascada de reacciones oxidativas y la consiguiente inactivación de enzimas, peroxidación lipídica, degradación de proteínas y daño en el ADN (Wang et al. 2012); sin embargo, la planta posee mecanismos antioxidantes, que equilibran la producción de ROS, tales como los compuestos que contienen tiol (glutationa) y ascorbato; vitaminas solubles en grasa (α-tocoferol y β-caroteno) y antioxidantes enzimáticos, como las catalasas, superoxido dismutasa y glutatión peroxidasa (Azcón-Bieto & Talon, 2008). El daño oxidativo se puede estimar midiendo el contenido de prolina, carotenos y clorofila a y b, porque altas cantidades de este osmolito y pigmentos pueden proteger a las plantas del estrés, mediante la desintoxicación de ROS, como también, evidencian el posible daño al aparato fotosintético (Volkov, 2015). Esta resistencia al daño oxidativo, probablemente, varíe según el genotipo, como lo expresan Sarabi et al. (2017), quienes concluyen que las variedades Iraníes “Suski-e-Sabz" y "Ghobadlu" de Melón, presentan mecanismos fisiológicos y bioquímicos frente al estrés por salinidad, mostrando buen contenido relativo de agua (81,52 y 82,55 %), alto índice de estabilidad de la membrana (72,60 y 71,95 %), alta densidad de estomas y tricomas, área foliar, biomasa y concentración de potasio en hojas y tallos; sin embargo, estos genotipos sufren daño oxidativo, dado que producen cantidades bajas de carotenoides (0,07 µg/g) y de clorofila a y b, conforme la concentración de sales en la solución del suelo se incrementa; por otra parte, la enzima catalasa muestra un incremento respecto al testigo, manteniendo bajo al peróxido de hidrógeno.
La acumulación de carotenoides en zapallos puede variar dependiendo del genotipo o del grado de rusticidad del cultivar (Ortiz Grisales et al. 2015). En el caso de las calabazas silvestres, que se producen en la naturaleza y su potencial como fuente de provitamina A, se investiga para ser utilizado en programas convencionales de fitomejoramiento o biofortificación, con el objetivo de aumentar el contenido total de carotenoides y β-caroteno. Jaeger de Carvalho et al. (2012) evaluaron el contenido de carotenoides totales, el α-caroteno, el β-caroteno y sus isómeros, en dos muestras locales A y B de zapallos Cucurbita moschata, para verificar su potencial de producción de semillas. Los resultados mostraron un contenido medio de carotenoides totales de 404,98 μg/g, en la muestra A y 234,21 μg/g, en la muestra B; el contenido de α-caroteno varió de 67,06 a 72,99 μg/g en las muestras A y B, respectivamente; el β-caroteno fue el isómero más abundante encontrado, variando de 244,22 a 141,95 μg/g en las muestras A y B, respectivamente. El contenido de β-caroteno en la muestra cruda A demostró ser prometedor para la producción de semillas para cultivo y consumo. Otros dos genotipos rústicos de C. moschata, “Ariel y Plutón” fueron caracterizados en la investigación de Armesto et al. (2020), con el fin de comparar su desempeño en función del manejo agronómico (convencional y orgánico); las diferencias más importantes se obtuvieron entre los dos cultivares en condiciones de cultivo orgánico, encontrándose que la variedad Ariel posee los niveles más altos de carotenoides (39,53 μg/g), evidenciándose una fuerte correlación entre el color y el contenido de carotenoides.
Ortiz Grisales et al. (2015) evaluaron introducciones de C. moschata a libre polinización S0 y sus líneas S1 y S2 en dos localidades y encontraron un contenido de 600 μg/g de carotenos totales y determinaron que existe una correlación inversa entre materia seca y carotenos totales; a menor contenido de materia seca mayor contenido de carotenos totales.
Las condiciones para el almacenamiento de los frutos son factores clave en la preservación de los carotenoides, donde el principal factor dañino es la temperatura. Al respecto, Song et al. (2018) concluyen que la temperatura de almacenamiento incide sobre la conservación de los carotenoides en productos deshidratados de zapallo, dando como resultado una composición y distribución diferente de los isómeros de carotenoides. El almacenamiento a 4 °C provoca mayor retención de β-caroteno e induce solo ligeros cambios en la distribución de los isómeros. El almacenamiento a 40 °C tiene mayor efecto sobre la pérdida de caroteno y la isomerización de todos los β-carotenos, en comparación con otras condiciones de almacenamiento; la luteína se degradó en menor medida que el β-caroteno y el α-caroteno, en zapallos deshidratados. Según Dutta et al. (2006) concluyen que la temperatura de cocción incide en la degradación, tanto del β-caroteno como del color visual del puré de zapallo, sometido a una temperatura de 60 a 100 °C, durante un período de 0 y 2 horas, presentándose un cambio en el color visual, como manifestación directa del cambio en el contenido de β-caroteno. Esta misma respuesta la reportan Gomes Ribeiro et al. (2015), para la pulpa de zapallo cultivado en Brasil, cocinado a diferentes temperaturas, encontrando una disminución de carotenos en pulpa inversamente proporcional al incremento de la temperatura, disminuyendo la bioaccesibilidad de β-caroteno y α-caroteno. Mendelova et al. (2017) encontraron que el contenido total de carotenoides varía entre los genotipos Liscia, Orange, Hannah, UG 201 F1, Waltham y Serpentine, después del tratamiento térmico de la pulpa; el valor más alto de carotenos lo presenta la variedad Orange, con 97,67 µg/g y el más bajo, Liscia, con 39,01 µg/g. Aa su vez, el mayor contenido de carotenoides totales se encuentra en el genotipo Hannah, con 9,42 µg/g y el más bajo, UG 205 F1 56,55 µg/g; después del tratamiento térmico, se encontró cierta disminución en los carotenoides totales, polifenoles y también en la actividad antioxidante.
La extracción de carotenoides comprende el uso de solventes orgánicos habitualmente combinados con solventes tóxicos; en vista de la creciente preocupación ambiental sobre el uso de solventes orgánicos en la extracción de productos naturales, hay un progresivo interés en la tecnología de separación "verde" (Gueye Rokhaya et al. 2017). Los carotenoides son normalmente extraídos con solventes orgánicos miscibles en agua, como acetona, metanol o etanol; sin embargo, con la introducción de la cromatografía líquida de alto desempeño (HPLC) en el análisis de carotenoides, el tetrahidrofurano está siendo muy utilizado, aunque el método tradicional para separar estos compuestos es la cromatografía descendente en columna (flujo por gravedad auxiliado con trompa de vacío), llamada cromatografía en columna abierta (CCA) (Rodríguez, 2015). Recientemente, se ha experimentado con la extracción con fluido de CO2 supercrítico (SC-CO2), utilizado como un método alternativo a la extracción con solventes orgánicos tradicionales, para extraer carotenoides de materiales agrícolas, debido a sus ventajas, tales como: residuos no tóxicos, procesos no inflamables y ambientalmente aceptables con alta selectividad. Al respecto, Shi et al. (2013) estudiaron el efecto de la extracción supercrítica de CO2 (SC-CO2), en el rendimiento y en la actividad antioxidante de carotenoides de zapallo, encontrando que no existen cambios significativos en las propiedades antioxidantes de los carotenoides extraídos a 50 °C; asimismo, se encontró que la temperatura de funcionamiento de SC-CO2 influye notablemente en la selectividad de los carotenoides, en especial, con la relación de β-caroteno/carotenoides totales; sin embargo, la actividad antioxidante del extracto de carotenoides disminuye después de modificar la temperatura entre 50 a 80 °C. Martínez-Valdivieso et al. (2014) evaluaron el potencial de la espectroscopia de reflectancia del infrarrojo cercano (NIRS), para predecir el contenido total de carotenoides, luteína y β-caroteno, en la piel y pulpa de los frutos de Cucurbita pepo, encontrando que el contenido total de carotenoides y luteína varió de 68 a 428 μg/g, de peso seco y 53 a 421,7 μg/g, de peso seco, respectivamente, en la pulpa de los frutos de C. pepo. El contenido de β-caroteno varió de 1,3 a 23,9 μg/g de peso seco en la pulpa de C. pepo.
Dado que la técnica de extracción de superficie de respuesta (RSM) optimiza el tiempo de tratamiento y la energía, alcanzando un mejor rendimiento en carotenoides al utilizar menos disolvente, Benmeziane et al. (2018) compararon los métodos de extracción de carotenos convencional versus extracción por ultrasonido (EAU), optimizada por la metodología de superficie de respuesta (RSM), de carotenoides en cáscaras de melón, encontraron que los principales carotenoides identificados fueron luteína (63,24 μg/g) y β-caroteno (56,43 μg/g); los resultados de RSM mostraron que el contenido de carotenoides del extracto fue de 124,61 μg/g, mostrándose como un método eficaz para la extracción de carotenoides de los desechos de melón, por lo que se puede concluir, que los residuos de la fruta del melón se pueden utilizar para obtener una serie de compuestos promotores para la salud, los cuales, tienen múltiples usos en la industria alimentaria, como aditivos, edulcorantes, o harina para sopas; en la farmacéutica, como antioxidantes y vitamina A o en la cosmética en, por ejemplo, la elaboración de cremas.
Carotenoides como antidepresivos. En 1964, se evidenciaba que la imipramina y otros antidepresivos tricíclicos eran capaces de inhibir la recaptación presináptica de la noradrenalina (Davinelli et al. 2018); luego, Joseph J. Schildkraut (1965) planteó que la catecolamínica de los trastornos afectivos está relacionada con la noradrenalina (Nad), en la aparición de los cuadros depresivos (Chen & Kotani, 2016). En Inglaterra, el grupo de Copen, en 1972, planteó la hipótesis indolamínica de la depresión, donde destacan el rol de la serotonina como agente regulador principal de este trastorno (Grimmig et al. 2017). En la búsqueda de antidepresivos más seguros, el desarrollo de los inhibidores selectivos de la recaptación de serotonina, tales como fluoxetina, fluvoxamina, paroxetina, citalopram, sertralina, representan un avance significativo, donde, recientemente, se reportan una serie de antidepresivos que mejoran los perfiles de efectos secundarios, con mayor especificidad sobre los distintos sistemas neurotransmisores; no obstante, estos efectos secundarios, como presión alta, hepatotoxicidad, excitabilidad, agitación, insomnio, cuadros confusionales, aumento de apetito, aumento de peso, impotencia y disminución de la libido, sequedad de boca, visión borrosa, retención urinaria, hipotensión ortostática y vértigo (Xuan et al. 2016; Kim & Kim, 2018; Saha et al. 2017), aparte de una incomodidad, representan también una amenaza a la salud del paciente, por tanto, las investigaciones actuales tienen como objeto encontrar alternativas terapéuticas, con menores efectos adversos, en el tratamiento de la depresión.
Kim et al. (2016) encontraron que el β-caroteno de zapallo, empleado en el antidepresivo Sweetme sweet pumpkin (SSP), redujo significativamente los niveles de la noradrenalina (Nad) y un incremento de serotonina en el cerebro de ratones, lo que podría indicar un efecto antidepresivo de SSP y del β-caroteno; asimismo, Dhingra & Bansal (2014) evaluaron la actividad antidepresiva del β-caroteno en ratones albinos machos jóvenes suizos, sometidos a un estrés leve e impredecible crónico, administrando β-caroteno (50 y 100 mg/kg) e imipramina (15 mg/kg), durante 21 días. La mayor dosis (100 mg/kg) de β-caroteno e imipramina disminuyó significativamente el período de inmovilidad de los ratones en la prueba de suspensión de la cola. Estos compuestos restauraron significativamente la preferencia reducida por la sacarosa en ratones estresados. El β-caroteno revirtió significativamente el aumento inducido por el estrés en la catalasa cerebral, monoamino oxidasa (MAO-A), sustancias reactivas al ácido tiobarbitúrico; por lo tanto, el β-caroteno, mostró una actividad similar a la de un antidepresivo en ratones estresados y no estresados, probablemente, a través de la inhibición de MAO-A y el estrés oxidativo. Su actividad antidepresiva en ratones estresados también se podría deber a la disminución de los niveles plasmáticos de corticosterona.
Brown et al. (2018) sugieren que los β-carotenos y la trans astaxantina pueden afectar al sistema serotoninérgico, pero no al sistema de noradrenalina, incrementando los niveles de serotonina en el hipocampo, la corteza frontal, el estriado y el hipotálamo.
La biosíntesis y acumulación en frutos, como el tomate y cítricos, son afectados por la genética y los factores ambientales, pero es determinante factores, como la luz y la temperatura (Lado et al. 2018); sin embargo, hay un principio para la composición de los carotenoides y es que el α-caroteno y el β-caroteno son precursores de provitamina A, mientras que la luteína y la zeaxantina son pigmentos macular de la retina (Norshazila et al. 2014).
La biosíntesis de los carotenoides podría estar relacionada con factores agroambientales (Tuan et al. 2019). Según los estudios realizados por diferentes investigadores, la cantidad de carotenoides es variable; Azevedo-Meleiro & Rodriguez-Amaya (2007), evaluando los principales carotenoides en tres especies de Cucurbita, identificaron que los principales carotenoides en C. moschata fueron β-caroteno y α-caroteno, mientras que la luteína y el β-caroteno predominan en las especies C. maxima y C. pepo, en donde al parecer, la hidroxilación es un punto de control en la biosíntesis de carotenoides. Nakkanong et al. (2012) identificaron que la especie C. moschata acumulaba β-caroteno y α-caroteno y la especie C. máxima, acumulaba violaxantina y luteína de color amarillo en frutos maduros y en concentraciones iguales, debido a la expresión de los genes CHYB y ZEP.
El β-caroteno es considerado el principal carotenoide en la mayoría de las especies, con concentraciones superiores a 70 μg/g (Provesi & Amante, 2015); sin embargo, la sobreexpresión de la enzima PSY mejora el contenido de carotenoides totales y aumenta la síntesis de β-caroteno (Welsch et al. 2010).
La importancia de los carotenoides radica en la participación en diversos procesos fotosintéticos y funciones biológicas; no obstante, los efectos benéficos para la salud y los múltiples usos agroalimentarios, los convierten en un importante aliado para tratar enfermedades degenerativas, como el cáncer; de ahí la investigación y mejoramiento de las cucurbitáceas, como fuente importante de carotenos, las cuales, poseen una amplia variabilidad de colores que van del amarillo al naranja y dependiendo del genotipo y nivel de mejoramiento, varía el contenido de α y β carotenos, siendo los carotenoides predominantes en esta hortaliza.















