Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Perspectivas en Nutrición Humana
Print version ISSN 0124-4108
Perspect Nut Hum vol.10 no.2 Medellín July/Dec. 2008
REVISIÓN BIBLIOGRAFICA
Soporte nutricional en el paciente crítico: una puesta al día
Nutritional support in critical ill patient: bring up to date
Gloria María Agudelo Ochoa1; Nubia Amparo Giraldo Giraldo1
1Profesoras Escuela de Nutrición y Dietética de la Universidad de Antioqia.
Artículo recibido: 26 de septiembre de 2008
Aceptado: 12 de noviembre de 2008
Resumen
Los pacientes críticos presentan alteraciones que se manifiestan en desórdenes clínicos que demandan una atención médica y nutricional oportuna donde el soporte nutricional juega un papel fundamental. El objetivo del artículo fue realizar una puesta al día sobre los avances del soporte nutricional en el paciente crítico. Se revisaron publicaciones en bases de datos sobre tópicos como la selección de pacientes candidatos al soporte, evaluación del estado nutricional, determinación de las necesidades energéticas, tipo de soporte y complicaciones. Entre los hallazgos relevantes se encontró, que pese a los avances en el soporte nutricional, no hay consenso en aspectos como la evaluación nutricional, la cual es difícil y no obstante se dispone de métodos objetivos y subjetivos, ningún indicador aislado tiene la habilidad para determinarlo; igual ocurre con la determinación de los requerimientos energéticos, pues aunque lo ideal sería utilizar la calorimetría indirecta, dadas sus limitaciones se han validado y propuesto varias ecuaciones pero no hay acuerdo en cuál de ellas utilizar. La evidencia recomienda como primera opción el soporte nutricional enteral frente al parenteral y si bien las complicaciones se deben evitar al máximo, cuando se presentan es necesaria identificarlas e implementar las medidas correctivas del caso. En conclusión, el paciente crítico se puede beneficiar ampliamente del soporte nutricional siempre y cuando éste sea implementado en forma oportuna y de acuerdo a sus condiciones clínicas y nutricionales; el soporte nutricional debería ser suministrado por un equipo integral en el cual la participación del nutricionista es fundamental y de gran responsabilidad.
Palabras clave: paciente crítico, soporte nutricional, nutrición enteral, nutrición parenteral, evaluación nutricional, requerimientos de energía.
Abstract
Patients in critical conditions present alterations in organs and metabolic systems that demand an appropriate medical and nutritional support which is fundamental to prevent further deterioration and to improve clinical outcomes. The objective of this review is to bring up to date the current information and publications from scientific databases about the advances in nutritional therapies for critical ill patients; this review is important to conclude that specialized nutritional support can benefit critical ill patients even more when this is implemented opportunely with appropriate technical conditions by professionals. In order to avoid risk of severe complications for these patients, professionals in nutrition must be part of the clinical team giving integral attention to critical ill patients.
Key words: critical patients, nutritional support, enteral nutrition, parenteral nutrition, nutritional assessment, energy expenditure.
INTRODUCCIÓN
La malnutrición en el paciente crítico es un problema común y su consecuencia más importante es el aumento en la morbilidad y mortalidad, la cual se ha asociado con una mayor incidencia de infecciones, retraso en los procesos de cicatrización de los tejidos, disminución en la funcionalidad muscular, aumento de la estancia hospitalaria y mayores costos en la atención (1). Con el propósito de disminuir el riesgo de malnutrición en estos pacientes, el soporte nutricional (SN) es fundamental y debe ser parte de su manejo integral.
Los pacientes en unidad de cuidados intensivos (UCI) casi siempre requieren de SN especializado el cual debe estar a cargo de un equipo multidisciplinario que implemente los protocolos desde la selección del paciente hasta el control ambulatorio, si es del caso (2).
A continuación se presenta una revisión de la información científica disponible sobre el paciente crítico, los métodos para realizar su evaluación nutricional y determinar los requerimientos de energía; luego se describen los aspectos más relevantes del soporte nutricional y las complicaciones más frecuentes de la nutrición enteral y parenteral.
Para esta revisión se utilizó información disponible en las bases de datos Medline y Pubmed, y en los servicios de revistas Science Direct y Ovid, entre otras, consultando tanto artículos recientes como clásicos, además del aporte de las autoras respaldado con la experiencia clínica en el manejo de este tipo de pacientes. Se espera que esta actualización sea un insumo importante para el personal de salud encargado del cuidado del paciente crítico, muy especialmente al nutricionista dietista quien está llamado a liderar los grupos de soporte nutricional, para los cuales la actualización debe ser un asunto del día a día.
Paciente crítico
El paciente en estado crítico presenta una enfermedad aguda o crónica reagudizada que provoca un daño que va desde la limitación funcional de uno o más órganos hasta la muerte (3,4). Los pacientes con lesiones graves como quemaduras, traumatismo, y los que tienen infección documentada, presentan una sucesión de trastornos progresivos que se reflejan en anomalías clínicas, hemodinámicas, metabólicas y funcionales que se conoce como la respuesta inflamatoria (5). Cuando la inflamación aparece en áreas diferentes al sitio de la lesión afectando también tejidos sanos se le llama síndrome de respuesta inflamatoria generalizada (SRIG), que se caracteriza por liberación de citoquinas, enzimas, radicales libres tóxicos y activación de la cascada de complemento. Además, se producen otros cambios como disfunción endotelial progresiva con aumento de la permeabilidad capilar, llevando a alteración de los mecanismos de vasodilatación y vasoconstricción, responsables de la muerte por choque en muchos de los pacientes. El SRIG se caracteriza por hipermetabolismo, gasto cardíaco alto, consumo bajo de oxígeno, saturación alta de oxígeno en sangre venosa, acidosis láctica y balance de líquidos positivo que se acompaña de edemas y disminución de las proteínas circulantes. Una de las hipótesis del origen de este proceso es la falla de la barrera intestinal que permite el paso de las bacterias a los ganglios linfáticos mesentéricos para luego entrar al torrente sanguíneo y colonizar a distancia; a pesar de que esto no se ha demostrado en humanos, es claro, que existe una alteración en la relación simbiótica entre las bacterias intestinales y el huésped, ocasionada por la falta de nutrientes en la luz intestinal, la isquemia mesentérica provocada por la enfermedad o el tratamiento con fármacos vasoactivos que causan cambios en la flora intestinal (6).
Como lo describió Cuthbertson, la respuesta metabólica tiene dos fases: la ''ebb'' y la ''flow'', la fase ''ebb ''se presenta inmediatamente después de la lesión y cursa con hipovolemia, choque e hipoxia; hay disminución del gasto cardíaco, del consumo de oxígeno y de la temperatura corporal. La fase ''flow'' se caracteriza por incremento del gasto cardíaco, consumo de oxígeno, temperatura corporal, y niveles altos de insulina, catecolaminas, glucagón y cortisol (7, 8).
Los pacientes en estado crítico presentan alteraciones metabólicas que incrementan los requerimientos de energía y proteínas (9, 10). El aumento de las proteína de fase aguda se acompaña de una rápida disminución de la masa magra y del aumento del nitrógeno ureico en orina, lo que lleva a balance negativo de nitrógeno. Respecto a los lípidos, hay incremento de la lipólisis con aumento de los ácidos grasos libres circulantes, los cuales pueden ser oxidados a cuerpos cetónicos y utilizados como fuente energética en algunos tejidos o ser resintetizados a triglicéridos. La hiperglicemia es casi una constante en estos pacientes, secundaria a un aumento en la producción de glucosa, a la gluconeogénesis y a valores elevados de hormonas como la epinefrina que disminuye la liberación de insulina (9). El resultado final de todas estas alteraciones es la desnutrición, la cual a su vez incrementa el riesgo de infecciones nosocomiales, deterioro de la función respiratoria y aumento de la mortalidad (11–13).
Evaluación nutricional del paciente crítico
Evaluar el estado nutricional del paciente crítico es un proceso complejo, pues por sí misma la respuesta metabólica a cualquier injuria genera una serie de eventos que deben tenerse presentes al momento de interpretar los resultados. Matarese define la valoración del estado nutricional como un proceso sistemático, continuo y dinámico por medio del cual se obtiene, se confirma e interpreta información relacionada con la condición nutricional de un paciente (14). La ASPEN define como objetivos de la evaluación nutricional identificar deficiencias de nutrientes y determinar la necesidad de reposición, recolectar los datos para formular el plan de atención nutricional, evaluar la adherencia y la respuesta a la terapia nutricional (3).
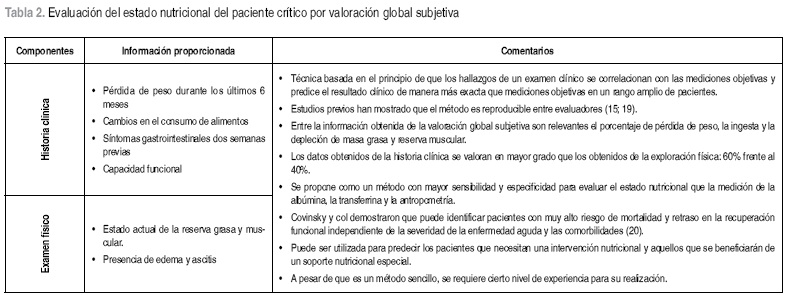
La evaluación del estado nutricional puede ser realizada por métodos objetivos y subjetivos. El método objetivo incluye indicadores directos (antropométricos, bioquímicos, clínicos y funcionales) e indirectos (alimentarios, actividad física, psicosociales); el método subjetivo parte de datos de la historia clínica y del examen físico. En el paciente crítico lo ideal es disponer de la información para realizar una valoración objetiva, sin embargo, las condiciones del paciente, la patología de base y el tratamiento médico, limitan la posibilidad de obtener todos los datos e interpretarlos de manera adecuada. La valoración global subjetiva surge como un método alternativo que ha sido validado en pacientes hospitalizados, mostrando una excelente correlación con medidas objetivas; es sencillo y de bajo costo aunque requiere un mínimo de experiencia en quien la realiza. (15). Desafortunadamente no se ha identificado hasta ahora ''el método ideal'' y ningún indicador aislado tiene la habilidad para determinar el estado nutricional del paciente. La recomendación de Carney y col, es utilizar el método de valoración global subjetiva complementado con el índice de masa corporal y la concentración de albúmina (17). De manera particular, las autoras consideran que estos dos últimos indicadores tienen limitaciones en los pacientes críticos. El registro del peso corporal es difícil de obtener en forma directa y la mayoría de las veces se determina de manera subjetiva llevando a subestimar o sobreestimar dicho parámetro y en consecuencia el resultado final del IMC. Respecto a la albúmina, aunque en el actual Sistema de Seguridad Social es casi el único parámetro bioquímico para evaluar el estado nutricional que incluye el Plan Obligatorio de Salud (POS), es un indicador con desventajas a la hora de su interpretación en el paciente crítico, especialmente por ser una proteína de fase aguda negativa y no reflejar la verdadera condición de la proteína visceral, entre otros factores por la presencia de edema, patología de base, estados post quirúrgicos, etc. De acuerdo a lo anterior, se considera que en medio de las limitaciones, la mejor alternativa para evaluar el estado nutricional de los pacientes críticos sigue siendo la valoración global subjetiva, la cual requiere habilidad por parte del evaluador.
En las tabla 1 y Tabla 2 se presenta un consolidado con los respectivos comentarios de los dos métodos y los indicadores utilizados para evaluar el estado nutricional del paciente crítico.
Determinación de requerimientos de energía en el paciente crítico
El cálculo del gasto energético en los pacientes críticos es fundamental en el tratamiento nutricional. Las investigaciones recientes se han enfocado en suministrar un soporte nutricional óptimo para evitar las complicaciones relacionadas con el exceso o el déficit de energía (21). El aporte excesivo de energía puede llevar a hiperglucemia, disfunción hepática e incremento en la producción de CO2, exacerbando así la insuficiencia respiratoria o prolongando el retiro del ventilador (6) pero un déficit también puede llevar a retraso en la cicatrización de las heridas, alteración de la respuesta inmune y disfunción de los músculos respiratorios (22). Aunque las dietas hipocalóricas en los pacientes críticamente enfermos han mostrado resultados positivos en los estudios retrospectivos (23), la reducción en el aporte de energía y la duración de éste no se conoce (24). En los pacientes de cuidados intensivos, la tasa metabólica puede medirse por tres métodos: calorimetría indirecta, método de Fick y ecuaciones que consideran la edad, el sexo, el peso, la estatura y el grado de injuria/enfermedad (6, 24).
La calorimetría indirecta es considerada el ''gold standard'' y el método preferido para utilizar en estos pacientes por la exactitud; la disponibilidad de instrumentos comerciales portátiles permite hoy día realizar esta medición tanto en pacientes con respiración espontánea como en aquellos en ventilación asistida (25), sin embargo algunos autores consideran que el equipo es costoso, que requiere personal entrenado y su uso es limitado en condiciones metabólicas específicas (26). El método de Fick es invasivo, dado que se requiere la inserción de un catéter para medir el gasto cardíaco, el índice de resistencia vascular sistémico y la presión de la arteria pulmonar por lo que su uso para estimar el gasto energético es poco práctico es (24).
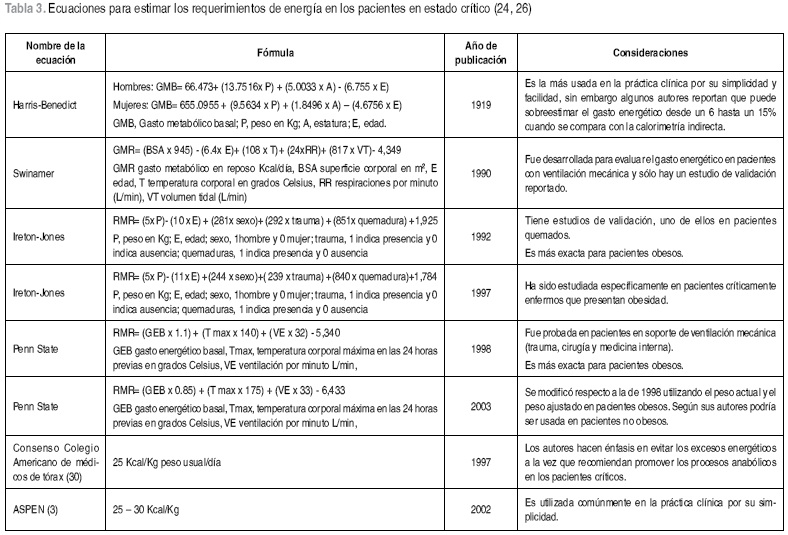
Existen numerosas ecuaciones para determinar el requerimiento de energía en los pacientes hospitalizados, algunas desarrolladas en personas sanas y modificadas para pacientes críticos al multiplicarlas por factores de estrés (27); otras ecuaciones han tenido en cuenta el hipermetabolismo de la enfermedad sin necesidad de utilizar factor de injuria (28). La literatura reporta que las ecuaciones en general pueden subestimar los requerimientos en un 30% o sobreestimarlos hasta en un 50%. (6). A pesar de esto no hay consenso en cual fórmula utilizar para calcular las necesidades de energía en los pacientes críticos y según los resultados de una revisión sistemática, se considera que la validación de la mayoría de las ecuaciones es limitada y para algunas inconsistente, sólo siete ecuaciones mas el método de Fick cumplieron los criterios de validación para incluirlas en el análisis realizado (24). Debido a que los pacientes más hipermetabólicos pocas veces tien en incrementos superiores al 15% del gasto energético basal, la provisión de 25–30 Kcal/Kg/día permite que el 90% de los pacientes alcancen los requerimientos energéticos (29).
Dado que los trabajos de validación de las diversas ecuaciones recomendadas para calcular los requerimientos de energía en los pacientes críticos son limitados, no es posible aconsejar cual debe utilizarse para garantizar mayor exactitud, lo único claro hasta ahora, es que debe evitarse la sobrealimentación por las condiciones metabólicas que exhiben estos enfermos y que la determinación de las necesidades de energía es un proceso dinámico que deberá cambiar según la evolución clínica del paciente. Queda entonces el interrogante de cuál ecuación usar y será necesario esperar nuevos estudios de validación y publicaciones que establezcan recomendaciones basadas en la evidencia científica. En la Tabla 3, se describen algunas de las ecuaciones reportadas para estimar los requerimientos de energía en estos pacientes y algunas consideraciones al respecto.
Soporte nutricional en el paciente crítico
Como lo muestran diversos estudios, en el paciente crítico el SN debería ser considerado un objetivo terapéutico primario y no relegarlo a un segundo plano con la justificación errónea de la gravedad de la patología o la estimación de una escasa expectativa de vida (9, 31). Entre otros el SN ha mostrado beneficios en la curación de las heridas, menor respuesta catabólica al trauma, mejoría en la permeabilidad intestinal, menor incidencia de traslocación bacteriana, disminución en las complicaciones y menor estancia hospitalaria (32–36). El SN se pude definir como el aporte de nutrientes por vías enteral o parenteral con el propósito de alcanzar y/o mantener un estado nutricional adecuado en los pacientes en los que la alimentación normal no se puede realizar (37,38). Factores como el riesgo/beneficio del tratamiento seleccionado para el paciente (34) y la valoración de la función intestinal (39) se deben considerar al momento de tomar la decisión del tipo de soporte a implementar en el paciente crítico.
Soporte nutricional enteral (SNE): se define como el aporte de nutrientes a través de la vía digestiva, utilizando medios diferentes a la alimentación convencional y tiene como propósito contribuir al aporte parcial o total de los requerimientos nutricionales (40). Son candidatos a este tipo de soporte los pacientes que no pueden, no deben o no quieren comer por vía oral pero mantienen un intestino funcionante, incluso se puede intentar en aquellos con una actividad funcional mínima con capacidad absortiva en el intestino delgado (41). Las únicas contraindicaciones absolutas de la NE son la obstrucción, la perforación intestinal y las fístulas de alto débito de yeyuno e íleon (41). Una vez que se ha tomado la decisión de suministrar NE, se debe elegir el acceso más adecuado y la técnica óptima para realizarlo, pues estos son factores fundamentales para lograr los objetivos del SNE y disminuir sus complicaciones. El acceso enteral se define de acuerdo al estado funcional y anatómico del tracto gastrointestinal, estado de conciencia, duración, posibilidad técnica del abordaje y el riesgo de broncoaspiración.
Los accesos se clasifican según el sitio de ubicación en gástricos y yeyunales y según la duración, en temporales y definitivos (41). El acceso gástrico tiene entre otras ventajas, que el estómago tolera volúmenes y osmolaridad altos, lo que permite en ciertas situaciones la administración de la NE en forma intermitente. Su desventaja es el riesgo de reflujo gastroesofágico y la broncoaspiración (39). La sonda nasogástrica es recomendable en pacientes en los cuales se espera un SN menor a seis semanas. La gastrostomía endoscópica o quirúrgica está indicada para pacientes sin contraindicación de NE a estómago y en quienes se espera una duración mayor a seis semanas, o en pacientes con lesiones en esófago y faringe en quienes no es posible un acceso nasal (43). El acceso yeyunal está indicado en pacientes con alto riesgo de broncoaspiración o con retardo en el vaciamiento gástrico. La sonda a yeyuno se recomienda para pacientes en quienes funciona el tracto gastrointestinal pero está contraindicada la vía gástrica y en los cuales se prevé una duración del SNE menor de seis semanas. Es también la elección para pacientes candidatos a nutrición enteral temprana luego de un trauma o cirugía abdominal quienes presentan una alta probabilidad de íleo gástrico (41); para la colación de la sonda a yeyuno se emplean técnicas fluroscópicas, endoscópicas y a ciegas. La yeyunostomía se indica cuando la duración del SNE se prevé mayor a seis semanas y se realiza mediante técnicas quirúrgicas, endoscópicas y laparoscópicas (43).
Respecto al material, las sondas de poliuretano o silicona son mejor toleradas por los pacientes que las de polivinilo. En cuanto al calibre, para uso nasal se recomienda entre 10 y 16 french, para gastrostomías entre 18 y 22 french y para yeyunostomía entre 8 y 10 french (42).
Definidos los accesos, técnicas y sondas, la selección de la fórmula se basará en la condición clínica y metabólica del paciente, la funcionalidad del tracto digestivo, especialmente la capacidad digestiva y absortiva, y las necesidades de energía y nutrientes (39,41,42). Las fórmulas se han clasificado de acuerdo a su composición en poliméricas, las cuales contienen los nutrientes intactos, y oligoméricas en las cuales los nutrientes se encuentran hidrolizados total o parcialmente; también se dispone en el mercado de fórmulas especializadas para algunas patologías y módulos de nutrientes. Además de la composición, es importante tener en cuenta la densidad energética y distribución de macronutrientes de cada fórmula (44). Finalmente se define el sistema de administración que puede ser infusión continua, intermitente, cíclica o por bolos.
El soporte nutricional parenteral (SNP): consiste en el aporte de nutrientes al organismo por vía venosa, de tal forma que éstos llegan directamente al torrente sanguíneo, evitándose el proceso digestivo y el filtro hepático (38). Es una técnica de alto costo con riesgo de complicaciones graves para el paciente, por lo cual está reservada para situaciones muy especiales (45). Son candidatos a este tipo de soporte pacientes incapaces de utilizar el tubo digestivo por más de siete días (Síndrome de Intestino corto, síndrome pilórico), pacientes que requieren una complementación porque la NE no alcanza a cubrir las demandas y pacientes con indicación de reposo intestinal (Colitis ulcerativa grave, pancreatitis aguda grave con hemorragia en sus primeras etapas, fístulas de alto débito) (46). Como desventajas, la NP produce atrofia de la mucosa intestinal por la disminución de la actividad enzimática de los enterocitos, situación que es reversible con la alimentación enteral (9, 34); otra desventaja es su alto costo tanto por los productos como por su preparación y administración (47, 48).
La NP se administra por medio de un acceso venoso central localizado en vena cava superior o inferior, generalmente a través de la vena subclavia, lo cual permite la administración de volúmenes y concentraciones altas de mezclas durante períodos prolongados (46). Respecto a los componentes de la NP, el aporte de proteínas se hace a través de soluciones de aminoácidos cristalinos en concentraciones desde 3,5 al 15%. Los lípidos se administran en emulsiones intravenosas como fuente de energía y ácidos grasos esenciales, para lo cual se precisa de un aporte mínimo entre 4 y 8% del aporte energético diario; están contraindicados en pacientes con hiperlipidemias severas, nefrosis lipoide, alergia severa al huevo y pancreatitis asociada con hiperlipidemia. Se dispone de emulsiones en concentraciones entre el 10 y 20%, preferibles estas últimas con aporte de triglicéridos de cadena larga y cadena media (44). Los carbohidratos constituyen la principal fuente de energía, se utiliza la dextrosa en agua destilada en concentraciones entre el 30 y 50%. Además de los macronutrientes, la solución de NP debe incluir electrolitos, vitaminas y elementos trazas de acuerdo a las necesidades de cada paciente (38).
El SN mixto consiste en la administración simultánea de NE y NP. Está indicada en aquellos pacientes que no alcanzan a cubrir sus demandas de energía y nutrientes sólo con NE; cuando el paciente es candidato a NP pero una mínima parte de su intestino es funcional, se recomienda NE para mantener el trofismo intestinal (48).
Complicaciones del soporte nutricional en el paciente crítico
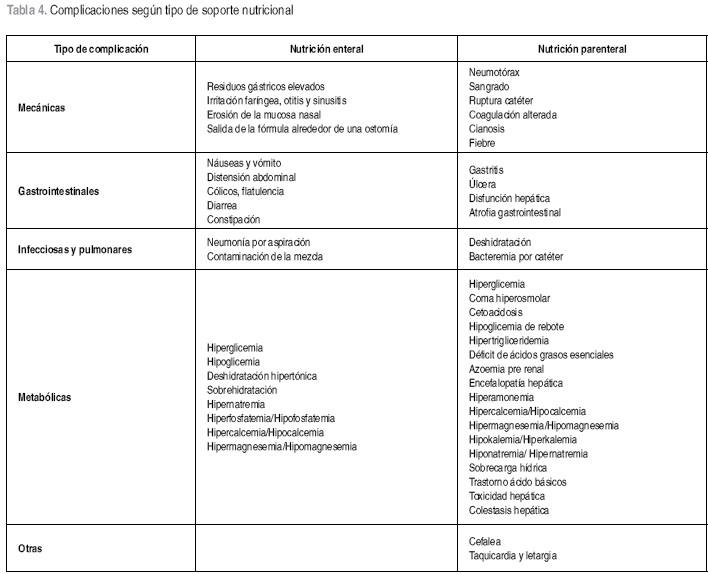
A pesar de sus beneficios el SN no está exento de riesgos y efectos adversos. Las complicaciones tanto de la NE como de la NP se han agrupado en mecánicas, metabólicas, gastrointestinales e infecciosas. En la tabla 4 se relacionan las complicaciones de cada tipo de soporte (42) y a continuación se revisan algunas de las más frecuentes.
Nutrición enteral: entre el 10 y 15% de los pacientes que reciben SNE pueden presentar algún tipo de complicación y en éstos, del 1 al 2% pueden ser graves. La mayoría son detectables, por lo tanto corregibles y no ameritan la suspensión del SN (49).
Residuo gástrico alto: considerada como una de las complicaciones más frecuentes en los pacientes críticos que reciben NE por vía gástrica, sin embargo no hay acuerdo en la cantidad que se debe considerar como tal y se han propuestas cifras entre 60 y 300 ml (50). Algunos autores lo definen como un volumen residual mayor a 200 ml obtenidos en cada valoración gástrica (51, 52), otros proponen un residuo con características alimentarias mayor a 150 ml (38, 42, 53). La alta incidencia de esta complicación se ha atribuido entre otros factores a una alteración del vaciamiento gástrico por patologías previas, diagnóstico médico al ingreso, alteraciones bioquímicas, uso de medicamentos y otros como ansiedad, dolor e infección (50). Cuando se presenta un aumento en el residuo gástrico, una de las medidas para su manejo es el retiro parcial de la NE, lo que finalmente conduce a una disminución del aporte de energía y nutrientes, situación demostrada en el estudio de Heyland y col (54). Para evitar esta situación, se recomienda utilizar para el tratamiento de las alteraciones en el vaciamiento gástrico, medicamentos procinéticos y vías de acceso transpilóricas (50, 55). La detección y manejo oportuno del residuo gástrico alto en los pacientes que reciben SNE es importante también para disminuir al máximo la ocurrencia la neumonía secundaria a la aspiración de la alimentación.
Diarrea: se encuentran en la literatura diversas definiciones de la diarrea como complicación asociada al SNE. Grau y col la definen como la presencia de cinco o más deposiciones líquidas en 24 horas o como la presencia de más de dos deposiciones de un volumen superior a 1000 cc/día (52), Lamache y col proponen la presencia de más de 600 cc de evacuaciones líquidas diarias (49) y Mora la define como más de tres deposiciones líquidas al día (38). Por las diferentes definiciones, la prevalencia de la diarrea como complicación del SNE presenta rangos tan amplios que pueden ir entre el 20 al 70%, sin embargo, para los grupos que utilizan definiciones objetivas, los datos más recientes muestran que la incidencia queda limitada entre el 10 y el 18% (56). Las causas de la diarrea durante el SNE son múltiples: factores relacionados con la dieta, con la administración), causas infecciosas, medicamentos, patología de base (56). Aunque aun es generalizado el concepto de que la NE es el principal factor responsable de la diarrea, los aspectos antes mencionados deben ser considerados, pues como lo mostró el estudio de Edes y col, sólo en un 25% de los casos, la dieta fue considerada responsable de la diarrea en los pacientes que recibían SNE (57). Álvarez y col también afirman que solo en un pequeño porcentaje de pacientes la diarrea está asociada con la NE (41).
Broncoaspiración: Grau y col la definen como la presencia de secreciones de características similares a la dieta en el aspirado traqueal (52). Sin duda una de las complicaciones más graves del SNE es la neumonía por aspiración, la cual sucede entre 1 y 44%, asociándose especialmente al SNE intragástrico. Factores como la patología de base, la tolerancia a la NE, el calibre y localización de la punta de la sonda, la presencia de reflujo gastroesofágico y las medidas terapéuticas implementadas influyen en la incidencia de esta complicación (58). En los últimos años se ha recomendado el acceso a yeyuno para disminuir su riesgo, sin embargo, varios estudios han demostrado que éste es similar tanto en pacientes con sondas nasoentéricas como de gastrostomías y yeyunostomías y que no hay diferencia significativa en la eficacia de la alimentación yeyunal versus la gástrica en pacientes críticos (59). La base del tratamiento continúa siendo la profilaxis, con instauración de medidas posturales como la elevación de la cabecera de la cama, comprobación de la existencia de retención gástrica, administración de la alimentación en infusión continua mediante bomba y uso de sondas de pequeño calibre (3). Por último, no se conoce ninguna forma de alimentación por sonda que evite el riesgo de broncoaspiración y una vez producida la misma, debe realizarse rápidamente la succión intratraqueal a ciegas y/o broncoscopia, así como la administración de oxigeno y antibióticos (60).
Hiperglicemia: se ha asociado a efectos negativos en los pacientes críticos como aumento en el riesgo de infección, polineuropatías, disfunción multiorgánica y aumento en la mortalidad (61, 62). Hasta hace poco los valores de glicemia tolerados en los pacientes críticos eran inferiores a 215 mg/dLen las fases agudas (63, 64, 65), sin embargo, ante el mal pronóstico, los estudios de Van der Berher postulan que una terapia de insulina agresiva para mantener los niveles de glicemia no mayor de 110 mg/dl logra disminuir la mortalidad, la incidencia de hiperbilirrubinemia, bacteremia, neuropatías, necesidad de transfusiones y días de estancia hospitalaria (66, 67). Aún no hay evidencia suficiente para recomendar el uso de altas dosis de insulina a todos los pacientes, sin embargo, estos resultados sugieren la necesidad de un control estricto de la glicemia (68). La NE puede ocasionar la aparición de la hiperglicemia o agravarla, es por lo tanto fundamental un riguroso monitoreo y si se presenta, seleccionar fórmulas enterales diseñadas para tal fin y/o recurrir a la terapia insulínica (69).
Autoretiro de la sonda: se refiere al retiro voluntario por parte del paciente de la sonda de nutrición enteral. Aunque es una situación frecuente, no se reporta en los estudios, tampoco es tratada a profundidad por los expertos sobre el tema. Es frecuente en niños, en pacientes con alteraciones neurológicas y en aquellos bajo el efecto de medicamentos como los opiáceos. Por la experiencia en el manejo de pacientes críticos con SN, una de las consecuencias del autoretiro de la sonda es la suspensión temporal de la NE lo que conlleva a la disminución en el aporte de energía y nutrientes. El autoretiro implica colocar de nuevo la sonda, con las molestias y riesgos que esto implica para el paciente, en algunas ocasiones es necesario incluso intentar otro abordaje.
Nutrición parenteral: a pesar de sus beneficios, las complicaciones relacionadas con la NP pueden afectar la calidad de vida e incrementar la mortalidad de los pacientes que la reciben (70). Las complicaciones mecánicas están relacionadas con la inserción y cuidado del catéter venoso central, las sépticas son el resultado de infecciones asociadas al catéter y las metabólicas se relacionan con la enfermedad hepática, ósea y con la alteración de cualquiera de los componentes de la NP (71). A continuación se revisan algunas de las más frecuentes en la práctica clínica.
Hipertrigliceridemia: el punto de corte para considerar elevación de los triglicéridos varía entre los autores, pero se acepta como valores >400 mg/dL (72,73). El reporte de hipertrigliceridemia en los pacientes con NP según estudios multicéntricos está entre el 5,7% y el 26,2% (74, 75). La alteración en el aclaramiento de los lípidos, el exceso de lípidos o dextrosa son los responsables de la hiperlipidemia inducida por NP. La obesidad, diabetes mellitus, sepsis, pancreatitis y enfermedad hepática predisponen a la hipertrigliceridemia debido a la disminución del aclaramiento de las grasas (71). Esta complicación puede precipitar a su vez la pancreatitis aguda, especialmente cuando los valores en sangre exceden los 1000 mg/dL (76). Detectada esta complicación, lo primero a considerar es el aporte excesivo de carbohidratos, el cual debe reducirse, seguido de una disminución de los lípidos si la hiperlipidemia no logra corregirse. La infusión de lípidos no debe pasar de 0,12 g/Kg/h en pacientes críticos o en quienes tengan alteración en el aclaramiento de los lípidos (77); otros autores proponen una dosis máxima de 1 g/Kg/día en este tipo de pacientes (78). La infusión continua de lípidos en 24 horas comparado con infusión cíclica ha sido asociada con mejoría en la oxidación de los lípidos, un mejor perfil de ácidos grasos y menos efectos deletéreos en el funcionamiento del sistema retículo endotelial (79). La infusión de lípidos debe suspenderse cuando los valores de triglicéridos excedan los 400 mg/dL, en cuyo caso podrían darse dos a tres veces por semana para prevenir la deficiencia de ácidos grasos esenciales (72,80).
Colestasis y esteatosis: se puede presentar cuando se suministra NP por largo tiempo (81). Las anormalidades en las pruebas de función hepática han sido reportadas entre un 20 y 90% de los pacientes que reciben NP (82–84). La esteatosis hepática más común en adultos es la acumulación de grasa en los hepatocitos en forma de triglicéridos y ésteres de colesterol (82) mientras que la colestasis es más frecuente en niños y se define como una disminución o interrupción del flujo de bilis caracterizado por agrandamiento de los hepatocitos e hiperplasia de las células de Kupffer (85). Algunos autores han definido colestasis como fosfatasas alcalinas > 380 UI/L o transaminasa glutámica > 50 UI/L o bilirrubina > 1,2 mg/dl (72). La patogénesis de la enfermedad hepática asociada a la NP es multifactorial. Para prevenir la colestasis por NP, se recomienda evitar el exceso energético, proveer la energía de forma balanceada, ciclar la NP, utilizar lípidos con triglicéridos de cadena media y larga, evitar la sepsis e iniciar la NE tan pronto como sea posible (71).
Desequilibrios hidroelectrolíticos: la alteración de los electrolitos es una complicación común en pacientes que reciben NP, encontrándose en la literatura reportes entre 43% y 56,5% de los pacientes (74, 86). La hipernatremia se define como un valor plasmático >145 mEq/L en cuyo caso el cloruro de sodio aportado en la NP debe suspenderse; la hiponatremia se presenta con valores menores a 135 mEq/L y es necesario reponer el déficit en la NP o restringirse su volumen entre 1.000 y 1.500 ml/día, excepto en pacientes hipovolémicos. (86). La hiperkalemia se presenta con valores superiores a 5mEq/L y es un trastorno que pone en peligro la vida del paciente por lo cual deben considerarse los aportes de cloruro y fosfato de potasio cuando se suministra NP (86). La hipokalemia, cifras inferiores a 3,5 mEq/L, es tan grave como la hiperkalemia y antes de iniciar el reemplazo es necesario identificar su causa. Para reponer el potasio en la NP se utilizan dos sales: cloruro y fosfato de potasio, teniendo en cuenta que la solución no debe aportar más de 20–40 mEq/L (86). La hipercalcemia se presenta con valores superiores a 10,5mg/dL o un calcio ionizado mayor a 5,0 mg/dL, la hipocalcemia con cifras menores a 8,5 mg/dL o un calcio ionizado menor de 4,0mg/dl. Si ésta última es severa y sintomática se utiliza gluconato o cloruro de calcio de manera intravenosa, sino es grave, se repone vía oral o se puede suministrar en la NP en forma de gluconato que aporta 90 mg de calcio elemental por ampolla de 10 cc teniendo en cuenta que debe corregirse según el valor de albúmina (86), Finalmente, la hiperfosfatemia se presenta cuando las cifras de fósforo sérico son superiores a 5,0 mg/dl; en los pacientes que reciban NP debe considerarse el aporte que es de 15 mmol por cada 5 cc de fosfato de potasio (86); la hipofosfatemia (fósforo <2,5 mg/dl) se presenta hasta en un 28% de los enfermos críticos, principalmente aquellos con traumatismo, trastornos respiratorios o enfermedades infecciosas. El aporte de fósforo en la NP en adultos se recomienda entre 20 y 40 mg/Kg/día (3), y se debe suministrar de forma temprana en presencia de cetoacidosis diabética y en pacientes graves.
Partiendo de la experiencia en el manejo de los pacientes críticos y de la revisión de la literatura científica , se concluye que por su condición estos pacientes presentan alteraciones en el metabolismo de los nutrientes que los llevan a una desnutrición de comienzo rápido, incrementando el riesgo de infecciones nosocomiales y de mortalidad; esta situación hace prioritaria la evaluación oportuna del estado nutricional como parte del proceso de la atención, y aunque no hay acuerdo en el método a utilizar, una combinación de la valoración global subjetiva, del índice de masa muscular y del valor sérico de albúmina parecen ser indicadores importantes para precisar el diagnóstico nutricional, aunque se deben tener presentes las limitaciones en su interpretación. Al igual que con la evaluación nutricional, no existe consenso para la determinación de los requerimientos de energía y aunque múltiples ecuaciones han sido recomendadas, un aporte entre 25–30 Kcal/Kg parecen ser suficiente para evitar la sobrealimentación; en ese aspecto es muy importante considerar la estimación del peso con el cual se determina las necesidades energéticas por el riesgo de sobreestimar o subestimar el verdadero requerimiento. Tanto la NE como la NP son métodos seguros para suministrar los requerimientos nutricionales, no obstante los pacientes pueden presentar complicaciones las cuales se deben evitar al máximo pero cuando se presentan, es necesario un manejo médico–nutricional adecuado, buscando siempre la causa y en todo caso evitando la suspensión del soporte nutricional.
Al respecto, no hay criterios estandarizados en la definición y manejo de las diferentes complicaciones del SN, situación que hace difícil comparar su incidencia y prevalencia con el propósito de establecer metas que permitan ajustar permanentemente los protocolos para lograr disminuir su frecuencia. Finalmente, la recomendación para los profesionales de la salud responsables de la atención del paciente crítico es revisar en forma permanente la evidencia científica sobre todos aquellos aspectos relacionados con su manejo nutricional para brindar una atención de óptima calidad pues si no fuera así, el propósito del soporte nutricional puede pasar a un segundo plano y más que un beneficio para el paciente, se puede convertir en una amenaza para su ya deteriorada condición de salud. Es el profesional en nutrición y dietética el llamado a liderar los grupos de soporte y con un conocimiento respaldado en la actualización permanente y en la experiencia adquirida, apoyar todas las decisiones relacionadas con la atención nutricional del paciente crítico.
REFERENCIAS
1. Ulibarri Pérez JI, Picón César MJ, García Benavent E. Detección precoz y control de la desnutrición hospitalaria. Nutr Hosp. 2002;17:139–46. [ Links ]
2. Villazon A, Torres R. Importancia de la nutrición en el apoyo metabólico del paciente grave. En: Morales JL, ed. Nutrición, cirugía y terapia intensiva. Bogotá: Manual Moderno; 2004. p. 521–7. [ Links ]
3. ASPEN. Board of Directors and the Clinical Guidelines Task Force. Guidelines for the use of parenteral and enteral nutrition in adult and pediatric patients. J Parenter Enteral Nutr. 2002;26S:1SA–138SA. [ Links ]
4. El portal de la anestesia en México. [homepage on the internet] México. [Citado 28de octubre de 2007]. Disponible en:http://anestesiaweb.ens.uabc.mx/. [ Links ]
5. Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest. 1992;101:1644–55. [ Links ]
6. Nin L, Pemann M, Kiegler G. Apoyo nutricional en el paciente grave En: Arenas H, Anaya R eds. Nutrición enteral y parenteral. México: McGraw–Hill; 2007. p. 321–38. [ Links ]
7. Bone RC. Systemic inflammatory response syndrome: a unifying concept of systemic inflammations. In: Fein A, Abraham EM, eds. Sepsis and multiorganic failure. Philadelphia: Williams & Wilkins; 1997. p. 3–10. [ Links ]
8. Winkler M, Malone A. Medical nutrition therapy for metabolic stress: sepsis, trauma, burns and surgery. In: Mahan LK, Escott's. Krause's food, nutrition, and diet therapy. Philadelphia: Saunders; 2004. p.1058–70. [ Links ]
9. Zanello M, Di Mauro L, Vincenzi M. Therapeutic effects of artificial nutrition in intensive care patients: new insights. Curr Anaest Crit Care. 2006;17:375–83. [ Links ]
10. Vergara A, Muñoz N. Nutrición en traumatismo. En: Arenas H, Anaya R, eds. Nutrición enteral y parenteral. México: McGrawHill; 2007. p. 395. [ Links ]
11. García B, Grau T. La nutrición enteral precoz en el enfermo grave. Nutr Hosp. 2005;20:93–100. [ Links ]
12. Heyland DK. Nutritional support in the critically ill patients. A critical review of the evidence. Crit Care Clin. 1998;14:423–40. [ Links ]
13. Deitch EA, Winterton J. The gut as a portal of entry for bacteremia. Role of protein malnutrition. Ann Surg. 1987;205:681–92. [ Links ]
14. Matarese L. Valoración metabólica y nutricional de pacientes hospitalizados. En: Patiño JF, Echeverry S, eds. Metabolismo, nutrición y schock. 4 ed. Bogotá: Panameriacana; 2006. p.155. [ Links ]
15. Detsky AS, Mc Laughlin JR, Baker JP, Johnson N, Whittaker S, Mendelson RA, et al. What is subjective global assessment of nutritional status? J Parenter Enteral Nutr. 1987;11:8–13. [ Links ]
16. Montejo JC, Culebras J, García A. Recomendaciones para la valoración nutricional del paciente crítico. Rev Med Chile. 2006;134:1049–56. [ Links ]
17. Carney D, Meguid M. Current concepts in nutritional assessment. Arch Surg. 2002;137:42–5. [ Links ]
18. Gómez Candela C, Mateo Lobo R, De Cos AI, Iglesias Rosado C, Castillo Rabaneda R. Evaluación del estado nutricional en el paciente oncológico. En: Soporte nutricional en el paciente oncológico. Madrid: You& Us SA; 2002. p.17–30. [ Links ]
19. Hirsch S, de Obaldia N, Petermann M, Rojo P, Barrientos C, Iturriaga H, Bunout D. Subjective global assessment of nutritional status: further validation. Nutrition. 1991;7:35–8. [ Links ]
20. Convinsky KE, Martin Ge, Beyth RJ, Justice AC, Sehgal AR, Landefeld CS. The relationship between clinical assessment of nutritional status and adverse outcomes in older hospitalized medical patients. J Am Geriatr Soc. 1999;47:5323–539. [ Links ]
21. Elia, M. Changing concepts of nutrient requirements in disease: implications for artificial nutritional support. Lancet. 1995;345:1279–84. [ Links ]
22. Frankenfield DC, Omert LA, Badellino M, Wiles CE, Bagley SM, Goodarzi, S, et al. Correlation between measured energy expenditure and clinically obtained variables in trauma and sepsis patients. J Parenter Enteral Nutr. 1994;18:398–403. [ Links ]
23. Dickerson RN, Boschert KJ, Kudsk KA, Brown RO. Hypocaloric enteral tube feeding in critically ill obese patients. Nutrition. 2002;18:241–6. [ Links ]
24. Frankenfield D, Hise M, Malone A, Russell M, Gradwell, E, Compher C. Prediction of resting metabolic rate in critically ill adult patients: results of a systematic review of the evidence. J Am Diet Assoc. 2007;107:1552–61. [ Links ]
25. Brandi LS, Bertolini R, Calafa M. Indirect calorimetry in critically ill patients: clinical applications and practical advice. Nutrition. 1997;13:349–58. [ Links ]
26. MacDonald A, Hildebrandt L. Comparison of formulaic equations to determine energy expenditure in the critically ill patient. Nutrition. 2003;19:233–39. [ Links ]
27. Mifflin MD, St Jeor ST, Hill LA, Scott BJ, Daugherty SA, Koh YO. A new predictive equation for resting energy expenditure in healthy individuals. Am J Clin Nutr. 1990;51:241–7. [ Links ]
28. Ireton–Jones CS, Turner WW Jr, Liepa GU, Baxter CR. Equations for the estimation of energy expenditures in patients with burns with special reference to ventilatory status. J Burn Care Rehabil. 1992;13:330–3. [ Links ]
29. Hunter DC, Jaksic T, Lewis D, Benotti PN, Blackburn GL, Bistrian BR. Resting energy expenditure in the critically ill: estimations versus measurement. Br J Surg. 1988;75:875–8. [ Links ]
30. Cerra FB, Benitez MR, Blackburn GL, Irwin RS, Jeejeebhoy K, Katz DP, et al. Applied nutrition in ICU patients. A consensus statement of the American College of Chest Physicians. Chest. 1997;111:769–78. [ Links ]
31. Rombeau JL. Indications and administration of enteral and parenteral nutrition in critically ill patients. In: Carlson RW, Geheb MA, eds. Principles and practice of medical intensive care. Philadelphia: Saunders; 1993. p. 1528–51. [ Links ]
32. Reid C, Campbell I. Nutritional and metabolic support in trauma, sepsis and critical illness. Curr Anaesth Crit Care. 2004;15:336–49. [ Links ]
33. Zaloga G. Parenteral nutrition in adult in patients with functioning gastrointestinal tracts: assessment of outcomes. Lancet. 2006;367:1101–11. [ Links ]
34. Gramlich L, Kichian K, Pinilla J, Rodych N. Dhaliwal R, Heyland D. Does enteral nutrition compared to parenteral nutrition result in better outcomes in critically ill adult patients? A systematic review of the literature. Nutrition. 2004;20:843–8. [ Links ]
35. Giner M. A correlation between malnutrition and poor outcome in critically ill patients still exist. Nutrition. 1996;1995:12–23. [ Links ]
36. García de Lorenzo A, Alvarez M, Calvo J, de Ulíbarri J, del Rio C, Galbán P, et al. Conclusiones del II Foro del debate SENPE sobre desnutrición hospitalaria. Nutr Hosp. 2005;20:1–7. [ Links ]
37. Howard L. Enteral and parenteral nutrition therapy. In: Harrison's principles of internal medicine. 14th ed. New York: McGraw–Hill; 1998. p. 472–80. [ Links ]
38. Mora R. Soporte nutricional especial. 3 ed. Bogotá: Editorial Médica Panamericana; 2002. p. 128–253. [ Links ]
39. Stroud M, Duncan H, Nightingale J. Guidelines for enteral feeding in adult hospital patients. Gut. 2003;52:2–12. [ Links ]
40. Nism AA, Allins AD. Enteral nutrition support. Nutrition. 2005;21:109–12. [ Links ]
41. Álvarez J, Peláez N, Muñoz A. Utilización clínica de la nutrición enteral. Nutr Hosp. 2006:21:87–99. [ Links ]
42. Gómez G, Rugeles S. Terapia nutricional y metabólica del paciente hospitalizado. Libro azul. Bogotá: Lito Camargo; 2007. p. 46–51, 61–64. [ Links ]
43. Velásquez J. Accesos y tipos de nutrición enteral. En: Arenas H, Anaya R, eds. Nutrición enteral y parenteral. México: McGrawHill; 2007. p. 261–9. [ Links ]
44. Mendez Y. Productos para alimentación enteral. En: Fuentes del Toro S, ed. Nutrición, cirugía y terapia intensiva. México: Manual Moderno; 2004. p. 688–95. [ Links ]
45. Nightingale JM. Parenteral nutrition: multidisciplinary management. Hosp Med. 2005;66:147–51. [ Links ]
46. Kehr J, Maíz A. Nutrición parenteral central. En: Arenas H, Anaya R, eds. Nutrición enteral y parenteral. México: McGrawHill; 2007. p. 244–9. [ Links ]
47. Scolapio JS. A review of the trends in the use of enteral and parenteral nutrition support. J Clin Gastroenterol. 2004;38: 403–7. [ Links ]
48. Kirby D. Decisions for enteral access in the intensive care unit. Nutrition. 2001;17:776–9. [ Links ]
49. Lamache L, Fuchs V. Alimentación enteral. En: Fuentes del Toro S, ed. Nutrición, cirugía y terapia intensiva. México: Manual Moderno; 2004. p. 655. [ Links ]
50. Montejo J, Jiménez J, Ordóñez J, Caparrós T, García A, Ortiz C, et al. Complicaciones gastrointestinales de la nutrición enteral en el paciente crítico. Med Intensiva. 2001;25:152. [ Links ]
51. Montejo JC. Enteral nutrition–related gastrointestinal complications in critically ill patients. A multicentre study. Crit Care Med. 1999;27:1447–53. [ Links ]
52. Grau T, Bonet A. Estudio multicéntrico de incidencia de las complicaciones de la nutrición enteral total en el paciente grave. Estudio ICOMEP 2a parte. Nutr Hosp. 2005;4:278–85. [ Links ]
53. Zafer T, Erdogan B, Noyan T, Cekinmez M, Atalay B, Bilgin N. The effect of metoclopramide on gastric emptyingin traumatic brain injury. J Clin Neurosci. 2007;14:344–8. [ Links ]
54. Heyland D, Schroter D, Drover J, Jain M, Keefe J, Dhaliwal R, et al. Nutrition supports in the critical care setting: currents practice in Canadian ICUs–opportunities for improvement? J Parenter Enteral Nutr. 2003;27:74. [ Links ]
55. Zaloga GP, Marik P. Promotility agents in the intensive care unit. Crit Care Med. 2000;28:2657–8. [ Links ]
56. Bliss DZ, Guenter PA, Greg R. Defining and reporting diarrhea in tube–fed patients– What a mess. Am J Clin Nutr. 1992;55:753–9. [ Links ]
57. Edes TE, Walk BE, Austin JL. Diarrhea in tube–fed patients: feeding formula not necessarily the cause. Am J Med. 1990;88;91–3. [ Links ]
58. Marse P, Ibañez J, Jorda R, Raurich M, Ayestarán JI, Rubert C. Reflujo gastroesófagico y nutrición enteral. Med Intensiva. 1994;18: 426–9. [ Links ]
59. Kreymann K, Berger M, Deutz N, Hiesmayr M, Jolliet P, Kazandjiev G, et al. ESPEN guidelines on enteral nutrition: intensive care. Clin Nutr. 2006;25:210–33. [ Links ]
60. Heyland DK, Dhaliwal R, Day A. Validation of the Canadian clinical practice guidelines for nutrition support in mechanically ventilated, critically ill adult patients: results of a prospective observational study. Crit Care Med. 2004;32:2260–6. [ Links ]
61. López J, Mesejo A, Montejo JC. Nutrición artificial en la hiperglucemia y diabetes mellitus en pacientes críticos. Nutrición. 2005;20:1–9. [ Links ]
62. González J. Glucosa control guidelines: current concepts. Clin Nutr. 1998;17:7–17. [ Links ]
63. McMahon MM, Rizza RA. Nutrition support in hospitalizad patients with diabetes mellitus. Mayo Clin Proc. 1996;71:587–94. [ Links ]
64. Cuerda Compés MC, Camblor Álvarez M, Bretón Lesmes I, García Peris P: Nutrición artificial, hiperglucemia, inmunosupresión. Rev Clin Esp. 1997;197:836–40. [ Links ]
65. Sanz Paris A: Diabetes y nutrición. Nutr Hosp. 2000;15(suppl 1):58–68. [ Links ]
66. Van den Berghe G, Wouters P, Weekers F. Intensive insulin therapy in critically ill patients. N Engl J Med. 2001;345:1359–67. [ Links ]
67. Van den Berghe G, Wouters P, Bouillon R. Outcome benefits of intensive insulin therapy in the critically ill: insulin dose versus glycemic control. Crit Care Med. 2003;31:359–66. [ Links ]
68. Coursin DB, Connery LE, Ketzler JT. Preoperative diabetic and hyperglycemic management's issues. Crit Care Med. 2004;(Suppl)32:S116–25. [ Links ]
69. D'Andrea E, Bartullo H. Complicaciones de la nutrición enteral. En: Arena H, Anaya R, eds. Nutrición enteral y parenteral. México: Mc Graw–Hill Interamericana; 2007. p. 317. [ Links ]
70. Moreno JM, Planas M, de Cos AI, Virgili N, Gomez–Enterría, P, Ordóñez J, et al. Registro nacional de la nutrición parenteral domiciliaria del año 2003. Nutr Hosp. 2006;21:127–31. [ Links ]
71. Ukleja A, Romano M. Complications of parental nutrition. Gastroenterol Clin N Am. 2007;36:23–6. [ Links ]
72. Hamilton C, Austin T. Essential fatty acid deficiency in human adults during parenteral nutrition. Nutr Clin Pract. 2006;21:387–94. [ Links ]
73. Sacks G. Is IV lipid emulsion safe in patients with hypertrigliceridemia. Nutr Clin Pract. 1997;12: 20–123. [ Links ]
74. Bonet A, Grau T. Estudio multicéntrico de incidencia de las complicaciones de la nutrición parenteral total en el paciente grave. Estudio ICOMEP. 1a parte. Nutr Hosp. 2005;4:268–77. [ Links ]
75. Llop J, Sabin P. The importance of clinical factors in parenteral nutrition–associated hypertriglyceridemia. Clin Nutr. 2003;22:577–83. [ Links ]
76. Cameron JL, Capuzzi DM. Acute pancreatitis with hyperlipemia: the incidence of lipid abnormalities in acute pancreatitis. Ann Surg. 1973;177:483–9. [ Links ]
77. Iriyama K, Tsuchibashi T. Elimination of fat emulsion particles from plasma during glucose infusion. Br J Surg. 1996;83:946–8. [ Links ]
78. Battistella FD, Widergren JT. A prospective, randomized trial of intravenous fat emulsion administration in trauma victims requiring total parenteral nutrition. J Trauma. 1997;43:52–8. [ Links ]
79. Jensen GL, Mascioli EA. Parenteral infusion of long and medium–chain triglycerides and reticuloendothelial system function in man. J Parenter Enteral Nutr. 1990;14:467–71. [ Links ]
80. Goulet O. Lipid emulsions: dosage and monitoring Education and Critical Practice Program. 23 ESPEN Congress Munich 2001: 87–93. [ Links ]
81. Montemerlo H, García C. Complicaciones metabólicas de la nutrición parenteral. En: Arenas H, Anaya R, eds. Nutrición enteral y parenteral. México: Interamericana; 2007. p. 287–97. [ Links ]
82. Zamir O, Nussbaum MS. Effect of enteral feeding on hepatic steatosis induced by total parenteral nutrition. J Parenter Enteral Nutr. 1994;18:20–5. [ Links ]
83. Kelly DA. Liver complications of pediatric parenteral nutrition epidemiology. Nutrition. 1998;14:153–7. [ Links ]
84. Btaiche IF, Khalidi N, Parenteral nutrition–associated liver complications in children. Pharmacotherapy. 2002;22:188–211. [ Links ]
85. Leaseburge LA, Winn NJ. Liver test alterations with total parenteral nutrition and nutritional status. J Parenter Enteral Nutr. 1992;16:348–52. [ Links ]
86. Batani R, Abdullah D. Evaluation of the total parenteral nutrition service at University Sains Malaysia Hospital. Eur J Clin Nutr Metabol. 2007;10:2–5. [ Links ]