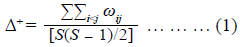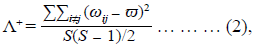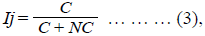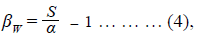Introducción
Los humedales son áreas que se caracterizan por el nivel freático próximo o por encima de la superficie, con un comportamiento estacional o permanente (Salimi et al, 2021). En los últimos años se ha evidenciado el interés en estos ecosistemas, lo que se evidencia en el número de grupos de investigación que se dedican a estudiarlos y la variedad de temas investigados (Aponte, 2022; Rivera et al., 2021; Salazar- Navarro et al., 2020). Pese a ello, los humedales están a merced de impactos como los incendios y la contaminación por metales pesados, los cuales repercuten sobre la calidad del ecosistema y los servicios ecosistémicos que proveen (Dang et al., 2021; Zhao et al., 2021).
Los humedales costeros de Perú se caracterizan por presentar una amplia diversidad de aves (Quiñonez & Hernández, 2017), mamíferos (Pacheco et al., 2020), plantas vasculares (Aponte & Cano, 2013) e invertebrados (Castillo-Velásquez & Huamantinco-Araujo, 2020; Castillo-Velásquez et al., 2021). La urbanización, la disposición del desmonte, la introducción de especies invasoras y la ganadería, todas fruto de la influencia humana en estos ecosistemas, son actividades que podrían repercutir sobre la diversidad de especies (Aponte et al., 2020).
Algunos patrones de diversidad de las plantas vasculares de la costa de Lima se han evaluado y se ha encontrado que alrededor del 50 % de las especies presentes en los humedales corresponde a especies invasoras o potencialmente invasoras, las cuales han llegado a ellos como fruto de las actividades humanas (Aponte & Cano, 2013). El tamaño de los humedales parece no influir en la riqueza vegetal que albergan, pues se han encontrado humedales grandes y pequeños con una gran riqueza por unidad de área; por ejemplo, Los Pantanos de Villa tiene más de 270 hectáreas y 72 especies (0,26 especies/ hectárea) y el humedal de Carquín-Hualmay, con 11 hectáreas, registra 41 especies (3,72 especies/hectárea) (Aponte & Cano, 2018; Ramírez & Cano, 2010). El análisis de la diversidad beta espacial a partir de índices de similitud e índices beta indica un alto recambio entre las localidades, lo que evidencia la gran complementariedad entre estos ecosistemas (Aponte, 2017; Aponte & Ramírez, 2014; Arana & Salinas, 2003; Gonzales et al., 2019; La Torre & Aponte, 2009), así como la necesidad de protegerlos como corredor costero.
A pesar de que se ha podido determinar la riqueza, la diversidad alfa y la diversidad beta de la flora vascular en algunos de estos humedales, esta aproximación tiene limitaciones; por ejemplo, en dichas evaluaciones se consideran todas las especies por igual, obviando aspectos evolutivos importantes para la interpretación de la diversidad (Lean & Maclaurin, 2016). Una evaluación complementaria a partir de aspectos filogenéticos permitiría abarcar más características del subconjunto de taxones, por ejemplo, taxonómicas y de historia. Los índices de diversidad taxonómica utilizan las relaciones entre especies, lo que representa información evolutiva (Faith, 1992; García-de Jesús et al., 2016). La diversidad taxonómica es mayor en las comunidades, con una considerable cantidad de especies distantes en la clasificación taxonómica frente a otras comunidades en las que la relación es más cercana (Clarke & Warwick, 1998). Las medidas de distancia taxonómica tienen importancia en la evaluación de los cambios espaciales y ambientales de la diversidad (Warwick & Clarke, 1998), y sirven de indicador para los procesos evolutivos que ocurren en estas áreas (Forest et al., 2007). Estos índices son independientes del esfuerzo de muestreo y del entorno, y se calculan haciendo uso de los datos de ausencia o presencia, lo que implica una ventaja frente a aquellos estudios con diferentes esfuerzos de muestreo, ya que pueden compararse entre sí (Clarke & Warwick, 2001; Schweiger et al., 2008). Dicha ventaja hace de este un método ideal para los humedales de la costa central del Perú, ya que se han evaluado en momentos diferentes y con esfuerzos de muestreo que difieren (por ejemplo, en Aponte & Cano, 2018, y en Arana & Salinas, 2003).
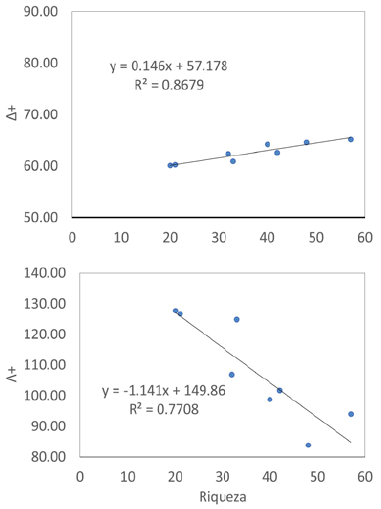
En este contexto, el presente estudio abordó la evaluación de la diversidad taxonómica (índices Δ+ y Λ+) comparando los valores para ver si variaban en función del nivel de protección de los humedales. Asimismo, se propone un modelo matemático de la riqueza y la diversidad taxonómica que pueda servir para un cálculo rápido de la diversidad filogenética de las plantas vasculares de esta región. Por último, se estudió el recambio espacial de las plantas vasculares en la costa central del Perú para establecer si existía alguna relación entre la diversidad beta y la distancia entre humedales.
Materiales y métodos
Area de estudio
Los humedales costeros del Perú se ubican en el desierto árido del Pacífico sur. En este estudio se analizó la flora vascular de ocho humedales costeros ubicados en la región central del país: los humedales de Puerto Viejo (PV; coordenadas: 12°34'16,77"S -76°42'35,36"O), Pantanos de Villa (PAN; coordenadas 12°12'39,9"S - 76°59'20,56"O), Ventanilla (VEN; coordenadas 11°52'35,6"S - 77°09'01,92"O), Santa Rosa (SR; coordenadas 11°35'45,93"S - 77°15'58,10"O), Paraíso (PAR; coordenadas 11°12'04,91"S -77°35'22,57"O), Carquín (CAR; coordenadas 11°06'06.62''S - 77°36'50.01''O), Medio Mundo (MM; coordenadas 10°58'05,15"S - 77°39'23,99"O) y Chimbote (CH; coordenadas 09°05'51"S; 78°32'52"O) (Figura 1). Se eligieron por tener todos ellos estudios previos de su flora vascular. No se conocen estudios científicos sobre flora vascular de otros humedales costeros de la misma región. Estas localidades se encuentran entre los 0 y los 22 metros sobre el nivel del mar a lo largo de la franja desértica del Pacífico central; en general, el agua que los nutre proviene de afloramientos, fuentes subterráneas y canales de conducción de aguas de los asentamientos humanos. Estos humedales se componen generalmente de un cuerpo de agua principal rodeado por juncales con dominancia de Schoenoplectus americanus; totorales con predominio de Typha domingensis; salicor-niales dominados por Salicornia neei, y gramadales dominados por Distichlis spicata y Sporobolus spp. Se caracterizan, además, por la presencia de asentamientos humanos en sus inmediaciones (Aponte et al., 2020); la distancia entre ellos es variable, siendo la mínima de 12,6 km (entre CAR y PAR) y la mayor de 430 km (entre CH y PV); para revisar otros detalles de las localidades, pueden consultarse los artículos citados en la tabla 1, la figura 1 y el material suplementario 1,https://www.raccefyn.co/index.php/raccefyn/article/view/1696/3282.
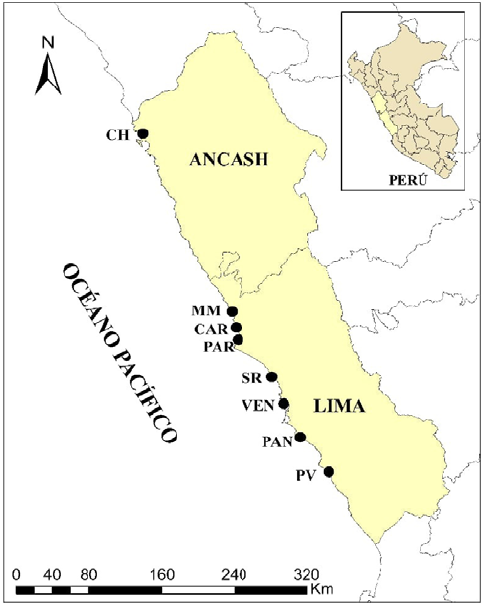
Figura 1 Ubicación de los humedales de la costa central del Perú. CH: humedales de Chimbote; MM: albufera de Medio Mundo; CAR: humedal de Carquín; PAR: laguna El Paraíso; SR: humedal Santa Rosa; VEN: humedales de Ventanilla; PAN: Pantanos de Villa; PV: humedales de Puerto Viejo
Tabla 1 Humedales evaluados en el presente trabajo con su respectiva clasificación de protección y especies reportadas
| Humedal | Estado de conservación | Número de especies encontradas | Referencia |
|---|---|---|---|
| Los pantanos de Villa | Área Natural Protegida | 47 | Ramírez & Cano (2010) |
| Puerto Viejo | Ninguno | 32 | La Torre & Aponte (2009) |
| Medio Mundo | Área de conservación regional | 21 | Aponte & Cano (2013) |
| Laguna El Paraíso | Ninguno | 40 | Aponte & Cano (2013) |
| Ventanilla | Área de conservación regional | 20 | Aponte & Ramírez (2014) |
| Carquín | Ninguno | 41 | Aponte & Cano (2018) |
| Santa Rosa | Ninguno | 57 | Gonzales et al. (2019) |
| Chimbote | Ninguno | 41 | Arana & Salinas (2003) |
Preparación de los datos
Se recopilaron las listas de las plantas vasculares utilizando los estudios más recientes en cada localidad (Tabla 1). En los ocho humedales se han registrado un total de 109 especies pertenecientes a 94 géneros, 34 familias, 19 órdenes y 3 subclases (Magnoliidae, 107 especies; Equisetidae, 1 especie; Polypodiidae, 1 especie) (Tablas S1yS2,).
La taxonomía de las plantas fue actualizada a partir de la plataforma Trópicos (www.trópicos.org) para evitar sinónimos. Con los datos obtenidos se hicieron dos matrices: una sobre presencia o ausencia de las especies por localidad, y otra en la que se clasificaron las especies por clase, subclase, orden, familia, género y especie siguiendo las actualizaciones utilizadas en dichas bases de datos, las cuales se basan en el artículo del The Angiorperm Phyllogeny Group (2009; 2016) y en el de Chase & Reveal (2009); el ranking taxo-nómico utilizado puede apreciarse en el material suplementario 1y en laTabla S2,https://www.raccefyn.co/index.php/raccefyn/article/view/1696/3282.
Cálculo de la diversidad taxonómica
Se calcularon dos índices de diversidad taxonómica: la distancia taxonómica promedio (Δ+) y la variación de la distancia taxonómica (Λ+) en los ocho humedales evaluados. La Δ+ mide la longitud de trayectoria promedio entre todos los pares de especies dentro de la clasificación taxonómica, en tanto que la Λ+ refleja la desigualdad del árbol taxonómico para una comunidad dada (ecuaciones 1 y 2):
donde S es el número de especies y ωij es la distancia que adhiere a las especies i y j en el árbol taxonómico jerárquico (número de niveles taxonómicos superiores que separan a dos especies hasta que se llegan a unir en un mismo punto: clase, subclase, orden, familia y género). Esta distancia (ωij) recibió un valor de manera que su proporción con respecto a los valores asignados a cada nivel taxonómico sumara 100 (Clarke & Warwick, 1999; 1998). Asimismo, se hicieron gráficos de embudo de confianza para Δ+ y Λ+ en los cuales las líneas de los extremos indican los límites dentro de los cuales se encuentran el 95 % de los valores simulados de ambos índices, en tanto que las líneas centrales indican los valores medios (Iglikowska & Namiotko, 2010). Ambos índices y gráficos se obtuvieron con el programa PRIMER, versión 6 (Clarke & Gorley, 2006).
Por último, se compararon los valores de Δ+ de los humedales protegidos y los no protegidos, para lo cual se verificó la normalidad (p>0,05 en la prueba de Shapiro Wilk) y se hizo la prueba de t de Student.
Correlación y modelamiento de la correlación entre la riqueza y la diversidad taxonómica
Con la finalidad de evaluar la correlación entre la diversidad taxonómica y la riqueza, se empleó la prueba de correlación de Pearson utilizando los valores de los índices taxonómicos obtenidos y la riqueza de la flora de cada humedal evaluado después de verificar la normalidad (p>0,05 en la prueba de Shapiro Wilk).
Asimismo, para modelar la diversidad taxonómica a partir de los datos de riqueza, se hizo una regresión lineal entre los índices Δ+ y Λ+ (por separado) en función de la riqueza. Este modelo fue elegido por tener pocas variables (solo la pendiente y un intercepto), lo que facilita su análisis y comprensión. La confiabilidad del modelo se calculó con el coeficiente de determinación (R2) para lo que se utilizó el programa PAST 4.05 (Hammer et al., 2001).
Evaluación de la similitud y recambio espacial
La similitud de la flora entre los humedales de la región se evaluó mediante el índice de Jaccard (Ij) (3):
donde C es el número de especies comunes entre dos localidades y NC el número de especies no comunes.
Para evaluar la correlación entre la diversidad beta (recambio espacial) y la distancia geográfica entre humedales se utilizó la prueba de Spearman. Para ello se calculó primero el recambio de especies entre cada par de humedales utilizando el índice de Whitaker (4) (Koleff et al., 2003):
donde S es el valor de la riqueza y α el número promedio de especies de todos los humedales evaluados.
Una vez determinado el recambio, se procedió a hallar las distancias espaciales entre los humedales utilizando Google Earth. Con este conjunto de datos se realizaron las pruebas de correlación.
Resultados
Diversidad taxonómica
Los valores más altos de Δ+ se encontraron en los humedales SR, PAN y CAR y de Λ+, en los humedales de VEN, MM y PAR (Tabla 2). En la figura 2A se puede observar que la flora de los humedales PAR, MM y VEN estuvo por debajo del intervalo de confianza, lo cual implicaría que las especies en dichos humedales son filogenèticamente distintas de las de los otros. Los valores de Λ+ en todos los humedales costeros estuvieron dentro del intervalo de confianza (Figura 2B). Por otro lado, los valores de Δ+ de los humedales con algún grado de protección y aquellos sin protección no presentaron diferencia alguna (t=0.96; p>0,05).
Tabla 2 Valores de Δ+ y Λ+ para los humedales del presente estudio: PV: humedales de Puerto Viejo; PAN: pantanos de Villa; VEN: humedales de Ventanilla; SR: humedal Santa Rosa; PAR: laguna El Paraíso; CAR: humedal de Carquín; MM: albufera de Medio Mundo; CH: humedales de Chimbote
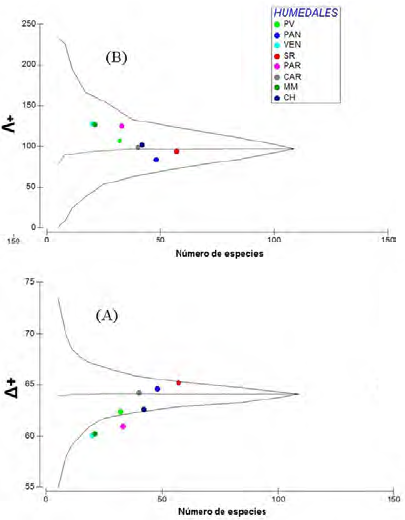
Figura 2 Gráficos de embudo de (A) distancia taxonómica promedio (Δ+) y (B) variación en la distancia taxonómica (Λ+) versus el número de especies de cada uno de los humedales costeros del Perú: PV: humedales de Puerto Viejo; PAN: pantanos de Villa; VEN: humedales de Ventanilla; SR: humedal Santa Rosa; PAR: laguna El Paraíso; CAR: humedal de Carquín; MM: albufera de Medio Mundo; CH: humedales de Chimbote
Los análisis de correlación indicaron que la riqueza de especies se relacionó positivamente con el Δ+ (r=0,931; p<0,05) y negativamente con el Λ+ (r=-0,878; p<0,05). La figura 3 muestra los modelos obtenidos mediante la regresión lineal; en ambos casos, los modelos fueron confiables (R2>0,75 para la relación con Λ+), aunque el modelo de A+ en función del número de especies lo fue más (R2=0,86).
Similitud y recambio
La comparación entre la flora de los humedales mostró una baja similitud (Ij = 0,48 en promedio), lo que se interpretó como un recambio alto entre localidades, con excepciones como las registradas entre MM y PAR y MM y VEN (Ij=0,74 e Ij=0,63, respectivamente). La menor similitud se registró entre los humedales SR y MM y SR y VEN (Ij=0,26 y Ij=0,29, respectivamente) (Figura 4). Por último, no se encontró correlación entre la distancia de los humedales y la diversidad beta (ρ=-0,18; p>0,05).
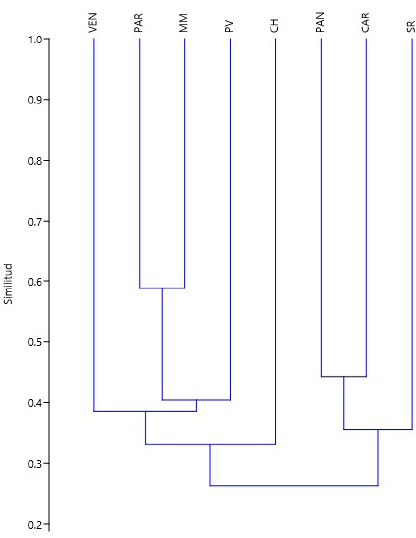
Figura 4 Dendrograma de similitud entre ocho humedales de la costa central del Perú. Coeficiente cofenético=0,7887. PV: humedales de Puerto Viejo; PAN: pantanos de Villa; VEN: humedales de Ventanilla; SR: humedal Santa Rosa; PAR: laguna El Paraíso; CAR: humedal de Carquín; MM: albufera de Medio Mundo; CH: humedales de Chimbote
Discusión
Según Clarke & Warwick (1998), la diversidad taxonómica no tiene una relación dependiente de la riqueza de especies, patrón que se ha encontrado en escarabajos (Scarabaeoidea) (García-de Jesús et al., 2016), macrófitas lacustres (Alahuhta et al., 2017) y crustáceos decápodos (Germán- Gómez, 2020); pese a ello, nuestro estudio evidenció un patrón contrario: la flora de estos humedales se correlaciona con la diversidad taxonómica, lo que sugiere que conforme aumentan las especies de plantas vasculares en los humedales, aumenta la complejidad de su estructura filogenètica. Cerca del 50 % de estas especies se considera invasor o invasor potencial (Aponte & Cano, 2013), por lo que es probable que el ser humano esté modelando la evolución de la estructura floristica y filogenètica de los humedales en esta zona, y que las nuevas especies estén apareciendo debido a la intervención humana. Esta observación está respaldada por reportes recientes; por ejemplo, en el último censo de flora realizado en el humedal SR, se encontró que el 55 % de las nuevas especies reportadas era invasor potencial (Gonzales et al., 2019), a lo que se suman las observaciones de nuevas especies en otros taxones de la misma región (Aponte, 2022). Es importante hacer un seguimiento temporal y una actualización floristica de los otros humedales costeros para verificar si sucede lo mismo en las otras localidades y confirmar así la hipótesis propuesta.
En la mayoría de los humedales analizados en este estudio (con excepción de Chimbote) se han determinado múltiples impulsores de cambio (Aponte et al., 2020) que podrían incidir sobre la flora, ya sea reduciendo su diversidad floristica (por ejemplo, mediante los incendios) o aumentándola (mediante la introducción de especies). En cuanto a la diversidad taxonómica, Clarke & Warwick (1998) no encontraron una relación entre esta y la perturbación antropogénica. Casos como los de CAR y SR (humedales sin ningún tipo de protección), que presentaron altos valores de A+, pueden ser indicativos de la necesidad de evaluar la diversidad taxonómica en función del impacto que presenta cada uno de los humedales, verificando si los que se degradan registran una mayor o menor diversidad taxonómica.
Las características filogenéticas de las especies que difieren en la clasificación taxonómica contribuyen a que los valores de diversidad taxonómica calculados sean mayores (Faith, 1992; Polasky et al., 2001). Los resultados obtenidos permiten sugerir que deben protegerse prioritariamente los humedales que albergan la mayor variabilidad, es decir, el SR, el CAR y el PAN, los cuales registraron los valores más altos; debe anotarse que el PAN ya cuenta con el grado de protección necesario. Estos humedales presentan una flora con una mayor historia evolutiva y, por ende, poseen una composición floristica filo-genéticamente más diversa y con mayor capacidad de adaptarse al cambio climático y a otros problemas ambientales (Faith, 1992; Forest et al., 2007; Lean & Maclaurin, 2016; Mace et al., 2003). Es importante mencionar que una de las limitaciones de este estudio es que las especies introducidas o invasoras se analizaron conjuntamente con las demás y, por ello, los índices estimados incluyeron dicho efecto. La cercanía de estos humedales a la urbe y las actividades humanas (Aponte & Cano, 2013) es propia de su historia como ecosistemas; sin embargo, se habrían obtenido resultados distintos si se hubieran analizado las especies introducidas por separado.
En estudios previos se ha propuesto que estos ecosistemas tienen un potencial de especies todavía no registradas, ya sea por su recambio temporal o porque algunos humedales aún no se han evaluado (Aponte & Apeño, 2019), lo que significa que el valor de la distancia taxonómica podría cambiar temporalmente. Puede ser que el valor de A+ se incremente con los muestreos, ya que estos ecosistemas albergan flora monoespecífica, es decir, cada especie nueva reportada en la región podría representar géneros o familias nuevos. Por ejemplo, la última evaluación del humedal Santa Rosa reportó 12 nuevos registros para la región que significaron dos familias y dos géneros no registrados antes en este espacio geográfico (Gonzales et al., 2019). Esta situación debe incentivar el planteamiento de estudios que permitan conocer el recambio temporal de las especies y el papel de las plantas invasoras en él.
Por otra parte, los modelos lineales obtenidos podrían facilitar el cálculo de los índices de diversidad taxonómica y arrojar resultados rápidos solo conociendo la riqueza de los humedales de la región, lo que permitiría tener rápidamente una perspectiva complementaria. Dicha ecuación es apropiada para los ecosistemas evaluados, pero sería importante verificar si estos patrones persisten en otras regiones a lo largo del tiempo para poder seguir empleándola.
En este estudio se agregó el humedal CH a las evaluaciones espaciales realizadas en los últimos años (Aponte & Cano, 2018, 2013); pese a ello, la interpretación de la diversidad beta no ha variado, es decir, en estos ecosistemas hay una alta complementariedad. Asimismo, al no hallarse correlación entre la distancia entre los humedales y la diversidad beta, las medidas de conservación clásicas no podrían emplearse atendiendo a este criterio de distancia (conservar humedales alejados), sino que se podrían conservar también aquellos cercanos entre sí; además, debería considerarse la agrupación de todos ellos en un sistema interconectado (un corredor), ya que, a pesar de su cercanía, hay un alto recambio. En Perú existe un sistema que se puede extrapolar al caso de los humedales, se trata de la Reserva Nacional del Sistema de Islas, Islotes y Puntas Guaneras, que ha demostrado su eficiencia para la conservación de la biodiversidad, como lo demuestra el caso de los cangrejos decápodos (Germán-Gómez et al., 2020).
A pesar de que el número de los humedales registrados en la costa suramericana es considerable (puede revisarse un mapa en el Atlas de humedales costeros de Pacífico disponible en www.humedalescosteros.org), no todos cuentan con estudios sobre su flora vascular; por ello nos unimos a otros autores (Gómez-Sánchez et al., 2022) para sugerir que se hagan inventarios florísticos donde corresponda, así como evaluaciones complementarias sobre la de diversidad taxonómica para estudiarla a una mayor escala, por ejemplo, a nivel de la costa del Pacífico sur, el cual constituye un corredor biológico interconectado.
Conclusiones
Los humedales de Santa Rosa, Pantanos de Villa y Carquín presentaron los valores más altos de diversidad filogenética (Δ+), lo que requeriría su conservación para protegerla. La comparación de la flora de los humedales evidenció una baja similitud, lo que se interpreta como señal de un recambio alto entre estas localidades (alta diversidad beta en la región). Por último, no se encontró correlación de la distancia entre humedales con la diversidad beta.
Estos resultados deben tomarse en consideración para proponer áreas de conservación a lo largo del corredor donde se ubican e incentivar evaluaciones complementarias en otros humedales de la costa suramericana.