Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.6 no.2 Popayán Jul./Dec. 2008
ESTUDIO MORFOLÓGICO, HISTOLÓGICO Y ULTRAESTRUCTURAL DE LA NODULACIÓN DE Frankia - Morella pubescens H. & B. ex Willdenow, (Myricaceae) "in situ"
MORPHOLOGIC, HISTOLOGIC AND ULTRASTRUCTURAL STUDY OF THE NODULATION OF Frankia-Morella pubescens H. y B. ex Willdenow, (Myricaceae)"in situ"
GERARDO ANDRÉS TORRES RODRÍGUEZ1, JAIRO A MURCIA VELASCO2
1 Universidad del Cauca - Unidad de Microscopía Electrónica.
2 Universidad del Cauca - Biólogo Programa de Biología.
Correspondencia: Andrés Torres. E-mail: gator@unicauca.edu.co
Recibido para evaluación: Abril 7 de 2008. Aprobado para publicación: Julio 10 de 2008
RESUMEN
Las raíces de Morella pubescens H. & B. ex Willdenow, se encuentran en simbiosis con el actinomiceto del género Frankia, conocido como actinorriza. La simbiosis le permite a la planta fijar dinitrógeno y al actinomiceto adquirir fuentes de carbono. Se conocen aproximadamente 270 especies de plantas que presentan este mismo tipo de simbiosis. Este trabajo tiene como objetivo caracterizar las estructuras y proceso infectivo en la asociación simbiótica de Frankia sp en las raíces de Morella pubescens. Los nódulos se colectaron se describieron en su morfología externa y se procesaron para Microscopia óptica de alta resolución, Electrónica de Transmisión y tinciones de histoquímica. Los resultados mostraron un patrón de infección muy organizado y las estructuras típicas de la invasión por parte de Frankia sp en el tejido radicular de la planta observándose claramente la ultraestructura de las hifas y vesículas fijadoras de nitrógeno.
PALABRAS CLAVE:
Actinorriza, ultraestructura, simbiosis, actinomiceto.
ABSTRACT
Morella pubescens H. y B. ex Willdenow is a plant that carries out a symbiosis with an actinomicet of the species Frankia over the radical tissue of certain plants, which makes it known as actinorrize, of which 270 species are found and by which dinitrogen, contained in an unavailable form in the atmosphere can be fixed symbiotically to organic nitrogen: nitrates and ammonia. The work has as its objective to characterize the structures and infective process in the symbiotic association of Frankia sp in the roots of Morella pubescens. The nodes were collected, their external morphology was described and they were processed for high resolution optic Microscopy, Electronic Transmission and tinctures of histo-chemistry. The results showed a very organized infection pattern and structures typical of invasion by Frankia sp in the radical tissue of the plant, clearly observed in the ultra structure of the hiphas and fixed vesiculars of nitrogen.
KEYWORDS:
Actinorhizal plants, ultrastructure, symbiosis, actinomycete
INTRODUCCIÓN
Morella pubescens H. & B. ex Willdenow (Myricaceae) es una planta que realiza una relación de simbiosis con un actinomiceto del género Frankia sobre el tejido radicular de algunas plantas, por lo cual se conocen como actinorriza [1] y entre las que se encuentran 270 especies [2] pertenecientes a 25 géneros [3] y 8 familias [4], a través de esta asociación pueden fijar simbióticamente el dinitrógeno, contenido en la atmósfera de una forma no disponible, a nitrógeno orgánico: nitratos y amonio [5].
Una parte del nitrógeno es utilizado para el metabolismo de la planta, la cual le da a la bacteria una fuente de carbono [6] [7], y el excedente es agregado al suelo para ser utilizado por otros organismos, principalmente plantas y bacterias [8].
Frankia es un género de bacterias grampositivas filamentosas que utilizan nitrógeno atmosférico para crecer. En medio de cultivo estas bacterias se caracterizan por desarrollar estructuras como hifas, vesículas y esporangios, sin embargo, cuando forma asociaciones no siempre desarrolla esporangios y vesículas, depende de la planta hospedera, en esta investigación se muestran las estructuras más evidentes y típicas de esas asociaciones.
En Colombia Morella pubescens es conocida con el nombre de "laurel de cera" u "Olivo de cera", en razón a que sus frutos producen una gran cantidad de cera [9]. Esta planta vinculada a la familia Myricaceae [10], promisoria para la recuperación de suelos degradados y cuencas hidrográficas [11] [12]; es utilizada para mejorar el campo de pastoreo [11] y como fuente de obtención de cera [13].
Los árboles y arbustos fijadores de nitrógeno pueden asociarse con cultivos agrícolas, también como bancos forrajeros y como cercas vivas.
El Laurel de Cera tiene gran variedad de productos y usos como: obtención de cera, leña, carbón, madera, productos medicinales e industriales, sombra, división de lotes y demarcación de linderos, barreras rompevientos, control de erosión, refugio de avifauna silvestre, reciclaje de nutrimentos [14]. Por otra parte esta especie incrementa el nivel de nitrógeno al suelo a través de materia orgánica suministrada por hojas, flores y raíces muertas.
A pesar de la importancia ecológica que tiene para el suelo esta especie no se ha realizado un estudio macroscópico (nódulos), histológico y ultraestructural de la simbiosis y sus células infectadas. Este trabajo tiene como objetivo caracterizar las estructuras y proceso infectivo en la asociación simbiótica de Frankia sp en las raíces de Morella pubescens.
METODOLOGÍA
Se tomaron 10 plantas adultas de las cuales se seleccionaron igual número de nódulos, estas se colectaron en la vereda La Esperanza (2200 m.s.n.m), municipio de Sotará y kilómetro 3 vía Popayán Coconuco.
Las muestras transportadas al laboratorio debidamente refrigeradas, fueron sometidas a un proceso de limpieza para registro fotográfico y medición de nódulos, se seleccionaron tres de estos al azar por cada planta los cuales se fijaron en glutaraldehído al 2% en búffer de fosfato (BP) 0.2M pH 7.4. y conservadas a 4°C hasta su procesamiento.
Microscopía Óptica de Alta Resolución (MOAR)
Las muestras, fijadas con glutaraldehído, fueron lavadas en BP 0.2M pH 7.4 y posfijadas en OsO3 2% en BP 0.2M pH 7.4, deshidratadas en alcoholes ascendentes y acetona, infiltradas en resina spurr, y finalmente orientadas en moldes de inclusión [15], para la obtención de cortes de espesor de 1 a 5 µm en ultramicrótomo Leica Ultracut. Los tejidos teñidos con azul de toluidina fueron observados en microscopio de alta resolución Microphot Nikon.
Histoquímica
Las muestras fijadas con glutaraldehído y cacodilato de sodio 0.2M pH 7.2 fueron deshidratadas en alcoholes ascendentes, posteriormente se infiltraron en Xilolparafina y posteriormente se orientaron en moldes con parafina 52°C. El material se cortó en Microtomo a un espesor de 6 a 7µm, se tiñeron con azul mercúrico de bromofenol (AMB), verde rápido - safranina (VR-S), y Lugol, previamente desparafinados con xilol. La preparación de los reactivos se hizo de acuerdo a Jensen (1962)[16]. El tejido fue observado en microscopio de campo claro Nikon Microphot.
Las muestras para MOAR e histoquímica se procesaron en el Sistema de Análisis de Imágenes Leica Qwin 550.
Microscopía Electrónica de Transmisión (MET)
A partir de los bloques procesados para MOAR se obtuvieron cortes de 60 a 90nm los cuales se recogieron en rejillas y se tiñeron con acetato de uranilo y citrato de plomo para su observación al Microscopio Electrónico de Transmisión Jeol 1200 EX.
RESULTADOS
Morfología Externa
Los nódulos de Morella se encontraron en suelos arenosos y con poca materia orgánica. Estos se originan vía infección pelo radicular de un punto de infección para formar uno, o varios primordios lobulares que crecen por expansión de la punta distal del lóbulo y se ramifican por la división del meristemo, presentan raicillas nodulares son perennes y sus nódulos no se compactan entre ellos. Presentan una coloración café y un tamaño intermedio de 2 a 3 cm², con una extensión lobular de 0.3 cm² (Figura 1).

Microscopía Óptica de Alta Resolución
Para los análisis de MOAR se tomaron diferentes bloques observándose características histológicas así como el patrón de infección sin diferencias significativas entre estos. La bacteria Frankia sp se distribuye en la parte media del córtex formando un anillo entre el cilindro central y la epidermis. En la figura 2 se puede observar claramente el cilindro central con floema y un xilema de paredes celulares engrosadas, el endodermo caracterizado por el engrosamiento de la pared celular y su notable tinción. Se hace muy evidente la presencia de células corticales infectadas y las no infectadas, determinándose un patrón de infección muy organizado.
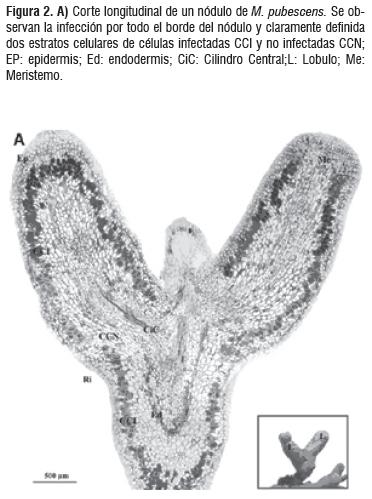
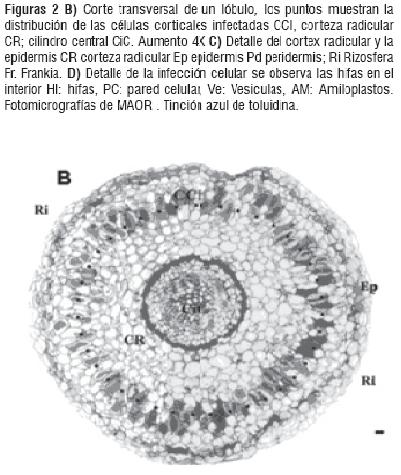
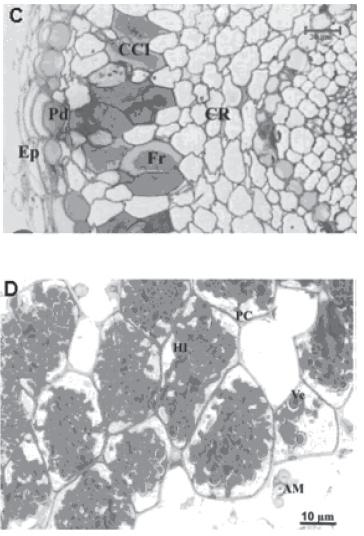
Pruebas de Histoquímica
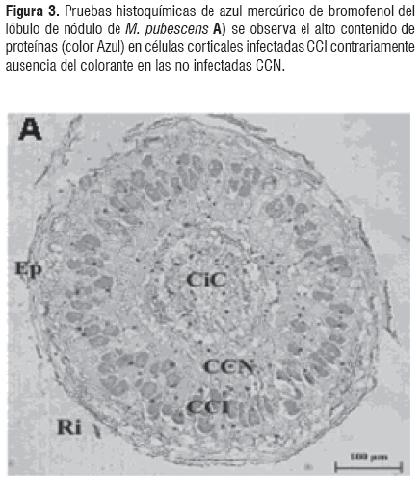
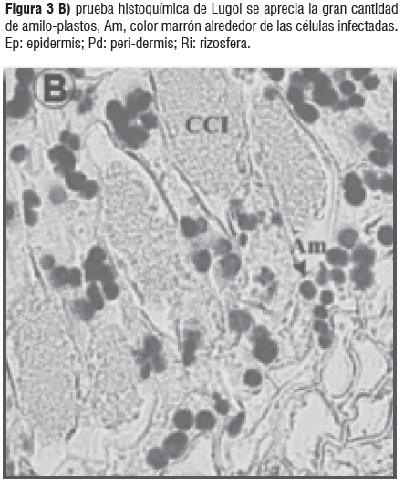
La prueba de Azul Mercúrico de Bromofenol muestra la alta actividad de división celular y metabólica evidenciada por la tinción de las proteínas, Figura 3A). Los mismos resultados se observaron con la prueba con Verde Rápido - Safranina la cual evidenció el alto contenido de material de replicación característico de la alta actividad de división celular. La tinción con lugol mostró el alto contenido de amiloplastos en las células del parénquima alrededor del anillo de infección, esto se debe a los altos requerimientos de carbón por parte de la bacteria (Figura 3B)
Microscopía Electrónica de Transmisión
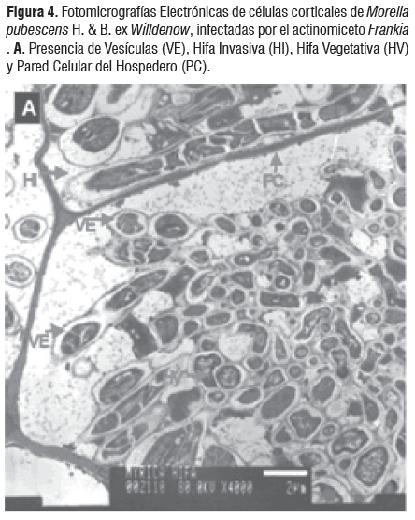
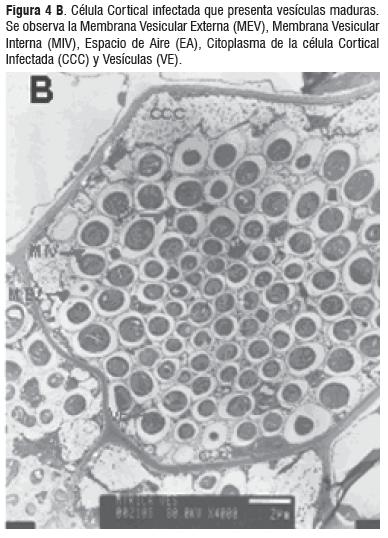
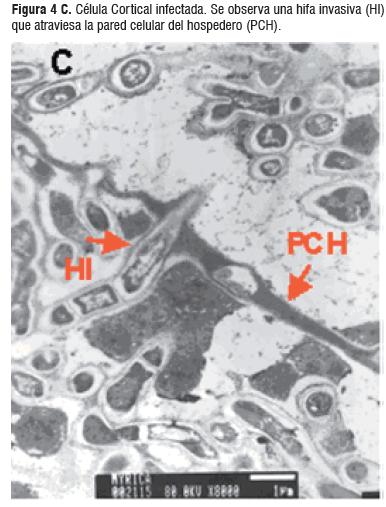
Las observaciones muestran las estructuras del proceso infectivo de Frankia como hifas y vesículas, características en la simbiosis del género Morella. La figura 4A) muestra diferentes tipos de vesículas entre éstas las maduras que se caracterizan por la septación interna. Igualmente se hace muy evidente una gran cantidad de vesículas maduras con espacios vacíos, que indican la efectividad de la fijación de nitrógeno y el aislamiento de la vesícula para proteger la nitrogenasa del oxígeno, Figura 4B). La figura 4C) muestra la forma de infección intracelular de una hifa invasiva septada la cual rompe la pared celular de las células de la planta.
CONCLUSIONES
Los nódulos de la simbiosis Frankia - Morella pubescens presentan el patrón de desarrollo y crecimiento de los nódulos tipo Morella caracterizado por un tipo de infección vía pelo radicular a partir de un punto que origina uno o mas primordios lobulares que crecen por expansión de la punta distal del lóbulo y se ramifica por la división del meristemo con raicillas nodulares perennes y nódulos no compactados.
La zona de infección de Frankia en los lóbulos nodulares de Morella pubescens tiene la forma de un anillo que se encuentra en la zona media del córtex entre el cilindro central y la epidermis, ya que estas células corticales son excretoras con alto contenido de retículo endoplasmático, aparato de golgi y ribosomas, lo que le asegura a la bacteria los altos requerimientos proteínicos para la formación de sus estructuras.
En las células corticales de los lóbulos nodulares de Morella pubescens, Frankia desarrolla sus estructuras características: hifas y vesículas fijadoras de nitrógeno, sin observarse los esporangios posiblemente debido a que la bacteria no se encontraba en etapa de esporulación.
Un gran número de amiloplastos alrededor de la zona de infección muestra los altos requerimientos de carbono por parte de la bacteria.
La evidencia de material de replicación y alto contenido proteínico en la zona de infección muestra la alta actividad de división celular y metabólica de la bacteria dentro de las células corticales infectadas del hospedero.
AGRADECIMIENTOS
Agradecemos la colaboración prestada por el profesor Nelson Rojas docente de la Universidad del Cauca - Departamento de Biología quien aportó su asesoría en las pruebas histoquímicas mostradas en este trabajo.
REFERENCIAS
[1] BERRY, A. M; MCINTYRE, L y MCCULLY M. E. Fine-structure of root hair infection leading to nodulation in the Frankia-Alnus symbiosis. En Canadian Journal of Botany. Vol. 64, 1986. p. 292-305. [ Links ]
[2] SWENSEN, Susan and MULLIN, Beth. Phylogenetic relationships among actinorhizal plans. The impact of molecular systematics and implications for the evolution of actinorhizal symbioses. En Physiologia plantarum. Vol. 99, 1997. p. 565 - 573. [ Links ]
[3] HUSS DANELL, K. Actinorhizal symbiosis and their N2 fixation. New Phytol. Vol. 136, 1997. p. 375 - 405. [ Links ]
[4] McEWAN, Neil y GATHERER, Derek. Codon indices as a predictor of gene functionality in Frankia operon. Canadian Journal of Botany. Vol. 77, No. 9; Septiembre, 1999. p. 1287 - 1292. [ Links ]
[5] SALOMÓN, Eldra Peral et al. Biología de Ville: Ecología. 3ed. Santafé de Bogotá: Mcgraw - Hill, 1998. p. 1083. ISBN 968 - 25 - 2393 - 6. [ Links ]
[6] NEWCOMB, William; BAKER, Dwight y TORREY, John. Ontogeny and structure of effective root nodules of the autumn olive (Elaeagnus umbellata). Canadian Journal of Botanic. Vol. 65, 1987. p. 80 - 94. [ Links ]
[7] NEWCOMB, William and WOOD, Susan. Morphogenesis and fine structure of Frankia (actinomycetales): The microsymbiont of nitrogen - fixing actinorhizal root nodules. International Review of Cytology. Vol. 109, 1987. p.1 - 88. [ Links ]
[8] TORREY, John G. Nitrogen fixation by actinomycete - nodulated angiosperms. Bioscience. Vol. 28, No. 9. Septiembre, 1978. p. 586 - 592. [ Links ]
[9] PARRA, C. Taxonomía del género Morella (Morellaceae) en Colombia. Santafé de Bogotá: Pontificia Universidad Javeriana, 1998. p. 195. [ Links ]
[10] PARRA, C. Revisión taxonómica de la Familia Myricaceae en Colombia Caldasia 2003. 25(1) : 23-64. [ Links ]
[11] GONZAGA, L. Obtención de marcadores moleculares para la caracterización del germoplasma de Aliso Cerezo (Alnus acuminata H.B.K) de dos cuencas hidrográficas en los departamentos de Risaralda y Quindío. Ciencia et Técnica. Vol. 55, No. 16; Agosto, 2001. p. 145 - 149. [ Links ]
[12] BENSON, D y SILVESTER, W. Biology of Frankia Strains, Actinomycete Symbionts of Actinorhizal Plants. Microbiology Review. Vol. 57, No. 2, June, 1993. p. 293 - 319. [ Links ]
[13] ROBELLO, N y TITUANA, S. Producción técnica y comercial de cera de laurel en el municipio de La Cruz Nariño. Trabajo de grado - Universidad del Cauca, 2000. [ Links ]
[14] BOTERO, Raúl y RUSSO, Ricardo. Utilización de árboles y arbustos fijadores de nitrógeno en sistemas sostenibles de producción animal en suelos ácidos tropicales. Agroforestería para la producción animal. Febrero, 1997. p. 121 - 143. [ Links ]
[15] GONZÁLES SANTANDER, R. Técnicas de Microscopía Electrónica en Biología. 1977 .p 48 - 60. [ Links ]
[16] JENSEN, William. Botanical Histochemestry. Freeman & Co. 1962. [ Links ]














