Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Prospectiva
Print version ISSN 1692-8261
Prospect. vol.13 no.2 Barranquilla July/Dec. 2015
https://doi.org/10.15665/rp.v13i2.488
DOI: http://dx.doi.org/10.15665/rp.v13i2.488
Análisis cinético de la Adsorción de Cr (VI) en soluciones acuosas a concentraciones de 10-20 mg/L con el uso de cáscara de yuca amarga (Manihot esculenta)
Sorption kinetic analysis of Cr (VI) in aqueous solutions at concentrations of 10-20 mg/L using bitter cassava peel (Manihot esculenta)
Alberto Albis A.1, Laura V. Cajar R.2, Miguel I. Domínguez L.2
1 Doctor en Ciencias. Grupo de Investigación en Bioprocesos. Facultad de Ingeniería. Universidad del Atlántico. Barranquilla-Colombia
2 Grupo de Investigación en Bioprocesos. Facultad de Ingeniería. Universidad del Atlántico. Barranquilla-Colombia
E-mail: albertoalbis@mail.uniatlantico.edu.co
Recibido 10/06/15, Aceptado 30/06/2015
Cite this article as: A. Albis, L. Cajar, M. Domínguez,, "Sorption kinetic analysis of Cr (VI) in aqueous solutions at concentrations of 10-20 mg/L using bitter cassava peel (Manihot esculenta)", Prospect, Vol 13, N° 2, 64-71, 2015.
Resumen
Este documento muestra el estudio cinético realizado sobre la sorción de cromo hexavalente Cr (VI) en soluciones acuosas para un rango de concentraciones iníciales entre 10-20 mg/L utilizando cáscara de yuca amarga (Manihot esculenta) como material adsorbente. Para ello, se realizaron pruebas experimentales que permitieron identificar la cantidad de Cr (VI) adsorbida por el material lignocelulósico en intervalos de tiempo definidos. Se desarrolló el estudio cinético para entender el mecanismo del proceso de adsorción y la cinética de la velocidad de adsorción de Cr(VI) y el modelo que mejor se ajustó fue el modelo cinético de pseudo segundo orden.
Palabras clave: Adsorción; Cromo hexavalente Cr(VI); Cáscara de yuca; Cinética de adsorción; Modelos cinéticos.
Abstract
This document shows a kinetic sorption study of hexavalent chromium Cr (VI) in aqueous solutions for a range of initial concentrations of 10-20 mg/L using bitter cassava peel (Manihot esculenta) as adsorbent material. To this end, experimental tests which allowed identifying the amount of Cr (VI) adsorbed on the lignocellulosic material in established time intervals were performed. The kinetic study performed to understand the mechanism of the adsorption process and the kinetics of the adsorption of Cr (VI). The best fitting was presented by the pseudo second order kinetic model.
Key words: Adsorption; Hexavalent chromium Cr (VI); Cassava pee; Adsorption kinetics; Kinetic models.
1. Introducción
El incremento de uso de metales y sustancias químicas en los procesos industriales ha dado paso a la generación de grandes cantidades de efluentes acuíferos que contienen altos niveles de contaminantes orgánicos e inorgánicos. Se sabe que la presencia de metales pesados en el ambiente acuático causa daños severos a estos ecosistemas; además de que eliminan microorganismos durante los tratamientos biológicos de aguas residuales, lo que ocasiona que el proceso de purificación decaiga. Además de lo anterior, las sales de estos metales pesados son solubles en agua y por consecuencia no pueden ser separadas por métodos ordinarios[1].
Uno de los metales más ampliamente usado en la industria química es el cromo, el cual se encuentra en rocas, plantas, suelos, el polvo volcánico, los humanos y animales. El cromo se manifiesta en el medio ambiente más comúnmente en su forma trivalente Cr (III), hexavalente Cr (VI) y en la forma metálica Cr (0) elemental. El Cr (III) ocurre naturalmente en muchos vegetales, frutas, carnes, granos y levadura. El Cr (VI) y el Cr elemental son generalmente producidos mediante procesos industriales.
Los derivados del Cr (cromatos y dicromatos), usualmente, son de origen antropogénico, que en sus altas concentraciones producen toxicidad para las plantas, ocasionando disminución en la incorporación de calcio, de potasio, de fósforo, de hierro y de manganeso, además, de afecciones en el metabolismo de los carbohidratos y disminución de la clorofila [2]. La Agencia de Protección del Ambiente (EPA) de los EE. UU considera al Cr (VI) como uno de los 17 agentes químicos más dañinos para la salud. Mientras que las otras formas del cromo son poco tóxicas e incluso necesarias para las formas de vida.
Existen métodos para la remoción/reducción del Cr (VI) del agua tales como fitorremediación, tratamiento electroquímico, aislados microbianos, coagulación floculación, biosorción, entre otros[3, 4]. De estos, la biosorción resulta un método efectivo y económico debido al empleo de biomasa que es desecho del procesamiento de algunos alimentos.
En estudios previos, se ha encontrado que la cáscara de yuca dulce (Manihot esculenta) remueve de manera efectiva el Cr (VI) de soluciones acuosas [4]; en este artículo se pretende mediante investigación con firmar que el biosorbente (cáscara de yuca[5]) cumple el propósito de remover el metal (Cr), además de las variables que afectan la remoción, y por supuesto, un modelo cinético que se ajuste al comportamiento de la biosorción del Cr (VI) cuando se encuentre en cuerpos de agua a concentraciones entre 10 y 20 mg/L.
2. Metodología
2. 1 Obtención del adsorbente y preparación
La cáscara de yuca se adquirió en el municipio de Juan de Acosta del departamento del Atlántico (Colombia) a través de cultivadores de la zona. Se realizó un tratamiento previo a su utilización como adsorbente que consistió en: lavado con agua de grifo y secado al sol durante 48 horas, posterior lavado ácido (pH=3) con ácido sulfúrico H2SO4 con agitación constante durante 6 horas, secado en horno a 105°C durante 24 horas y molienda y tamizado del material seco para la selección del tamaño de partícula (Dp<150µm) utilizado en la parte experimental.
2. 2 Reactivos
Los reactivos utilizados dicromato de potasio, ácido sulfúrico, hidróxido de sodio, ácido clorhídrico, Pftalato de potasio, bicarbonato de sodio, carbonato de so-dio, fenolftaleína fueron de grado analítico.
Se preparó una solución madre de Cr (VI) a 1000 ppm por disolución de dicromato de potasio en agua desionizada. Las soluciones de trabajo fueron preparadas por dilución de la solución madre con agua desionizada. El pftalato de potasio, el ácido clorhídrico, el hidróxido de sodio, el bicarbonato de sodio, el carbonato de sodio y la fenolftaleína, fueron utilizadas durante la titulación Boehm.
2. 3 Equipos
El pH de las soluciones se determinó utilizando un medidor de pH Thermo Electronic Corporation modelo Orión 210A+. La concentración de cromo en solución se midió por fluorescencia de rayos X de reflexión total con un Espectrómetro S2 PICOFOX (Bruker), utilizando como están dar interno una solución estándar de galio (Sigma) con una concentración de 998 mg/L. Los espectros de FTIR se midieron en un espectrofotómetro de infrarrojo IRAffinity-1S (SHIMADZU).
2. 4 Experimentos de adsorción
Se diluyeron cantidades adecuadas de la solución stock para obtener 100mL de soluciones de Cr (VI) a 10, 13, 17 y 20ppm. Se agregó HCL 0,1M para llevar el pH de las soluciones a 2. 0 A cada una de estas soluciones se agregó 1. 0 g de cáscara de yuca y se agitó mediante el uso de agitador magnético.
Cada 3 minutos se tomó una alícuota de cada solución, se centrifugó y se separó el sobrenadante para analizar la cantidad de cromo (VI) remanente. Este procedimiento se realizó por 30 minutos para cada corrida y a tres temperaturas diferentes (25, 20 y 35°C).
El porcentaje de remoción de Cr (VI) fue calculado con la da por una difusión intraparticular, por ello se plantea la siguiente expresión: siguiente ecuación:
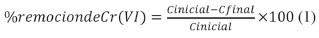
Todos los experimentos fueron realizados por duplicado para validación estadística.
2. 5 Modelos cinéticos
Para encontrar el modelo matemático que describa de mejor manera el fenómeno de adsorción entre el Cr (VI) y la cáscara de yuca, se realizó regresión a los resultados experimentales a partir de modelos ya establecidos.
2. 5. 1 Modelo cinético pseudo primer orden
Este modelo se ha aplicado a varios sistemas de adsorción, tales como cáscaras de cacahuate para la adsorción de Cr(VI), residuos de té y café para la adsorción de Cr(VI), Cd(II) y Al(III), carbón activado para CN-, ceniza volátil para Cr(VI) y o-xileno, tal y como lo reportan Ho y McKay [6][7].
Este modelo asume la biosorción como una reacción de primer orden en cada uno de sus reactantes y presenta la siguiente expresión:
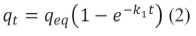
2. 5. 2 Modelo cinético pseudo segundo orden
Este modelo fue desarrollado por Ho y McKay [7]y dado a conocer en 1999, en él se supone que el adsorbato se adsorbe en dos sitios activos de la biomasa y la ecuación que describe este modelo es la siguiente:
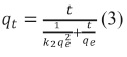
2. 5. 3 Modelo cinético de Elovich
Matemáticamente descrito por la siguiente ecuación:
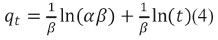
Este modelo describe la quimisorción de fases sobre superficies solidas considerando un intercambio de especies en la superficie homogénea del sólido.
2. 5. 4 Modelo de Difusión Intraparticula
Por otro lado algunas veces existe la posibilidad de que el paso limitante de la velocidad pueda estar influenciada por una difusión intraparticular, por ello se plantea la siguiente ecuación:
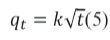
2. 6 Ecuación de Arrhenius
En 1889 Arrhenius expresó la relación entre la constante cinética de velocidad de una reacción química y la temperatura de la siguiente forma:
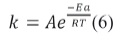
En 1889 Arrhenius expresó la relación entre la constante cinética de velocidad de una reacción química y la temperatura de la siguiente forma:
R es la constante de los gases, 8. 3145 JK-1 mol-1 y Esa es la energía de activación en J/mol, T es la temperatura absoluta en K. A es el factor pre-exponencial cuyas unidades son iguales a las de la constante de velocidad k[8].
2. 7 Análisis FTIR
Para encontrar los sitios activos de la cáscara de yuca. Las muestras fueron sometidas a un proceso de secado para eliminar su humedad, se encapsularon en discos mezclando la cáscara de yuca con bromuro potásico y luego se analizaron por FTIR. El rango de frecuencias empleado fue el comprendido entre 350 y 7500 cm-1.
2. 8 Porosidad del adsorbente
La porosidad del lecho se determinó por el desplazamiento del aire del lecho, mediante agua en un determinado volumen de la cáscara de yuca empacada. En una probeta se colocó la muestra y se llevó a ras con agua hasta el nivel de los sólidos. Seguidamente se estableció por diferencia el agua desplazada[4].
3. Resultados
3. 1 Caracterización de material adsorbente
El pH de la cascara de yuca medido para tres muestras diferentes, presenta un valor promedio de 3,78. Para cuantificar los sitios activos de la cáscara de yuca se empleó la titulación Boehm y análisis FTIR. A fin de determinar los grupos funcionales responsables de la remoción de Cr (VI), se procedió al análisis FTIR del material antes y después del proceso de adsorción. Como se muestra en la figura 1, el espectro de infrarrojo muestra picos anchos en el espectro, lo cual indica la naturaleza compleja del material adsorbente. La vibración de estiramiento del enlace O-H aparece alrededor de los 3400 cm-1. Es una absorción intensa y amplia (desde 3600 hasta 3200 cm-1 aproximadamente). El ancho e intenso pico a 3450 cm-1 es un indicativo de la presencia de grupos hidroxilo.
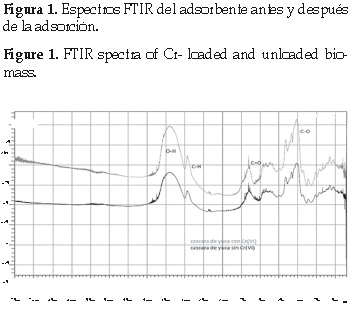
El pico observado a 2900 cm-1 corresponde a un estiramiento y deformación del grupo C-H. El pico alrededor de 1650 cm-1 corresponde al estiramiento del enlace C=O que se manifiesta entre los 1725 y 1700 cm-1. Es una banda muy ancha característica indicando presencia de grupos carboxilos. La intensa banda entre 1000 y 1200 cm-1 corresponde al grupo C-O de alcoholes y fenoles que presenta absorciones fuertes de tipo estiramiento entre los 1260 y 1000 cm-1. Los espectros para el proceso antes y después de la adsorción presentan un comportamiento similar, con la única diferencia en la longitud de estiramiento de sus picos[9].
Que se manifiesta entre los 1725 y 1700 cm-1. Es una banda muy ancha característica indicando presencia de grupos carboxilos. La intensa banda entre 1000 y 1200 cm-1 corresponde al grupo C-O de alcoholes y fenoles que presenta absorciones fuertes de tipo estiramiento entre los 1260 y 1000 cm-1. Los espectros para el proceso antes y después de la adsorción presentan un comportamiento similar, con la única diferencia en la longitud de estiramiento de sus picos [9].
Mediante la titulación Bohem se encontró la concentración de sitios ácidos, básicos y los grupos funcionales lactónicos, fenólicos y carboxílicos como se muestra en la tabla 1.

Como se puede observar, el grupo carbonilo descrito por el pico en el análisis FTIR, confirma la presencia del grupo carboxílico y lactónico; el enlace OH confirma la presencia de grupo fenólico y sitios activos básicos. En la figura 1, se puede observar que luego de que el Cr (VI) interactúa con el bioadsorbente, la absorbancia (abs) del enlace aumenta debido a la formación de un complejo entre el Cr(VI) y el sitio activo.
3. 2 Efecto de la cantidad de adsorbente en la remoción de Cr (VI)
Se tomaron 3 recipientes con 100mL de solución de Cr (VI) a 100ppm y pH 2 cada uno, y se añadieron cantidades distintas de cáscara de yuca (entre 1. 0 y 5. 0 g) a una temperatura de 30°C. Se agitaron durante una hora y se tomaron tres muestras durante cada experimento.
La tabla 2 muestra los valores de remoción obtenidos a diferentes cantidades de adsorbente.

Se tomaron 3 recipientes con 100mL de solución de Cr (VI) a 100ppm y pH 2 cada uno, y se añadieron cantidades distintas de cáscara de yuca (entre 1. 0 y 5. 0 g) a una temperatura de 30°C. Se agitaron durante una hora y se tomaron tres muestras durante cada experimento.
Se puede observar que al aumentar la cantidad de cáscara de yuca empleada, aumenta la cantidad de Cr(VI)adsorbida. Esto se explica por la mayor cantidad de sitios activos disponibles puesto que la cáscara de yuca contiene materiales vegetales lignocelulósicos con muchos hidroxilos y grupos carboxílicos que son responsables de la unión de iones e Cr (VI) en la solución acuosa; sin embargo la disponibilidad de un grupo funcional en particular o sitio de adsorción no garantiza necesariamente su accesibilidad como sitio de adsorción para un ion del metal debido a que presenta barreras esteáricas, conformacionales o de otros tipos[10-12].
3. 3 Efecto de la temperatura en el proceso de adsorción de Cr (VI)
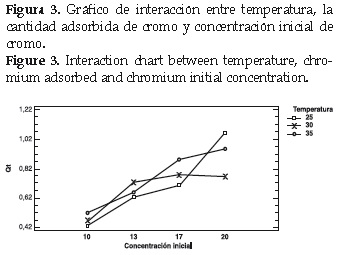
Para analizar el efecto que produce la temperatura sobre la velocidad de adsorción, se comparan los perfiles de remoción para cada una de las concentraciones iníciales planteadas a las temperatura de trabajo (25, 30 y 35°C). Lo anterior se muestra en la figura 2.
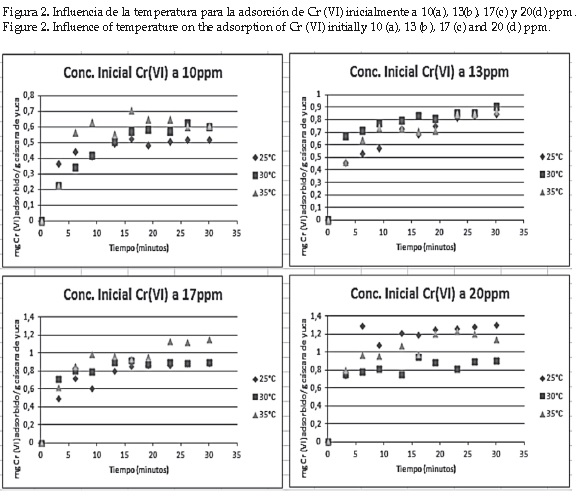
Al observar las figuras anteriores, se analiza que no existe una relación definida al aumentar la temperatura en los distintos ensayos de remoción.
A concentración inicial de 10 ppm y 25°C se aprecia mayor velocidad de adsorción; es decir, se alcanza el equilibrio más rápidamente. Sin embargo, la cantidad de Cr(VI) adsorbida es una poco más baja al comparar el mismo experimento a 30 y 35°C. Se realizó un análisis de varianza para verificar la relación entre los factores tiempo, concentración inicial y temperatura como se muestra en la tabla 3.
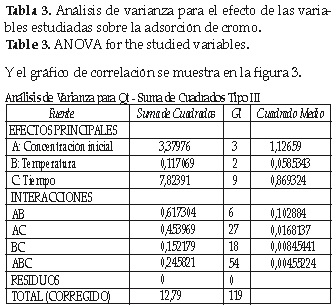
De la tabla 3 se sabe que la temperatura tiene poca influencia en la velocidad de adsorción y en la capacidad de adsorción de Cr (VI) por parte del adsorbente.
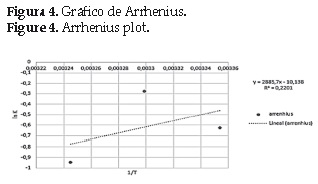
Para conocer la energía de activación del proceso de adsorción a las diferentes temperaturas se aplicó la ecuación de Arrhenius linealizada y obteniendo la figura 4. La energía de activación se calculó como 240kJ/mol.
3. 4 Concentraciones de equilibrio a diferentes temperaturas
La tabla 4 muestra las concentraciones de equilibrio a las temperaturas trabajadas experimentalmente así como su desviación estándar.
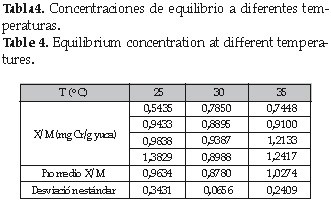
Las desviaciones estandar que muestra la tabla anterior nos dice que los puntos de equilibrio en las temperaturas de estudio se encuentran con una dispersion considerable (alta variabilidad) especialmente en las temperaturas de 25°C y 35°C con respecto al promedio, puesto que en el de 30°C la dispersion es un poco aceptable, por lo cual un modelo lineal (isotermas) dificilmente describe su comportamiento.
3. 5 Estudio de la cinética de adsorción
La cinética de adsorción se estudió a partir de la relación entre la cantidad de Cr (VI) adsorbido por gramo de yuca y el tiempo que tomó llegar a ese valor.
Los resultados se muestran en la figura 5, 6 y 7.
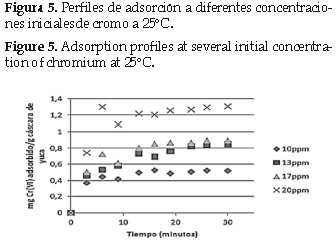
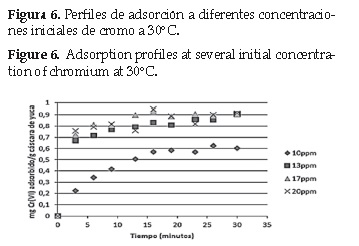
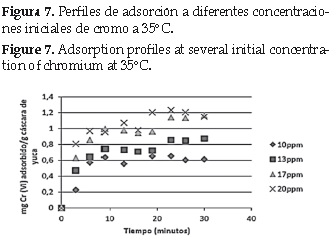
Para establecer el modelo matemático que se ajusta al fenómeno apreciado en las figuras anteriores, se aplicó regresión a los modelos planteados en la sección 2. 5.
Partiendo de las ecuaciones 3, 4, 5 y 6 se calcularon las constantes de velocidad (k) para cada modelo respectivamente, a través del método de los mínimos cuadrados, los resultados se muestran en la tabla 5.
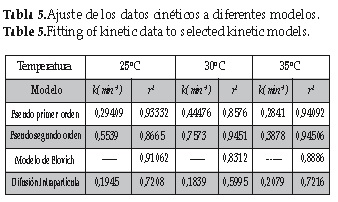
Se puede observar que los modelos que mejor describen el fenómeno son los modelos de pseudo primer y segundo orden. Sin embargo, de manera general, el modelo de pseudo segundo orden presenta mayor grado de correlación promedio (0,92) que el modelo de pseudo primer orden (0,91).
3. 6 Comparación de las constantes de velocidad de adsorción (k) con diferentes adsorbente reportados en laliteratura
Se determinó anteriormente que el modelo cinético que mejor se ajusta a los datos experimentales es el de pseudo-segundo orden; por tal razón, el valor de k obtenido por dicho modelo ha sido comparado con otros adsorbentes reportados en la literatura a pH 3, 30°C, 50ppm de Cr (VI) inicial y 1 gramo de bioadsorbente empleado. Estos se muestran en la tabla 6.
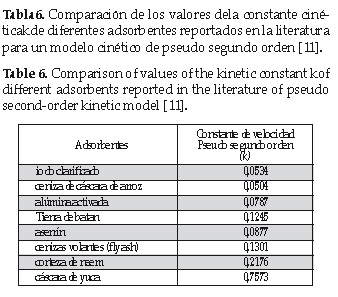
De los resultados se puede observar que los valores de k se encuentran en el mismo orden de magnitud. Los valores de k de los otros adsorbentes comparados con los de la cáscara de yuca, son menores (entre 3 a 14 veces), lo cual se puede atribuir a que los experimentos de la cáscara de yuca fueron trabajados a concentraciones iniciales diferentes y a una mayor velocidad de adsorción de la cáscara de yuca, hipotéticamente debido a la mayor exposición de los sitios activos o a una distribución favorable del tamaño de poro; por otro lado el valor del pH 2 utilizado en la experiencia es menor al de los otros adsorbentes pH 3. Para este caso, el estudio realizado por Bhattacharya, Das [10], explica que los cambios de pH influyen en el proceso de remoción, y es conocido que ha valores de pH bajos la presencia de iones H+ es mayor, aumentando la probabilidad de neutralizar las cargas negativas (OH-) sobre la superficie del adsorbente[11].
4. Conclusiones
La cáscara de yuca empleada como adsorbente posee mayor cantidad de sitios activos ácidos (grupos lactónicos, fenólico y carboxílicos) que básicos, por lo cual, favorece la formación de enlaces con moléculas de carga negativa. La mecánica de adsorción del Cr(VI) en solución acuosa para el rango de concentración inicial de 10 a 20ppm utilizando cáscara de yuca como adsorbente se ajusta al modelo de pseudo segundo orden en un grado de correlación con los resultados experimentales del 91,88%. La constante cinética varía entre 0,3878 y 0,5539min-1 para el rango de temperatura comprendido entre 25 y 35°C, sin embargo, la temperatura no influye en la cantidad de Cr (VI) adsorbido en el equilibrio, esta solo depende de la concentración, la cantidad de adsorbente empleado y el pH de trabajo.
Referencias
[1] C. A. S. Sierra and H. G. García, "Verificación analítica para las determinaciones de cromo hexavalenteen aguas por espectrofotometría," Revista Ingenierías USB med, vol. 4, no. 1, pp. 22-26, ene. 2013. [ Links ]
[2] J. Montilla and Acosta M, "Evaluación de la contaminación por cadmio y plomo en agua, suelo, y sedimento y analisis de impactos ambientales en la subcuenca del rio balsillas afluente del rio Bogotá," Trabajo de grado, Fac de Ing. Universidad de la Salle, Bogotá, 2011. [ Links ]
[3] D. Sowjanya, "Eco-friendly remediation of industrial effluents via biosorption technology," Int J Eng Research Technol, vol. 2, no. 11, pp. 1275-1284, nov. 2013. [ Links ]
[4] Pajaro, M. and O. Romero, "Remoción de Cr (VI) en un medio acuoso mediante el uso de la cáscara de la yuca (Manihot esculenta)," Trabajo de grado, Fac. de Ing. Universidad del Atlántico, Atlántico, 2012. [ Links ]
[5] L. Suarez, "Apuntes sobre el cultivo de la yuca (Mani hot esculenta crantz). tendencias actuales," Cultivos Tropicales, vol. 32, no. 3, jul. 2011. [ Links ]
[6] W. Plazinski, "Modeling of sorption kinetics: the pseudo-second order equation and the sorbate intraparticle diffusivity," J IntAdsorp Soc,vol. 19, no. 5, pp. 1055-1064, mar. 2013. [ Links ]
[7] M. L. Pinzón-Bedoya and L. E. Vera Villamizar, "Modelamiento de la cinética de bioadsorción de Cr (III) usando cáscara de naranja," Revista DYNA, vol. 76, pp. 95-106, mar. 2009. [ Links ]
[8] R. Chang, Principios esenciales de química general. México: McGraw Hill, 2006. [ Links ]
[9] J. A. Garzon Santamaria, L. A. González López, and C. D. Tejada Tovar, Adsorción de Cr (VI) utilizando carbón activado a partir de cáscara de naranja, trabajo de grado, Fac de Ing, Universidad de Cartagena, Bolivar, 2012. [ Links ]
[10] A. Bhattacharya, "Adsorption, kinetics and equilibrium studies on removal of Cr (VI) from aqueous solutions using different low-cost adsorbents," Chem Eng J, vol. 137, no. 3, pp. 529-541. abr. 2008. [ Links ]
[11] M. Dakiky, "Selective adsorption of chromium (VI) in industrial wastewater using low-cost abundantly available adsorbents," Adv Environ Res, vol. 6,no. 4, pp. 533-540,oct. 2002. [ Links ]
[12] V. M. Nurchi, and I. Villaescusa, "The chemistry behind the use of agricultural biomass as sorbent for toxic metal ions: pH influence, binding groups, and complexation equilibria," in Biomass - Detection, Production and Usage, D. Matovic, Ed. Slavka,Croacia: INTECH Open Access Publisher, 2011. [ Links ]













