I. Introducción
El cultivar de arracacha (Arracacia xanthorrhiza Bancroft) es una de las especies más ancestrales de los Andes, incluso antes que la papa (Solanum tuberosum L.), conocida también como apio criollo o zanahoria blanca (Castanha,Villar, Matta-Junior, Dos Anjos y Duarte, 2018). Tiene gran importancia económica y uso potencial debido al alto contenido de almidón y carotenoides, que la convierten en una opción económica importante para los pequeños productores (Choquechambi, Callisaya, Ramos, Bosque, Mújica, Jacobsen, Sorensen y Leidi, 2019). Colombia es el segundo país productor de arracacha después de Brasil, con un rendimiento promedio de 12,95 t ha-1, siendo los departamentos de Tolima, Boyacá y Norte de Santander los que presentan mayor producción y áreas de siembra para el año 2022, con 56.455, 17.234 y 8.989 t, respectivamente (Agronet, 2023).
La seguridad alimentaria y la nutrición son una de las principales preocupaciones de los países para lograr esquemas de alimentación sostenibles ante la eminente influencia del cambio climático (Padhan, Biswas y Panda, 2020). Los cultivos de raíces y tubérculos andinos son una fuente alternativa de alimentación, económicamente viables, localmente adaptables y presentan gran resistencia a las variaciones de las condiciones climáticas (Rincón, Ruiz, Molano, Álvarez-Herrera y Pinto, 2021; Pinto-Acero, Alvarado-Gaona y Álvarez-Herrera, 2012), por lo que constituyen un recurso valioso que debe ser preservado y popularizado (Tsehay, Admassu, Admassu y Gebeyehu, 2023). En este sentido, el cultivo de arracacha podría considerarse para resolver problemas de hambre y desnutrición, ya que anteriormente, solo se ha considerado como alimento de "hambruna" (Chandra, Narres, Thenua, Singh y Geethanjali, 2020).
La arracacha es una planta perenne, perteneciente a la familia apiaceae que contiene apios o raíces tuberosas reservantes comestibles de importancia comercial, adaptada entre los 1500 a 3000 m sobre el nivel del mar (Muñoz, Alvarado y Almanza-Merchán, 2015; Atencio, Villamil, Garnica y Martínez, 2022). La multiplicación de la arracacha se lleva a cabo mediante propágulos, conocidos como cormelos, que presentan yemas en su superficie. Estos cormelos varían en número de 9 a 48 y se obtienen de una planta adulta (Matos, Marcano, Azócar y Mora, 2015). Sin embargo, esta forma de propagación ha ocasionado una disminución en la producción, la cual está vinculada a la baja tecnificación y a problemas fitosanitarios (Garnica, Rodríguez, Jaramillo y Vallejo, 2020), ocasionados principalmente, por el uso de material contaminado en la siembra (Atencio et al., 2022), que dispersa la enfermedad a los nuevos cultivos. Del mismo modo, Matos et al. (2015) reportan que esta técnica de propagación disminuye la diversidad genética de los cultivares al mantener genotipos homogéneos entre individuos de manera prolongada durante varios ciclos de cultivo.
Aunado a lo anterior, la tradicional propagación vegetativa hace que la multiplicación de material sea lenta, pues se debe esperar entre 12 y 18 meses para que la planta genere propágulos (colinos), lo cual dificulta muchas veces la consecución de material para la siembra (Matos et al., 2015). Frente a esta problemática, la multiplicación in vitro es una alternativa para la obtención de material de calidad para la siembra (Slíva, Viehmannova y Vitamvas, 2010), ya que permite producir rápidamente una alta cantidad de material vegetal libre de enfermedades, no obstante, la contaminación microbiana usualmente ocurre durante el proceso de propagación en los medios de cultivo, causando muchos problemas, dentro de los que se destacan la reducción en la producción de material vegetal para la siembra y la muerte del propágulo (Huh, Lee, Kim, Kang y Lee, 2015), además, se reportan muy pocos estudios sobre técnicas de propagación para cultivares nativos in vitro, así mismo, la consecución de material de arracacha de calidad en el mercado es difícil, ya que se ha generado escasez de propágulos en el mercado, por lo que no se pueden asegurar siembras con altos rendimientos en las zonas productoras (Atencio et al., 2021).
En este sentido, el objetivo de esta investigación fue establecer un protocolo óptimo para la micropropagación de arracacha, a través de tratamientos de desinfección sobre explantes de arracacha para introducción in vitro, lo que permitiría la multiplicación rápida de clones con características adecuada.
2. Materiales y Métodos
La investigación se desarrolló en el laboratorio de Manejo de Control Biológico de Cultivos, de la Universidad Pedagógica y Tecnológica de Colombia (Boyacá-Colombia), sede Tunja, el cual está ubicado a una altitud de 2703 m, con coordenadas 5° 33' 13'' de latitud norte y 73° 21' 30'' de longitud oeste.
Las plantas de arracacha empleadas corresponden al material 'paliverde', provenientes del municipio de Jenesano (Boyacá), las cuales, fueron sembradas bajo cubierta plástica a una temperatura ambiente promedio de 15,9 °C y humedad relativa del 65%. Se seleccionaron propágulos sanos y libres de daños, los cuales fueron lavados con agua destilada, para eliminar residuos. Posteriormente, se extrajeron explantes de 1 a 2 mm de longitud a partir de los propágulos, a los que se les realizaron los tratamientos de desinfección.
Se realizaron dos fases experimentales de tratamientos de desinfección. En la primera fase se aplicaron 14 tratamientos con diferentes dosis de hipoclorito de sodio (NaClO), alcohol (OH) y tiempos de inmersión (Tabla 1) seleccionadas a partir de estudios realizados por Bedoya-Pérez, Sánchez-Jaramillo, Bermúdez-Gómez, Ramírez-Restrepo (2016) y Ticona y Triguero (2019) Cada tratamiento tuvo ocho repeticiones para un total de 112 unidades experimentales (UE). Los explantes desinfectados fueron sembrados en medio de cultivo Murashige y Skoog (con pH entre 5,7 y 5,8), suplementado con 3 mg.L-1 de 6-Bencilaminopurina (BAP), 0.1 mg.L-1 de ácido 1-naftalenacético (ANA) y esterilizado en autoclave Advance de 18 L (StarClave, Colombia) a 120 °C y 0,1 MPa de presión durante 20 minutos.
Tabla 1 Tratamientos de desinfección de explantes de arracacha con diferentes dosis de desinfectante y tiempos de inmersión (fase uno)
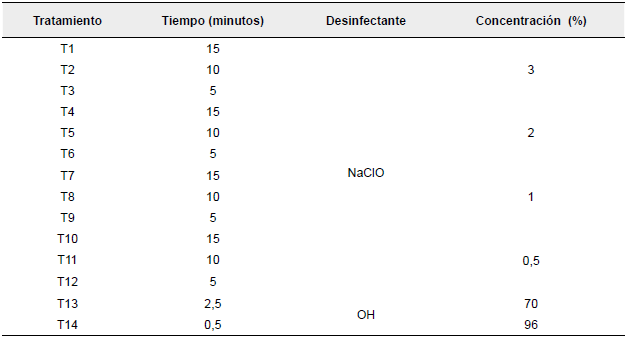
Nota: NaClO: hipoclorito de Sodio; OH: Alcohol
Fuente: Los autores
En la segunda fase, se escogió el tratamiento con mejores resultados en la primera fase, que correspondió a la aplicación de NaClO 2% y se mezcló con nuevas combinaciones de desinfectantes y diferentes tiempos de inmersión, que resultaron en la aplicación de ocho tratamientos con 10 repeticiones, para conformar un total de 80 UE (Tabla 2). A todos los tratamientos del segundo ensayo se les realizó el siguiente procedimiento: los propágulos provenientes de plantas madre fueron lavados 3 veces con jabón comercial y enjugados con agua destilada, posteriormente, se sumergieron en alcohol al 70% durante 1 min y luego fueron inmersos en los diferentes tratamientos. Los explantes fueron sembrados en medio B5 Gamborg (Sigma Aldrich, MO, USA) con pH entre 5,7 y 5,8 suplementado con las mismas dosis de BAP y ANA utilizadas en el medio Murashige y Skoog. Los tratamientos se aplicaron dentro de una cámara de flujo laminar vertical BBS-V700 (Biobase Biodusty, Shandong, China) y luego fueron enjugados tres veces con agua estéril y destilada.
Tabla 2 Tratamientos de desinfección con bactericida y tiempos de inmersión (fase dos)
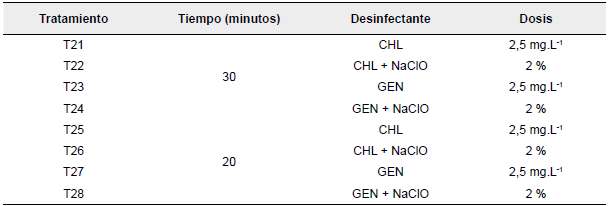
Nota: CHL: Cloranfenicol; NaClO: hipoclorito de sodio; GEN: Gentamicina
Fuente: Los autores
Se evaluó el porcentaje de contaminación de explantes, para lo cual se determinó el número de explantes contaminados por tratamiento y dividiéndolo en el total de explantes sembrados. El porcentaje de muerte celular se determinó como el número de explantes muertos al final de los ensayos, dividido en el total de explantes sembrados, expresado en porcentaje.
Se descartaron los datos atípicos mediante una prueba de normalidad de Kolomgorov-Smirnov. Posteriormente, los resultados obtenidos fueron sometidos a un análisis de varianza (Anova) para diferenciar los tratamientos y mediante una prueba de comparación de diferencias mínimas significativas (DMS) (P<0,05), estos fueron clasificados, usando el software SAS 9,2e (SAS Institute Inc, Cary, NC).
3. Resultados y Discusión
Fase Uno
Los tratamientos que presentaron mayor capacidad desinfectante en los explantes de arracacha fueron la aplicación de NaClO al 3% durante 5 y 15 min (T3 y T1), y de NaClO al 2% por 15 min (T4), mientras que, los tratamientos que reportaron mayor contaminación fueron T13 y T14, los cuales correspondían a la aplicación de alcohol al 70% y 96%, respectivamente (Figura 1). Lo anterior ocurre debido a que el hipoclorito de sodio causa daño en la membrana celular de las bacterias y origina lisis del microorganismo, debido a que el cloro libre en el compuesto es capaz de oxidar y dañar las estructuras celulares (Da Cruz-Nizer, Inkovskiy y Overhage, 2020).
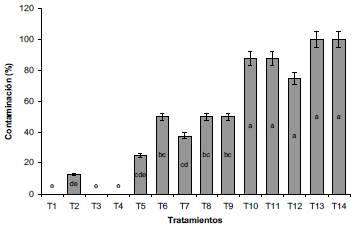
Fuente: Elaboración propia
Figura 1 Porcentaje de contaminación de explantes de arracacha sometidos a diferentes tratamientos de desinfección. TI: NaClO 3%, I5 min; T2: NaClO 3%, I0 min; T3: NaClO 3%, 5 min; T4: NaClO 2%, I5 min; T5: NaClO 2%, I0 min; T6: NaClO 2%, 5 min; T7: NaClO I%, I5 min; T8: NaClO I%, I0 min; T9: NaClO I%, 5 min; TI0: NaClO 0,5%, I5 minfTM: NaClO 0,5%, I0; TI2: NaClO 0,5%, 5 min;TI3: OH 70%, 2,5 min;TI4: OH 96%, 0,5 min. NaClO: Hipoclorito de Sodio; OH: Alcohol. Letras distintas indican diferencias significativas de acuerdo a la prueba de DMS (P≤0,05).
Al respecto, el hipoclorito de sodio es capaz de dañar la membrana celular de varias maneras, mediante la oxidación de los lípidos, ya que el cloro puede reaccionar con los lípidos de la membrana celular, causando la oxidación y desestabilización de la bicapa lipídica, lo que provoca la pérdida de la integridad estructural de la membrana y conlleva la muerte celular. También, el hipoclorito de sodio modifica y desnaturaliza las proteínas de la membrana, lo que puede afectar su función y estructura, alterando el transporte de sustancias a través de la membrana, aumentar la permeabilidad y generar daño celular (Huang, Zhang, Wang, Gu, Zhou, Wu y Wang, 2023). Así mismo, genera aumentos de especies reactivas de oxígeno intracelulares, que son moléculas inestables y reaccionan con los componentes de la membrana celular, como los lípidos y las proteínas, para provocar daño oxidativo (Wang, Ni, Hou, Ma, Zhang, Li y Gao, 2023).
Del mismo modo, se observó que los tratamientos correspondientes a NaClO al 0,5% (T10, T11 y T12) presentaron altos porcentajes de contaminación (>70%), lo cual indica que las concentraciones de hipoclorito son un factor importarte para ocasionar la lisis de las paredes celulares de las bacterias fitopatógenas. Además, se apreció que, al incrementar la concentración del desinfectante y el tiempo de exposición, el porcentaje de contaminación disminuyó, lo cual es similar a lo reportado por Bedoya-Pérez et al., (2016) quienes en establecimiento in vitro de Aloysia triphylla encontraron que porcentajes de 1,5% de NaClO durante 10 min, reducen el nivel de contaminación en un 74%. En este sentido,Wang et al. (2023) menciona que dosis superiores a 30 mg.L-1 de NAClO son requeridas para remover cerca del 90% de las bacterias resistentes a antibióticos, por lo que concentraciones mayores no se pueden utilizar para la desinfección.
La muerte celular mostró un comportamiento inversamente proporcional a la contaminación por hongos o bacterias (Figura 2), si bien los tratamientos con aplicación de OH al 70% y 96% no presentaron necrosis ni muerte celular, si obtuvieron altos porcentajes de contaminación. Por lo tanto, bajos porcentajes de contaminación se traducen en altos porcentajes de muerte celular, lo cual se explica por el elevado grado de oxidación de los explantes, que es generado a partir de las altas concentraciones de NaClO y un mayor tiempo de exposición, ya que estas causan el rompimiento de las paredes celulares tanto de bacterias y hongos como de las células vegetales, acorde a lo reportado por Wang et al. (2023) Al respecto, es probable que las concentraciones empleadas de NaClO sean muy altas, pues Huang, Yuan y Chen (2020) mencionan que la aplicación de 0,15% fue la más efectiva en la inducción de callos en los explantes de híbridos de Anthurium.
El porcentaje de supervivencia de explantes tiende a disminuir en el tiempo, como lo reportaron Matos et al. (2015), quienes encontraron que en arracacha cultivar 'Quiroreño' sembrado en medio de cultivo B5M se presentó a la sexta semana un 91,6% de supervivencia, mientras que en el cultivar 'Algodón' tan solo alcanzó un 17% de supervivencia bajo las mismas condiciones de establecimiento in vitro. Esta reducción en la supervivencia del explante se debe al deterioro tisular, el cual se manifiesta en la deshidratación de los tejidos (Raghu, Martín, Priya, Geetha y Balachandran, 2007; Shashikala, Shashidara y Rajashekharan, 2005). Al respecto, Melo, Barbosa, Motoike, Sabino,Ventrella y Peternelli (2011) mencionan que la adición de 0,3 M de sacarosa al medio de cultivo es ideal para evitar la deshidratación del explante.
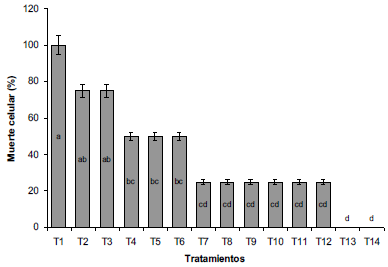
Fuente: Elaboración propia
Figura 2 Porcentaje de muerte celular de explantes de arracacha sometidos a diferentes tratamientos de desinfección. TI: NaClO 3%, 15 min; T2: NaClO 3%, 10 min; T3: NaClO 3%, 5 min; T4: NaClO 2%, 15 min; T5: NaClO 2%, 10 min; T6: NaClO 2%, 5 min; T7: NaClO 1%, 15 min; T8: NaClO 1%, 10 min; T9: NaClO 1%, 5 min; T10: NaClO 0,5%, 15 min;TII: NaClO 0,5%, 10; TI2: NaClO 0,5%, 5 min; TI3: OH 70%, 2,5 min; TI4: OH 96%, 0,5 min. NaClO: Hipoclorito de Sodio; OH: Alcohol. Letras distintas indican diferencias significativas de acuerdo a la prueba de DMS (P≤0,05).
En general, los tratamientos TI, T2, T3, T4, T5, y T6 con las aplicaciones de 3% y 2% de NaClO mostraron las menores tasas de contaminación de explantes. De otra parte, la aplicación de OH generó los resultados con menor muerte celular y mayor contaminación, similar a lo reportado por Teixeira, Winarto, Dobránszki, Zeng (2015) quienes afirman que la aplicación de 80% de etanol durante 20 min combinado con NaClO al 1% fue usado para desinfectar hojas, peciolos, espatas, espádices y raíces de Anthurium andreanumy encontraron I00% de contaminación en espatas y espádices.
En contraste,Ticona y Triguero (2019) encontraron que utilizando hipoclorito de sodio al 1% de concentración durante 10 minutos se presentó un 39,8% de contaminación de yemas apicales por hongos y bacterias, mientras que cuando se utilizó alcohol al 70% se obtuvo mayor porcentaje de sobre vivencia con 82,I% y menor porcentaje de contaminación que bajó al 17,1% en explantes de yemas de papaya (Carica papaya L.) en propagación in vitro. Una alternativa recientemente empleada en Valeriana officinalis L., es la aplicación de nanoplata para la eliminación de la contaminación bacteriana de explantes, ya que al emplear 100 mg.L-1 de nanoplata por 180 minutos, más 70% de etanol y 10% de hipoclorito al 1% por un minuto mostró un porcentaje contaminación de tan solo un 11% (Abdi, Salehi y Khosh-Khui, 2008).
En este sentido, los bajos porcentajes de contaminación contrastaron con la alta tasa de muerte celular, lo cual indica que, una exposición a altas concentraciones de hipoclorito de sodio reduce la supervivencia de los explantes.
Fase dos
De acuerdo a la fase uno, se determinó que los altos porcentajes de contaminación se deben principalmente a la presencia de bacterias, por lo que se realizó una fase dos, con la aplicación de bactericidas en la etapa de desinfección, los cuales fueron cloranfenicol y gentamicina en mezcla con hipoclorito de sodio al 2% para evitar el alto porcentaje de muerte celular. Los tratamientos que mostraron mejores resultados fueron el T22 y T26, con un 10% y 20% de contaminación, respectivamente (Figura 3). Se destaca la eficiencia del CHL combinado con la aplicación de NaClO al 2% en la disminución de la infección, ya que este último aditivo continúa mostrando los mejores resultados también en la fase dos. Similarmente, el CHL en dosis de 30 mg.L-1 combinado con OH al 70% y NaClO al 0,82%, alcanzó a obtener un 15% de explantes sanos de Mentha arvensis, mientras que cuando el CHL no se aplicó, todos los explantes sufrieron de contaminación (Héctor, Barrón, Godoy, Díaz, Hernández y Torres, 2005).
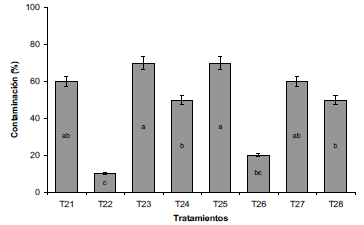
Fuente: Elaboración propia
Figura 3 Porcentaje de contaminación de explantes de arracacha sometidos a diferentes tratamientos de desinfección. T2I: CHL, 30 min; T22: CHL + NaClO 2% 30 min; T23: GEN, 30 min; T24: GEN + NaClO 2%, 30 min; T25: CHL, 20 min; T26: CHL + NaClO 2%, 20 min; T27: GEN, 20 min; T28: GEN + NaClO 2%, 20 min. NaClO: Hipoclorito de Sodio; OH: Alcohol; CHL: Cloranfenicol; GEN: Gentamicina. Letras distintas indican diferencias significativas de acuerdo a la prueba de DMS (P≤0,05).
La gentamicina no logró disminuir de forma eficaz la contaminación a pesar de estar combinado con NaClO al 2% (T24 y T28) y presentó valores de infección promedio de 57,5% cuando fue aplicada, acorde a lo reportado por Salehi y Khosh-Khui (1997) quienes en explantes de rosa 'Baby Masquerade' tan solo alcanzaron una desinfección del 20%. Así mismo, Tewelde, Patharajan, Teka y Berthe-Sbhatu (2020) mencionan que al emplear dosis de gentamicina de 50, 100 y 200 mg.L-1 solo se alcanzó a tener un 27% de microbrotes sanos en Zingiber officinaley afirman que el uso de antibióticos de forma individual no siempre es efectivo en controlar la contaminación bacteriana de los explantes o los medios, por lo que se recomienda la utilización combinada de antibióticos.
4. Conclusiones
Para la desinfección de explantes de arracacha de 1 a 2 mm de longitud, se recomienda el uso de NaClO en concentraciones de 2% y 3%, sin embargo, la exposición prolongada de este desinfectante puede ocasionar la muerte celular. El uso de NaClO al 2% durante 10 a 15 minutos evita el deterioro celular, lo que permite mayor éxito en la introducción de explantes.
El uso de cloranfenicol reduce el porcentaje de contaminación, sin embargo, es necesario evaluar el crecimiento por más de 8 semanas para evaluar la muerte celular y la posible contaminación por bacterias endógenas que la desinfección en las primeras semanas no puede eliminar, pero que tampoco se observan en el medio de cultivo. Se recomienda replicar los tratamientos en nuevos medios de cultivo para inducir el enraizamiento de explantes.















