Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cirugía
Print version ISSN 2011-7582On-line version ISSN 2619-6107
rev. colomb. cir. vol.27 no.2 Bogotá Apr./June 2012
Nanotecnología: avances y expectativas en cirugía
Nanotechnology: advances and expectations in surgery
Sara Jaimes1, Alisia González1, Carolina Granados1, David Álvarez2, Erick Espitia3
1 Estudiante, Facultad de Medicina, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
2 Médico, residente de Urología, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
3 Médico cirujano; profesor instructor, Departamento de Cirugía, Hospital Universitario San Ignacio, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
Correspondencia: Erick Espitia, Correo electrónico: espitiae@javeriana.edu.co Bogotá, D.C., Colombia.
Fecha de recibido: 6 de octubre del 2011. Fecha de aprobación: 30 de abril de 2012.
Resumen
La nanotecnología es una ciencia enfocada al estudio y la manipulación de partículas sólidas coloidales de tamaños que oscilan entre 10 y 1.000 nanómetros, que, a su vez, pueden ser usadas ampliamente en el campo quirúrgico como elementos de diagnóstico temprano de lesiones tumorales, marcadores tumorales intraoperatorios o distribuidoras de medicamentos a blancos específicos, entre otros.
Palabras clave: nanotecnología; tamaño de la partícula; espectrometría raman; neoplasias.
Abstract
Nanotechnology is the science that focuses on the study and manipulation of solid colloidal particles ranging in size from10 nm to 1000 nm. The manipulation of these particles and elements can be widely applied in surgery, with elements such as those that allow the early diagnosis of tumor lesions, intra-operative tumor markers, or the delivery of drugs to specific targets, among others.
Key words: nanotechnology; particle size; spectrum analysis, raman; neoplasms.
Introducción
El creciente interés del personal médico por aplicar las nuevas tecnologías en el campo de las ciencias médicas, ha permitido incrementar la efectividad y la seguridad, y mejorar los resultados terapéuticos, lo cual ha generado la aparición de la nanomedicina como herramienta terapéutica del quehacer médico en la actualidad.
La cirugía es el procedimiento más efectivo y ampliamente usado para tratar ciertas enfermedades de los seres humanos y, en algunos casos, la única opción de tratamiento viable. Este tipo de tecnología permite expandir las posibilidades terapéuticas.
En esta revisión se busca explicar en qué consiste la nanotecnología, sus principios básicos y algunas utilidades en el campo de la cirugía.
Materiales y métodos
Se hizo una revisión en Medline de las publicaciones que incluyeran los términos nanotechnology y surgery. Se revisaron importantes y diversas publicaciones, y se seleccionaron, analizaron y referenciaron en esta publicación.
Definición
La nanotecnología es el campo de las ciencias aplicadas dedicado a la manipulación y el control de partículas y elementos que se encuentran en un rango de medidas que va de 10 a 1.000 nanómetros. La unidad representativa de esta nueva escala es el nanómetro, que equivale a la milmillonésima parte de un metro (10-9 m) y que, a su vez, es equivalente a decir que en 1 milímetro hay 1’000.000 nanómetros. Todo elemento que se encuentre en este rango de medida se considera como un elemento nanotecnológico (1, 2) (figura 1).
Las propiedades físicas y químicas de la materia cambian a escala nanométrica, lo que se traduce en comportamientos diferentes en cuanto a la conductividad eléctrica, conductividad térmica, resistencia, elasticidad y biocompatibilidad con respecto a las escalas convencionales conocidas.
Componentes esenciales en nanotecnología
1. Nanopartículas. Son partículas con un diámetro entre 1 y 1.000 nm, que pueden ser nanoesferas o nanocápsulas (figura 1). Están compuestas por polímeros biodegradables y tienen la capacidad de llevar medicamentos o diferentes elementos en su interior, repartirlos y acumularlos en sitios blanco; además, tienen una penetración directa en redes capilares gracias a su pequeño tamaño (3).
2. Micelas poliméricas. Son partículas formadas por uniones de polímeros “anfifílico” (sic.). Las micelas tienen la capacidad de encapsular moléculas como lípidos, antimicrobianos, antioxidantes y vitaminas, los cuales no son solubles o son pocos solubles en agua y con ayuda de las micelas logran serlo; además, permiten minimizar su eliminación por el sistema retículoendotelial (figura 2). Pueden ser usadas potencialmente en el tratamiento de tumores, pues su rica irrigación facilita que estas partículas liposolubles traspasen las membranas celulares con mayor facilidad y en mayor cantidad hacia dichos blancos terapéuticos (4).
Una ventaja adicional, valorada últimamente, es la adición de ligandos a la superficie de la micela, lo que genera especificidad hacia los diferentes blancos. Una preparación que se ha desarrollado recientemente es la unión de medicamentos insolubles en agua, como el tamoxifeno, localizándolo en el centro hidrófobo, y la colocación de ligandos como anticuerpos conjugados contra el tumor en el manto hidrofílico, lo que ha mejorado la captación del medicamento por el blanco terapéutico, disminuyendo la necesidad de este para un mismo efecto deseado. Se está utilizando esta misma propuesta para otros agentes quimioterapéuticos, como la doxorrubicina y el cisplatino (5).
3. Liposomas. Son vesículas artificiales, individuales o multilaminares (a base de lecitinas u otros lípidos) en escala nanométrica formadas por hidratación de fosfolípidos que, al igual que las micelas, pueden incorporar en su interior diferentes componentes, aun en mayores cantidades (figura 3). La composición de las membranas puede ser muy diversa, lo cual es una ventaja a la hora de encapsular moléculas hidrofílicas o hidrofóbicas. Se utilizan para la entrega de moléculas o complejos biológicos moleculares, como en la administración de fármacos y la transferencia de genes. Los liposomas también se han utilizado para estudiar las membranas y sus proteínas (6), por ejemplo, el liposoma cargado de doxorrubicina, la anfotericina liposómica, entre otros.
4. Dendrímeros. Son estructuras poliméricas, pero a diferencia de las micelas, sus unidades de transporte no se encuentran en el centro, sino que están conformados por un sistema de ramificaciones perfectas, el cual utiliza para el transporte de diferentes componentes; estas ramificaciones le permiten tener una mayor capacidad de carga (figura 4). Gracias a ello, además de ser utilizado en el campo de la oncología, se ha potenciado también como elemento de transporte de medio de contraste y otros elementos radioterapéuticos.
5. Nanotubos. Son estructuras tubulares compuestas por átomos de carbono de diámetro nanométrico que se componen también de varias láminas de diferentes materiales enrolladas sobre sí mismas. A su vez, los nanotubos pueden ser monocapa (un solo tubo) o multicapas (varios tubos), uno dentro de otro. Esta configuración le da a la estructura mayor dureza y flexibilidad, a comparación de los materiales conocidos actualmente, tanto así que puede tener mayor dureza y resistencia que un diamante, a pesar de tener la misma composición química (7).
Los nanotubos pueden utilizarse como nanopinzas o nanoestructuras.
• Nanopinzas: la unión de dos nanotubos que se someten a cambios de voltaje genera una modificación estructural que, según su disposición, crea movimientos de apertura o cierre, dando opción de modificar partículas a nanoescala con estas pinzas (8).
• Nanoestructuras: dada las características físicas generadas por los nanotubos, se ha logrado el desarrollo de materiales como mallas y materiales quirúrgicos de alta resistencia y durabilidad, bajo la manipulación y unión de los nanotubos (9).
6. Quantum dots (Q dots, QD). Son cristales fluorescentes que pertenecen a la escala nanométrica y producen luz cuando son excitados. Esta característica los hace muy útiles cumpliendo la función de marcador biológico (10).
7. Partículas SERS (Surface-Enhanced Raman Scattering) (dispersión de superficie mejorada). SERS es una técnica sensible a la superficie que utiliza el mismo principio de la espectroscópica Raman, pero con una señal mucho mayor que permite la detección de moléculas individuales. La espectroscopia Raman es una técnica que estudia la vibración, la rotación y los modos de baja frecuencia dentro de un sistema. Las partículas SERS son nanopartículas para la identificación tumoral in vivo, basadas principalmente en oro coloidal (11).
Aplicaciones de la nanotecnología en cirugía
Nanotecnología en cirugía oncológica
Actualmente, los cirujanos utilizan únicamente instrumentos de corte, sus ojos, sus manos, su intuición y experiencia, para garantizar la resección completa de una masa tumoral. Esto se debe a que no se han validado elementos operatorios que mejoren significativamente la habilidad del cirujano para eliminar estos tumores (11). Es, precisamente en este último punto, donde las investigaciones recientes se han basado, permitiendo:
1. la identificación exacta de la lesión maligna;
2. la resección completa de la masa tumoral con márgenes quirúrgicos negativos para cáncer;
3. la preservación de estructuras no afectadas por el cáncer;
4. la resección de ganglios linfáticos que drenan el tumor, y
5. la identificación de pequeños residuos locales de cáncer.
El pronóstico a largo plazo del paciente depende del cumplimiento de estos retos operatorios y, por esta razón, el uso de partículas nanotecnológicas adquiere importancia. Las nanopartículas, como los Q dots, el oro coloidal y los liposomas poliméricos, tienen propiedades funcionales y estructurales que mejoran el quehacer del acto quirúrgico. Cuando conjugamos estos materiales con ligandos específicos, como anticuerpos monoclonales, péptidos u otras moléculas, estas nanopartículas pueden utilizarse para identificar células malignas y microambientes tumorales (como el estroma y vasos tumorales) con alta especificidad y afinidad (11).
Diagnóstico temprano
Una de las principales formas para el diagnóstico temprano de cáncer por medio de la nanotecnología, es la captura de células tumorales en la circulación. Esto se ha logrado por medio de la identificación de las células tumorales de forma magnética en el torrente sanguíneo de ratones, seguida por una rápida detección fotoacústica (12). Para mejor la sensibilidad y la especificidad de la detección, se conjugan nanotubos de carbono recubiertos con oro con el ácido fólico y se usan como un segundo medio de contraste para obtener la imagen fotoacústica. Con ello se logra que las células tumorales se concentren en los vasos sanguíneos “tumorales” del ratón. Este método tiene grandes aplicaciones en cuanto a detección temprana y prevención de metástasis tumorales (13).
Uso de quantum dots en cirugía oncológica
Akerman, et al., (14) conjugaron quantum dots y péptidos con gran afinidad por varios tipos de células tumorales y tejido perivascular, y lograron demostrar el realce y la tipificación fluorescentes de los quantum dots en los vasos y el estroma tumorales, mediante una inyección intravenosa en ratones. De igual forma, Gao, et al., (15) demostraron que la fluorescencia tumoral era significativamente mayor al utilizar quantum dots conjugados con antígenos específicos, que quantum dots no conjugados. Yu, et al., (16) y Cai, et al., (17) comprobaron esto al conjugar quantum dots con anticuerpos contra alfa-fetoproteína y péptidos RGD (arginina-glicina- ácido aspártico) para la identificación del cáncer de hígado y de gliobastomas, respectivamente, con tipificación exacta de la lesión con estos biotrazadores.
Stroh, et al., (18) demostraron que el uso de quantum dots permitía identificar de una forma segura la masa tumoral gracias al intenso brillo emitido, a longitudes de onda sintonizables y al bajo riesgo de extravasación, en comparación con las tintas orgánicas conjugadas. En este estudio los autores también usaron diferentes tamaños de quantum dots para mostrar la distribución según el tamaño en varios tumores y evidenciaron que las células de la médula ósea de linaje negativo que se consideran progenitoras de la formación de nuevos vasos endoteliales habían sido marcadas ex vivo con quantum dots y visualizadas in vivo, fluyendo y adhiriéndose a los vasos sanguíneos tumorales después de haber sido suministradas de forma intravenosa.
Más recientemente, Tada, et al., (19) utilizaron quantum dots para estudiar el proceso biológico que involucra el enfoque activo de las nanopartículas, mediante quantum dots marcados con HER2 (Human Epidermal Growth Factor Receptor 2) (anticuerpos contra el receptor 2 del factor de crecimiento epidérmico humano), para detectar el cáncer de seno en modelos animales. Por medio de este estudio, los autores pudieron identificar quantum dots individuales que circulaban por el torrente sanguíneo, los cuales se extravasaban dentro del tumor, atravesaban la matriz extracelular, se unían a receptores tumorales y se translocaban dentro de la región perinuclear de las células.
En conclusión, la sensibilidad de los quantum dots acompañada de técnicas de microscopía e imágenes in vivo, están ayudando a obtener un mayor entendimiento de la biología tumoral, a mejorar los esquemas de detección temprana y a orientar nuevos diseños terapéuticos.
Uso de partículas SERS en cirugía oncológica
Tratando de superar el potencial tóxico de los quantum dots, Qian, et al., (20) desarrollaron las nanopartículas SERS, las cuales tienen características especiales que las ponen en ventaja respecto a las anteriores, como:
1. baja o nula toxicidad a largo plazo u otros efectos adversos in vivo;
2. propiedades ópticas únicas;
3. poder ampliar la eficiencia de absorción de la dispersión hasta llegar a absorber moléculas 1014 o 1015 veces, lo que permite la espectroscopia de detección y la identificación de moléculas individuales a temperatura ambiente;
4. proveer mayor información espectroscópica;
5. su pico de emisión es 20 a 30 veces más estrecho que el pico de emisión de los quantum dots;
6. ser 200 veces más brillantes que los quantum dots, en un rango de 650 a 750 nm, y
7. poder acceder al tumor de forma activa mediante ligandos o de forma pasiva.
Qian, et al., (20) comprobaron la identificación tumoral y la detección espectroscópica in vivo por medio de experimentación animal, y encontraron una significativa relación entre la emisión de luz en distintos espectros y la localización de márgenes y lesiones tumorales asociadas.
Ganglio linfático centinela
Una de las aplicaciones de la nanotecnología más prometedoras es detectar y visualizar el ganglio linfático centinela por imagen fluorescente infrarroja intraoperatoria, ya que el cirujano se basa en el estado del ganglio centinela para definir el tratamiento. Frangioni, et al., (21) estudiaron el uso de los quantum dots en un melanoma espontáneo en cerdos pequeños, inyectándolos en los cuatro cuadrantes alrededor del melanoma. Por medio de imágenes en tiempo real, se identificaron las pulsaciones tumorales en el ganglio linfático centinela y en ganglios linfáticos previamente inyectados; asimismo, se pudieron identificar los ganglios linfáticos centinela en todas las inyecciones y después de la resección el tejido linfoide se confirmó histológicamente el tumor. Con este procedimiento se observó que la tecnología de los quantum dots tenía un doble papel en este proceso ya que los patólogos pueden usar la fluorescencia para orientar su disección.
Detección de células tumorales residuales
A pesar de la adecuada resección tumoral practicada por el cirujano, el estudio histológico puede revelar pequeños depósitos adyacentes de tumor que no son visibles para el ojo humano y que tampoco son palpables. La sensibilidad del ojo humano depende de la intensidad de la señal y las características macroscópicas, y se complementa con el tacto; con la implementación de elementos productores de luz visible, la capacidad del ojo para distinguir los detalles aumenta. El uso de nanopartículas, tales como los quantum dots y las partículas SERS, puede mejorar la sensibilidad del ojo humano. Esto es fundamental ya que, sí las células residuales del tumor pudieran detectarse en la sala de cirugía, la resección quirúrgica sería más exacta. Esto cobra gran importancia, ya que una completa resección del tumor es el indicador pronóstico más importante para la mayoría de cánceres (11).
Márgenes tumorales
En el cáncer de seno, 20 a 55 % de las pacientes sometidas a mastectomía parcial requieren una segunda intervención quirúrgica por la presencia de márgenes tumorales positivos. Esto también ocurre en la mayoría de cánceres por la incapacidad del cirujano para distinguir a simple vista entre tejido normal y tumoral. Weissleder, et al., (22) desarrollaron una nanopartícula denominada Cross-Linked Iron Oxide-Cy5.5 (CLIO-Cy 5.5), útil como agente de contraste en resonancia magnética (RM) y en la sonda óptica de fluorescencia infrarroja.
El CLIO-Cy 5.5 está compuesto de una cubierta nuclear de óxido de hierro supramagnético con dextrán entrecruzado, al cual el fluorocromo Cy5.5 se une de manera covalente.
Este grupo examinó la precisión de la delimitación de los márgenes tumorales de tumores ortoptópicos implantados en un huésped. Se practicó una RM en ratas con tumores cerebrales después de la administración de este compuesto y se observó una captación tumoral hipointensa en T2, que indicaba la acumulación de nanopartículas; posteriormente, las ratas fueron llevadas a craneotomía y expuestas a varios espectros de luz para la delimitación del margen tumoral y resección del mismo. Se llevó a cabo un estudio histológico en el tumor resecado, usando la fluorescencia para guiar los márgenes tumorales.
Nanotecnología en cirugía torácica
En el caso particular del cáncer de pulmón, siempre se han considerado como dificultades terapéuticas la prevalencia subclínica de metástasis ganglionares y la anatomía variable del drenaje linfático.
Sin embargo, la supervivencia del paciente se ha logrado prolongar gracias a la linfadenectomía, ya que existe mayor detección ganglionar, al igual que aumento en la remoción de los ganglios que albergan focos ocultos de enfermedades metastásicas (23).
Esto se ha logrado gracias al mapeo in vivo de adenopatías o lesiones con el uso de imágenes de fluorescencia infrarroja (Near Infrared, NIR) que detectan la luz con longitudes de onda en el rango de 900 a 700 nm, por fuera del espectro visible (23). Algunos sistemas de imágenes ópticas NIR han sido desarrolladas por John Frangioni, del Beth Israel Medical Center Deaconness (24), capaces de superponer fluorescencia NIR en imágenes invisibles y lograr que sean imágenes visibles en tiempo real. Este sistema de imagen aplicado en el campo operatorio, ha logrado crear una fusión de imagen infrarroja de espectro visible en tiempo real, permitiéndole al cirujano identificar de forma activa y manipular las estructuras positivas de la imagen NIR en el paciente.
Se han diseñado nanopartículas coloides y nanocápsulas de sílice, para convertir la longitud de onda de luz infrarroja en térmica, dando fortaleza a los estudios preclínicos. Al evaluar su eficacia en la ablación del tumor, se ha llegado a identificar el segmento de destrucción térmica celular, específicamente de las células tumorales afectadas.
Además, se han introducido nanopartículas con agentes utilizados en la terapia génica y anticuerpos marcados con quantum dots para caracterizar patrones de localización subcelular. También, se usan biomarcadores en estudios in vitro, con los cuales las células tumorales que expresan el receptor del factor de crecimiento de mutación epitelial se hacen evidentes.
Nanoelementos para la administración de medicamentos en cáncer
El sistema de vascularización tumoral se basa en procesos de angiogénesis que generan un entramado vascular mayor, pobre diferenciación del endotelio y poros endoteliales con mínimo drenaje linfático y venoso respecto a las necesidades previstas. Este proceso de angiogénesis, además del tamaño de las partículas de los tratamientos a escala convencional, genera las principales dificultades de estos, al limitar la difusión de medicamentos a través de los poros aberrantes, lo cual facilita la identificación, la degradación de partículas por el sistema retículo-endotelial y la pobre selectividad hacia células tumorales.
Estos problemas han comenzado a ser resueltos, gracias a las nanopartículas que tienen paso directo El mecanismo pasivo consiste en la acumulación del medicamento en los lechos con más vasos del cuerpo, sin selectividad por una región en especial. El mecanismo activo consiste en la acumulacióna través de los poros endoteliales aberrantes (por su tamaño inferior a 200 nm), mayor acumulación del medicamento en el blanco terapéutico y mayor selectividad hacia las células tumorales (25). Esta selectividad hacia las células tumorales se da mediante dos mecanismos, el pasivo y el activo (figura 5).
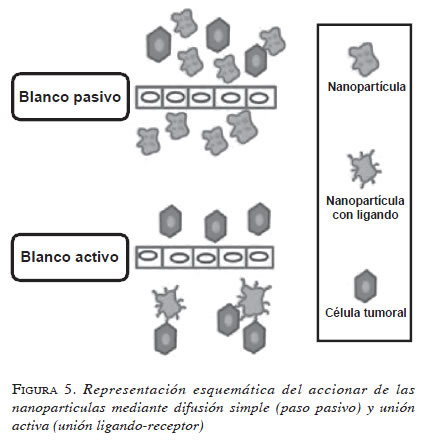
El mecanismo pasivo consiste en la acumulación del medicamento en los lechos con más vasos del cuerpo, sin selectividad por una región en especial.
El mecanismo activo consiste en la acumulación del medicamento en el blanco terapéutico, por medio del reconocimiento molecular, ya sea por ligandos, anticuerpos u otro tipo de moléculas específicas del tumor.
Estos medicamentos antitumorales son degradados por el sistema retículo-endotelial, por lo cual en las nuevas nanopartículas se ha generado un recubrimiento nanométrico que evita su identificación y su posterior degradación.
El impacto más inmediato de la administración de medicamentos mediante nanopartículas en cáncer, es el tratamiento localizado de tumores sólidos, al identificar objetivos moleculares relacionados con los vasos tumorales, como las integrinas fundamentales en la angiogénesis tumoral (3). Las integrinas se unen a secuencias que contienen diferentes nanopéptidos, los cuales se unen selectivamente a células tumorales; un ejemplo de esto son las integrinas vb3 y vb5, que se unen a la secuencia RGD, la cual construye un nanopéptido llamado RGD-4C que, al unirse a la doxorrubicina utilizada en la quimioterapia, aumenta su actividad y disminuye los efectos tóxicos sobre el hígado y el corazón; esto se debe a que este nanopéptido se une exclusivamente a células tumorales del cáncer de seno en humanos (5).
Hood, et al., (26) profundizaron sobre una alternativa antiangiogénica para el tratamiento de los tumores sólidos, consistente en el uso de un análogo de vb3 sintético, unido a un complejo de genes terapéuticos y nanopartículas catiónicas a nivel endotelial de las células tumorales. Esto también ha servido para la detección de procesos de angiogénesis tempranos por medio de la detección de moléculas paramagnéticas de vb3 por RM.
La tecnología stealth (5) ha aprovechado la acumulación pasiva de los medicamentos que existen, al presentarse un fenómeno de extravasación de nanopartículas por vía intravenosa (20 a 150 nm). La circulación de las nanopartículas, junto con su extravasación, permite llegar a zonas de tejido donde se presentan células cancerígenas e inflamación. La microcirculación del tejido sano presenta una unión intercelular de 10 nm de distancia, a diferencia del tejido tumoral que presenta una arquitectura discontinua con poros entre 100 y 1.000 nm de diámetro.
Las nanopartículas, al poseer tamaños mucho más reducidos que el resto de sustancias circulantes en el organismo, tienen la capacidad de alcanzar selectivamente poros con los diámetros que presentan los tejidos tumorales (5).
Para lograr en un futuro la implementación de esta clase de fármacos, es necesario solucionar distintos inconvenientes. Uno de ellos es que se deben alcanzar altas concentraciones de carga del medicamento, al igual que se debe mantener un rango terapéutico elevado, lo cual ha sido difícil considerando su importante extravasación y las complicaciones en el control de su circulación.
La liberación del fármaco ha sido un tema de amplio estudio. Se ha logrado demostrar que se puede implementar un recubrimiento liposómico capaz de activarse al contacto con sustancias particulares que la activen, por ejemplo, la fosfolipasa A2 que se encuentra en altas concentraciones en los procesos inflamatorios y cancerígenos puede inducir su liberación. Por lo tanto, la elección de una adecuada composición de lípidos acompañantes sería suficiente para lograr la estabilización y la prolongación de los perfiles farmacocinéticos y solo actuar en los lugares donde sea necesario (5).
Otro método interesante que se ha desarrollado es la utilización del ácido fólico como coadyuvante, el cual se ha unido al extremo distal del polietilenglicol de las cadenas de la superficie de los macrófagos circulantes. Esto ha sido clave para llegar a sitios comprometidos por procesos inflamatorios y tejido neoplásico. El ácido fólico ha demostrado tener claras ventajas al interiorizarse rápidamente en receptores que expresan las neoplasias de ovario, endometrio, colon, recto y pulmón, ausentes en la mayoría de los tejidos normales (5).
Medicina regenerativa
La ingeniería de tejidos es una nueva práctica en la medicina, que reúne las sofisticadas prácticas de la ingeniería con la ciencia y la biología, todo con el fin de ayudar a la reparación y reemplazo de tejidos y órganos que van a ser incorporados al ser humano para mejorar su funcionalidad.
Desde el inicio se ha convertido en un campo multidisciplinario que ha sabido incorporar combinación de células, matrices y reactores que, en conjunto, han sido capaces de generar un nuevo tejido. Se espera acabar con los problemas de incompatibilidad inmunológica ya que, a partir de la extracción de células, se puede llegar a obtener un tejido que se va a implantar en este mismo organismo.
El logro más ambicioso de la medicina regenerativa es tener el control de las nanoestructuras subyacentes de la célula y la matriz extracelular. La nanotecnología tiene el potencial de proporcionar instrumentos que pueden acelerar el progreso en esta práctica (27, 28).
Enfoque hacia el futuro
La nanotecnología ha comenzado a generar gran impacto en el tratamiento del cáncer, al reducir la recurrencia y evitar la segunda o tercera cirugía después de la resección inicial. Por ello, la nanotecnología es una de las prioridades del futuro de la medicina, la cual se empieza a enfocar en cuatro pilares fundamentales:
1. la necesidad de desarrollar nanopartículas multifuncionales, útiles como blanco, medicamento o medio de contraste en imágenes diagnósticas;
2. el desarrollo de nanopartículas biocompatibles que puedan identificar tumores mediante enlaces moleculares activos biodegradables que puedan ser eliminadas por filtración renal o excreción hepatobiliar;
3. la creación de nanopartículas con menor toxicidad, y
4. la integración de la nanotecnología con otras ciencias tecnológicas, como robótica (cirugía robótica miniinvasiva), computación de alta velocidad y gráficas en tercera dimensión (29-31).
Conclusiones
La nanotecnología permite plantear una gran cantidad de aplicaciones en el campo de la cirugía, generando enormes cambios en la forma de visualizar y aplicar la medicina en el corto y mediano plazo.
A pesar de los grandes avances en enfermedad tumoral, la nanotecnología sigue siendo un área poco comprendida por el hombre, pero plantea una interesante posibilidad para futuras investigaciones, buscando ante todo el bienestar de nuestros pacientes.
La nanotecnología (biomarcadores moleculares y bioinformática) es una gran promesa para el tratamiento individualizado del cáncer, en el cual las decisiones quirúrgicas se han comenzado a basar en información en tiempo real molecular y celular (27).
Este trabajo no recibió el apoyo económico de la industria farmacéutica.
Referencias
1. Kreuter J. PharmazeutischeTechnologie, Definición de nanopartículas. Fecha de consulta: 1 de abril de 2011. Disponible en: http://www.pharmazie.uni-frankfurt.de/PharmTech/ipt_kreuter/ index.html. [ Links ]
2. Whitesides GM. The "right" size in nanobiotechnology. Nat Biotechnol. 2003;21:1161-5. [ Links ]
3. Álvarez JD, Hernández C, Cataño JG. Nanotecnología, avances y expectativas en urología. Urol colomb. 2008;18:41-8. [ Links ]
4. Sahoo SK, Labhasetwar V. Nanotech approaches to drug delivery and imaging. Drug Disc Today. 2003;8:1112-20. [ Links ]
5. Emerich DF, Thanos CG. Targeted nanoparticle-based drug delivery and diagnosis. Journal of Drug Targeting. 2007;15:163- 83. [ Links ]
6. Medical Subject Headings (MeSH) Database. Fecha de consulta: 1 de abril de 2011. Disponible en: http://www.ncbi.nlm. nih.gov/mesh/68008081. [ Links ]
7. Kim P, Lieber CM. Nanotube nanotweezers. Science 1999;286:2148-50. [ Links ]
8. Kim P, Lieber CM. Report: Nanotube nanotweezers. Science 1999;286:2148-50. [ Links ]
9. Baughman RH, Zakhidov AA, de Heer WA. Carbon nanotubes -the route toward applications. Science. 2002;297:787-92. [ Links ]
10. Wu X, Liu H, Liu J, Haley KN, Treadway JA, Larson JP, et al. Immunofluorescent labeling of cancer marker Her2 and other cellular targets with semiconductor quantum dots. Nat Biotechnol. 2002;21:41-6. [ Links ]
11. Singhal S, Nie S, Wang MD. Nanotechnology applications in surgical oncology. Annu Rev Med. 2010;61:359-73. [ Links ]
12. Galanzha EI, Shashkov EV, Kelly T, Kim JW, Yang L, Zharov VP. In vivo magnetic enrichment and multiplex photoacoustic detection of circulating tumour cells. Nat Nanotechnol. 2009;4:855-60. [ Links ]
13. Jain KK. Advances in the field of nanooncology. Jain BMC Medicine. 2010;8:83. [ Links ]
14. Akerman ME, Chan WCW, Laakkonen P, Bhatia SN, Rouslahti E. Nanocrystal targeting in vivo. Proc Natl Acad Sci USA. 2002;99:12617-21. [ Links ]
15. Gao XH, Yang LL, Petros JA, Marshal FF, Simons JW, Nie SM. In vivo cancer targeting and imaging with semiconductor quantum dots. Nat Biotechnol. 2004;22:969-76. [ Links ]
16. Yu XF, Chen LD, Li KY, Li Y, Xuan Luo SX, Liu Jia, et al. Immunofluorescence detection with quantum dot bioconjugates for hepatoma in vivo. J Biomed Opt 2007;12:014008-1 - 014008-5. [ Links ]
17. Weibo C, Shin DW, Chen K, Gheysens O, Qizhen C, Shan X. Peptide-labeled near-infrared quantum dots for imaging tumor vasculature in living subjects. Nano Lett. 2006;6:669-76. [ Links ]
18. Stroh M, Zimmer JP, Duda DG, Levchenko T, Cohen K, Brown E. Quantum dots spectrally distinguish multiple species within the tumor milieu in vivo. Nat Med. 2005;11:678-82. [ Links ]
19. Tada H, Higuchi H, Wanatabe TM, Ochuchi N. In vivo realtime tracking of single quantum dots conjugated with monoclonal anti-HER2 antibody in tumors of mice. Cancer Res. 2007;67:1138-44. [ Links ]
20. Qian XM, Peng XH, Ansari DO, Yin-Goen Q, Chen G, Shin D. In vivo tumor targeting and spectroscopic detection with surface-enhanced Raman nanoparticle tags. Nat Biotechnol. 2008;26:83-90. [ Links ]
21. Tanaka E, Choi HS, Fujii H, Franfioni JV. Image-guided oncologic surgery using invisible light: Completed preclinical development for sentinel lymph node mapping. Ann Surg Oncol. 2006;13:1671-81. [ Links ]
22. Kircher MF, Mahmood U, King RS, Weissleder R, Josephson L. A multimodal nanoparticle for preoperative magnetic resonance imaging and intraoperative optical brain tumor delineation. Cancer Res. 2003;63:8122-5. [ Links ]
23. Schulz MD, Khullar O, Frangioni JV, Grinstaff MW, Colson Y. Nanotechnology in thoracic surgery. Ann Thorac Surg. 2010;89:S2188-90. [ Links ]
24. Troyan S, Kianzad V, Gibbs-Strauss S, Gioux S, Matsui S, Oketokoun R. The FLARE intraoperative near-infrared fluorescence imaging system: A first-in-human clinical trial in breast cancer sentinel lymphnode mapping. Ann Surg Oncol. 2009;16:2943-52. [ Links ]
25. Flaherty KT, Malkowicz SB, Vaughn DJ. Phase I study of weekly liposome-encapsulated doxorubicin in patients with advanced, androgen-independent prostate cancer. Am J Clin Oncol. 2004;27(2):136-9. [ Links ]
26. Hood JD, Bednarski M, Frausto R, Guccione S, Reisfeld RA, Xiang R, et al. Tumor regression by targeted gene delivery to the neovasculature. Science. 2002;296:2404-7. [ Links ]
27. Boulaiz H, Álvarez PJ, Ramírez A, Marchal JA, Prados J, Rodríguez-Serrano F, et al. Nanomedicine: Application areas and development prospects. Int J Mol Sci. 2011;12:3303-21. [ Links ]
28. Garry MD, Mark S, Jerzy K. Nanotechnology for the treatment of coronary in stent restenosis: A clinical perspective. Vascular Cell. 2011;3:8. [ Links ]
29. Varshosaz J, Soheili M. Production and in vitro characterization of lisinopril loaded nanoparticles for the treatment of restenosis in stented coronary arteries. J Microencapsul. 2008;25:478-86. [ Links ]
30. Hakim M, Billan S, Tisch U, Peng G. Diagnosis of head-and-neck cancer from exhaled breath. Br J Cancer. 2011;104:1649-55. [ Links ]














