Introducción
El mediastino se desarrolla del endodermo, mesodermo y ectodermo, a partir de la cuarta semana de gestación, y en la séptima semana se fusiona la membrana pleuropericárdica con el mesodermo ventral del esófago, cuya posterior evolución determina el completo desarrollo mediastínico, que es el compartimiento central, extrapleural del tórax, que separa las dos cavidades pleurales, ubicado por detrás del esternón, por delante de la columna vertebral y por encima del diafragma.
El mediastino alberga múltiples estructuras anatómicas. Tiene características embriológicas, fisiológicas y anatómicas particulares, pues a través de él pasan sangre, linfa, aire y alimento ingerido; es, además, el área donde mayor actividad tienen los nervios autónomos. A este nivel ocurre el desarrollo embriológico de los sistemas circulatorio, respiratorio y digestivo, por lo que pueden presentarse malformaciones congénitas de diversa índole, que, junto a procesos inflamatorios, traumáticos y neoplásicos, hacen de este un compartimiento muy complejo, donde se presenta una amplia variedad de enfermedades 1-5.
El crecimiento de tumores en el mediastino causa compresión de las estructuras vecinas, como la médula espinal, vasos sanguíneos y esófago, además de la diseminación a estructuras circundantes, como el corazón y los grandes vasos. Sus complicaciones también se derivan del tratamiento, sea por cirugía, radioterapia o quimioterapia 5-7.
Dada su situación anatómica, el mediastino permaneció durante siglos como un territorio inexplorado, pero con el advenimiento de la radiología, se comenzaron a diagnosticar los tumores de mediastino; sin embargo, por mucho tiempo existió el valladar de su inaccesibilidad operatoria. El acceso quirúrgico a ese espacio medio de la caja torácica ha sido siempre el gran problema al que se han enfrentado los cirujanos torácicos 7-9.
Teniendo en cuenta esas premisas y el aumento del número de enfermos operados con tumores mediastinales malignos en nuestro entorno 10-12, se decidió realizar una revisión bibliográfica, con el objetivo de profundizar en sus diferentes aspectos cognoscitivos actualizados sobre este importante tema.
Métodos
Mediante la técnica de búsqueda documental digital en diferentes bases de datos: Scielo, Lilacs, Web of Science, PubMed, efectuada en enero de 2019, se localizaron publicaciones de la presente centuria sobre el referido tema, utilizando las siguientes palabras clave: mediastino, compartimientos mediastinales, tumores mediastinales, diagnóstico, tratamiento, esternotomía.
Revisión del tema
Algunos aspectos históricos
Desde 1787, en el diccionario de ciencias y artes se registra una definición del "espacio mediastinal" y otra curiosa acepción, donde lo detallan como una doblez de la pleura, que divide el pecho en dos mitades y viene desde la espalda 1,13.
Pocos cirujanos, a finales de 1800 y principios de 1900, intentaron describir enfoques quirúrgicos para el mediastino 5,13. En 1888, NassilofF demostró que al esófago podía llegarse mediante un acceso posterior, tomando como referencia el tratamiento empleado en pacientes con perforación. Años después, otros cirujanos comenzaron a acercarse a anomalías del mediastino anterior. En 1893, Bastinelli describió la extracción de un quiste dermoide mediastínico anterior y realizó una resección del manubrio esternal. En 1896, Ludwig Rehn de Frankfort utilizó el acceso quirúrgico transcervical 1,14. Ya en 1897, Milton escribió extensamente sobre la cirugía del mediastino al utilizar las ventajas de la esternotomía media, y encontró que le daba un excelente acceso a esa localización. Las mediastinotomías anteriores fueron descritas en 1901 por ese autor en Inglaterra y por Ricard en Francia 5,14.
La primera operación de la miastenia grave fue realizada por Sauerbruch el 6 de marzo de 1911. A través de un acceso transcervical operó a una mujer de 19 años de edad que padecía esa afección y bocio coexistente. Extrajo un tumor de 49 g de timo hiperplásico y observó mejoría posterior del cuadro clínico. En los siguientes 20 años hubo informes intermitentes de cirujanos que ejecutaron esta intervención, con buena respuesta en términos de mejoría sintomática 1,15.
La era moderna de la cirugía tímica comenzó con Alfred Blalock en el John's Hopkins Hospital en 1936, quien a través de una vía transesternal extirpó un tumor del timo en un paciente con miastenia grave y sugirió que la exploración de la región tímica estaría indicada en todos los pacientes con miastenia. Unos años más tarde, en 1941, aplicó esta teoría e introdujo la timectomía en casos de pacientes miasténicos sin timoma, con mejoras similares. En 1944 comunicó su serie de 20 pacientes y así comenzó a aplicarse una nueva opción terapéutica para combatir la miastenia; pero ya en 1940 Heuer, quien había publicado una monografía sobre los tumores del mediastino, también describió la eliminación exitosa de tumores neurogénicos del mediastino posterior y las características de varios tipos de tumores del timo 15,16.
En 1959, Carlens realizó una mediastinoscopia transcervical, utilizando el mediastinoscopio creado por él. Mucho más tarde Joel Cooper, en 1988, desarrolló el retractor del manubrio esternal, que permite una mejor visualización del mediastino anterior y exposición de la glándula, lo que hace posible una completa resección del timo desde el cuello; modificación que de nuevo hizo popular el acceso transcervical. La utilización de un videoscopio contribuye a mejorar la visión y disección anatómica 5,17-19.
Detalles anatómicos el mediastino
Existen varias clasificaciones que dividen el mediastino en diferentes compartimientos, basadas en la anatomía topográfica o quirúrgica y en la radiología. Según Shields y Felson, se distingue un compartimiento anterior, uno medio y otro posterior. El Dr. José L. Martínez propuso la división del mediastino en 9 compartimientos: previsceral: superior medio e inferior; visceral: superior, medio e inferior, y retrovisceral: superior, medio e inferior 1,5.
Actualmente, la más usada es la clasificación que lo divide en mediastino superior e inferior y este a su vez en anterior, medio y posterior 9,14
1. Mediastino superior: Se extiende desde la apertura torácica superior hasta el plano horizontal que pasa por el ángulo esternal y el borde inferior de la IV vértebra torácica. Contiene, de delante hacia atrás, las siguientes estructuras: origen de los músculos esternohioideo y esternotiroideo, timo y sus restos, venas braquiocefálicas, mitad superior de la vena cava superior, arco aórtico, tronco arterial braquiocefálico, arteria carótida común izquierda, arteria subclavia izquierda, nervios frénicos, nervios vagos, nervio laríngeo inferior izquierdo o recurrente, tráquea, esófago, conducto torácico, terminación de los músculos largos del cuello, tejido areolar y graso.
2. Mediastino inferior: Se sitúa por debajo del superior. Este a su vez se subdivide por la presencia del corazón en anterior, medio y posterior.
a) Mediastino anterior: Situado delante del pericardio, detrás del esternón y por encima del diafragma. Contiene vasos mamarios internos, extremo inferior del timo, tejido areolar graso y ganglios linfáticos.
b) Mediastino medio: Es la región más amplia del mediastino inferior y contiene el corazón y su pericardio, la aorta ascendente, arterias y venas pulmonares, bronquios principales, cava superior, nervios frénicos y otras estructuras.
c) Mediastino posterior o espacio retro-cardíaco de Helzknecht. Está limitado al frente por el corazón, detrás por las últimas ocho vértebras dorsales, encima por el mediastino superior y debajo por el diafragma. Contiene el esófago, la aorta descendente torácica, los nervios neumogástricos, simpáticos e intercostales, el conducto torácico, las venas ácigos y hemiácigos, las venas ácigos accesoria, cadenas simpáticas, ganglios linfáticos, tejido areolar y graso.
El mediastino recibe el drenaje linfático del cuello, la pared torácica anterior, los pulmones, el esófago, el pericardio, el diafragma y la cavidad abdominal 1,5,13. Los ganglios mediastinales se dividen en:
Grupo anterior: Tiene tres cadenas ganglionares, todas en el mediastino superior, dos verticales y una transversa, que se anastomosa a las dos primeras.
Grupo medio: Ganglios intertraqueobronquiales (situados debajo de la bifurcación traqueal), los peritraqueales y los del pedículo pulmonar.
Grupo posterior: Ganglios aorticoesofágicos (situados a lo largo del esófago).
La localización de un tumor en uno u otro compartimento orientará hacia la naturaleza de dicha lesión, unido a la clínica del paciente y las características imagenológicas 5,10.
Aspectos fisiológicos del mediastino
Las funciones del mediastino son múltiples, entre las cuales figura ser amortiguador de doble membrana, al estar sometido a la influencia de la presión negativa que se encuentra en ambas cavidades pleurales, lo que le permite, en condiciones patológicas, pendular hacia el lado de menor presión. El mediastino responde a estos hechos manteniendo una función normal de los órganos. También tiene función hemodinámica, pues al ser negativa en -3 mm Hg, la presión mediastínica permite la aspiración torácica.
Las funciones accesorias son diversas: acción sobre el ritmo respiratorio y cardiaco, acción sobre la función respiratoria, acción sobre la presión arterial, acción sobre la motilidad cardiaca y el débito coronario, acción sobre el sistema neurosensitivo, función de fagocitosis y de fijación tisular, relaciones mediastino-endocrinas y mediastino-neurotróficas 1,14.
Algunos aspectos clínico-epidemiológicos
Aproximadamente 40 % de los pacientes con tumores en el mediastino son asintomáticos. Los timomas y los carcinomas tímicos constituyen las neoplasias más comunes del mediastino 3,10,11. Los timomas representan el 50 % de los tumores del mediastino anterior y entre 15-20 % del total de los tumores mediastinales. En los niños 20,21 los tumores neurogénicos del mediastino posterior son los más frecuentes y representan casi 50 % de los tumores mediastinales, en contraste con los adultos, en los cuales el timoma en el mediastino anterior resulta el más común 10,11.
Los linfomas representan 20 % de todas las neoplasias mediastinales en los adultos y 50 % en los niños 20,21. Los tumores de células germinales del mediastino constituyen 10-15 % de los tumores mediastinales, y esos mismos porcentajes de las tumores mediastinales anteriores 22-27. Los quistes mediastinales causan 20-32 % de los tumores mediastinales primarios, y entre ellos, los quistes broncogénicos representan 50-60 % 28,29. Los tumores mesenquimáticos se diagnostican en 10 % de los tumores mediastínicos, y son más frecuentes en la población pediátrica; entre estos, los lipomas resultan los más frecuentes 30-32. La enfermedad de Castleman puede afectar cualquier grupo o territorio ganglionar, pero mayormente se origina en el tórax (70 %) 33.
No son infrecuentes los linfomas, las afecciones tumorales de las glándulas tiroides y paratiroides, los teratodermoides, el carcinoma primario del mediastino, los tumores de células germinales, los hamartomas, plasmocitomas y tumores de origen linfático, principalmente en la parte anterior (representan alrededor de 17 %). Allí los más comunes son los linfomas de Hodgkin, variedad esclerosis nodular, que son de mejor pronóstico; mientras los linfomas no Hodgkin, con una presentación clínica similar, son de evolución agresiva y mala pronóstico 33-36.
Las afectaciones localizadas incluyen quistes y tumores primarios, infecciones, hemorragias, enfisema y aneurismas; las enfermedades sistémicas: los tumores metastásicos y los trastornos granulomatosos e inflamatorios. Las lesiones originadas en esófago, en grandes vasos, tráquea y corazón se manifiestan como una masa y establecen un diagnóstico diferencial con la enfermedad primaria del mediastino 2,11-14,37.
Manifestaciones clínicas
Las afecciones quirúrgicas del mediastino devienen un tema controversial, por la variedad de las manifestaciones clínicas, compromiso de estructuras adyacentes y complejidad de las intervenciones quirúrgicas a realizar.1,2,8, A pesar de la afectación local, la intervención de factores secretores tumorales e inmunológicos y las múltiples enfermedades sistémicas que pueden acompañarlo, ocasionalmente se presentan de forma asintomática, solo como hallazgo incidental en estudios radiográficos 6,10,37.
El cuadro sintomático es muy florido; sin embargo, existe un porcentaje no despreciable de pacientes asintomáticos, de manera tal que la identificación de la presencia del tumor en estos pacientes suele ser fortuita, casi siempre a través de una radiografía de tórax.
Las manifestaciones dolorosas son las más comunes. En general el dolor es retroesternal, con irradiación al dorso, o bien erosivos óseos, o de tipo neurálgico o braquiálgico, propios de los tumores nerviosos, en particular con prolongación intramedular. También puede originarse por extensión tumoral a la pared torácica, pleura, diafragma u otros sitios, lo que sería indicativo de malignidad 1,2,11.
De igual forma, hay manifestaciones circulatorias, que suelen ser las más aparentes, y se generan por compresión de la circulación venosa de retorno, lo que ocasiona 32,34,35,37.
√ Edema de cuello y cara, sobre todo en los párpados.
√ Inflamación y turgencia de las venas, inicialmente en la base de la lengua, que aumenta al hablar, toser, deglutir y al inclinar la cabeza y el tórax hacia delante.
√ Cianosis y circulación colateral son los signos más tardíos. Afectan la región anteroto rácica, el hombro y la base del cuello; pero si compromete la vena ácigos, aparece circulación toracoabdominal muy manifiesta. Este síndrome se conoce con el nombre de síndrome de la vena cava superior. En general es producido por enfermedades malignas y, por tanto, su pronóstico es malo; sin embargo, algunos pocos casos pueden tener un origen benigno, ya sea por enfermedades vasculares (fístula arteriovenosa, aneurisma aórtico, trombosis de la vena cava superior) u otras (tuberculosis, hematoma traumático, fibroma quístico, tiroides retroesternal).
El cuadro clínico respiratorio por lo común consiste en tos seca y disnea con predominio inspiratorio 12,13,28. Los síntomas digestivos suelen ser atribuibles a la compresión del esófago; el síntoma fundamental es la disfagia, casi siempre tardía, intermitente y a veces paradójica (mayor para líquidos que para sólidos) 14,17,34.
Además, puede haber manifestaciones neurológicas, capaces de presentarse en forma de neuralgia aguda o bien de parálisis motoras. Así, la afección del neumogástrico causa sialorrea, bradicardia, disnea y tos. La parálisis del simpático se manifiesta por el síndrome de Claude Bernard-Horner (ptosis palpebral, miosis, enoftalmia y estrechamiento de la abertura palpebral). En los tumores neurógenos puede producirse la afección medular por compresión, pero es rara. Por último, en el síndrome de Tobias-Pancoast son frecuentes las braquialgias por invasión del plexo braquial 17,32,36,37.
Las manifestaciones parietales son raras y se observan sobre todo en la infancia, como abombamiento con deformación torácica o invasión neoplásica de la pared. En los quistes y tumores benignos son menos frecuentes, porque la compresión permite el desplazamiento de los elementos mediastinales; por el contrario, resultan más comunes en los malignos, porque se añade la fijación e invasión del tumor a las estructuras 14,16.
Diagnóstico
La ubicación más común de los tumores mediastinales depende de la edad del paciente.9,35,36 Por ejemplo, en los niños son más comunes en el compartimiento posterior y suelen ser de origen neurogénico y benignos,20,21,25,32 mientras que, en los adultos (más comúnmente de la tercera a la quinta décadas de la vida) se forman en el compartimiento anterior, y constituyen habitualmente linfomas o timomas malignos 37.
En la práctica diaria es posible diagnosticar estas entidades mediante el estudio anatomopatológico, pero resulta primordial la combinación de hallazgos clínicos e imagenológicos junto con exámenes auxiliares como la inmunohistoquímica, la microscopia electrónica y modernamente, el análisis cromosómico 24. El desarrollo tecnológico ha permitido que el diagnóstico sea más frecuente y certero 6,14,18,19.
Ante un paciente con un tumor mediastinal debe establecerse un diagnóstico diferencial entre las diversas causas que lo originan. Para ello se impone tener en cuenta los siguientes aspectos:
La edad: en los niños, los tumores neurogénicos y los quistes enterogénicos son las masas mediastínicas más frecuentes; en los adultos, los tumores neurogénicos, linfomas y quistes tímicos.2
Los síntomas;
Las pruebas de laboratorio: se solicitan ante la sospecha de determinados tumores, por ejemplo: pruebas de función tiroidea, en pacientes con bocio endotorácico; niveles de hormonas paratiroideas; anticuerpos antireceptor de acetilcolina, para descartar miastenia grave en pacientes con sospecha de timoma, aunque estén asintomáticos; α-fetoproteinas y β-gonadotropina coriónica humana, excreción de ácido vanilmandélico y catecolaminas en orina de 24 horas, en el feocromocitoma, paraganglioma y neuroblastoma; entre otros 2,8,10,15.
Y por supuesto, las imágenes y procedimientos diagnósticos, a saber 6,7:
Radiografía simple de tórax. Es la prueba diagnóstica inicial, que muestra dónde está la lesión. Las proyecciones posteroanterior y lateral, y a veces las oblicuas, permiten evaluar el tamaño, la localización y la densidad del tumor, así como la presencia de calcificaciones en la masa.
Tomografía computarizada (TC) de tórax 1,37. Es un estudio de rutina en los pacientes con una masa mediastinal, que posibilita determinar: situación, tamaño, forma, densidad y composición del tumor, presencia y tipo de calcificaciones, características del borde del tumor, relación con las estructures vecinas, presencia y localización de linfadenopatías, y otros hallazgos asociados; además de que es capaz de diferenciar las masas sólidas de las quísticas. También permite discriminar el contenido de las zonas ocultas del mediastino en las radiografías convencionales, debido a la superposición de las opacidades esternal, cardíaca y de la columna vertebral.
Resonancia magnética nuclear 1,5,14. Está indicada en el estudio de los tumores neurogénicos, para confirmar si existe o no afectación de estructuras nerviosas, en pacientes en los que no puede utilizarse el medio de contraste para la realización de la TC, por falla renal o alergia; para determinar si existe invasión vascular o del plexo braquial, u otro proceso. Tiene la ventaja de no emitir radiaciones ionizantes, y puede ser más útil que la TC para evaluar la dilatación del foramen de conjunción en los tumores neurogénicos del mediastino posterior. También se ha mostrado superior para diagnosticar diferentes tipos de quistes.
Ecografía. Diferencia lesiones quísticas y sólidas y sirve para dirigir la punción aspiración con aguja fina (PAAF). La ecografía transesofágica se emplea en el estudio de lesiones esofágicas y estructuras paraesofágicas 6,7,10. Puede ser útil para evaluar tumores situados en el mediastino medio, y en pacientes con taponamiento cardíaco o estenosis pulmonar.
Isótopos 1,14 Tiene una sensibilidad de 93 % y una especificidad de 100 % en el diagnóstico del bocio endotorácico si existe tejido tiroideo funcionante, para detectar linfomas y diferenciarlo de los timomas, o para localizar mucosa gástrica ectópica, entre otras ventajas.
Tomografía por emisión de positrones (PET) 1,5,9,37. Es útil para el diagnóstico y estadificación del carcinoma broncogénico y los linfomas, y para seguimiento de tumores de células germinales tras el tratamiento.
Otras técnicas diagnósticas de importancia, sobre todo en caso de realización de biopsia por aspiración con aguja fina (BAAF) son:
Broncoscopia 28,29. Es válida para el estudio de lesiones del mediastino medio con afectación pulmonar asociada, y para realizar punción de adenopatías.
Punción-aspiración con aguja fina. Tiene limitaciones, pues se necesitan muestras mayores de tejido. Está contraindicada cuando se sospecha un timoma, debido al elevado riesgo de diseminación por el trayecto de la aguja 5,15.
Biopsia. La técnica se realiza en función del lugar donde se localice la lesión. Si no es accesible por técnicas específicas, se impone ejecutar una toracoscopia, o mediastinoscospia.
En algunos casos, se puede realizar biopsias de médula ósea, de ganglios periféricos, de ganglios mediastinales, o de la masa, por aspiración transbronquial o transesofágica, con apoyo de ultrasonido y agujas especiales.
La biopsia por aspiración transtorácica con aguja fina, ayudada por un estudio de imagen, es un procedimiento sencillo, de gran sensibilidad para diagnosticar una neoplasia maligna, pero no para precisar el tipo de tumor. Por eso, frecuentemente se debe recurrir a mediastinostomía anterior, mediastinoscopia, toracoscopia o minitoracotomía, para tomar una muestra suficiente, de al menos 1 mL cúbico; en raras ocasiones se recurre a la mediastinostomía posterior. En caso de un tumor localizado, sin metástasis, con diagnóstico preoperatorio incontrovertible, es preferible proceder a la resección de la masa tumoral durante el mismo acto quirúrgico de la biopsia, ampliando el mismo acceso o realizando una esternotomía parcial o total 5,10,16,17
Mediastinoscopia Este estudio puede ser realizado con el equipo clásico o mediante el video-mediastinoscopio, avance técnico que permite incorporar imágenes de video al instrumento convencional, a fin de obtener una mejor visión de las estructuras mediastinales. Igual sucede con el mediastinoscopio bivalvo, que amplia el espacio mediastínico y posibilita el trabajo bimanual, con la ayuda del asistente. En la actualidad, la videomediastinoscopia (VMC) o mediastinoscopia videoasistida es la modalidad preferida en la mayoría de las instituciones, por cuanto la variante clásica quedó relegada a un segundo plano 18,19.
Otros estudios37 no son indispensables ni necesarios para el diagnóstico de los tumores mediastinales, pero complementan la información obtenida; por ejemplo, el esofagograma, la esofagoscopia, la broncoscopia, la ecobroncoscopia y el ecocardiograma, para evaluar el grado de contacto o invasión de estos órganos. Si se sospecha un tumor germinal, debe indicarse una TC abdominal para explorar el retroperitoneo, y una ecografía testicular, se palpe o no masa tumoral.
Acceso quirúrgico del mediastino 1,16,37
Las principales vías de acceso quirúrgico al mediastino son:
Vía superior: vía de Carlens (incisión supraesternal), cervicotomia lateral izquierda
Vías torácicas:
Anteriores (intrapleurales): esternotomia media, esternotomia parcial (con incisión supraesternal o puerta de trampa). Esternotomia total o de Milton Duval y la vía de Chamberlain.
Toracotomías (intrapleurales): anterolateral (Rienhoff), posterolateral (Sweet), axilar vertical (Nuncio di Paola).
Toracotomías posteriores (extrapleurales): vía paravertebral posterior derecha, ventana pleural.
Vía inferior: Retroesternal y preperitoneal, ventana pericárdica transdiafragmática, trans-hiatal.
Tratamiento
El tratamiento se sustenta sobre diferentes bases terapéuticas, pero para la gran mayoría, es de elección la cirugía, con excepción de los linfomas y los tumores de células germinales seminomatosos y algunos metastásicos, en cuyo caso la quimioterapia o radioterapia constituye la terapéutica de elección 38-41. La escisión quirúrgica completa se considera lo ideal, aunque también está indicada la reducción en las lesiones de tamaño inicialmente inoperable.
En muchos pacientes con tumores de mediastino, el tratamiento quirúrgico es complejo y exige con frecuencia una técnica difícil (figura 1) 15,16,42. El conocimiento de la fisiología del mediastino y del control de la ventilación, así como de las nuevas técnicas anestésicas, permiten aplicar un tratamiento quirúrgico más seguro en esta región corporal, con lo cual se logra disminuir las tasas de morbilidad y mortalidad 8,43.
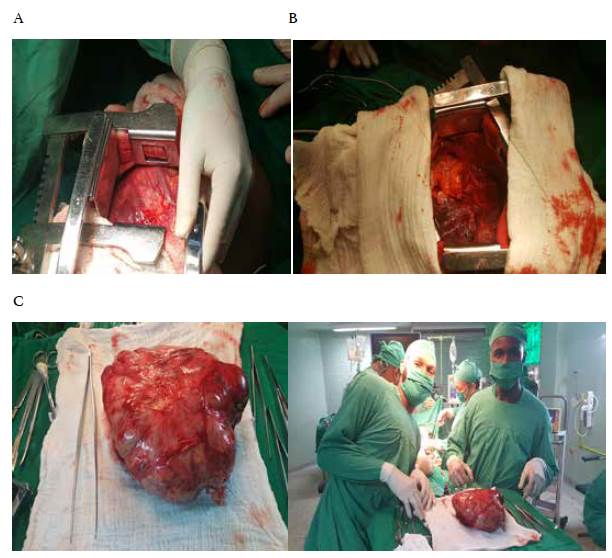
Figura 1 Imágenes de la extirpación de un tumor mediastinal gigante (timoma) en un paciente masculino de 45 años quien acudió a consulta por cansancio y disnea de esfuerzo. A: toracotomía anterolateral izquierda, se evidencia el tumor gigante en el mediastino medio. B: espacio anatómico que ocupaba el tumor, se evidencia el contacto directo con el miocardio y el pulmón izquierdo. C: Pieza quirúrgica obtenida, timoma de más de 10 cm.
Consideraciones finales
Las neoplasias mediastinales son poco frecuentes, pueden aparecer a cualquier edad, y la mayoría se descubren incidentalmente en una radiografía de tórax de rutina en pacientes asintomáticos. Los tumores malignos del mediastino son poco frecuentes, pero los benignos constituyen un desafío diagnóstico para radiólogos y patólogos. En las neoplasias malignas se identifica una amplia gama de variedades histológicas, atribuibles a las características del órgano afectado.
La tomografía computarizada, asociada o no a la biopsia percutánea, es el estándar de oro para el diagnóstico preoperatorio. El diagnóstico definitivo generalmente se establece mediante el estudio histopatológico posquirúrgico, con excepción de los linfomas y los tumores de células germinales seminomatosos y algunos metastáticos. La selección de la vía de entrada al tórax, así como el procedimiento quirúrgico, están condicionados por la localización y tamaño del tumor en el mediastino.















