Introducción
Actualmenente, el sistema CRISPR-Cas9 es la herramienta más versátil para la edición genética. CRISPR (clustered regularly interspaced short palindromic repeats) es una región del ADN de algunas bacterias que actúa como un mecanismo inmunológico contra un virus. Como sistema, consta de dos componentes: Cas9, que actúa como unas “tijeras moleculares” que cortan y pegan segmentos de ADN con una precisión absoluta. CRISPR, como tal, es un fragmento de ARN, el segundo componente, que guía a Cas9 hasta el área del ADN que tiene que cortar, para que la maquinaria de recombinación de la célula incluya el material genético que se desea usar. En 2012, varios científicos crearon versiones sintéticas de este ARN-guía, que posibilita cortar y pegar nucleótidos del ADN de cualquier célula (1).
El debate sobre modificar la línea germinal humana no comenzó con el advenimiento de CRISPR-Cas9. Cuando aparecieron las primeras ideas de edición genética, médicos en el campo de la medicina reproductiva ya estaban seleccionando embriones antes de implantarlos, escogiendo así los genomas que se propagarán en las generaciones siguientes. Y, desde hace muchos años, aquellos quienes practican y quienes observan las ciencias han contemplado la noción de que algún día el ser humano será el autor primario de su propia constitución genética.
En 1978, nació Louise Brown, la primera “bebé probeta”, y fue momento decisivo en la biología reproductiva, que demostró cómo la procreación humana podría reducirse a procedimientos simples en el laboratorio. Con la fertilización in vitro, padres con problemas de infertilidad engendraron hijos relacionados genéticamente; mientras que al mismo tiempo se abrieron las puertas a otro tipo de manipulaciones que podrían realizarse eventualmente en el embrión temprano durante el crecimiento en el laboratorio. En las últimas décadas del siglo XX, los científicos idearon más y mejores métodos para manipular genomas animales. Ya en 1990 era rutinario generar modelos murinos de enfermedad humana modificando genes específicos de embriones de ratón. Aunque el proceso no podía aplicarse a humanos, sentó las bases para inventos como ZFN (zinc finger nucleases), TALEN (transcription activator-like effector nucleases) y CRISPR-Cas9 transformaran un método rudimentario en un método exacto, directo y optimizado para usarse en humanos. Entonces, si era posible crear la vida humana en el mismo ambiente estéril del laboratorio en el que se estaban creando las tecnologías de edición genética, podía especularse que algún día los dos métodos convergerían.
La secuenciación del genoma humano fue el avance en genética humana que aceleró el entusiasmo para editar el ADN. Sin embargo, ya desde 1998 empezaron a surgir preocupaciones éticas respecto a modificar el genoma: consentimiento informado, desigualdad, accesibilidad y consecuencias inesperadas para futuras generaciones. Además, se sintió el optimismo propio de la posibilidad de mejorar la humanidad mediante la erradicación de enfermedades, el evitar defectos genéticos y, en general, la mejora del curso natural de la evolución (2).
Posteriormente, la Asociación Americana para el Avance de la Ciencia y el Centro Genético y Políticas Públicas concluyeron que intervenir con la línea germinal humana no era todavía seguro y responsable, que las preocupaciones éticas eran importantes y que era una problemática la modificación genética para el “mejoramiento” (3,4). Además de estas conferencias, el advenimiento de otros dos procedimientos médicos aprobados en algunos países, que permitieran a los padres “elegir” y “modificar”, aunque de forma limitada, el material genético que heredarán sus hijos involucró las mismas metas y controversias de la edición genética. El diagnóstico genético preimplantación y la terapia de remplazo mitocondrial o fertilización in vitro de tres padres demostraron que las comunidades científica y médica están dispuestas a eliminar cualquier crítica desde la ética en nombre de proporcionar hijos saludables a sus padres. Sin duda, en las sociedades liberales contemporáneas, la genética y la biología molecular han revolucionado la relaciones entre medicina y sociedad, que se pueden analizar desde tres planos: el uso de la información, el gobierno de la vida (biopolítica) y la preponderancia de la autonomía individual (en este caso de los padres a “elegir”, lo que constituye el meollo de la eugenesia liberal). El debate ético sobre el mejoramiento humano va más allá de la cura o la prevención de enfermedades, porque señala dinámicas de poder, transformaciones culturales y la problematicidad de dichas relaciones entre medicina y sociedad (5,6).
Aunque el escrutinio tecnológico de ambos procedimientos ha sido adecuado, los análisis tanto filosóficos como regulatorios han sido escasos, incluso para la terapia de remplazo mitocondrial, en la que cambia la línea germinal que se pasará a sus siguientes generaciones. Las preguntas que se hicieron los inventores de CRISPR-Cas9, investigadores y genetistas, a medida que la tecnología se hizo disponible, fueron: ¿qué tan cómodos se sienten investigadores y reguladores para usar CRISPR-Cas9 y crear cambios heredables en el genoma humano? ¿Qué pasará cuando médicos especialistas en fertilidad sepan que tienen la capacidad de “mejorar” el genoma de embriones con variables que no provienen de sus padres? ¿Reflexionarán acerca de las consecuencias? (7).
En noviembre de 2018, el día anterior a la inauguración de la Segunda Cumbre Internacional sobre Edición Genética en Humanos, He Jiankui, científico chino, anunció vía YouTube que editó los genes de unas mellizas para hacerlas resistentes a la infección por VIH, con lo que violó sistemáticamente muchas de las reglas establecidas para experimentar en seres humanos. No solo implantó embriones modificados sin un proceso adecuado de consentimiento informado, sino que además falsificó documentos del comité de ética, intercambió muestras de sangre para que pacientes con VIH pudieran participar en procesos de reproducción asistida y comprometió a los participantes a reintegrar el costo de la fertilización in vitro si se retiraban del estudio. El doctor He es un científico, no un médico, y su institución académica negó cualquier participación o apoyo en este tipo de investigación; sin embargo, se espera que haya más bebés editados genéticamente (8,9).
El hecho de que un científico editara embriones viables y los implantara, y que ello llevara al nacimiento de dos niñas editadas genéticamente no solo es irresponsable, sino inmoral. Lo sucedido demuestra que otras personas podrían tener los medios, los motivos y la oportunidad para hacer algo similar. Esto nos lleva a recalcar la necesidad de 1) una mejor supervisión de las clínicas de fertilidad en las que se pueden realizar este tipo de procedimiento, 2) un proceso de educación a comunidades científicas y no científicas para que entiendan los problemas e implicaciones de la tecnología antes de aplicarla y 3) un debate moral adecuado que incluya a todas las partes involucradas. Así, el 14 de marzo de 2019 se anunció y se publicó en Nature el llamado oficial para adoptar una moratoria global de todos los usos clínicos de la edición genética en la línea germinal humana.
Métodos
Se llevó a cabo una revisión sistemática de la literatura científica y popular para identificar los artículos relevantes. Durante noviembre de 2019 se realizó una búsqueda electrónica en PubMed y en Embase, usando términos MeSH y términos libres en caso de no existir un término indexado con los conectores AND u OR según las especificaciones: CRISPR-Cas9, gene editing, human germline, editing, technical limitations, ethics, regulatory, personal opinions, consensus, statements, reports, con la siguiente estrategia de búsqueda: CRISPR-Cas9 AND/OR gene editing AND/OR human germline AND/OR editing AND/OR technical limitations AND/OR ethics AND/OR regulatory AND/OR personal opinions AND/OR consensus AND/OR statements AND/OR reports; (((“gene editing/ethics [MeSH Major Topic]) AND (crispr cas sytems/genetics [MeSH Major Topic])) AND (y_5 [Filter])). Adicionalmente, en Google general se buscaron publicaciones no científicas que incluyeran piezas de opinión relevantes, como periódicos y revistas de circulación internacional, y para acceder a los documentos oficiales de diferentes instituciones y organizaciones. La estrategia de búsqueda fue: CRISPR-Cas9 +/− gene editing +/− human germline +/− personal opinions +/− consensus +/− statements, o el enlace correspondiente al documento official.
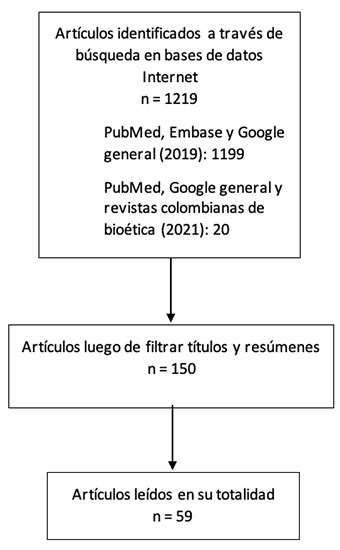
Los criterios de inclusión de fuentes bibliográficas fueron: 1) trabajos originales correspondientes a hallazgos científicos pertinentes; 2) consensos, declaraciones y reportes; 3) artículos de revisión, y 4) artículos de opinión pública publicados en periódicos y revistas. No hubo restricción de fecha de publicación, y se incluyeron documentos en inglés, francés, español, alemán e italiano. Una vez seleccionadas las fuentes bibliográficas, se filtraron títulos y resúmenes para eliminar duplicados, información repetitiva o no relevante, o no relacionada con los criterios anteriores. Posteriormente, se leyeron todos los artículos relacionados, se descartaron los que no se consideraron pertinentes para esta revisión, y con los demás se sintetizó la información. Así mismo, se realizó una búsqueda en PubMed, Google general y en tres revistas indexadas de bioética editadas en Colombia (Revista Colombiana de Bioética, Revista Latinoamericana de Bioética y Persona y Bioética), con los términos MeSH CRISPR-Cas9 AND Colombia en junio de 2021, a fin de complementar la revisión sistemática con reflexiones sobre la aplicación de CRISPR-Cas9 y sus implicaciones éticas desde un país como Colombia (figura 1).
Resultados
La búsqueda inicial generó 1158 artículos académicos, 16 documentos de consenso, 2 libros y 23 artículos de periódicos de alta circulación. Estos 1199 documentos se filtraron evaluando sus títulos y resúmenes hasta obtener 142. Luego se eliminaron duplicados, información repetitiva y aquellos que al ser leídos no cumplían con los criterios de inclusión anteriores. En la búsqueda complementaria se encontraron 20 artículos científicos y de bioética entre los años 2015 y 2021, de los cuales 8 se identificaron por incluir autores colombianos o haber sido publicados en Colombia y que hacen referencia a la aplicación de CRISPR-Cas9 y sus posibles implicaciones o conflictos bioéticos. Finalmente, se utilizaron 59 documentos para sintetizar la información en los siguientes cuatro apartados.
Limitaciones técnicas del uso de CRISPR-Cas9 en la línea germinal humana
La edición genética de la línea germinal humana, técnicamente, se puede realizar en embriones tempranos (10,11), en gametos y durante la gametogénesis (12) y en células madre pluripotenciales inducidas (13,14).
Cuando se expone a un individuo a una intervención médica con efectos secundarios deletéreos, se debe considerar que los riesgos asociados con dichos efectos no sobrepasen los beneficios potenciales del tratamiento. La edición genética de la línea germinal resulta en cambios que estarán presentes en todas las células del organismo y que se transmitirán a generaciones subsiguientes; por tanto, al igual que para la edición genética de células somáticas, debe establecerse su eficacia y seguridad antes de considerar la tecnología como una intervención terapéutica factible.
Para que el sistema CRISPR-Cas9 funcione, requiere un medio de transporte y entrega de la proteína Cas9, de los ARN-guías y de secuencias reconocibles para su empalme. Estos componentes deben optimizarse para las condiciones específicas en las que se desea usar CRISPR-Cas9. Es mandatorio que el medio de transporte y de entrega sean seguros, que las endonucleasas que cortan el ADN cromosómico sean específicas y que todo cuanto sucede después del corte dependan de la maquinaria celular que repara el ADN. Con base en ello, es posible definir las dificultades que se presenten cuando se usa CRISPR-Cas9.
A fin de transportar y entregar el sistema CRISPR-Cas9 se usan vectores virales capaces de penetrar las células en grandes cantidades. Sin embargo, su uso es controvertido, debido a efectos colaterales serios, que incluyen respuestas inmunológicas importantes contra el vector o la proteína, generación de cáncer e incluso la muerte en pacientes que participaron en estudios clínicos (15); pero gracias a mejoras significativas en la tecnología se han reducido estos riesgos y se están consiguiendo resultados interesantes y más seguros en la clínica (16). Para evitar el uso de vectores virales, los componentes de CRISPR-Cas9 se pueden integrar a plásmidos. No obstante, se ha visto que parte del ADN plásmico puede integrarse aleatoriamente al genoma del huésped. Además, cabe la posibilidad de que estas secuencias de ADN bacteriano induzcan respuestas inmunológicas que afecten la eficiencia de la edición genética (17). Nuevas técnicas de transporte y entrega de CRISPR-Cas9, especialmente para introducirlo en células germinales, incluyen el uso de la ribonucleoproteína que evita el uso del ADN viral o bacteriano o de nanopartículas de lípidos, más seguras por su precisión y rápida degradación (7).
Una de las mayores preocupaciones del uso de CRISPR-Cas9 es la posibilidad de corte y edición por fuera del blanco, en áreas del genoma que son sensibles a rupturas en la doble cadena (18). Además, las secuencias cortas de los ARN-guías del sistema toleran uno a tres errores del acoplamiento con el sitio que se va a editar. Este problema se reduce mediante evaluaciones computacionales del potencial de ediciones por fuera del blanco para seleccionar los ARN-guías. Sin embargo, todos los ARN-guías tienen efectos por fuera del blanco en regiones desconocidas, por lo que esta limitación no puede eliminarse completamente (19). La importancia de los efectos fuera del blanco depende de su aplicación; algunas aplicaciones médicas los toleran, a menos que causen una patología nueva (20).
Por otra parte, la edición del blanco puede ser limitada o incompleta; un fenómeno llamado mosaiquismo, que se ha documentado en alrededor del 25 % de un grupo de cigotes humanos no viables sometidos a edición genética con CRISPR-Cas9 (11) y con resultados similares en cigotes de primates (21). Para mejorar estos problemas de edición incompleta se continúan desarrollando reactivos químicos, estrategias en cultivo celular y estrategias informáticas para predecir la eficiencia de CRISPR-Cas9 (22).
Una de las grandes inquietudes al experimentar con la edición genética de la línea germinal humana es qué tan confiable es la información que se obtendría. Estos experimentos serían muy difíciles de controlar y podría ser imposible analizar sus resultados, al menos hasta que pase un tiempo considerable (décadas, generaciones, etc.), y al tener en cuenta la incertidumbre de la conexión causal que se sucede entre la expresión genética y el papel potencial de otros factores que modifiquen los resultados biológicos en el futuro (23).
En general, debido al número limitado de experimentos y a las dificultades técnicas mencionadas, hasta la fecha no se recomienda el uso clínico de la edición genética en la línea germinal humana para la prevención de la transmisión de alelos causantes de enfermedad, pues todavía no se entienden sus consecuencias a largo plazo y existen alternativas seguras para que parejas portadoras de enfermedades genéticas graves puedan tener hijos sanos.
Implicaciones éticas del uso de CRISPR-Cas9 en la línea germinal humana
Aunque eventualmente las limitaciones técnicas de CRISPR-Cas9 se van a considerar obsoletas, gracias al avance tecnológico, sus implicaciones éticas son permanentes y se originan en dos principios: 1) los cambios genéticos que se hacen en la línea germinal se transmitirán indefinidamente a generaciones futuras y 2) no existe consenso sobre el estatus del embrión humano, ya que no está lo suficientemente desarrollado como para dar consentimiento informado respecto al procedimiento. Es más, cuando se considera al ser humano como un fin, sin respetar su naturaleza ontológica, nos arriesgamos a 1) experimentar con embriones viables que se tratan como un medio para conseguir una meta; 2) que la procreación se transforme en fabricación sujeta a control de calidad; 3) que se corra el riesgo de usar la tecnología para “mejoramiento humano”; 4) que el uso de la tecnología aumente las desigualdades entre los seres humanos; 5) que no haya garantía para que las generaciones futuras estén a salvo de sufrir problemas genéticos graves, y 6) que se cause un daño al ecosistema, debido a aceleración del proceso de evolución y a un posible desequilibrio ecológico (23,24).
Opiniones de los científicos
Abrumados por el rápido progreso de la tecnología, científicos involucrados tanto en la invención como en la aplicación de la edición genética se dieron cuenta de que la discusión pública se estaba quedando atrás respecto a los avances en la investigación. Siguiendo el ejemplo de las reuniones de Asilomar en la década de 1970, los científicos involucrados en CRISPR-Cas9 se reunieron para discutir directrices respecto a su uso y publicaron sus manifiestos casi simultáneamente en Nature y en Science, en 2015.
El manuscrito de Science está firmado por investigadores dedicados principalmente a la aplicación de la edición genética para desarrollar terapias en células somáticas y presenta cuatro razones para rechazar la edición genética en la línea germinal humana: 1) la tecnología no está todavía en condiciones de aplicarse con seguridad y no hay posibilidad de conocer sus efectos en futuras generaciones. 2) Existen alternativas para evitar el nacimiento de niños con ciertos defectos congénitos. 3) Existe el riesgo de usar la tecnología con fines no terapéuticos. 4) Se corre el riesgo de perder la confianza de los ciudadanos si se emprenden experimentos temerarios, lo que rechazaría o impediría el desarrollo de un área terapéutica prometedora. Los autores abogan por una moratoria de su uso y promueven un diálogo similar al que discutió la terapia de remplazo mitocondrial y que llevó a su aprobación (25).
El artículo de Science fue producto de una reunión convocada en Napa (California, Estados Unidos) y que trató de seguir las pautas de la Conferencia de Asilomar. El grupo recomendó: 1) prohibir en todos los países, incluyendo a aquellos que tienen regulaciones laxas en la materia y a los que no las tienen en absoluto, la edición genética en la línea germinal humana mientras que las implicaciones ambientales y éticas de esta actividad no sean debidamente discutidas. 2) Promover la educación y la información del público sobre esta era nueva de la biología humana, haciendo referencia a los logros, a los riesgos y a las implicaciones éticas, jurídicas y sociales de la modificación del genoma. 3) Estimular la investigación transparente sobre la eficacia y la especificidad de la edición genética con CRISPR-Cas9 aplicada a modelos humanos y no humanos, para valorar su aplicación en la terapia genética germinal. Específicamente, propusieron que “ni los embriones humanos tempranos, ni las células germinales sometidas a edición genética sean empleadas para generar un embarazo”. 4) Convocar a un grupo representativo de todas las partes interesadas en esta área científica y tecnológica para considerar estos asuntos y adoptar propuestas de acción (26).
En diciembre de 2015, las Academias Nacionales de Ciencias, Ingeniería y Medicina de los Estados Unidos (NASEM) invitaron a la Sociedad Real del Reino Unido y a la Academia China de las Ciencias a una Cumbre Internacional de Edición Genética en Humanos, en la que se acordaron los siguientes puntos: 1) mantener la investigación básica y preclínica en este campo con la exigencia de que si se hiciera edición genética con embriones humanos tempranos o en células germinales, ninguna de ellas se utilice para conseguir un embarazo reproductivo. 2) Apoyar la investigación de edición genética en células somáticas siempre bajo el marco regulatorio de la terapia genética. 3) Rechazar por el momento la edición genética de la línea germinal humana, en tanto no exista una seguridad suficiente y amplio consenso social para llevarla a cabo. 4) Promover la creación de un foro permanente de debate sobre la edición genética en el que participen todos los interesados. 5) Abogar por una regulación internacional que establezca un uso aceptable de la edición genética en la línea germinal humana y que armonice las normativas nacionales (27).
Estas tres declaraciones de contenido semejante pretendían inspirar la gobernanza mundial de la investigación y uso de CRISPR-Cas9 fundamentándose en cuatro principios: 1) la edición genética ofrece unas posibilidades extraordinarias de mejora de la vida humana y del medio ambiente, pero puede resultar muy peligrosa si se usa temerariamente o con una finalidad perversa. 2) Los científicos no deben apresurarse ni ocultar a la ciudadanía la información sobre lo que hacen, porque se corre el riesgo de generar alarmas innecesarias que pueden llevar a la adopción de medidas restrictivas injustificadas y perjudiciales para el desarrollo de la ciencia. 3) Es importante educar a la opinión pública para que pueda comprender que se está usando con prudencia y que las aplicaciones de la edición genética serán beneficiosas. 4) El embrión humano temprano no es un fin en sí mismo, por lo cual se puede experimentar en ellos la edición genética siempre y cuando sean descartados y no implantados (24).
Este marco de comprensión de la edición genética tiene insuficiencias importantes: 1) supone que la tecnología tendrá efectos muy positivos si se evita su mal uso. 2) No discute sus implicaciones económicas, sociales y políticas. 3) Acepta sin discusión el uso del embrión humano como material de investigación. 4) Atribuye a los expertos legítimos la proposición de políticas. 5) Encarga a los expertos la educación del público sin considerar sus conflictos de intereses al hacerlo. 6) No hace referencia a las regulaciones internacionales existentes sobre el tema.
A partir de la publicación de estos tres documentos, la literatura científica se vio saturada con revisiones escritas por expertos de diferentes disciplinas que describen las mismas dificultades técnicas e implicaciones descritas. En febrero de 2017, NASEM publicó el análisis más extenso y detallado sobre la edición genética de la línea germinal humana como resultado de las opiniones del consenso producidas por un Comité para la Educación Genética Humana (28). Este reporte se ha interpretado como lo que “abrió las puertas” a la modificación genética hereditable en humanos y trazó la línea límite para las intervenciones dirigidas hacia el “mejoramiento humano”, al concluir que la modificación de la línea germinal humana sería permisible bajo ciertas condiciones y bajo estricta supervisión. Sin embargo, un análisis detallado sobre el documento publicado por el Hastings Center comenta que a esta decisión se llega debido al compromiso del comité para involucrar al público en la elaboración de políticas sobre el tema, pero que en realidad si se toma seriamente la prioridad a la participación del público, ninguna de sus posiciones pueden entenderse como prescripciones políticas e, incluso, si se adoptaran sus recomendaciones, los efectos serían contrarios a lo que prescriben y bloquearían el programa de la edición genética (29).
Uno de los grandes temores de los científicos de occidente es que las guías y las recomendaciones públicas se puedan interpretar a conveniencia, sobre todo en países con regulaciones laxas o sin regulaciones para investigaciones, incluyendo tecnologías avanzadas como la edición genética. El primer debate se dio en 2015, cuando se publicó el primer experimento que usó la tecnología en embriones humanos no viables para corregir el gen HBB que causa la talasemia beta (11). El artículo evidenció la inconformidad científica, cuando lo rechazaron los comités editoriales de Nature y Science, que expusieron objeciones éticas a los experimentos descritos. Un científico comentó a los medios de comunicación que la atención recibida por aquellos quienes editan el genoma podría ser “el tipo de motivación equivocada que lleva a las personas a hacer cosas” (30). Pero a pesar de las fuertes reacciones de agencias científicas y gubernamentales, y de la estipulación de los Institutos Nacionales de Salud (NIH) de no proporcionar financiación gubernamental para cualquier tipo de investigación que involucrara la edición genética en embriones humanos (31), la ambición de algunos científicos temerarios continuó, y en noviembre de 2018, como ya se mencionó, otro científico chino anunció que editó los genes de una mellizas (8). El anuncio de este experimento se hizo la víspera de la Segunda Cumbre sobre Edición Genética en Humanos, y aunque sus organizadores condenaron el hecho, rechazaron el llamado a una moratoria. En su lugar, apoyaron planes para guiar a los científicos “para que algún día fueran capaces, de forma segura, de crear niños editados genéticamente con el fin de prevenir enfermedades”. Otros científicos calificaron esta posición como irresponsable (12).
Finalmente, el 14 de marzo de 2019 se anunció y publicó en Nature el llamado oficial a adoptar una moratoria global de la edición genética en la línea germinal humana. En este, especialistas de siete países propusieron, más que una prohibición, un modelo de gobernanza que permita a las diferentes naciones adoptar la cuestión de la manera que mejor se adapte a sus condiciones (32). Sin embargo, algunos científicos consideraron que no es ético tener un método disponible para evitar que algunas familias tengan un hijo enfermo, y no utilizarlo (33,34). Así, pues, hay que considerar que el riesgo de una tecnología poderosa como CRISPR-Cas9 no está en la tecnología en sí, sino en quienes la usan.
Bioética de la edición genética en la línea germinal humana
La valoración ética de la edición genética en la línea germinal humana no es fácil porque replantea los conceptos de naturaleza humana, salud y medicina. Básicamente, se pueden presentar tres posiciones que se pueden defender apoyándose en argumentos diferentes:
Prohibición de toda edición genética de la línea germinal humana apoyada en dos argumentos: a) se basa en principios, al considerar que el genoma humano, entendido como la dotación genética resultante de la fusión del óvulo y el espermatozoide, es sagrado como tal y no puede sufrir ninguna alteración deliberada. Este argumento pone la naturaleza biológica por encima del ser humano, que reduce su vida a una simple expresión de fuerzas naturales. b) Prudentemente, parte del reconocimiento del ser humano, no de la biología pura, como un fin en sí mismo. Así, el ser humano tiene una naturaleza ontológica que se concreta en una serie de deberes morales, que no se identifica con las leyes de la naturaleza biológica, y que se debe respetar (35).
Prohibición de la edición genética en la línea germinal humana que no tenga una finalidad terapéutica, en la que se entiende que la identidad genética recibida desde la concepción se considera un bien fundamental de la persona, el cual se debe proteger y cuidar. Esto no evita que la edición genética de la línea germinal humana sea en sí un tabú, sino solo en la medida en que amenaza la consideración del ser humano como un fin. Esto ocurre cuando: a) se experimenta con embriones humanos para desarrollar la edición genética, porque se trata al embrión como un medio y no como un fin; b) la procreación se convierte en un proceso de fabricación, en el cual el hijo se reduce a la condición de producto sujeto a control de calidad; c) existe el riesgo razonable de que la edición del genoma se emplee para fines distintos al terapéutico, y d) el uso de la tecnología incrementa sustancialmente las desigualdades entre los seres humanos (36). Ninguna de estas razones conduce a una prohibición absoluta, pero cada una aboga por una moratoria, pues no se puede renunciar absolutamente a una opción que usada con prudencia y comprobada su seguridad podría acabar con enfermedades genéticas, no solo en un individuo, sino también en su descendencia (37).
Regulación de la edición genética en la línea germinal humana con finalidades terapéuticas y perspectivas, cuyos defensores sostienen que el temor al mal uso de la tecnología no es razón para abandonarla, sino que debe regularse adecuadamente para impedir abusos. Para ello, la elección de las características genéticas de los hijos es una prerrogativa que pertenece a los padres, quienes suponen que este criterio es más valioso que el de la lotería genética y confían en que la tecnología mejorará la vida de las personas, de sus familias y de la especie humana (38). Algunos afirman que si el ser humano tiene la posibilidad de controlar su propia evolución, debe asumirla y conseguir las mejores condiciones de vida para los individuos y la especie humana (39). Argumentan que la prohibición del uso de estas técnicas es totalmente ineficaz, porque siempre habrá un lugar en el que se acepten estas prácticas; por ello, en lugar de prohibirlas para que terminen en la clandestinidad o en países con márgenes legales amplios, proponen establecer una regulación para que toda intervención que use la tecnología se realice bajo estrictos controles de seguridad y con fines no perversos (40).
Actividad regulatoria e implicaciones políticas y jurídicas del uso de CRISPR-Cas9 en la línea germinal humana
El advenimiento de la técnica de ADN recombinante en la década de 1970 planteó el debate respecto a si se debía o no intervenir en la línea germinal del ser humano. Para ello, algunos Estados, agencias internacionales y organizaciones comenzaron a regular sobre el tema. Ahora que se cuenta con un método de edición genética preciso, sencillo y económico, se debe conocer el alcance de dichas regulaciones redactadas pensando en la posibilidad de que con CRISPR-Cas9 se hicieran reales.
Recomendaciones de grupos, organizaciones y gobiernos
Existen políticas internacionales y estatales que regulan la investigación del embrión humano y las intervenciones en el desarrollo humano temprano que aplican tanto a la investigación como al potencial uso clínico de la edición genética de la línea germinal humana (41). Sus marcos normativos se refieren al amplio concepto ético aplicado a las tecnologías de reproducción asistida y de investigación genómica en humanos y consideran los principios éticos de autonomía, beneficencia, no maleficencia y justicia. Las políticas se diferencian en cómo definen el embrión humano o la célula germinal, la herramienta política en particular (legislación, regulación, guía profesional), cómo poner en vigor el contenido de los documentos (ordenado por la ley u obediencia voluntaria) y los mecanismos de vigilancia (licencias, etc.). En general, la mayoría de los documentos disponibles restringen el intentar iniciar un embarazo con un embrión o célula germinal que haya sido genéticamente alterada (42).
A través de las diferentes jurisdicciones la regulación de la manipulación genética de la línea germinal puede caracterizarse como: 1) restrictiva, con un rango amplio de restricciones y moratorias a toda actividad relacionada con embriones humanos y células germinales. 2) Intermedia y permisiva, que permite diferentes grados de investigación y actividades clínicas, aunque con limitaciones y vigilancia. Se debe, sin embargo, aclarar que algunas políticas restrictivas limitan el financiamiento estatal para la investigación, pero no la previenen, pues otros Estados y fundaciones pueden patrocinarla.
En el plano internacional, es importante revisar las normas aprobadas por la Organización de las Naciones Unidas y los Estados que son potencias biotecnológicas. La Declaración Internacional de la Unesco de 1997, sobre el genoma y los derechos humanos, prohíbe las intervenciones en la línea germinal humana en su artículo 24. En octubre de 2015, su Comité Internacional de Bioética publicó un informe actualizado sobre el tema en el cual reafirmaba la necesidad de una moratoria en la edición genética de la línea germinal humana y sostenía que los problemas relacionados con su seguridad y sus implicaciones éticas prevalecen sobre otras consideraciones (43).
La Unión Europea reguló tangencialmente la edición genética de la línea germinal humana en la directiva europea relativa a la protección jurídica de las intervenciones biotecnológicas de 1988, en la que afirma que la intervención genética germinal en seres humanos es contraria al orden público y a la moralidad, por lo cual prohíbe las patentes de procedimientos de modificación de la identidad genética. En 2016, el Grupo Europeo sobre Ética en Ciencia y Tecnologías Nuevas (EGE) aprobó una declaración que refleja la complejidad de la cuestión y la pluralidad de posiciones respecto al tema. Sobresalen los siguientes puntos: 1) entiende que la prohibición universal de editar el genoma viene de la moratoria establecida en Asilomar y que se está revisando. 2) Reconoce la terapia de remplazo mitocondrial como una modificación al genoma, por lo cual —para algunos— ya se cruza la línea. 3) Recomendó una moratoria en la edición genética de embriones o gametos humanos. 4) Para algunos, la modificación del genoma con fines reproductivos no puede justificarse éticamente y apelan a la prohibición de la Carta Europea de Derechos Fundamentales (44).
El Consejo de Europa ha sido la organización mundial pionera en regular las materias relacionadas con la ingeniería genética con principios de actuación que puedan universalizarse. El Convenio Europeo sobre Derechos Humanos y Biomedicina, reunido en Oviedo en 1997, fijó los límites a las intervenciones sobre el genoma humano. En 2015, el Comité de Bioética del Consejo de Europa aprobó una Declaración sobre la edición genética que resalta cómo el Convenio de Oviedo es el único instrumento internacional legalmente vinculante dedicado al reconocimiento de los derechos humanos en el ámbito de la biomedicina, y que recoge principios que pueden servir de referencia para el debate internacional sobre la edición genética (45).
Como ya se describió, después de la publicación del primer tratado sobre edición genética en embriones humanos, los científicos, a través de las tres declaraciones discutidas, abogan únicamente por una moratoria en el campo. Estados Unidos secundó esta petición y los NIH hicieron una declaración oficial en la que aseguraron continuar financiando la edición genética en células somáticas, pero no la financiación en la línea germinal humana (31). La Casa Blanca publicó en el mismo 2015 un comunicado en el cual señalaba que alterar la línea germinal humana con fines clínicos es una frontera que no se debe cruzar en estos momentos (46).
Lo anterior muestra la diferente perspectiva de abordaje sobre la gobernanza de la edición genética en Estados Unidos y en Europa. Mientras que en el primero hay un marco legal escaso, que deja la autorregulación a los científicos, la segunda cuenta con una base normativa que debe ser respetada por los Estados que la ratifican.
La posición del Reino Unido sobre la edición genética difiere de la estadounidense. Aunque desde 1990 está prohibida por ley la edición genética de embriones humanos con fines terapéuticos, es posible hacer investigación en el campo con la autorización de la Unidad de Fertilización y Embriología Humanas (HFEA). En febrero de 2016, la HFEA aprobó el primer proyecto de investigación para aplicar edición genética al estudio de genes implicados en el desarrollo embrionario, a efectos de mejorar la viabilidad de embriones obtenidos por fertilización in vitro y desarrollar tratamientos nuevos contra la infertilidad. Ningún embrión usado en el estudio sería implantado (47).
En todo el mundo se han identificado cinco tipos de respuestas por parte de los Estados, respecto a la edición genética en embriones humanos: 1) no regular nada sobre el particular, que es lo común en países donde apenas existe investigación en el campo (como en el caso colombiano). 2) Establecer una regulación restrictiva, como en Estados Unidos. 3) Ofrecer un marco regulatorio ambiguo, como en Argentina. 4) Establecer una prohibición a través de directrices no coactivas, como en China, donde grupos continúan trabajando y sorprendiendo con su temeridad. 5) Prohibir la práctica con leyes sancionadoras, como en Alemania y el Reino Unido (10).
Guías del manejo regulatorio para usar CRISPR-Cas9 en la línea germinal humana
A pesar de las prohibiciones internacionales, moratorias temporales y regulación, el uso de CRISPR-Cas9 será imposible de controlar, debido a su bajo costo, a su uso simple y a la heterogenicidad de los códigos éticos de las diferentes regiones del mundo. Por otra parte, la autorregulación, como ya se ha visto, crea riesgos para que la investigación avance sin la adecuada diligencia ética (8,11,40). Así, se han propuesto algunas guías prácticas para la investigación, el desarrollo clínico y la distribución de la tecnología que ofrecen supervisión y vigilancia adecuada (47):
Guías para investigación
Desde el principio, los experimentos diseñados los deben evaluar adecuadamente reguladores institucionales y agencias de financiamiento, en cuanto a seguridad y beneficio para los pacientes antes de que la investigación comience. Para ello, deben demostrar la especificidad de las modificaciones introducidas por CRISPR-Cas9 en un modelo celular y asegurarse de que el ADN modificado se propague a una velocidad normal. Cualquier terapia genética que se pretenda usar en la línea germinal debe incluir un mecanismo para revertir la introducción potencial de alelos no deseados con efectos secundarios que podrían reconocerse solo en generaciones subsiguientes, sin remover la edición terapéutica original (48).
Además de la seguridad, los beneficios para el paciente deben ser claros y esto se daría en dos situaciones: a) cuando los efectos terapéuticos de la edición genética no se consiguen mediante la selección de embriones con diagnóstico genético preimplantación y b) en enfermedades que potencialmente afectarán la mayor parte de los embriones (49). Si la terapia de la edición genética pasa la evaluación ética, los comités de ética de investigación deben solicitar a los investigadores una demostración que pruebe el concepto en varias generaciones de modelos animales, antes de considerar estudios clínicos en humanos.
Finalmente, como los embriones no se consideran sujetos humanos, sino que su protección estaría en manos de los propios investigadores, de las instituciones y del Estado, la investigación no requiere autorización de los Comités de Ética de Investigación, por lo que se debe delegar la vigilancia a comités especiales multidisciplinarios con guías estandarizadas por el Gobierno del Estado, que aseguren su consistencia a nivel nacional (47).
Guías para el desarrollo clínico
Una vez la edición genética de la línea germinal humana se haya validado en el laboratorio, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA), la Agencia Europea de Medicamentos (EMA) y sus equivalentes en otros Estados, deberán aprobar el uso clínico de la terapia, que para el caso de Colombia es el Invima. CRISPR-Cas9 se encuentra dentro de la definición que la FDA y la EMA tienen de tecnologías de transferencia genética (50).
Antes de comenzar los estudios de fase I, es preciso obtener el consentimiento informado de los padres, de la misma manera que los padres ejercen consentimiento informado por sus hijos. Y aunque este solo cubrirá la primera generación editada genéticamente, no se puede justificar el consentimiento informado para las generaciones subsiguientes, pues seres inexistentes no tienen este derecho (51,52). Sin embargo, es necesario considerar ejercitar un consentimiento informado con estándares más altos que para estudios clínicos. Estudios de fase I a fase III deben ser ejecutados cuidadosamente para permitir que estas terapias estén disponibles una vez se concluya su seguridad y eficacia. Debido a la impracticidad de los estudios multigeneracionales en fases I a III, es mandatorio obtener la máxima información posible de los estudios preclínicos y continuarse con estudios de fase IV para confirmar efectos a largo plazo, a fin de mitigar los tiempos excesivos para su desarrollo antes de comercializarse.
Guías para distribución
Una vez las agencias regulatorias aprueben su comercialización, las terapias de edición genética de la línea germinal pueden distribuirse a través de clínicas de infertilidad. En algunos países, las compañías de seguros no cubren los gastos relacionados con la fertilización in vitro, y aunque podrían cubrir algunos de ellos, reduciéndolos a quienes reciben edición genética terapéutica, esto pondría en desventaja a aquellos que conciben naturalmente y para padres que no poseen los medios para pagar. Así, pues, se debe decretar legislación y adoptar prácticas de excelencia para asegurar justicia y autonomía a quienes no puedan o no quieran usar la tecnología (53).
CRISPR-Cas9 en Colombia
Por su facilidad de uso y amplia gama de aplicaciones, CRISPR-Cas9 representa un horizonte de posibilidades para países como Colombia, donde ya se viene utilizando, por ejemplo, en la industria agrícola (54). Sin embargo, un escollo tiene que ver con los obstáculos que pueden presentarse a través del mecanismo de patentes. Para Romero Ariza (55), “[s]egún el uso que se dé a esta tecnología es posible disminuir la brecha de desigualdad entre países o aumentarla”. Se debe proteger, por tanto, la posibilidad de su utilización amplia, por lo menos en investigación, en países que no pueden asumir los costos aparejados a las patentes. En el área clínica ha habido también autores colombianos que indican posibles aplicaciones y ventajas de CRISPR-Cas9, como Valencia Enciso y Mendivil (56), quienes señalan que algunos modelos de modificación genética podrían usarse para el tratamiento de trastornos lipídicos, que pueden disminuir el riesgo de enfermedades cardiovasculares. Por otro lado, Montaño et al. (57) señalan que la edición genética por medio de CRISP-Cas9 podría ser una oportunidad para entender los cambios genéticos involucrados en la patogénesis de la leucemia linfoblástica aguda, y que son responsables de recaídas o resistencias a tratamientos. En muchas universidades del país se viene ya utilizando esta tecnología en diversas investigaciones y trabajos académicos.
En cuanto a las aplicaciones en el campo de la salud, Caro Romero (58) pone el relieve en la necesidad de considerar las particularidades de un sistema de salud como el colombiano, en el que, por ejemplo, las enfermedades complejas y raras no son adecuadamente atendidas por diversas razones, entre otras, por su difícil diagnóstico y los altos costos de los pocos tratamientos existentes. Ante este panorama, se plantea la posibilidad de aceptar la modificación genómica para la prevención y el tratamiento. La modificación genómica por motivos de salud es bien recibida en general por diversos actores en la sociedad, no así cuando se propone para otros fines, por ejemplo, para que los progenitores puedan elegir características fenotípicas de sus hijos de acuerdo con preferencias individuales o culturales.
Para Leal et al. (59), la edición genética tiene un potencial para la curación de enfermedades genéticas, pero esto conlleva una responsabilidad ética, especialmente en la transmisión de genes editados en células germinales, que causan un impacto desconocido para futuras generaciones. Así mismo, para estos autores dicha tecnología puede generar conflictos sociales de desigualdad si solo va a estar disponible en países o personas con altos ingresos. Castillo (60) pone de manifiesto la importancia de que esta técnica se use en células somáticas con aplicaciones clínicas; sin embargo, reconoce la necesidad de establecer un marco legal y ético para el seguimiento de estudios preclínicos y clínicos donde se esté desarrollando.
El tema de la regulación se torna fundamental en escenarios con sistemas jurídicos que no han asumido con el cuidado y la seriedad necesarios los diversos retos que plantea el avance biotecnológico. Aunque en Colombia existe ya un Consejo Nacional de Bioética, creado mediante la Ley 1374 de 2010, pero conformado efectivamente solo hasta febrero de 2020 (61), todavía no ha habido un pronunciamiento oficial sobre CRISPR-Cas9. Del mismo modo, sigue pendiente que las diversas entidades estatales se ocupen de señalar criterios claros para el uso de esta tecnología. Para autores como Lamprea Bermúdez y Lizarazo Cortés (62), más que expedición de normas jurídicas vinculantes o directrices de derecho blando, se trata de fortalecer las capacidades institucionales, jurídicas y tecnocientíficas del país para asumir los retos de una tecnología como CRISPR-Cas9. Así mismo, para ellos, el uso de esta tecnología en línea germinal humana no es recomendable, por lo menos hasta que se tengan más datos que permitan un grado aceptable de confiabilidad y seguridad. Para Caro Romero (58), el principio de beneficencia debe ser considerado de manera especial a la hora pensar en la aplicación de CRISPR-Cas9. Por supuesto, será fundamental también examinar cómo los otros tres principios clásicos de la bioética (respeto por la autonomía, no maleficencia y justicia) entrarían a orientar la aplicación de esta técnica. Aunque todos son importantes, el principio de justicia sería especialmente relevante en un país como Colombia. Pero la reflexión ética en bioética no se agota con la apelación a estos cuatro principios, y deberá considerarse el papel de la dignidad humana y los consensos que surjan del debate público y plural en la sociedad.
Finalmente, para Márquez Díaz (63), hay que reconocer el enorme potencial de CRISPR-Cas9 para revolucionar la modificación genómica. Al igual que los otros autores, subraya el aspecto de seguridad de esta técnica, en relación con su capacidad para lograr, con un grado aceptable de certeza y exactitud, la eliminación y reordenamiento del ADN. Quizás con CRISPR 2.0, una versión más precisa de CRISPR-Cas9 y con ventajas adicionales, se puedan lograr aplicaciones clínicas más seguras y efectivas. Sin embargo, para Márquez Díaz el mayor reto no está en lo técnico, sino en lo bioético, “debido a que no hay restricción alguna en emplear la herramienta de edición genética CRISPR para lo que se desee en términos genéticos, modificando células u organismos, lo que incluiría bebés de diseño […], bioterrorismo, etcétera”. Por esto se requiere una buena integración entre la implementación de los avances tecnocientíficos en biomedicina y la reflexión necesaria desde la bioética que ha de guiar la acción.
Los usos y aplicaciones de CRISPR-Cas9 deben analizarse en Colombia a través del diálogo interdisciplinario, pluralista, crítico, basado en la evidencia y éticamente bien sustentado, tal como lo promueve la bioética. Se espera que esta tecnología permita avances importantes en el campo biomédico, así como aplicaciones eficaces y útiles, tanto en la práctica clínica como en otros escenarios de las ciencias biológicas, de acuerdo con principios éticos que promueven el respeto por el ser humano, los animales y la naturaleza, así como la solidaridad y el beneficio para todos en la sociedad.
Conclusiones
CRISPR-Cas9 es hoy en día la herramienta más versátil de la ingeniería genética y, por su bajo costo y habilidad para editar genomas fácilmente, la está utilizando ampliamente la comunidad científica internacional. A pesar de que existe apoyo general para su uso clínico, existen preocupaciones éticas y sobre su eficacia y seguridad en el contexto de la edición genética de la línea germinal humana. Entre las limitaciones técnicas están los problemas relacionados con el transporte y la entrega del sistema, el corte y la edición por fuera del blanco establecido y el mosaiquismo o edición incompleta. Además, hay investigadores que opinan que no se deben considerar las aplicaciones clínicas de edición del genoma hasta que se entiendan suficientemente sus consecuencias a largo plazo, tanto para el individuo como para la especie humana.
Aunque las limitaciones técnicas del sistema eventualmente se consideren obsoletas, gracias al avance tecnológico, las preocupaciones éticas son permanentes y se originan en dos principios: 1) los cambios genéticos que se hacen en la línea germinal se transmitirán a generaciones futuras y 2) no existe consenso sobre el estatus del embrión humano, ya que como entidad no está lo suficientemente desarrollado para consentir al procedimiento.
Al ser heredable la edición del genoma, la aplicación más controversial de CRISPR-Cas9, las sociedades profesionales, científicas y médicas; la industria, y los mismos pioneros de la tecnología, han publicado decenas de declaraciones, reportes y consensos acerca del tema. Aunque la mayoría de ellas defienden la prohibición o la moratoria, otros sugieren su permisibilidad bajo condiciones estrictas. También se han propuesto guías prácticas para la investigación, el desarrollo clínico y la distribución de la tecnología, que ofrezcan supervisión y vigilancia adecuada, ya que el uso de CRISPR-Cas9 será imposible de controlar.
El mundo cuenta hoy con una tecnología intencional y consciente de “evolución dirigida por humanos”. Los avances en edición genética nos permiten rescribir el lenguaje de la vida y nos pondrán en control de nuestro destino genético. Es nuestra decisión saber cómo darle el mejor uso a esta tecnología. No hay manera de desaprender este conocimiento, así que debemos adoptarlo. Pero debemos hacerlo con cuidado y con suma responsabilidad frente al poder inimaginable que nos brinda.
Finalmente, es muy importante que en Colombia se comprenda la necesidad de discutir ampliamente sobre las aplicaciones y aspectos éticos de CRISPR-Cas9, una tecnología que ya es conocida en el país y donde ya ha empezado a utilizarse. Se trata de una gran oportunidad para responder a diversas necesidades en el campo de las ciencias biológicas y la medicina en países como Colombia. Por lo anterior, la sociedad debe ocuparse del tema, lo mismo que las instancias correspondientes, como asociaciones profesionales, el Congreso y, por supuesto, el Consejo Nacional de Bioética, que tiene en sus manos ofrecer guías y orientaciones que, desde la bioética, conduzcan la práctica y la investigación que involucran CRISPR-Cas9.